2. 农业部动物疫病病原生物学重点实验室东北科学观测实验站,哈尔滨 150030
2. Northeast Scientific Inspection Observation Station, Key Laboratory of Animal Pathogen Biology of Ministry of Agriculture, Harbin 150030, China
禽白血病病毒[avian leukemia (leukosis) virus,ALV]隶属反转录病毒科、α反转录病毒属成员,其基因组为单股、正链、线性RNA的二聚体,具有经典的C型反转录病毒基因组结构(5′LTR-5′UTR-gag-pol-env-3′UTR-3′LTR),可引起禽类的多种肿瘤性疾病[1]。目前,根据宿主感染范围、中和抗体交叉反应和gp85基因同源性比对等方法[2],可将ALV分为11个亚群(A-K)。其中,外源性病毒包含A、B、C、D、J和K亚群,均可自然感染鸡群;而内源性病毒主要有E、F、G、H和I亚群,除E亚群分离于鸡外,其余亚群多见于野生鸟类[3]。感染ALV后的鸡,一方面表现为直接发病,病鸡体表或内脏出现肿瘤,最终导致死亡;另一方面还会出现发育迟缓,免疫力低下,产蛋率降低等亚临床症状,并易受到外界各种病原体的侵害,增加混合感染的概率[4],给我国养鸡业造成了巨大的经济损失。
近年来,随着ALV多个亚群混合感染情况在各地鸡群中不断出现,加上RNA病毒本身具有遗传多样性的特点,以致ALV基因组极易发生变异或重组,并使病毒有效逃避宿主防御机制、扩大感染宿主的范围并表现出更为复杂的致病特征[5-6]。例如,Li等[7]在江苏某鸡场分离出1株由ALV-K gp85基因、ALV-E gp37基因和ALV-J LTR基因组成的JS15SG01株,感染该毒株的SPF鸡表现出严重的病毒血症现象且病毒脱落能力也显著增强,并伴有明显的嗜神经症状,给ALV的防控带来新的挑战。因此,ALV的分离鉴定及基因组序列分析对于了解该病毒的致病机制、遗传进化状况以及制定ALV有效防控措施至关重要。本研究从RT-PCR检测为ALV阳性的病死鸡组织样品中分离、鉴定到1株E亚群禽白血病病毒,命名为HLJE2020,通过对其全基因组序列进行分析,分析其遗传演变趋势,为黑龙江地区禽白血病病毒的净化提供参考和依据。
1 材料与方法 1.1 试验材料1.1.1 样本与细胞 2020年8月,黑龙江省某鸡场的海兰白病死鸡,无明显临床症状。取病死鸡的心、肝、肺、肾和法氏囊,各组织眼观无异常。原代鸡胚成纤维细胞(CEF)由SPF级鸡胚制备,DF-1细胞系、大肠杆菌DH5α感受态细胞和BL21(DE3)感受态细胞均由东北农业大学兽医微生物与免疫学实验室保存。
1.1.2 主要试剂 禽白血病病毒ELISA抗原检测试剂盒购自哈尔滨国生生物科技股份有限公司;ExTaq DNA聚合酶、反转录酶RRI和RT-ace、Oligo(dT)18 Primer、DL2000 DNA Marker、pMD-19T(Simple)质粒等购自大连宝生物工程公司;ALV P27单克隆抗体由中国农业科学院哈尔滨兽医研究所惠赠;山羊抗小鼠FITC-IgG购自Sigma公司。
1.2 样本的检测将采集的心、肝、肺、肾和法氏囊进行研磨处理,采用TRIzol法提取RNA并反转录为cDNA,同时使用DNA提取试剂盒提取DNA,利用参考文献中的禽白血病病毒(ALV)、禽网状内皮组织增生症病毒(REV)、传染性法氏囊病毒(IBDV)、传染性支气管炎病毒(IBV)、新城疫病毒(NDV)、禽流感病毒(AIV)、禽呼肠孤病毒(ARV)、马立克病毒(MDV)、传染性贫血病病毒(CAV)和传染性喉气管炎病毒(ILTV)的特异性引物[8-16]进行PCR检测(表 1),引物均由吉林吉林省库美生物科技公司合成。
|
|
表 1 鸡常见传染性病毒的检测引物 Table 1 Primers for detection of common infectious viruses in chicken |
使用液氮将检测为ALV阳性的组织研磨至粉状,依照1∶5的比例加入灭菌PBS,置于-80 ℃反复冻融3次后,4 ℃ 12 000 r·min-1离心10 min,收集上清液并过滤一次后接种于生长密度达70% CEF和DF-1细胞中,吸附作用3 h,补加维持液培养7 d后反复冻融2次,收集上清液,按照上述方法盲传3代,病毒液于-80 ℃保存。
1.4 病毒的鉴定1.4.1 病毒亚群的鉴定 取P3代CEF细胞和DF-1细胞上清液提取RNA,采用参考文献中ALV-A-E、ALV-J和ALV-K的引物[17-18]进行RT-PCR扩增(表 2),从而进行ALV亚群的鉴定。
|
|
表 2 ALV亚群鉴定引物 Table 2 ALV subgroup identification primer |
1.4.2 病毒的间接免疫荧光(IFA)鉴定 以ALV P27单克隆抗体(1∶100稀释)为一抗,山羊抗小鼠FITC-IgG(1∶100稀释)为二抗,利用间接免疫荧光试验(IFA)检测CEF细胞中病毒增殖情况,并设立未感染的CEF细胞为阴性对照。
1.4.3 病毒的形态学鉴定 取细胞病毒液200 mL,4 ℃ 6 000 r·min-1离心20 min,再取上清,用超速离心机4 ℃ 35 000 r·min-1高速离心2 h后,弃上清,用100 μL灭菌的去离子水重悬沉淀。吸取25 μL滴于铜网上作用15 min,用2%磷钨酸负染色1 min 30 s,自然晾干,置于透射电子显微镜观察。
1.4.4 病毒传代的鉴定 收集P3至P11代细胞病毒液,依照禽白血病病毒抗原ELISA检测试剂盒说明书步骤进行ALV P27抗原检测,同时提取P3至P11代细胞病毒液RNA,使用ALV A-E鉴定引物进行RT-PCR检测,利用以上两种方法检测病毒传代稳定性。
1.5 病毒全基因组的测定1.5.1 病毒全基因组序列扩增与测序鉴定 参照GenBank中ALV-E参考毒株ev-1株(GenBank登录号:AY013303)全基因组序列,分段设计并合成用于扩增分离株全基因组序列引物(表 3)。提取细胞培养上清液RNA进行RT-PCR扩增,PCR产物经1% 琼脂糖凝胶电泳,胶回收目的片段与pMD-19T(Simple)载体进行连接、转化,挑选菌株提取质粒后进行PCR鉴定,鉴定结果为阳性的质粒送吉林省库美生物科技公司测序。
|
|
表 3 ALV-E全基因组序列扩增引物 Table 3 Amplification primer of ALV-E whole genome sequence |
1.5.2 病毒全基因组序列分析 应用DNAStar Lasergen 7.0软件对测序后各片段序列进行剪切、拼接和同源性比较;利用MEGA 7.0软件对分离株的env、gp85和LTR基因序列进行遗传进化分析;利用RDPv.4(Recombination Detection Program 4)软件[19]中7种重组检测算法(RDP、GENECONV、BootScan、Max Chi、Chimaera、SiScan、3Seq) 对分离株gp85基因进行潜在重组分析。之后利用SimPlot(v3.5.1)软件验证分离株gp85基因中是否存在重组情况。用于序列比对分析的28株ALV各亚群参考毒株(国内外最初和近些年最新发现且具有代表性的ALV参考毒株)详细信息见表 4。
|
|
表 4 用于序列比对的参考毒株信息 Table 4 Reference strains information for sequence alignment |
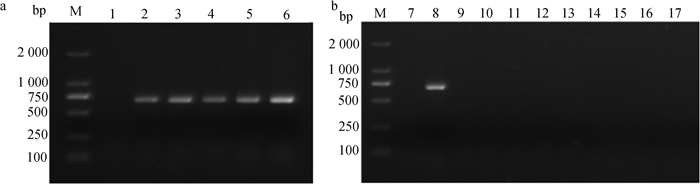
以病料提取的RNA为模板,经RT-PCR扩增获得ALV P27基因,结果显示,各组织均在约674 bp处出现特异性条带,与预期结果相符(图 1a),表明该病料中含有ALV;而病料各组织提取RNA或DNA后,均未扩增到REV、IBDV、IBV、NDV、AIV、ARV、MDV、CAV和ILTV的目的基因(图 1b)。
|
a.病死鸡病料的ALV P27检测;b.病死鸡病料的鸡常见病毒检测;M. DNA相对分子质量标准;1、7.阴性对照;2.心;3.肝;4.肺;5.肾;6.法氏囊;8.禽白血病病毒;9.禽网状内皮组织增生症病毒;10.传染性法氏囊病毒;11.传染性支气管炎病毒;12.新城疫病毒;13.禽流感病毒;14.禽呼肠孤病毒;15.马立克病毒;16.传染性贫血病病毒;17.传染性喉气管炎病毒 a. Detection of ALV P27 in sick materials of dead chickens; b. Detection of common viruses in sick materials of dead chickens; M. DL2000 DNA marker; 1, 7. Negative control; 2.Heart; 3.Liver; 4.Lungs; 5.Kidney; 6.Bursa; 8. ALV; 9. REV; 10. IBDV; 11. IBV; 12. NDV; 13. AIV; 14. ARV; 15. MDV; 16. CAV; 17. ILTV 图 1 病死鸡病料的RT-PCR鉴定结果 Fig. 1 The identification results of sick materials of dead chickens by RT-PCR |
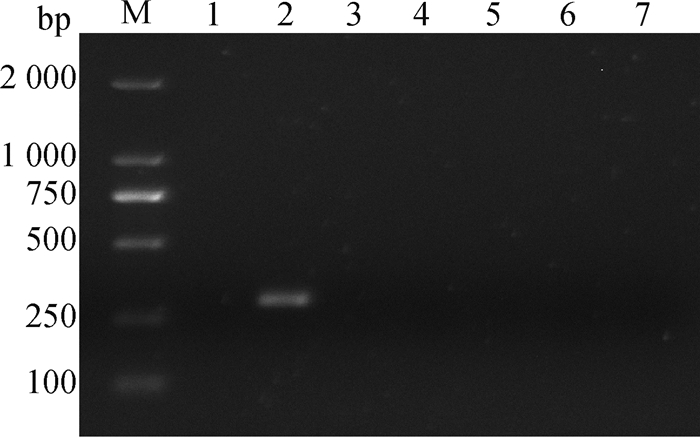
2.2.1 病毒的亚群鉴定结果 对盲传3代后的CEF和DF-1细胞上清提取RNA后进行RT-PCR鉴定。结果显示,经CEF细胞培养的上清液可扩增到约300 bp条带,而由DF-1细胞培养的上清液及阴性对照均未扩增出目的条带(图 2)。由于除E亚群ALV外,A~D亚群ALV均可在DF-1细胞传代培养[20-23],初步表明该分离株可能为E亚群禽白血病病毒。
|
M.DNA相对分子质量标准;1.阴性对照;2.A-E亚群(P3代CEF细胞上清);3.J亚群(P3代CEF细胞上清);4.K亚群(P3代CEF细胞上清);5.A-E亚群(P3代DF-1细胞上清);6.J亚群(P3代DF-1细胞上清);7.K亚群(P3代DF-1细胞上清) M.DL2000 DNA marker; 1.Negative control; 2.A-E subgroup (P3 generation CEF cell supernatant); 3.Subgroup J (P3 generation CEF cell supernatant); 4.K subgroup (P3 generation CEF cell supernatant); 5.A-E subgroup (P3 generation DF-1 cell supernatant); 6.Subgroup J (P3 generation DF-1 cell supernatant); 7.Subgroup K (P3 generation DF-1 cell supernatant) 图 2 ALV亚群RT-PCR鉴定结果 Fig. 2 RT-PCR identification results of ALV subgroup |
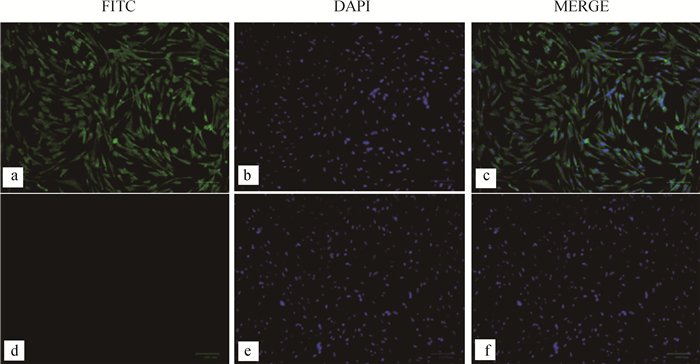
2.2.2 病毒的IFA鉴定结果 利用IFA法检测接种P3代细胞毒7 d的CEF细胞,结果显示,ALV P27单克隆抗体与接毒细胞呈阳性反应,细胞质中出现绿色荧光,细胞核呈蓝色荧光,可见ALV在细胞质中获得增殖,而未接毒细胞仅细胞核呈蓝色荧光,细胞质无特异性荧光(图 3)。
|
a~c.ALV-E感染的CEF细胞;d~f.CEF细胞阴性对照 a-c.ALV-E infected CEF cells; d-f.CEF cells negative control 图 3 间接免疫荧光检测结果(bar=100 μm) Fig. 3 Indirect immunofluorescence test results (bar=100 μm) |
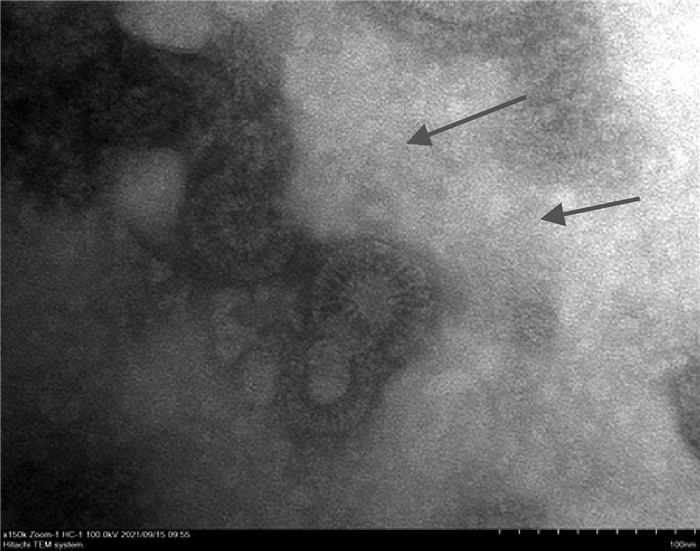
2.2.3 病毒形态学鉴定结果 P3代CEF细胞培养上清液经超速离心和负染色后,通过透射电镜可观察到病毒粒子近似球形,具有明显的囊膜和纤突结构,整体直径约为80 nm (图 4),与ALV形态大小相符,将该毒株命名为HLJE2020株。
|
图 4 透射电镜下的ALV病毒粒子(150 000×) Fig. 4 ALV virus particles under transmission electron microscope(150 000×) |
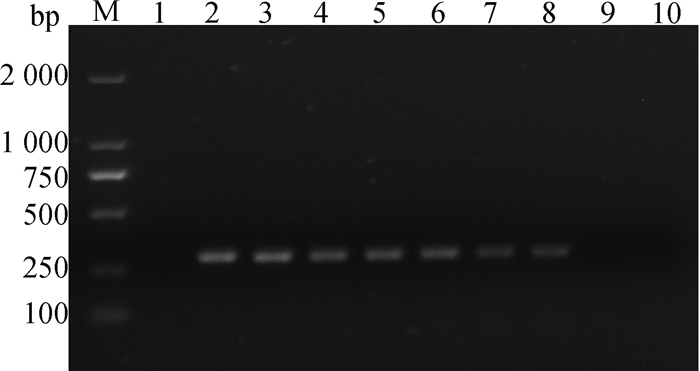
2.2.4 病毒传代的鉴定结果 取HLJE2020株P3至P11代CEF细胞培养上清液,利用ELISA和RT-PCR法检测分离株的传代稳定性。ELISA结果显示,随着传代次数的增加,病毒液中P27抗原的S/P值逐渐下降,并于P10代呈阴性(表 5)。RT-PCR结果显示P3~P9代可检测到目的基因,但P10代后未检测到病毒核酸(图 5)。上述结果表明,该分离株无法长期有效于CEF细胞中进行连续传代培养。
|
|
表 5 HLJE2020株各代CEF细胞培养上清液P27抗原检测结果 Table 5 P27 antigen detection results of supernatant of each generation HLJE2020 strain CEF cell culture |
|
N. DNA分子质量标准;1. 阴性对照;2~10. P3~P11细胞毒 N. DL2000 DNA marker; 1. Negative control; 2-10. P3-P11 cytotoxicity 图 5 HLJE2020株于CEF细胞传代的RT-PCR鉴定结果 Fig. 5 RT-PCR identification results of HLJE2020 strain passaged in CEF cells |
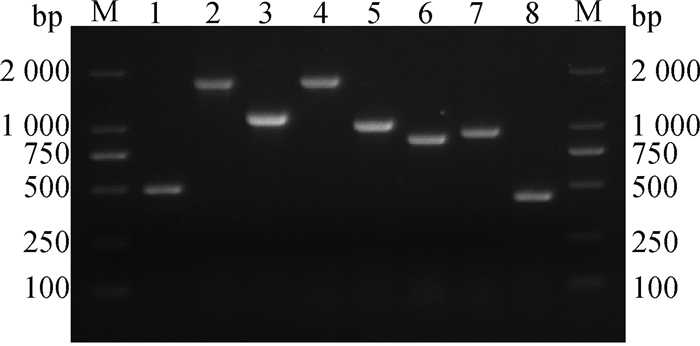
2.3.1 HLJE2020株全基因组序列扩增和测序结果 将HLJE2020株病毒液提取RNA后进行RT-PCR扩增,结果显示,各段均成功扩增出目的片段,与预期条带大小一致(图 6)。利用DNAStar软件将各段测序结果进行拼接,获得了HLJE2020株全基因组序列。结果显示,该分离株全基因组序列全长为7 524 bp,与经典的复制完整型C型反转录病毒结构相符,其中,3个编码蛋白的基因gag基因长2 106 bp,位于碱基位554—2 659;pol基因长2 688 bp,位于碱基位2 677—5 364;env基因长1 851 bp,位于碱基位554—571和5 252—7 084;两端完全相同,LTR基因全长274 bp,由U3、R和U5序列组成,长度分别为175、21和78 bp。将序列上传至GenBank,获得登录号为OK216743。
|
M. DNA分子质量标准;1~8. F1~F8扩增片段 M. DNA Marker DL2000; 1-8. F1-F8 amplified fragment 图 6 HLJE2020株全基因组序列扩增结果 Fig. 6 Amplification result of the whole genome sequence of HLJE2020 strain |
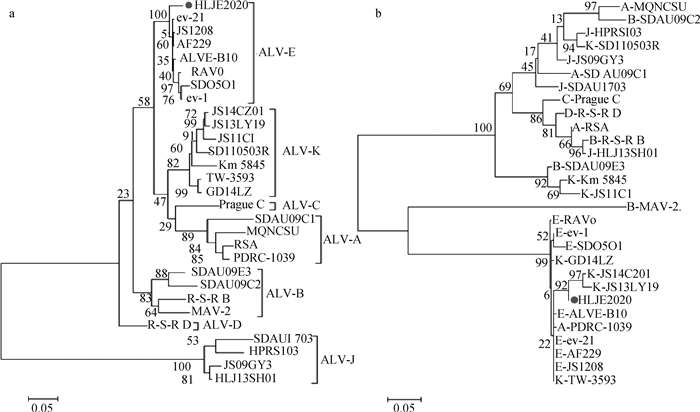
2.3.2 HLJE2020株全基因组序列分析结果 将HLJE2020株全基因组序列同选定的28株ALV各亚群参考毒株进行比对分析,结果显示(表 6),HLJE2020株与28株参考毒株间的核苷酸相似性为83.6%~98.5%;gag和pol基因较为保守,二者与ALV各亚群参考毒株间的核苷酸相似性分别为94.6%~99.3%和94.9%~99.1%,氨基酸相似性分别为95.9%~99.3%和95.6%~98.9%;而env和LTR基因的核苷酸相似性与其他参考毒株间的差异相对较大,二者与ALV各亚群参考毒株间的核苷酸相似性分别为51.6%~97.4%和58.1%~98.2%,其中二者均与E亚群ALV参考毒株的核苷酸相似性最高,分别为95.6%~97.4%和94.9%~98.2%,而遗传进化分析结果也显示二者与E亚群ALV参考毒株隶属同一个进化分支,其中与含有内源性ALV LTR基因的参考毒株JS14CZ01株和JS13LY19株具有较近的亲缘关系(图 7)。
|
|
表 6 HLJE2020株全基因组序列与ALV各亚群参考毒株的相似性比较 Table 6 Comparison of homology between the whole genome sequence of HLJE2020 strain and the reference strains of ALV subgroups |
|
a.HLJE2020株env核苷酸序列遗传进化树;b. HLJE2020株LTR核苷酸序列遗传进化树 a.Phylogenetic tree of env nucleotide sequence of HLJE2020 strain; b. Phylogenetic tree of LTR nucleotide sequence of HLJE2020 strain 图 7 HLJE2020株与ALV各亚群参考毒株核苷酸序列遗传进化树 Fig. 7 Phylogenetic tree of nucleotide between HLJE2020 strain and reference strains of ALV subgroups |
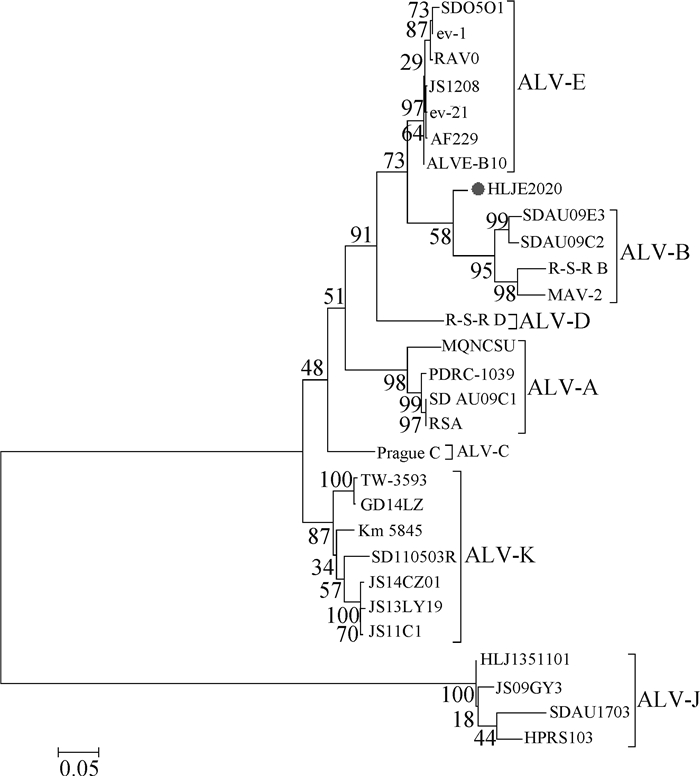
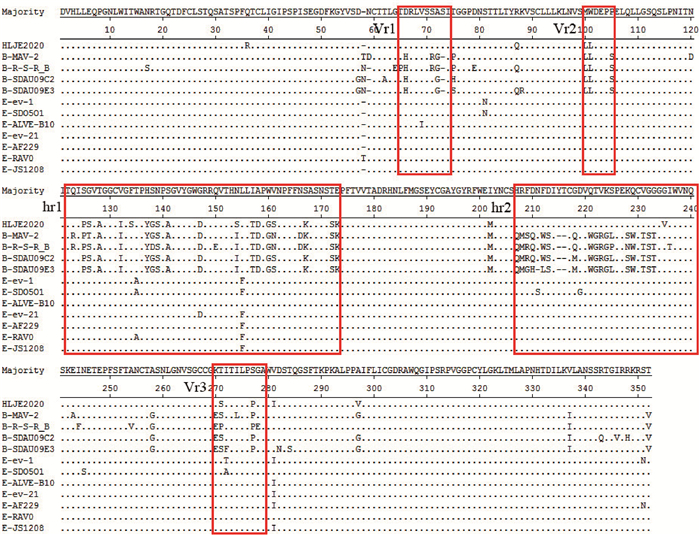
2.3.3 HLJE2020株gp85基因序列分析结果 gp85蛋白是病毒囊膜蛋白env编码的主要蛋白之一,由于其能特异性结合靶细胞膜上的受体,因而决定了ALV感染宿主的范围以及亚群的特异性。将HLJE2020株gp85基因同选定的28株ALV各亚群参考毒株gp85基因进行比对,结果显示(表 6),gp85基因与ALV各亚群参考毒株的核苷酸相似性为50.1%~94.1%,氨基酸相似性为37.3%~92.0%,其中, 与E亚群和B亚群ALV参考毒株的相似性均在90% 以上;而gp85核苷酸序列遗传进化分析结果显示该毒株gp85基因在B亚群和E亚群ALV之间出现一个单独的分支(图 8),且该分离株gp85氨基酸序列的5个易变异区域中的Vr2、hr1和Vr3区域的氨基酸组成与B亚群参考毒株相似,Vr1、hr2以及其他区域的氨基酸组成与E亚群参考毒株相似(图 9),推测该分离株gp85基因核苷酸序列在225—618 bp和810—840 bp处可能存在E亚群ALV与B亚群ALV的重组事件。
|
图 8 HLJE2020株与ALV各亚群参考毒株gp85核苷酸序列遗传进化树 Fig. 8 Phylogenetic tree of gp85 nucleotide between HLJE2020 strain and reference strains of ALV subgroups |
|
ALV各毒株gp85氨基酸序列中圆点表示氨基酸一致,破折号“—”表示氨基酸缺失,字母表示氨基酸突变 In the gp85 amino acid sequence of ALV strains, the dots represent consistent amino acids, the dashes "—" represent amino acid deletion, and the letters represent amino acid mutation 图 9 HLJE2020株与ALV参考毒株gp85氨基酸序列分析 Fig. 9 Amino acid sequence analysis of gp85 between HLJE2020 strain and ALV reference strain |
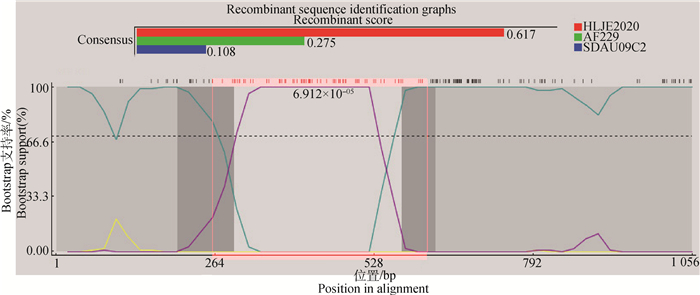
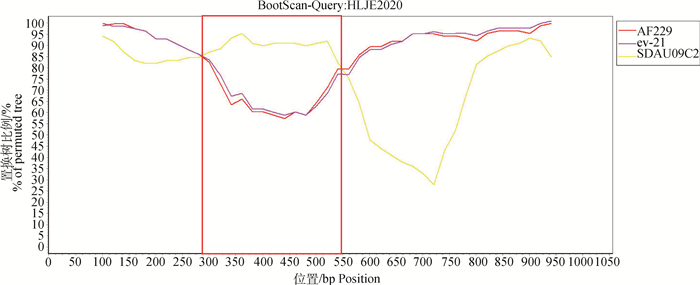
随后利用RDPv.4软件中的RDP、GENE-CONV、BootScan、MaxChi、Chimaera、SiScan和3Seq进一步分析HLJE2020株gp85基因的重组事件,结果显示(判断依据:至少保证5种算法的P值< 10-5且Recombinant sequence identification graphs中第一个柱状图面积评分需>0.600),该分离株gp85基因是由主要亲本毒株AF229株(美国2017年商品肉鸡分离株)与次要亲本毒株SDAU09C2株(中国2012年山东地方品系种鸡芦花鸡分离株)于核苷酸序列258—613 bp产生1处重组信号,形成了HLJE2020株重组gp85基因(表 7和图 10);而SimPlot软件分析结果也进一步表明HLJE2020株的gp85基因确实存在重组现象(图 11)。
|
|
表 7 HLJE2020株的RDPv.4重组分析数据 Table 7 RDPv. 4 recombination analysis data of HLJE2020 strain |
|
图 10 HLJE2020株gp85基因重组分析结果 Fig. 10 Analysis of gp85 gene recombination of HLJE2020 strain |
|
设置:窗口200 bp, 步长20 bp,间隙开启,Kimura两参数模型,T/t2.0 Settings: Window 200 bp, Step 20 bp, Gapstrip on, Kimura (2-parameter), T/t 2.0 图 11 HLJE2020株的SimPlot重组分析结果 Fig. 11 SimPlot recombination analysis results of HLJE2020 strain |
自1999年我国首次发现J亚群ALV以来,其在全国多地鸡场中的广泛分布严重阻碍了养鸡业的健康发展[24-25]。尽管我国从2008年起开始实行禽白血病根除计划(NEP)并取得一定成效,然而在某些采取净化措施不到位的地方品系鸡群中仍然存在着ALV多个亚群混合感染的情况[26],导致鸡体在受到多个基因组不同的ALV病毒粒子感染时,就可能产生包含来自两个或多个亲本基因组序列的重组ALV[6]。因此,务必要引起国内养禽业的重视。
本研究通过对黑龙江省某养鸡场病料进行检测,将ALV阳性样品处理后接种于CEF细胞培养,利用RT-PCR、IFA和透射电镜方法对分离株进行鉴定,分离到一株E亚群ALV HLJE2020株。通过对该分离株的传代稳定性进行研究,发现随着传代次数的增加,P27抗原的S/P比值也随之下降,在盲传至第10代后的P27抗原检测结果均呈阴性,这与徐海鹏等[27]从种蛋中分离出的E亚群ALV在CEF细胞上连续传代培养后P27抗原S/P值不断下降的结果一致。同时,RT-PCR结果也显示, 在盲传至第10代后检测不到病毒核酸的存在。推测其原因可能是E亚群ALV基因组中LTR基因同外源性ALV相比其启动子活性较弱,而LTR启动子活性的强弱与病毒的复制能力、翻译以及致瘤性密切相关[4],因而导致E亚群ALV的复制和感染能力很弱,无法长期连续传代培养,但具体原因仍需进行后续研究。
gp85基因是ALV env基因的重要组成部分,与敏感细胞的识别和黏附过程有关,它是决定ALV亚群分类的主要依据,其编码的蛋白也是病毒中和的主要抗原[2],其核苷酸序列的改变,特别是某些位点的变化可能对病毒的抗原性、细胞趋向性等方面产生影响,甚至有可能经过长期的突变和重组而产生新的亚群,因此其在ALV的遗传演化中发挥着重要作用[28]。在本研究中,通过对HLJE2020株gp85基因进行核苷酸(氨基酸)同源性、遗传进化和重组分析,发现该分离株gp85基因的重组区域主要集中在gp85基因5个高变区(hr1、hr2、Vr1、Vr2和Vr3)中的hr1和hr2,且该区域的重组元件是由B亚群ALV提供,这与先前多项研究中发现重组ALV毒株基因组中的重组区域主要位于LTR基因、gag基因或gp37基因且均由E亚群ALV提供重组元件的情况有所不同[4, 29]。有研究表明,gp85基因高变区中的hr1和hr2是病毒糖蛋白三聚体和宿主蛋白受体之间的主要结合域[30],当其受到外界环境或免疫反应的选择压力的干扰极有可能发生变异[31],而这些区域的改变就会对细胞受体的结合以及宿主范围产生影响[32],进而推测该分离株在此区域的改变可能使病毒感染、复制和传播的能力增强,并使其感染的宿主范围发生改变,同时也进一步表明我国ALV已发生新的变异趋势,这种新的变异现象的产生应当引起人们的高度重视。而有关该重组毒株的真实起源、形成过程等方面内容还有待后续研究。
4 结论本研究成功分离出1株E亚群ALV HLJE2020株,且该分离株基因组序列中的gp85基因可能存在E亚群ALV和B亚群ALV的重组现象,为今后ALV的变异趋势和致病机制的研究奠定基础。
| [1] |
LI H J, WANG P K, LIN L L, et al. The emergence of the infection of subgroup J avian leucosis virus escalated the tumour incidence in commercial yellow chickens in Southern China in recent years[J]. Transbound Emerg Dis, 2019, 66(1): 312-316. DOI:10.1111/tbed.13023 |
| [2] |
PAYNE L N, NAIR V. The long view: 40 years of avian leukosis research[J]. Avian Pathol, 2012, 41(1): 11-19. DOI:10.1080/03079457.2011.646237 |
| [3] |
马美哥. 我国部分地方品种鸡和进口白羽肉种鸡ALV-J的分子流行病学调查及致病性研究[D]. 石河子: 石河子大学, 2019. MA M G. Molecular epidemiological investigation and pathogenicity of subgroup J avian leukosis in part local breeders and imported broiler breeders[D]. Shihezi: Shihezi University, 2019. (in Chinese) |
| [4] |
ZHAO Z J, RAO M Z, LIAO M, et al. Phylogenetic analysis and pathogenicity assessment of the emerging recombinant subgroup K of Avian Leukosis virus in South China[J]. Viruses, 2018, 10(4): 194. DOI:10.3390/v10040194 |
| [5] |
SUN T, WANG X M, HAN W, et al. Complete genome sequence of a novel recombinant avian Leukosis virus isolated from a three-yellow chicken[J]. Arch Virol, 2020, 165(11): 2615-2618. DOI:10.1007/s00705-020-04764-7 |
| [6] |
WANG P K, YANG Y L, LIN L L, et al. Complete genome sequencing and characterization revealed a recombinant subgroup B isolate of avian Leukosis virus with a subgroup J-like U3 region[J]. Virus Genes, 2017, 53(6): 927-930. DOI:10.1007/s11262-017-1493-4 |
| [7] |
LI X Y, YU Y, MA M G, et al. Molecular characteristic and pathogenicity analysis of a novel multiple recombinant ALV-K strain[J]. Vet Microbiol, 2021, 260: 109184. DOI:10.1016/j.vetmic.2021.109184 |
| [8] |
毕研丽, 庄金秋, 王金良, 等. 双重PCR检测禽源生物制品中禽网状内皮组织增生症病毒和禽白血病病毒[J]. 畜牧与兽医, 2014, 46(4): 74-78. BI Y L, ZHUANG J Q, WANG J L, et al. Detection of avian reticuloendothelial hyperplasia virus and avian leukemia virus in avian biological products by dual PCR[J]. Animal Husbandry & Veterinary Medicine, 2014, 46(4): 74-78. (in Chinese) |
| [9] |
李凯, 高宏雷, 高立, 等. 禽网状内皮组织增生病病毒TaqMan探针荧光定量PCR检测方法的建立及应用[J]. 中国兽医科学, 2010, 40(11): 1137-1141. LI K, GAO H L, GAO L, et al. Development and application of a TaqMan real-time PCR assay for detection of reticuloendotheliosis virus[J]. Chinese Veterinary Science, 2010, 40(11): 1137-1141. (in Chinese) |
| [10] |
金娟, 李亚杰, 鲍恩东. 1株禽传染性支气管炎病毒的分离鉴定及其实时荧光定量PCR检测方法的建立[J]. 畜牧与兽医, 2020, 52(1): 115-121. JIN J, LI Y J, BAO E D, et al. Isolation and identification of a strain of avian infectious bronchitis virus and establishment of real-time fluorescent quantitative PCR for the strain[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(1): 115-121. (in Chinese) |
| [11] |
屈素洁, 施开创, 邹联斌, 等. 新城疫病毒和传染性支气管炎病毒双重荧光定量RT-PCR检测方法的建立[J]. 中国预防兽医学报, 2014, 36(11): 867-871. QU S J, SHI K C, ZOU L B, et al. Development of a dultiplex real-time RT-PCR assay for detection of Newcastle disease virus and avian infectious bronchitis viruses[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(11): 867-871. (in Chinese) |
| [12] |
王楷宬, 王素春, 朱琳, 等. 禽流感病毒实时荧光定量RT-PCR检测方法的建立[J]. 中国动物检疫, 2019, 36(4): 64-69. WANG K C, WANG S C, ZHU L, et al. Establishment of real-time RT-PCR for detection of avian influenza virus[J]. China Animal Health Inspection, 2019, 36(4): 64-69. DOI:10.3969/j.issn.1005-944X.2019.04.016 (in Chinese) |
| [13] |
钟丽, 孙美玉, 高立, 等. 禽呼肠孤病毒TaqMan实时荧光RT-PCR方法的建立及病毒组织分布比较研究[J]. 中国动物传染病学报, 2017, 25(2): 56-60. ZHONG L, SUN M Y, GAO L, et al. Development and application of a TaqMan RT-PCR assay for detection of avian reoviruses in tissues[J]. Chinese Journal of Animal Infectious Diseases, 2017, 25(2): 56-60. (in Chinese) |
| [14] |
张颖. 鸡马立克氏病病毒TaqMan探针双重荧光定量PCR检测方法的建立及应用[D]. 呼和浩特: 内蒙古农业大学, 2006. ZHANG Y. Establishment and application of diagnostic test for Marek's disease virus based on TaqMan probe double Fluorescent Quantitative Polymerase-Chain-Reaction (FQ-PCR)[D]. Hohhot: Inner Mongolia Agricultural University, 2006. (in Chinese) |
| [15] |
宋修庆. VP3对鸡贫血病毒复制的影响及核定位信号的作用[D]. 北京: 中国农业科学院, 2009. SONG X Q. Effect of chicken anemia virus VP3 on viral replication and function of nuclear location signal[D]. Beijing: Chinese Academy of Agricultural Sciences, 2009. (in Chinese) |
| [16] |
赵妍, 孔聪聪, 张晓敏, 等. 鸡传染性喉气管炎病毒TaqMan real-time PCR检测方法的建立[J]. 中国预防兽医学报, 2012, 34(8): 642-646. ZHAO Y, KONG C C, ZHANG X M, et al. Development of a TaqMan real-time PCR for detection of infectious laryngotracheitis virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2012, 34(8): 642-646. (in Chinese) |
| [17] |
SMITH L M, BROWN S R, HOWES K, et al. Development and application of polymerase chain reaction (PCR) tests for the detection of subgroup J avian leukosis virus[J]. Virus Res, 1998, 54(1): 87-98. |
| [18] |
俞燕, 周生, 李建梅, 等. A、B、J和K亚群禽白血病病毒多重PCR检测方法的建立及应用[J]. 中国预防兽医学报, 2020, 42(5): 462-468. YU Y, ZHOU S, LI J M, et al. Establishment and application of multiple PCR for detection of avian leukosis viruses subgroup A, B, J and K[J]. Chinese Journal of Preventive Veterinary Medicine, 2020, 42(5): 462-468. (in Chinese) |
| [19] |
MARTIN D P, MURRELL B, GOLDEN M, et al. RDP4:detection and analysis of recombination patterns in virus genomes[J]. Virus Evol, 2015, 1(1): vev003. |
| [20] |
陈茹. 两株A亚群和一株K亚群禽白血病病毒体外增殖及对雏鸡致病性比较[D]. 泰安: 山东农业大学, 2018. CHEN R. Comparisons of the proliferation in vitro and the pathogenicity in chickens between two ALV-a strains and one ALV-K strain[D]. Taian: Shandong Agricultural University, 2018. (in Chinese) |
| [21] |
武专昌. 一株B亚型ALV的分离、前病毒全基因组序列分析和感染性克隆的构建[D]. 泰安: 山东农业大学, 2012. WU Z C. Isolation, sequence analysis for the complete Proviral genome and construction of infectious clone of a subgroup B ALV[D]. Taian: Shandong Agricultural University, 2012. (in Chinese) |
| [22] |
CAI L M, SHEN Y W, WANG G H, et al. Identification of two novel multiple recombinant avian Leukosis viruses in two different lines of layer chicken[J]. J Gen Virol, 2013, 94(Pt 10): 2278-2286. |
| [23] |
SANDELINI K, ESTOLA T. Occurrence of different subgroups of avian Leukosis virus in Finnish poultry[J]. Avian Pathol, 1974, 3(3): 159-168. |
| [24] |
MAO Y Q, SU Q, LI J P, et al. Avian Leukosis virus contamination in live vaccines: a retrospective investigation in China[J]. Vet Microbiol, 2020, 246: 108712. |
| [25] |
ZHOU D F, XUE J W, ZHANG Y, et al. Outbreak of myelocytomatosis caused by mutational avian leukosis virus subgroup J in China, 2018[J]. Transbound Emerg Dis, 2019, 66(2): 622-626. |
| [26] |
LI Q H, WANG P K, LI M, et al. Recombinant subgroup B avian leukosis virus combined with the subgroup J env gene significantly increases its pathogenicity[J]. Vet Microbiol, 2020, 250: 108862. |
| [27] |
徐海鹏, 孟凡峰, 董宣, 等. 种蛋中内源性禽白血病病毒的检测和鉴定[J]. 畜牧兽医学报, 2014, 45(8): 1317-1323. XU H P, MENG F F, DONG X, et al. Detection and identification of an endogenous subgroup E avian leukosis virus in a chicken breeder embryo[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(8): 1317-1323. (in Chinese) |
| [28] |
DONG X, MENG F F, HU T, et al. Dynamic co-evolution and interaction of avian Leukosis virus genetic variants and host immune responses[J]. Front Microbiol, 2017, 8: 1168. |
| [29] |
WANG P K, NIU J R, XUE C, et al. Two novel recombinant avian leukosis virus isolates from Luxi gamecock chickens[J]. Arch Virol, 2020, 165(12): 2877-2881. |
| [30] |
FEDERSPIEL M J. Reverse engineering provides insights on the evolution of subgroups A to E avian sarcoma and Leukosis virus receptor specificity[J]. Viruses, 2019, 11(6): 497. |
| [31] |
VENUGOPAL K, SMITH L M, HOWES K, et al. Antigenic variants of J subgroup avian leukosis virus: sequence analysis reveals multiple changes in the env gene[J]. J Gen Virol, 1998, 79(Pt 4): 757-766. |
| [32] |
HOLMEN S L, MELDER D C, FEDERSPIEL M J. Identification of key residues in subgroup A avian leukosis virus envelope determining receptor binding affinity and infectivity of cells expressing chicken or quail Tva receptor[J]. J Virol, 2001, 75(2): 726-737. |
(编辑 白永平)



