20多种蛋白质或多肽可以发生结构错误折叠形成淀粉样纤维,这些淀粉样纤维沉积在机体组织或器官内可导致相应的淀粉样变性疾病(amyloidosis),如机体内正常存在的朊蛋白(prion protein)发生错误折叠后形成了淀粉样纤维,这种纤维聚集在中枢神经系统导致了人或动物的传染性海绵状脑病(transmissible spongiform encephalopathy,TSE),也称朊病(prion disease)[1]。p. Leu102Ser突变的人溶菌酶(human lysozyme)蛋白也可形成淀粉样纤维,导致家族性淀粉样变性疾病[2]。淀粉样纤维的形成是导致淀粉样变性疾病的关键原因。淀粉样纤维相关蛋白质或多肽也可在体外一定理化条件下形成淀粉样纤维,如朊蛋白多肽PrP106-126在37 ℃、pH 7.5的磷酸缓冲液中孵育24 h可形成淀粉样纤维[3],人溶菌酶蛋白在高温57 ℃、pH 7.4条件下能够形成淀粉样纤维[4]。蛋清溶菌酶(hen egg-white lysozyme,HEWL)与人溶菌酶蛋白在序列上有60.94%的相似性,蛋清溶菌酶蛋白在一定理化条件下也可形成淀粉样纤维[5-7],且形成的淀粉样纤维超微结构与朊蛋白淀粉样纤维[8]及导致阿尔茨海默病(Alzheimer’s disease,AD)的Aβ(β-amyloid protein,Aβ)淀粉样纤维[9]有极大相似性。蛋清溶菌酶蛋白有129个氨基酸,二级结构α螺旋含量30%~40%[10-12]。正常朊蛋白中α螺旋约含42%,在其结构错误折叠过程中,一部分α螺旋转化成了β折叠,导致朊蛋白淀粉样纤维中的α螺旋含量减少、β折叠含量显著提高[13-14]。蛋清溶菌酶蛋白在形成淀粉样纤维过程中β折叠含量也显著提高[15-16]。蛋清溶菌酶蛋白已经作为模型材料用于研究蛋白质结构错误折叠并组装成淀粉样纤维的过程[12, 15, 17]。然而蛋清溶菌酶蛋白形成的淀粉样纤维对细胞的生物学活性鲜见报道。因此本研究使用朊蛋白以及Aβ淀粉样纤维研究中常用的人神经母细胞瘤细胞SH-SY5Y,探讨一定理化条件下形成的蛋清溶菌酶淀粉样纤维对SH-SY5Y神经细胞的影响,为探究朊蛋白和其他蛋白质淀粉样纤维的形成机制及其致病性提供线索。
1 材料与方法 1.1 主要材料SH-SY5Y细胞购自上海酶研生物科技有限公司(编号CC-Y1459),蛋清溶菌酶(EC 3.2.1.17)购自MCE公司,8-苯胺基-1-萘磺酸(ANS)购自SIGMA公司,甘氨酸购自MP公司,MEM/F-12培养基、Gluta-max添加剂、丙酮酸钠(sodium pyruvate)、非必需氨基酸(non-essential amino acids,NEAA) 和胎牛血清(fetal bovine serum,FBS)购自Gibco公司,MTT试剂盒、Hoechst 33342染色液购自生工生物工程(上海)股份有限公司。
1.2 主要仪器T12透射电子显微镜购自FEI公司,Jasco-1500圆二色谱仪购自日本株式会社,Epoch紫外酶标仪购自美国Bio Tek,Cary Eclipse荧光分光光度计购自安捷伦科技有限公司,OS60恒温孵育摇床购自北京莱普特公司,Ti-S倒置荧光显微镜购自日本Nikon。
1.3 蛋清溶菌酶淀粉样纤维制备使用pH 2.0的50 mmol·L-1甘氨酸溶液配制1 mmol·L-1天然蛋清溶菌酶蛋白作为储备溶液。然后将100 μmol·L-1蛋清溶菌酶蛋白置于(57±0.1)℃、250 r·min-1摇床中孵育,每2 d收集孵育样品,于-20 ℃保存。
1.4 透射电镜观察超微结构取15 μL孵育的HEWL样品缓慢滴加于200目无碳方华膜上,待样品表面风干,以磷钨酸(phosphotungstic acid,PTA)负染30 s,吸去多余的染液后,再以超纯水清洗20 s,室温下干燥,使用透射电子显微镜(transmission electron microscopy, TEM)在100 kV电压下观察淀粉样纤维的超微结构。
1.5 疏水性检测使用ANS荧光试剂检测淀粉样纤维表面的疏水性,ANS荧光强度增加表示纤维的疏水性增强。以超纯水稀释HEWL样品至终浓度为1 μmol·L-1,ANS使用浓度为10 μmol·L-1,HEWL样品和ANS混匀后于室温下避光孵育3 min,最后使用荧光分光光度计进行ANS荧光扫描,激发波长为380 nm,波长范围为420~600 nm,激发狭缝为5 nm,发射狭缝为5 nm。
1.6 二级结构检测使用圆二色谱法(Circular dichroism,CD)检测蛋白质二级结构,检测方法参考李颖等[16]方法。然后使用仪器自带的CD multivariate SSE软件计算预测二级结构中α螺旋和β折叠的含量。
1.7 神经细胞培养及纤维处理SH-SY5Y细胞在37 ℃、5% CO2的培养箱中培养,完全培养基:MEM/F12培养基、1% Gluta-max、1% sodium pyruvate、1% NEAA、10%胎牛血清和1%双抗。正常培养24 h之后进行各组试验处理。
将4~10 d不同聚集程度的蛋清溶菌酶淀粉样纤维混合均匀,然后使用冷冻干燥机将纤维冻干处理,再将冻干的纤维溶解于完全培养基。纤维使用浓度分别为1、2和3 μmol·L-1,处理时间分别为12、24和48 h。pH 2.0甘氨酸溶液经相同冻干处理后作用于SH-SY5Y细胞作为阴性对照。正常培养细胞作为空白对照组,每组6个重复。
1.8 细胞毒性检测SH-SY5Y细胞在96孔板中的接种密度为5×104 ·孔-1。按照MTT试剂盒操作说明,含90 μL培养基的细胞孔中加入10 μL MTT(5 mg·mL-1)至终浓度为0.5 mg·mL-1,继续培养4 h后吸弃含有MTT的旧培养基,然后加入100 μL甲瓒溶解剂(formazan solubilization solution),轻轻振荡10 min以溶解沉淀物,最后使用酶标仪测定570 nm的吸光度。细胞活力计算公式:细胞活力(%)=(OD处理组/OD空白对照组) ×100。
1.9 Hoechst 33342核染色分别使用2和3 μmol·L-1的淀粉样纤维处理细胞48 h后,吸弃旧培养基,无菌D-PBS洗涤细胞1次,加入Hoechst 33342染色液后在室温条件下避光孵育30 min,最后置于倒置荧光显微镜下观察染色后的细胞核。
1.10 统计学分析用GraphPad prism 8.0统计软件进行数据分析。数据均采用“x±sx”表示,组内与对照组的均数差异采用单因素方差分析(One-Way ANOVA)。P>0.05为统计学差异不显著,P < 0.05为统计学差异显著,P < 0.01为统计学差异极显著。
2 结果 2.1 HEWL纤维的超微结构HEWL蛋白在57 ℃、pH 2.0甘氨酸溶液中孵育,4 d后,在TEM下观察到少量淀粉样纤维结构(图 1 A),8~10 d后观察到大量纤维(图 1 B和C),且4、8和10 d形成的纤维超微结构相同,均呈短杆状,直径约20 nm,纤维中心有长轴。经冻干处理后,淀粉样纤维的超微结构保持不变(图 1 D)。
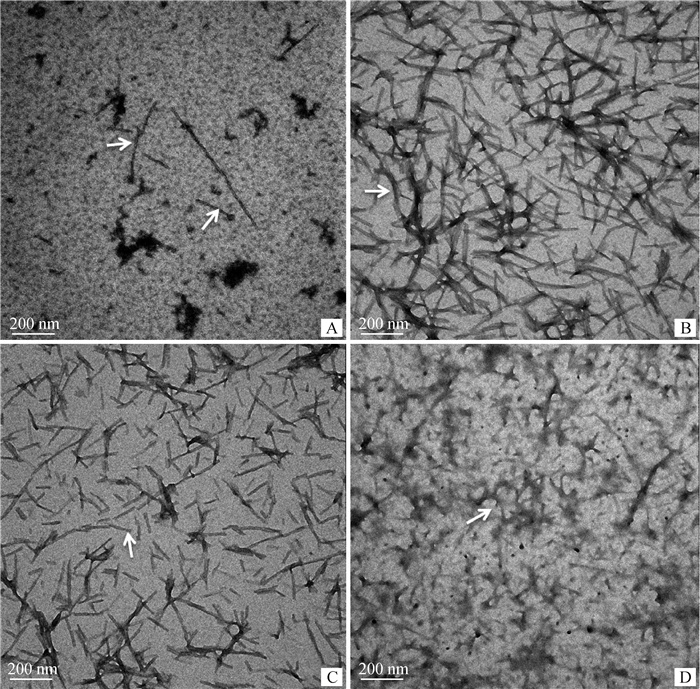
|
A. 4 d;B. 8 d;C. 10 d;D. 冻干后的HEWL淀粉样纤维 A. 4 d; B. 8 d; C. 10 d; D. HEWL fibrils after lyophilization 图 1 HEWL淀粉样纤维的超微结构 Fig. 1 Ultrastructures of HEWL fibrils |
天然HEWL蛋白与ANS荧光试剂结合后产生的荧光强度较低,而HEWL淀粉样纤维与ANS结合后产生的荧光强度显著增加,且8 d时纤维产生的ANS荧光强度明显高于4 d时(图 2),表明HEWL蛋白在形成淀粉样纤维之后的疏水性明显提高,且随着纤维数量增多,疏水性增强。
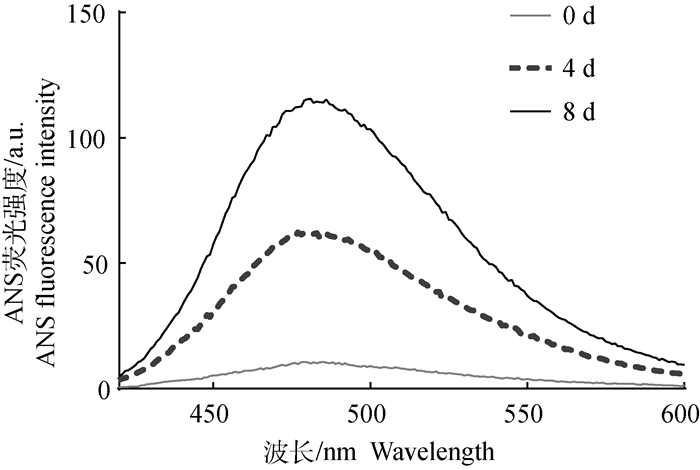
|
图 2 ANS荧光法检测HEWL淀粉样纤维的疏水性 Fig. 2 Hydrophobicity of HEWL fibrils by ANS fluorescence method |
圆二色谱检测结果显示,天然HEWL蛋白(0 d)在约208 nm处出现最低椭圆率,表示二级结构中主要是α螺旋(图 3),使用圆二色谱仪(Jasco-1500)自带CD multivariate SSE软件计算的α螺旋和β折叠含量分别为30.6%和20.8%(表 1)。4和8 d形成的HEWL纤维在约218 nm处出现最低椭圆率,表示二级结构中主要是β折叠,且4 d时HEWL纤维的α螺旋和β折叠含量分别为22.5%和29.6%,8 d时分别为12.8%和37.1%,表明随着HEWL纤维的形成和生长,α螺旋含量逐渐降低,而β折叠含量逐渐升高。
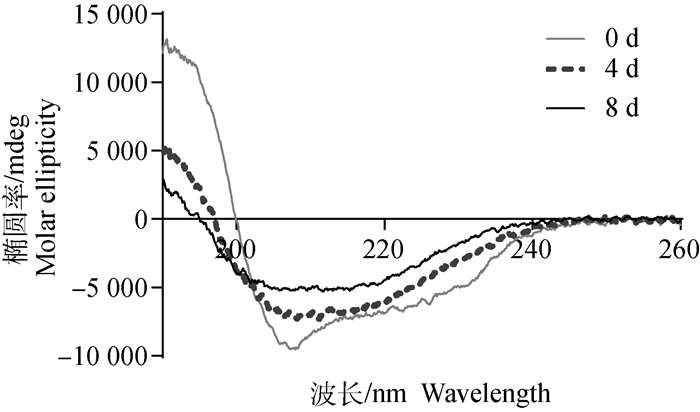
|
图 3 HEWL淀粉样纤维的二级结构测定 Fig. 3 Secondary structure detection of HEWL fibrils by CD method |
|
|
表 1 二级结构含量变化 Table 1 Changes in secondary structure content |
将4~10 d产生的HEWL淀粉样纤维混合后以不同浓度处理培养的SH-SY5Y细胞。1、2和3 μmol·L-1 HEWL淀粉样纤维分别处理细胞12、24和48 h后均极显著降低了细胞活力(P < 0.01),处理12 h的细胞活力分别为75.16%±15.51%、67.54%±12.13%和67.89%±10.26%(图 4 A);处理24 h的细胞活力分别为75.78%±13.01%、58.41%±5.55%和61.90%±8.94%(图 4 B),处理48 h的细胞活力分别为71.59%±14.75%、55.65%±5.78%和46.45%±6.23%(图 4 C)。pH 2.0甘氨酸溶液作为阴性对照,处理细胞48 h未影响SH-SY5Y细胞的细胞活力(P>0.05)。结果表明:HEWL淀粉样纤维对SH-SY5Y神经细胞具有较强的毒性,且毒性呈时间依赖性和纤维浓度依赖性。
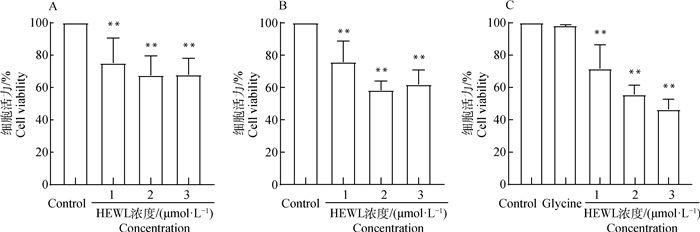
|
A. 12 h;B. 24 h;C. 48 h;pH 2.0甘氨酸溶液作为阴性对照;数据以“x±sx”表示(n=6),与空白对照组相比,**.P < 0.01 A. 12 h; B. 24 h; C. 48 h; Glycine solution of pH 2.0 as the negative control; Data were expressed as "x±sx" (n=6), compared with control, **.P < 0.01 图 4 HEWL淀粉样纤维对细胞活力的影响 Fig. 4 Effects of HEWL amyloid fibrils on cell viability |
同时,HEWL纤维处理SH-SY5Y神经细胞48 h之后,显微镜下观察细胞形态发现:空白对照组和阴性对照组的SH-SY5Y神经细胞生长正常,细胞呈梭形,神经突起细长并相互交联成网络状(图 5 A和5 B),而2~3 μmol·L-1HEWL纤维处理组的细胞胞体变圆且体积收缩,神经突起断裂导致细胞间交联消失,甚至细胞数量减少(图 5 C和5 D)。Hoechst 33342核染色结果显示:HEWL纤维在处理SH-SY5Y神经细胞48 h之后,空白对照组(图 5A)和阴性对照组(图 5 B)细胞的细胞核均发出微弱、弥散、均匀的蓝光,且染色质分布均匀,细胞核正常;2 μmol·L-1(图 5 C)和3 μmol·L-1(图 5 D)的HEWL纤维导致细胞核出现核浓缩、核碎裂、染色质边移等典型的细胞凋亡特征,且与空白对照组相比,视野下细胞数量明显减少。该结果进一步表明HEWL纤维可造成SH-SY5Y神经细胞的明显凋亡。

|
A. 空白对照组;B. 阴性对照组;C. 2 μmol·L-1 HEWL纤维处理组;D. 3 μmol·L-1 HEWL纤维处理组。第一行为Hoechst 33342核染色结果;第二行是白光视野图;箭头所示为凋亡细胞 A. Control; B. Negative control; C. 2 μmol·L-1 HEWL fibrils; D. 3 μmol·L-1 HEWL fibrils. The pictures in the first row are the results of Hoechst 33342 nuclear staining; The pictures in the second row are the results of white light field; White arrows indicated the apoptotic cells 图 5 HEWL淀粉样纤维引起的细胞形态学变化 Fig. 5 Morphological changes of cells induced by HEWL amyloid fibrils |
淀粉样纤维在体内主要沉积于细胞间质,导致细胞淀粉样变(amyloid change)。朊蛋白淀粉样纤维和Aβ淀粉样纤维不仅在形态学上相同,而且在理化属性上具相似性,包括疏水性增强和β折叠含量提高[18-19]。与淀粉样变性疾病不相关的蛋清溶菌酶蛋白在一定理化条件下也能够发生去折叠过程形成淀粉样纤维,已经作为蛋白模型材料来研究淀粉样纤维的形成机制[20-21]。
本研究使用蛋清溶菌酶蛋白在57 ℃、pH 2.0甘氨酸溶液孵育4 d后形成了淀粉样纤维,孵育8~10 d后纤维大量形成,纤维的超微结构呈短杆状且中心有轴, 直径约20 nm,与朊蛋白纤维和Aβ淀粉样纤维的超微结构相似,证明了由不同结构和功能的蛋白质形成的淀粉样纤维在形态学上极相似。分子动力学模拟和试验研究都证实了朊蛋白易在高温、酸性条件下形成淀粉样纤维[22-23],如朊蛋白多肽H2(helix 2,H2)在pH 2.9条件下形成了淀粉样纤维[14, 24]。与朊蛋白相似,蛋清溶菌酶蛋白在高温及酸性条件下能够形成淀粉样纤维,如57 ℃、pH 2.2[12],65 ℃、pH 2.0[6]和45~55 ℃、pH 3.8[17]等条件;Feng等[7]研究表明,pH 2.2甘氨酸溶液中57 ℃比45 ℃较易形成淀粉样纤维。高温和酸性环境可以通过改变蛋白质的构象稳定性和蛋白质间相互作用以促进蛋白质的部分变性和去折叠过程,进一步诱导蛋白质聚集和形成淀粉样纤维[11, 25-26]。因此,高温和酸性环境是影响淀粉样纤维形成的两个重要因素。此外,与天然HEWL蛋白相比,HEWL淀粉样纤维表面的疏水性增强,且8 d时的疏水性高于4 d,表明高温和酸性环境使蛋白质的疏水区域暴露程度增加,进一步驱动了纤维的形成和生长,证实了疏水区域暴露程度的增加能够促进蛋白质的去折叠和错误折叠过程[26];经圆二色谱法测定并使用自带CD multivariate SSE软件计算预测显示,与天然HEWL蛋白二级结构含量相比,孵育4和8 d的二级结构α螺旋含量分别降低了8.1%和17.8%,而β折叠含量分别提高了8.8%和16.3%,表明随着HEWL淀粉样纤维的形成和生长,一部分α螺旋结构转变成了β折叠结构,这与朊蛋白形成淀粉样纤维时发生了二级结构从α螺旋转化成β折叠的过程相似[13]。分子动力学模拟证实β折叠结构的形成驱动了蛋白组装成淀粉样纤维[27-28],因此,α螺旋转变成β折叠也是HEWL淀粉样纤维形成的重要驱动力。
该HEWL淀粉样纤维对培养的SH-SY5Y神经细胞产生了明显的毒性作用。HEWL纤维在较低浓度1 μmol·L-1处理细胞12 h已引起了极显著的细胞毒性,当处理时间延长至24和48 h时,或者使纤维浓度增加至2和3 μmol·L-1时,细胞毒性效果均逐渐增强,表明HEWL淀粉样纤维对SH-SY5Y神经细胞的毒性作用呈现时间依赖性和浓度依赖性;细胞形态学变化结果进一步证明,HEWL淀粉样纤维引起了SH-SY5Y神经细胞的凋亡。而使用pH 2.0甘氨酸溶液作为阴性对照,处理SH-SY5Y细胞48 h后未产生明显的影响,表明神经细胞毒性是由HEWL淀粉样纤维引起的。
4 结论蛋清溶菌酶蛋白在一定理化条件下可形成具有神经细胞毒性的淀粉样纤维。作者推测淀粉样纤维的神经细胞毒性取决于纤维结构本身,而不依赖于蛋白质的化学结构和功能。然而HEWL淀粉样纤维对SH-SY5Y神经细胞的毒性机制有待进一步研究。
| [1] |
YU K H, LEE C I. Quercetin disaggregates prion fibrils and decreases fibril-induced cytotoxicity and oxidative stress[J]. Pharmaceutics, 2020, 12(11): 1081. DOI:10.3390/pharmaceutics12111081 |
| [2] |
NASR S H, DASARI S, MILLS J R, et al. Hereditary lysozyme amyloidosis variant p. Leu102Ser associates with unique phenotype[J]. J Am Soc Nephrol, 2017, 28(2): 431-438. DOI:10.1681/ASN.2016090951 |
| [3] |
HE L, WANG X S, ZHU D S, et al. Methionine oxidation of amyloid peptides by peroxovanadium complexes: inhibition of fibril formation through a distinct mechanism[J]. Metallomics, 2015, 7(12): 1562-1572. DOI:10.1039/C5MT00133A |
| [4] |
DE FELICE F G, VIEIRA M N N, MEIRELLES M N L, et al. Formation of amyloid aggregates from human lysozyme and its disease-associated variants using hydrostatic pressure[J]. FASEB J, 2004, 18(10): 1099-1101. DOI:10.1096/fj.03-1072fje |
| [5] |
KREBS M R H, WILKINS D K, CHUNG E W, et al. Formation and seeding of amyloid fibrils from wild-type hen lysozyme and a peptide fragment from the β-domain[J]. J Mol Biol, 2000, 300(3): 541-549. DOI:10.1006/jmbi.2000.3862 |
| [6] |
SIVALINGAM V, PRASANNA N L, SHARMA N, et al. Wild-type hen egg white lysozyme aggregation in vitro can form self-seeding amyloid conformational variants[J]. Biophys Chem, 2016, 219: 28-37. DOI:10.1016/j.bpc.2016.09.009 |
| [7] |
FENG Z L, LI Y, BAI Y. Elevated temperatures accelerate the formation of toxic amyloid fibrils of hen egg-white lysozyme[J]. Vet Med Sci, 2021, 7(5): 1938-1947. DOI:10.1002/vms3.522 |
| [8] |
WANG L Q, ZHAO K, YUAN H Y, et al. Cryo-EM structure of an amyloid fibril formed by full-length human prion protein[J]. Nat Struct Mol Biol, 2020, 27(6): 598-602. DOI:10.1038/s41594-020-0441-5 |
| [9] |
NORLIN N, HELLBERG M, FILIPPOV A, et al. Aggregation and fibril morphology of the Arctic mutation of Alzheimer's Aβ peptide by CD, TEM, STEM and in situ AFM[J]. J Struct Biol, 2012, 180(1): 174-189. DOI:10.1016/j.jsb.2012.06.010 |
| [10] |
SETHURAMAN A, BELFORT G. Protein structural perturbation and aggregation on homogeneous surfaces[J]. Biophys J, 2005, 88(2): 1322-1333. DOI:10.1529/biophysj.104.051797 |
| [11] |
OW S Y, DUNSTAN D E. The effect of concentration, temperature and stirring on hen egg white lysozyme amyloid formation[J]. Soft Matter, 2013, 9(40): 9692-9701. DOI:10.1039/c3sm51671g |
| [12] |
MAHDAVIMEHR M, MERATAN A A, GHOBEH M, et al. Inhibition of HEWL fibril formation by taxifolin: Mechanism of action[J]. PLoS One, 2017, 12(11): e0187841. DOI:10.1371/journal.pone.0187841 |
| [13] |
PAN K M, BALDWIN M, NGUYEN J, et al. Conversion of alpha-helices into beta-sheets features in the formation of the scrapie prion proteins[J]. Proc Natl Acad Sci U S A, 1993, 90(23): 10962-10966. DOI:10.1073/pnas.90.23.10962 |
| [14] |
YAMAGUCHI K I, KUWATA K. Formation and properties of amyloid fibrils of prion protein[J]. Biophys Rev, 2018, 10(2): 517-525. DOI:10.1007/s12551-017-0377-0 |
| [15] |
MARIÑO L, PAUWELS K, CASASNOVAS R, et al. Ortho-methylated 3-hydroxypyridines hinder hen egg-white lysozyme fibrillogenesis[J]. Sci Rep, 2015, 5: 12052. DOI:10.1038/srep12052 |
| [16] |
李颖, 冯自立, 白瑜, 等. 蛋清溶菌酶的改造及其抑菌活性[J]. 畜牧兽医学报, 2021, 52(4): 1094-1102. LI Y, FENG Z L, BAI Y, et al. The modification of hen egg-white lysozyme and its antibacterial activity[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(4): 1094-1102. (in Chinese) |
| [17] |
SHARMA P, VERMA N, SINGH P K, et al. Characterization of heat induced spherulites of lysozyme reveals new insight on amyloid initiation[J]. Sci Rep, 2016, 6: 22475. DOI:10.1038/srep22475 |
| [18] |
GLYNN C, SAWAYA M R, GE P, et al. Cryo-EM structure of a human prion fibril with a hydrophobic, protease-resistant core[J]. Nat Struct Mol Biol, 2020, 27(5): 417-423. DOI:10.1038/s41594-020-0403-y |
| [19] |
GREMER L, SCHÖLZEL D, SCHENK C, et al. Fibril structure of amyloid-β(1-42) by cryo-electron microscopy[J]. Science, 2017, 358(6359): 116-119. DOI:10.1126/science.aao2825 |
| [20] |
SWAMINATHAN R, RAVI V K, KUMAR S, et al. Lysozyme: a model protein for amyloid research[J]. Adv Protein Chem Struct Biol, 2011, 84: 63-111. |
| [21] |
SERAJ Z, GROVES M R, SEYEDARABI A. Cinnamaldehyde and Phenyl Ethyl Alcohol promote the entrapment of intermediate species of HEWL, as revealed by structural, kinetics and thermal stability studies[J]. Sci Rep, 2019, 9(1): 18615. DOI:10.1038/s41598-019-55082-1 |
| [22] |
GU W, WANG T T, ZHU J, et al. Molecular dynamics simulation of the unfolding of the human prion protein domain under low pH and high temperature conditions[J]. Biophys Chem, 2003, 104(1): 79-94. DOI:10.1016/S0301-4622(02)00340-X |
| [23] |
SINGH J, UDGAONKAR J B. Unraveling the molecular mechanism of pH-induced misfolding and oligomerization of the prion protein[J]. J Mol Biol, 2016, 428(6): 1345-1355. DOI:10.1016/j.jmb.2016.01.030 |
| [24] |
YAMAGUCHI K I, KAMATARI Y O, FUKUOKA M, et al. Nearly reversible conformational change of amyloid fibrils as revealed by pH-jump experiments[J]. Biochemistry, 2013, 52(39): 6797-6806. DOI:10.1021/bi400698u |
| [25] |
BRUDAR S, HRIBAR-LEE B. The role of buffers in wild-type HEWL amyloid fibril formation mechanism[J]. Biomolecules, 2019, 9(2): 65. DOI:10.3390/biom9020065 |
| [26] |
WANG W, ROBERTS C J. Protein aggregation - Mechanisms, detection, and control[J]. Int J Pharm, 2018, 550(1-2): 251-268. DOI:10.1016/j.ijpharm.2018.08.043 |
| [27] |
PELLARIN R, CAFLISCH A. Interpreting the aggregation kinetics of amyloid peptides[J]. J Mol Biol, 2006, 360(4): 882-892. DOI:10.1016/j.jmb.2006.05.033 |
| [28] |
CERDÀ-COSTA N, ESTERAS-CHOPO A, AVILÉS F X, et al. Early kinetics of amyloid fibril formation reveals conformational reorganisation of initial aggregates[J]. J Mol Biol, 2007, 366(4): 1351-1363. DOI:10.1016/j.jmb.2006.12.007 |
(编辑 白永平)



