2. 中西兽医结合与动物保健福建省高等学校重点实验室, 福州 350002;
3. 福建省兽医中药与动物保健重点实验室, 福州 350002;
4. 中科国创(南平)生物科技股份有限公司, 南平 354200
2. University Key Laboratory for Integrated Chinese Traditional and Western Veterinary Medicine and Animal Healthcare in Fujian Province, Fuzhou 350002, China;
3. Fujian Key Laboratory of Traditional Chinese Veterinary Medicine and Animal Health, Fujian Agriculture And Forestry University, Fuzhou 350002, China;
4. ZooKo Biochec Technology Co. Ltd, Nanping 354200, China
鸡毒支原体(Mycoplasma gallisepticum,MG)是一种大小介于细菌和病毒之间的微生物,富含黏附蛋白,能顽固地黏附在呼吸道或泌尿道上皮细胞。能够引发鸡、火鸡及其他禽类的严重慢性呼吸道疾病(CRD)[1]。典型症状表现为咳嗽、流浆液性鼻液、湿性啰音。MG自报道以来广泛分布于世界上所有的养禽国家,每年给各养殖户带来严重的经济损失。据统计,鸡群在遭受MG感染之后弱雏增长率在10%左右; 蛋鸡的产蛋量下降20%左右; 肉鸡减重近40%[2]。国内外学者对MG感染的研究超过了60年,但MG感染仍然是现代集约化养禽业的防控重点[3]。
目前,疫苗仍是预防鸡毒支原体感染的主要方法,特别是在种鸡预防方面。然而,疫苗对MG感染不能完全保护,这可能是由于对MG与宿主相互作用以及宿主在感染后的免疫反应等方面认识有限。以往的研究证实了MG的致病作用与其在代谢过程中产生的神经氨酸酶、过氧化氢酶、卵磷脂酶、溶菌酶或溶血素有关; 也与出现在早期定植过程中的Gapa、CrmA和Pvpa等黏附蛋白存在高度相关性[4-5]。此外,体外鸡胚气管环研究检测发现,几种趋化因子和炎性细胞因子的表达释放,包括IL-18、IL-1β、TNF-α、IFN-γ、CCL20等[6-7],与黏膜炎症性病变存在高度相关性。尽管人们对MG与宿主之间的互作有所了解,但MG感染引起鸡气管黏膜炎性病变和黏膜免疫反应机制仍有待探索。
转录组测序已被应用于提供对分子机制的新见解,并探索宿主与病原体之间的相互作用[8]。因此,本研究首先利用MG-HY株菌液建立SPF雏鸡感染模型。随后,使用RNA-seq分析探索了感染组和对照组气管的全面基因表达谱。将表达量不同的基因(DEG)进行功能注释和分类,为鸡气管黏膜免疫相关基因的鉴定提供参考。最后,为了进一步证实转录组分析的结果,作者使用qRT-PCR验证了一些免疫相关基因表达,包括黏附分子(ALCAM、CD34、NECTIN1、CDH3)、炎性细胞因子(TNF-α、IL-1β、IL18、IL1R1)和趋化因子(CCL4、CXCL8、CXCL13、CXCL14、CCL20)。该数据为进一步研究MG与宿主之间的相互作用提供基础,并对临床上MG感染的防治具有重要的指导意义。
1 材料与方法 1.1 毒株和实验动物SPF鸡胚购自济南斯帕法斯家禽有限公司,SPF雏鸡由实验室自行孵化饲养。MG-HY株(TOC-ID50为10-4.5·0.2 mL-1),由本实验室分离鉴定保存[9]。
1.2 动物感染和样本采集将60只1日龄的健康SPF雏鸡随机分为两组(n =30),按照标准的育雏方法隔离饲养,两组饲养管理条件一致。在20日龄时,感染组和对照组雏鸡通过点眼滴鼻方式各接种0.2 mL·羽-1的MG-HY菌液和灭菌生理盐水,每日观察各组鸡只的临床症状,并对发病时间和临床症状特征进行详细记录。于接种后3、5、7和15 d,每次随机抽取6只雏鸡进行心脏采血处死后剖检,先观察气囊病变,根据Zhang等[10]的研究方法,评估气囊病变。后迅速采集气管组织。将部分气管组织用4%多聚甲醛固定,进行组织病理学分析。剩余的气管样品放置-80 ℃保存备用。
1.3 通过qRT-PCR定量气管中的MG负荷为了测定侵入气管内的细菌载量,在感染后3、5、7和15 d(分别记作3、5、7和15 dpi)无菌取雏鸡气管(每组n=6),使用PBS冲洗后称取100㎎组织在无菌条件下匀浆。按参考文献[11]建立的鸡毒支原体qRT-PCR检测方法,使用Roche Light Cycler仪器(Roche,上海)通过qRT-PCR检测雏鸡气管中MG的DNA含量。
1.4 基因文库构建与测序将气管组织保存在干冰中送Sangon Biotech有限公司进行测序分析,采用Total RNA Extractor(Trizol)提取试剂盒提取样品的Total RNA,经Qubit 2.0荧光计和Qubit2.0RNA试剂盒(Thermo,上海)评估合格后,使用Sangon Biotech(上海)的Illumina测序平台(Hiseq X Ten)上对cDNA文库进行测序[12]。
1.5 RNA-Seq数据分析Hiseq X Ten系统生成的原始序列数据首先运用Fast-QC (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)做质量评估,去除3′端测序接头序列和低质量(质量低于20个碱基)的碱基。干净读数以FASTQ格式存储并用于定量分析。然后采用Map Splice软件将过滤后序列与NCBI数据库Gallus gallus参考基因组进行比对,通过使用Picard工具(http://picard.sourceforge.net/)确定映射到每个基因的读数总数来推断每个基因的转录水平。运用DESeq软件进行差异表达的基因筛选,以log2 FC>1或 <-1且FDR < 0.05为阈值筛选差异表达基因,合并两组间的差异表达基因,通过基于MA绘图分析得到表达强度值[13]。
1.6 差异表达基因的功能注释对DESeq软件鉴定的log2倍数变化≥2的DEGs进行分析,通过基因本体(GO) (http://www.geneontology.org/)鉴定富集的生物学过程。最后,为了解DEGs相关的生物学途径,使用由KEGG自动注释服务器(KAAS)(http://www.genome.jp/tools/kaas/)运行的京都基因与基因组百科全书(KEGG)途径分析程序来获得功能注释。所有表达数据的统计和可视化均通过R包软件进行(http://www.r-project.org/)[14-15]。本研究中讨论的所有数据均已录入NCBI的基因表达综合数据库(GEO),收录号为SRR5186264。
1.7 差异表达基因qRT-PCR验证为了验证细菌感染气管差异表达基因的测序结果,选择黏附分子、细胞因子和趋化因子差异表达的基因(ALCAM、CD34、NECTIN1、CDH3、TNF-α、IL18、IL1R1、IL-1β、CCL4、CXCL13、CCL20、CXCL14)进行qRT-PCR,检测这些选定基因的mRNA水平。β-actin被用作参考基因以标准化靶基因的转录水平[16]。根据NCBI中鸡(Gallus gallus)的参考序列使用Primer 6.0软件设计引物,引物相关信息见表 1。qRT-PCR检测信号通路相关基因表达量的数据采用相对定量2-ΔΔCt方法进行计算[17],使用Graph Pad Prism 8软件展开表达量分析(在qRT-PCR反应中,设β-actin为内参)。
|
|
表 1 qRT-PCR引物 Table 1 qRT-PCR Primers |
雏鸡在感染MG后3 d(3 dpi)均无明显临床症状出现; 7 dpi,感染组个别雏鸡首先出现轻微的呼吸道症状; 15 dpi,感染组所有鸡均出明显的呼吸啰音,有4只鸡表现出咳嗽、眼部肿胀等症状。直至全群剖杀前,各组鸡均未出现死亡。
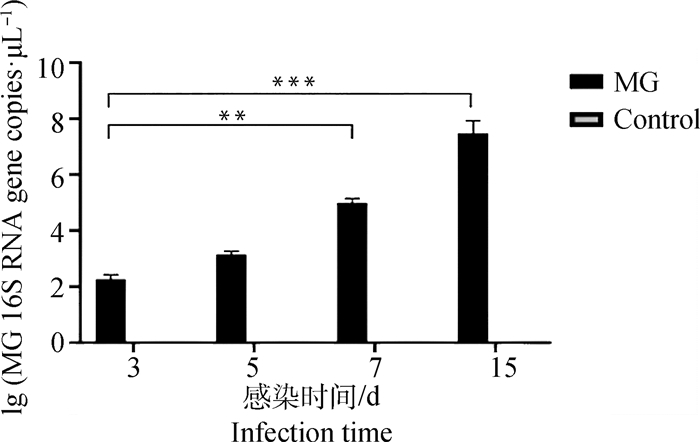
在3、5、7和15 dpi,对雏鸡进行剖检,剖检结果显示,感染组的鸡出现不同程度的气囊炎,气囊颜色浑浊和气囊壁增厚。对照组鸡均无明显病变,气囊透明无分泌物。雏鸡气管中的细菌DNA含量统计如图 1所示,在健康雏鸡气管中未检测到MG; 但感染组样本细菌载量在3 dpi约为1×102 copies·μL-1,5 dpi约为1×103copies·μL-1,在7和15 dpi显著增长,15 dpi时细菌载量约为1×108 copies·μL-1。
|
图 1 气管中细菌的载量分析 Fig. 1 Analysis of bacterial load in trachea |
15 dpi取感染组和对照组试验鸡的气管组织样本进行了转录组测序, 分别获得了超过5 500万条原始读数,质控后得到读数分别为57 745 164 (98.05%)、54 132 380(98.35%)。定位到鸡参考基因组,两组分别获得的定位读长为48 771 234和50 886 334,定位比例分别为92.93%和91.48%,所有样本的唯一映射读数率均>90%。此外,所有样本的GC含量均>50%以上,样本的基础质量评价指标(Q30)均>94%(表 2)。均一性评估结果显示(图 2),reads分布曲线平滑,未出现有断崖式上升或者下降。表明转录组文库中的mRNA片段化的随机性高,可以满足后续分析。
|
|
表 2 测序数据质控统计表 Table 2 QC statistical table of sequencing data |
|
图 2 试验样本的Reads在参考基因上的均一化分布统计 Fig. 2 Homogeneous distribution statistics of reads on reference genes for test samples |
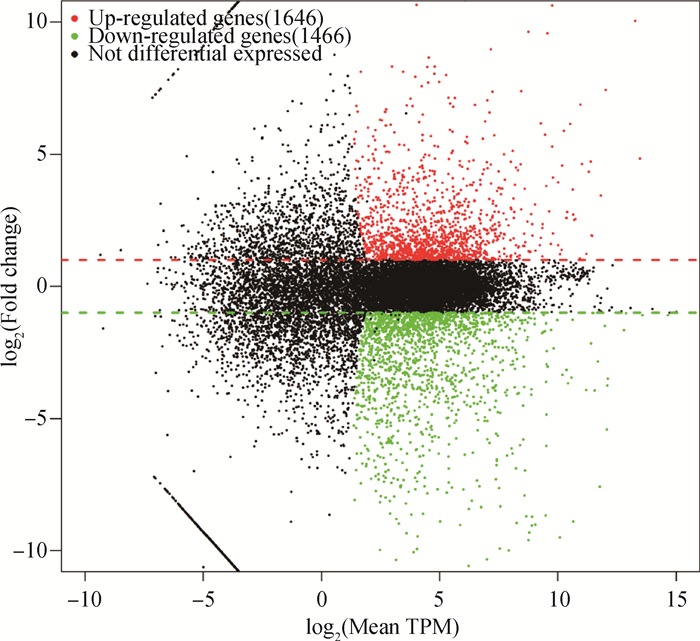
使用R包中的DESeq软件对15 dpi雏鸡气管的转录组数据进行差异表达分析。结果显示,感染组与对照组之间共筛选出3 112个显著(P < 0.01)差异表达基因(DEGs),其中, 1 646个上调基因,1 466个下调基因。通过MA图显示了DEGs的分布幅度(图 3)。通过NCBI数据库以鸡RefSeq mRNA数据库进行blastn相似性搜索,来实现差异表达基因的注释。
|
图 3 比较组表达差异基因分布火山图 Fig. 3 Volcano plot of differential gene distribution in comparison group |
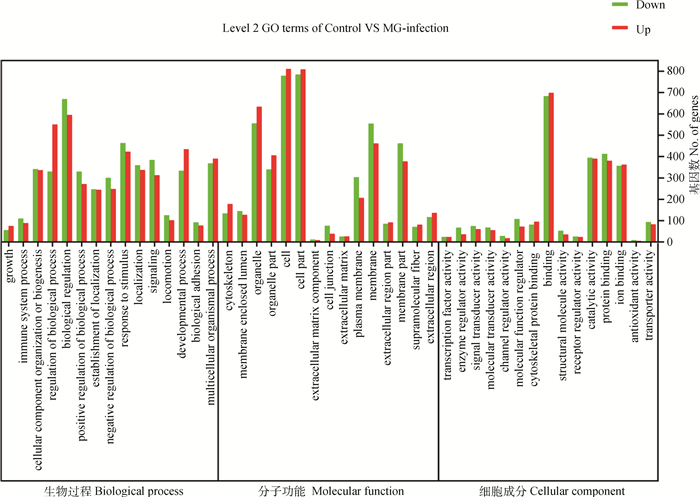
使用生物信息学工具DAVID对通过DESeq分析鉴定的差异表达基因功能进行了GO分析,以产生转录组文库的基因表达谱概述。根据它们的GO术语,总的差异基因被11 377个GO术语所标注,其中, 1 518个GO术语为显著富集(P < 0.05),根据GO注释将鸡Unigenes分为生物过程(1 986 Unigenes)、细胞组分(2 030 Unigenes)和分子功能(1 855 Unigenes)。因为一些基因被分为一个以上的子类别,所以这些子类别中的基因总和可能超过100%。对每个功能类别的前15个GO项进行了富集,并显示在(图 4),生物过程类别中最丰富的GO术语包括对生物调节(1 264 Unigenes)、刺激的反应(886 Unigenes)、多细胞生物过程(758 Unigenes)和细胞成分组织或生物发生(677 Unigenes)。至于细胞组分,1 592和1 588个Unigenes被分配到细胞和细胞部分GO术语,1 188个Unigenes被分配到细胞器术语,1 015个Unigenes个被分配到膜术语。在分子功能类别中,结合(1 380 Unigenes)、蛋白质结合(792 Unigenes)催化活性(774 Unigenes)是丰度最高的GO术语(图 4)。说明感染MG-HY株的雏鸡气管发生了复杂的生物学变化。
|
图 4 差异表达基因前15个最高的GO富集 Fig. 4 Top 15 highest GO enrichment of differentially expressed genes |
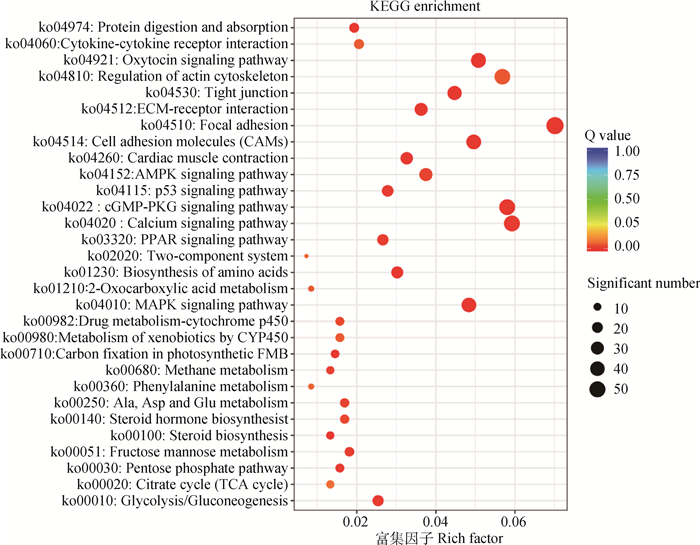
为了鉴定雏鸡的活跃生物学通路,使用KEGG注释系统对差异表达的Unigenes进行映射。对3 112个Unigenes进行KEGG注释,以(Q < 0.01)为条件判定差异表达基因Pathway富集的显著性(图 5)。结果表明,有827个Unigenes显著富集于30条的通路中,其中,几个高代表性的通路与鸡的黏膜免疫系统有关,包括细胞因子-细胞因子受体相互作用(240 Unigenes),细胞黏附分子(CAMs)(178 Unigenes),细胞外基质(ECM)受体相互作用(142 Unigenes)、紧密连接(178 Unigenes)、PPAR信号通路(48 Unigenes)和MAPK信号通路(12 Unigenes)等(表 3)。对这些途径的分析表明,MG感染影响了宿主气管免疫防御反应相关信号通路,使气管正常的生理活动和稳态受到异常调节,最终破坏气管组织形态结构并引起严重的炎症。
|
图 5 差异表达基因的KEGG显著性注释(top30) Fig. 5 KEGG significance annotation of differentially expressed genes (top30) |
|
|
表 3 免疫相关通路及其相关差异表达基因的富集 Table 3 Enrichment of immune-related pathways and their related differentially expressed genes |
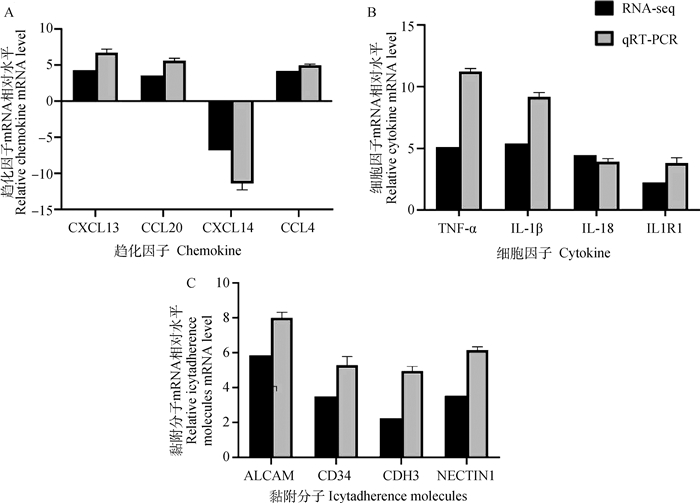
为了验证转录组测序的可靠性,对选择黏附分子、细胞因子和趋化因子差异表达的基因(ALCAM、CD34、NECTIN1、CDH3、TNF-α,IL18、IL1R1、IL-1β、CCL4、CXCL13、CCL20、CXCL14)进行qRT-PCR检测。结果如图 6所示,qRT-PCR检测结果与通过RNA-seq数据的结果趋势一致。从而证实了转录组测序结果的可靠性。
|
A.趋化因子mRNA相对水平; B.细胞因子mRNA相对水平; C.黏附分子mRNA相对水平 A. Relative chemokine mRNA level; B.Relative cytokines mRNA level; C.Relative icytadherence molecules mRNA level 图 6 qRT-PCR验证RNA-Seq中的差异表达基因 Fig. 6 qRT-PCR validation of differentially expressed genes in RNA-Seq |
MG是家禽慢性呼吸道疾病的主要病原体,感染后会造成巨大的经济损失[18]。在禽类呼吸系统中,气管充当与外界气体交换的通道,也是抵御外源污染物的第一道防线,因此使其成为MG攻击的首要目标[19]。本实验室前期研究发现MG感染引起雏鸡气管明显的组织学病变:包括雏鸡气管纤毛脱落、结构破坏、黏膜炎性细胞浸润等,导致气管炎症和呼吸功能障碍[20]。本研究为了进一步探究MG感染对鸡气管黏膜上皮损伤和黏膜免疫的作用机制,首先使用鸡毒支原体感染SFP雏鸡,随后,通过转录组测序分析(RNA-seq)探索了感染组和对照组鸡气管的全面基因表达谱。将DEGs进行功能注释和分类,筛选出与免疫相关的通路及其差异表达基因,对雏鸡气管与MG之间的互作机制提供了新的见解。
动物试验结果显示,MG感染组,15 dpi的所有雏鸡出现典型的临床症状和剖检病变:明显的呼吸啰音,咳嗽、眼部肿胀等症状,气囊增厚、积液,与先前研究结果一致。同样,研究表明,菌液接种后,MG在雏鸡气管内也显著增殖,感染组样本细菌载量在15 dpi对比3 dpi呈现4倍增长。说明细菌在气管内增殖与气管黏膜病变成正相关。然而,MG在宿主体内致病的机制研究仍不充分。
为了深入了解宿主的转录组谱如何响应MG感染的变化,作者运用RNA-seq技术对感染组和对照组的鸡气管组织进行转录组分析。在感染组和对照组的鸡气管组织中共鉴定出3 112个显著(P < 0.01)差异表达基因(DEGs),其中, 1 646个上调基因,1 466个下调基因(图 3)。数据分析显示,这些DEGs显著富集于免疫相关术语和途径,可能在抵抗MG感染中发挥重要作用。根据GO富集分析的结果显示,参与黏膜免疫应答子类别中差异基因显著失调,主要体现在生物调节、刺激的反应、多细胞生物过程、细胞成分组织或生物发生等生物过程。这表明MG定植在宿主气管的过程中,改变了宿主细胞膜的稳定性。先前的研究报道了MG脂质相关膜蛋白(LAMPs)是MG主要的毒力因子之一,它们可以刺激宿主细胞产生促炎细胞因子并诱导细胞凋亡和坏死[21-22]。本研究中,MG通过LAMPs与细胞受体结合后介导鸡气管上皮细胞的炎症反应,刺激下游信号通路几种促炎细胞因子(IL-1β、INF-α、IL18、IL1R1)和趋化因子(CCL20、CXCL13、CXCL14、CCL4)的活化。因此,诱导炎症细胞的激活和募集是MG发病机制的关键。
大多数已鉴定的DEGs参与宿主黏膜上皮免疫防御反应(P≤0.01),如表 3所示。当在生物学途径的背景下进行分析时差异基因显著富集于细胞因子-细胞因子受体相互作用,细胞黏附分子(CAMs),细胞外基质(ECM)受体相互作用、紧密连接、PPAR信号通路、MAPK信号通路和p53信号通路等。对这些途径的分析表明,在疾病发展过程中MG可能刺激一种或多种生理过程并引起气管免疫防御反应。免疫相关通路富集的DEGs在防御MG感染的潜在致病机制中发挥重要作用。细胞黏附分子是免疫系统的重要信号传递者,它们起到将抗原信号从细胞外传递到细胞内的作用[23-24]。本研究发现,许多显著富集在细胞黏附分子通路中,具有病原体识别、信号传递和调控白细胞与血管内皮细胞黏附等功能的黏附分子,包括ALCAM、CD34、NECTIN1和CDH3,在MG感染组雏鸡气管组织中下调。研究证实当黏附分子功能被下调后,宿主抗原呈递和加工能力会降低,使病原体逃避宿主的免疫系统进入呼吸道上皮细胞使其致病[25]。
宿主气管黏膜免疫应答的一个重要特征是参与炎症反应的DEGs活性增强,通过将免疫细胞吸引到炎症部位,直接参与炎症反应,并促进免疫反应和伤口愈合[26]。在本研究中检测到,主要富集于细胞因子-细胞因子受体相互作用信号通路的炎症因子和趋化因子,如IL18、IL1R1、TNF-α、IL-1β、CCL4和CXCL13等,在感染MG的雏鸡的气管组织中表达增强。IL18和IL1R1是促炎介质,参与许多细胞因子诱导的免疫和炎症反应[27-28]。TNF-α和IL-1β具有调节免疫应答功能,并在机体的抗感染免疫反应中起重要作用[29]; CCL4和CXCL13等趋化因子可以将免疫细胞募集到感染部位,进一步促进免疫细胞浸润,加剧气管组织病变[30]。MG感染后CXCL14的表达量降低了6倍,这与其他显著上调的趋化因子形成鲜明对比,如CXCL13(4倍),CCL4(3.5倍)和CCL20(3倍)。CXCL14在上皮组织中的稳定表达和高丰度,是一种针对呼吸道细菌的高活性抗菌肽(AMP),有助于肺部的细菌清除[31-32]。然而,尚未有任何关于家禽感染后产生的炎症刺激使趋化因子被抑制的报道。本研究CXCL14 mRNA表达水平受到炎症刺激的显著抑制,据此,作者推测CXCL14是在维持上皮组织稳态中发挥作用,在炎症条件建立之前就发挥灭菌功能,而不是直接参与炎症反应驱动的免疫过程,具体作用机制有待进一步验证。这些免疫相关的DEGs有助于阐明MG感染后雏鸡的免疫反应,但是,MG感染后通常无法清除,伴随着持续性免疫原性炎症使禽类易于合并感染其他病原体并导致CRD的发展。
本研究不仅丰富了鸡现有的序列信息数据,并且为进一步完善MG感染导致宿主气管上皮损伤和黏膜免疫机制提供依据。然而,仍然需要探索鸡毒支原体诱导强烈宿主反应的关键成分,雏鸡气管黏膜免疫的潜在机制也需要进一步研究证实。
4 结论运用RNA-seq探索了感染组和对照组鸡气管的全面基因表达谱。将DEGs进行功能注释和分类,鉴定出1 646个上调基因和1 466个下调基因。差异基因主要涉及生物调节、对刺激的反应、多细胞生物过程和细胞成分组织或生物发生等生物学过程和气管黏膜免疫相关信号通路。
| [1] |
BOWER K, DJORDJEVIC S P, ANDRONICOS N M, et al. Cell surface antigens of Mycoplasma species bovine group 7 bind to and activate plasminogen[J]. Infect Immun, 2003, 71(8): 4823-4827. DOI:10.1128/IAI.71.8.4823-4827.2003 |
| [2] |
丁亮. 鸡毒支原体F弱毒疫苗对肉鸡生长及免疫性能影响的研究[D]. 合肥: 安徽农业大学, 2011. DING L. The effect of F strain vaccine of M. gallisepticum on growth performance and immunity of broiler[D]. Hefei: Anhui Agricultural University, 2011. (in Chinese) |
| [3] |
陈继荣. 临床分离鸡毒支原体pvpA基因的分子特征及其原核表达[D]. 广州: 华南农业大学, 2008. CHEN J R. Molecular characterization of adhesin-encoding gene pvpA among isolated Mycoplasma gallisepticum and prokaryotic expression of PvpA[D]. Guangzhou: South China Agricultural University, 2008. (in Chinese) |
| [4] |
彭秀丽. 鸡毒霉形体黏附素特性鉴定及其鸡胚组织互作蛋白的分布研究[D]. 武汉: 华中农业大学, 2008. PENG X L. Characteristic identification of Mycoplasma gallisepticum adhesin protein and the distribution of its interactive proteins in chick embryo tissues[D]. Wuhan: Huazhong Agricultural University, 2008. (in Chinese) |
| [5] |
郝卫芳. 鸡毒霉形体HS株TM-1和mgc3基因的表位预测及原核表达[D]. 武汉: 华中农业大学, 2007. HAO W F. Epitope prediction and prokaryotic expression of genes of TM-1 & mgc3 of Mycoplasma gallisepticum HS strain[D]. Wuhan: Huazhong Agricultural University, 2007. (in Chinese) |
| [6] |
JAVED M A, FRASCA S Jr, ROOD D. Correlates of immune protection in chickens vaccinated with Mycoplasma gallisepticum strain GT5 following challenge with pathogenic M. gallisepticum strain Rlow[J]. Infect Immun, 2005, 73(9): 5410-5419. DOI:10.1128/IAI.73.9.5410-5419.2005 |
| [7] |
MAJUMDER S, ZAPPULLA F, SILBART L K. Mycoplasma gallisepticum lipid associated membrane proteins up-regulate inflammatory genes in chicken tracheal epithelial cells via TLR-2 ligation through an NF-κB dependent pathway[J]. PLoS One, 2014, 9(11): e112796. DOI:10.1371/journal.pone.0112796 |
| [8] |
BURGESS D J. A space for transcriptomics[J]. Nat Rev Genet, 2016, 17(8): 436-437. DOI:10.1038/nrg.2016.94 |
| [9] |
林琳. 闽北地区白羽肉鸡鸡毒支原体感染的病原学调查及其流行菌株的分离鉴定[D]. 福州: 福建农林大学, 2018. LIN L. Etiological investigation of M. gallisepticum in white meat-type chickens in northern Fujian province and isolation and identification of epidemic strains[D]. Fuzhou: Fujian Agricultural and Forestry University, 2018. (in Chinese) |
| [10] |
ZHANG D C, LONG Y Q, LI M, et al. Development and evaluation of novel recombinant adenovirus-based vaccine candidates for infectious bronchitis virus and Mycoplasma gallisepticum in chickens[J]. Avian Pathol, 2018, 47(2): 213-222. DOI:10.1080/03079457.2017.1403009 |
| [11] |
ZHANG W, LIU Y H, ZHANG Q M, et al. Mycoplasma gallisepticum infection impaired the structural integrity and immune function of bursa of fabricius in chicken: implication of oxidative stress and apoptosis[J]. Front Vet Sci, 2020, 7: 225. DOI:10.3389/fvets.2020.00225 |
| [12] |
AIRD D, ROSS M G, CHEN W S, et al. Analyzing and minimizing PCR amplification bias in Illumina sequencing libraries[J]. Genome Biol, 2011, 12(2): R18. DOI:10.1186/gb-2011-12-2-r18 |
| [13] |
WANG L K, FENG Z X, WANG X, et al. DEGseq: an R package for identifying differentially expressed genes from RNA-seq data[J]. Bioinformatics, 2010, 26(1): 136-138. DOI:10.1093/bioinformatics/btp612 |
| [14] |
ANDERS S, HUBER W. Differential expression analysis for sequence count data[J]. Genome Biol, 2010, 11(10): R106. DOI:10.1186/gb-2010-11-10-r106 |
| [15] |
MORIYA Y, ITOH M, OKUDA S. KAAS: an automatic genome annotation and pathway reconstruction server[J]. Nucleic Acids Res, 2007, 35(Web Server issue): W182-W185. |
| [16] |
施少华, 陈珍, 程龙飞, 等. 鸭源H7N9亚型禽流感病毒感染SPF鸡转录组学分析[J]. 中国人兽共患病学报, 2020, 36(11): 886-893. SHI S H, CHEN Z, CHENG L F, et al. Transcriptomic expression profiles of SPF chicken infected with duck-origin H7N9 subtype avian influenza virus[J]. Chinese Journal of Zoonoses, 2020, 36(11): 886-893. (in Chinese) |
| [17] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [18] |
孟冬霞, 贺东昌, 武果桃, 等. 鸡毒支原体感染病理模型复制[J]. 中国兽药杂志, 2012, 46(10): 36-38. MENG D X, HE D C, WU G T, et al. Establishment of pathology model of Mycoplasma gallisepticum infection[J]. Chinese Journal of Veterinary Drug, 2012, 46(10): 36-38. (in Chinese) |
| [19] |
SID H, HARTMANN S, PETERSEN H, et al. Mycoplasma gallisepticum modifies the pathogenesis of influenza A virus in the avian tracheal epithelium[J]. Int J Med Microbiol, 2016, 306(3): 174-186. DOI:10.1016/j.ijmm.2016.04.001 |
| [20] |
吴春琳, 黄宝钦, 蓝天韵, 等. 福建白羽肉鸡鸡毒支原体的分离鉴定及最小抑菌浓度测定[J]. 中国畜牧兽医, 2021, 48(4): 1489-1497. WU C L, HUANG B Q, LAN T Y, et al. Isolation, identification and minimum inhibitory concentration determination of Mycoplasma gallisepticum from white-feathered broilers in Fujian[J]. China Animal Husbandry & Veterinary Medicine, 2021, 48(4): 1489-1497. (in Chinese) |
| [21] |
KORYTINA G F, AKHMADISHINA L Z, KOCHETOVA O V, et al. The role of serum amyloid A1, adhesion molecules, chemokines, and chemokine receptors genes in chronic obstructive pulmonary disease[J]. Russ J Genet, 2019, 55(1): 105-113. DOI:10.1134/S1022795418120050 |
| [22] |
YU Y, CHEN Y, WANG Y, et al. TLR2/MyD88/NF-κB signaling pathway regulates IL-1β production in DF-1 cells exposed to Mycoplasma gallisepticum LAMPs[J]. Microb Pathog, 2018, 117: 225-231. DOI:10.1016/j.micpath.2018.02.037 |
| [23] |
SWART G W M. Activated leukocyte cell adhesion molecule (CD166/ALCAM): developmental and mechanistic aspects of cell clustering and cell migration[J]. Eur J Cell Biol, 2002, 81(6): 313-321. DOI:10.1078/0171-9335-00256 |
| [24] |
SAMANTA D, ALMO S C. Nectin family of cell-adhesion molecules: structural and molecular aspects of function and specificity[J]. Cell Mol Life Sci, 2015, 72(4): 645-658. DOI:10.1007/s00018-014-1763-4 |
| [25] |
NI L G, SONG C Y, WU X S, et al. RNA-seq transcriptome profiling of porcine lung from two pig breeds in response to Mycoplasma hyopneumoniae infection[J]. PeerJ, 2019, 7: e7900. DOI:10.7717/peerj.7900 |
| [26] |
MOHAMMED J, FRASCA S Jr, CECCHINI K, et al. Chemokine and cytokine gene expression profiles in chickens inoculated with Mycoplasma gallisepticum strains Rlow or GT5[J]. Vaccine, 2007, 25(51): 8611-8621. DOI:10.1016/j.vaccine.2007.09.057 |
| [27] |
JAHEJO A R, NIU S, ZHANG D. Transcriptome analysis of MAPK signaling pathway and associated genes to angiogenesis in chicken erythrocytes on response to thiram-induced tibial lesions[J]. Res Vet Sci, 2019, 127: 65-75. DOI:10.1016/j.rvsc.2019.10.013 |
| [28] |
QU J R, WANG W, ZHANG Q J, et al. Inhibition of lipopolysaccharide-induced inflammation of chicken liver tissue by selenomethionine via TLR4-NF-κB-NLRP3 signaling pathway[J]. Biol Trace Elem Res, 2020, 195(1): 205-214. DOI:10.1007/s12011-019-01841-0 |
| [29] |
ZOU M Y, YANG W L, NIU L M, et al. Polydatin attenuates Mycoplasma gallisepticum (HS strain)-induced inflammation injury via inhibiting the TLR6/MyD88/NF-κB pathway[J]. Microb Pathog, 2020, 149: 104552. DOI:10.1016/j.micpath.2020.104552 |
| [30] |
BEAUDET J, TULMAN E R, PFLAUM K, et al. Immunologic pathways in protective versus maladaptive host responses to attenuated and pathogenic strains of Mycoplasma gallisepticum[J]. Infect Immun, 2019, 87(3): e00613-18. |
| [31] |
DAI C, BASILICO P, CREMONA T P, et al. CXCL14 displays antimicrobial activity against respiratory tract bacteria and contributes to clearance of Streptococcus pneumoniae pulmonary infection[J]. J Immunol, 2015, 194(12): 5980-5989. DOI:10.4049/jimmunol.1402634 |
| [32] |
MAERKI C, MEUTER S, LIEBI M, et al. Potent and broad-spectrum antimicrobial activity of CXCL14 suggests an immediate role in skin infections[J]. J Immunol, 2009, 182(1): 507-514. DOI:10.4049/jimmunol.182.1.507 |
(编辑 白永平)



