布鲁氏菌(Brucella)引起的布鲁氏菌病(简称布病)作为一种严重的人畜共患病流行于世界170多个国家和地区,造成每年约50万人感染[1]。近年来,我国由于养殖量的快速提升和动物及其产品流动性的增加,布病已经扩散至全国各个省区,牛羊布病防控形势严峻[2]。因此,全面阐明布鲁氏菌的病原特点、揭示其免疫逃逸、毒力调控机制等致病机理,探寻新的、有效的治疗靶点,成为布病防控亟待解决的关键和该领域研究的核心。
细胞凋亡是为维持内环境稳定,由基因控制的细胞程序性死亡[3]。内质网应激(endoplasmic reticulum stress, ER stress)是诱导细胞凋亡的主要通路,内质网应激能增强非折叠蛋白反应,在蛋白糖基化作用和专有伴侣分子(binding immunoglobulin protein, BiP; also known as GRP78)的辅助下,维持细胞稳态;但强烈或持续的内质网应激,细胞无法维持稳态,将引起C/EBP同源蛋白(C/EBP homologous protein, CHOP)、半胱氨酸蛋白酶-3(caspase-3)的表达与活化,导致内质网应激介导的凋亡发生[4-5]。布鲁氏菌在内质网能够激活适度的ER Stress,抑制CHOP诱导的细胞凋亡,确保自身在胞内的生存与增殖[6-7]。
外膜蛋白(outer membrane protein,OMP)是布鲁氏菌细胞壁的主要组成成分,具有较强的免疫原性和保护性,在维持菌体结构稳定、营养摄取、激活宿主免疫应答中发挥重要作用,影响细菌毒力[1, 8]。OMP16在不同布鲁氏菌菌株中高度保守,能被免疫系统模式受体识别,作为自佐剂疫苗和病原检测靶点已被广泛研究[9-12];本实验室前期研究发现,布鲁氏菌缺失Omp16基因菌体致死,低表达Omp16降低布鲁氏菌在巨噬细胞及小鼠体内的存活,改变机体免疫因子IL-1β、IL-6、TNF-α等的表达[13-14],但OMP16蛋白对巨噬细胞凋亡及免疫活性的调控研究仍未阐明。本试验利用OMP16处理RAW264.7细胞为模型,检测内质网应激反应的标志性因子GRP78和CHOP的表达、细胞凋亡及细胞上清液中免疫因子的变化,为深入研究宿主细胞与布鲁氏菌感染互作关系提供试验数据。
1 材料与方法 1.1 细胞系与菌株小鼠RAW264.7巨噬细胞系由农业农村部动物生物技术重点实验室保存。RAW264.7细胞用含10%胎牛血清的DMEM培养液培养于37 ℃、5% CO2的培养箱中,细胞长至70%~80%时传代培养,用于后续试验。
1.2 材料和仪器DMEM细胞培养基购于Hyclone公司;MTT试剂购于Sigma公司;凯基全蛋白提取试剂盒,凯基BCA蛋白测定试剂盒,Annexin V-FITC细胞凋亡检测试剂盒均购于凯基生物公司;抗Caspase-3标签抗体购于Abcam公司;抗GRP78标签抗体,抗CHOP标签抗体购于SANTA公司;PrimeScriptTM RT reagent ki、RNAiso Plus和逆转录试剂盒购于TaKaRa公司。其他试剂为国产分析纯。
离心机购于德国Eppendorf公司;二氧化碳培养箱购于美国Thermo公司;蛋白电泳仪及转膜仪购于美国BioRAD公司。
1.3 OMP16蛋白表达与纯化按照实验室建立的OMP16原核表达纯化方法,表达纯化OMP16蛋白。pET-32a-OMP32重组质粒测序验证后,转化至大肠杆菌BL21,1 mmol·L-1 IPTG,30 ℃诱导表达12 h,收集菌体后超声破碎,SDS-PAGE检测蛋白表达形式,按Ni-NAT说明书步骤纯化并收集蛋白,PBS透析,TritonX-114去除内毒素,BCA法检测蛋白浓度后-80 ℃保存备用。
1.4 MTT试验将生长状态良好且处于对数期的RAW264.7细胞,按照2×104个细胞·孔-1接种于96孔板,细胞融合80%时,将OMP16蛋白按用0.1、1.0、10.0、50.0、100.0 μg·mL-1的浓度梯度添加于培养液中;24 h后添加MTT试剂,20 μL·孔-1,37 ℃培养4 h后,加入150 μL DMSO试剂,充分轻摇混匀,于490 nm处测量吸光值。
1.5 Hoechst试验将生长状态良好且处于对数期的RAW264.7细胞,按照5×104个细胞·孔-1均匀接种于48孔板,置于37 ℃、5% CO2培养箱,培养过夜;OMP16蛋白按照设置的浓度梯度添加入48孔板内,24 h后弃去培养液,每孔加入0.5 mL固定液固定10 min,洗涤后,每孔0.5 mL细胞染色液,避光放置于4 ℃冰箱20~30 min;洗涤后,使用荧光倒置显微镜检测。
1.6 免疫荧光试验将RAW264.7细胞接种于事先在孔底放有圆形爬片的24孔板中,置于37 ℃、5% CO2饱和湿度条件培养过夜;加入OMP16蛋白作用36 h后,弃去培养液,PBS洗涤3次,4% 多聚甲醛固定细胞爬片30 min,PBS洗涤3次;加入0.5%Triton-100,室温透膜20 min,PBS洗涤3次;5%牛血清白蛋白,室温封闭1 h;孵育1∶100稀释的Caspase-3抗体,4 ℃过夜,PBS洗涤3次;室温避光孵育1∶2 000稀释的GFP标记抗兔荧光二抗1 h,洗涤3次;滴加DAPI染核,避光孵育15 min,PBS洗涤3次;用中性树脂封片,激光共聚焦显微镜观察并拍照。
1.7 Western blot检测利用RIPA裂解液提取OMP16刺激的RAW264.7细胞总蛋白,BCA蛋白含量检测试剂盒测定蛋白浓度。经SDS-PAGE跑胶分离后,60 V恒压湿转至PVDF膜,5%脱脂奶粉室温封闭1 h,1∶200稀释的Caspase-3抗体和1∶2 000稀释的β-actin抗体4 ℃孵育过夜;TBST洗涤5次,1∶5 000稀释的辣根过氧化物酶标记抗兔二抗,室温孵育1 h,使用凝胶成像系统曝光检测。使用Image J软件分析条带灰度值,目的蛋白与β-actin灰度值的比值即为目的蛋白的相对表达水平。
1.8 荧光定量PCR检测利用Trizol裂解液提取OMP16刺激的RAW264.7细胞总RNA,测定浓度后,使用TaKaRa逆转录试剂盒反转录总RNA合成cDNA。根据GenBank中山羊GRP78(NM_001163434.1)及CHOP(NM_007837.3)的序列号设计引物,GRP78-F(5′-AGAAACTCCGGCGTGAGGTAGA-3′)、GRP78-R(5′-TTCCTGGACAGGCTTCATGGTA-3′)以及CHOP-F(5′-AGCTGGAAGCCTGGTATGAGGA-3′)、CHOP-R(5′-AGCTAGGGACGCA-GGGTCAA-3′)以及内参序列GAPHD-F(5′-AGGTCGGTGTGAACGGATTTG-3′)、GAPDH-R(5′-GGGGTCGTTGATGGCAACA-3′)。以cDNA为模板,参照TaKaRa公司的PrimeScriptTM RT reagent Kit说明书,进行定量PCR反应体系配制:SYBR® Premix Ex TaqTMII 10 μL, DNAase/RNase-free水6.8 μL,cDNA1.6 μL,PCR Forward Primer (10 μmol·L-1) 0.8 μL,PCR Reverse Primer (10 μmol·L-1) 0.8 μL,总体积20 μL。反应程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环,72 ℃3 min。以GAPDH为内参,采用2-△△Ct计算GRP78和CHOP的转录情况。
1.9 流式细胞术检测取生长良好的RAW264.7细胞均匀铺板在六孔板内,设置对照组及OMP16刺激组,收集数量为1×105左右的细胞,PBS洗涤后加入200 μL Binding Buffer重悬细胞;加入10 μL Annexin V-FITC混匀,避光室温条件下反应15 min;加入300 μL Binding Buffer及5 μL PI,1 h之内用流式细胞仪检测。
1.10 数据统计与分析用GraphPad Prism5进行制图,数据使用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),试验数据表示为“x±s”,P < 0.05表示差异显著,P < 0.01表示差异极显著。
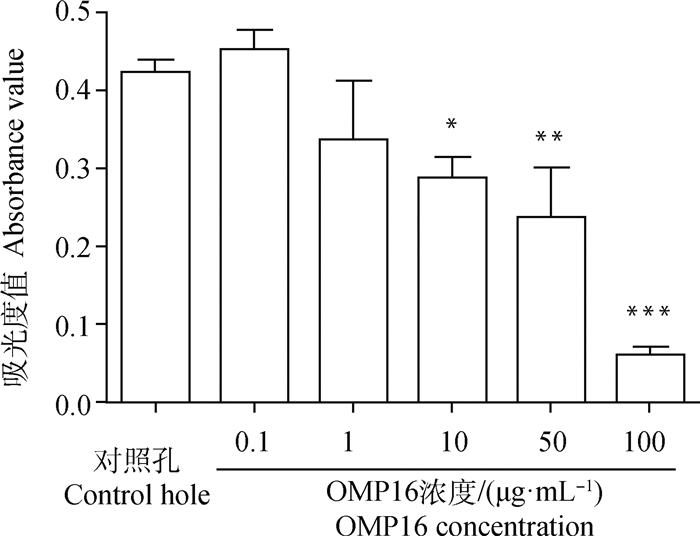
2 结果 2.1 OMP16最佳作用浓度及时间筛选RAW264.7细胞与0.1、1、10、50、100 μg·mL-1的浓度的OMP16作用24 h后,通过MTT与Hoechst方法确定OMP16作用的最佳浓度(图 1、2)。
|
*.P < 0.05;**.P < 0.01;***.P < 0.001 图 1 MTT法筛选OMP16作用于RAW264.7细胞最佳浓度 Fig. 1 The optimal concentration of OMP16 on RAW264.7 screened by MTT assay |

|
图 2 Hoechst法筛选OMP16作用于RAW264.7细胞最佳浓度 Fig. 2 The optimal concentration of OMP16 on RAW264.7 screened by Hoechst assay |
图 1显示,当OMP16浓度达到10 μg·mL-1时,显著影响细胞活性(P < 0.05),当浓度达到100 μg·mL-1时,OMP16极显著影响细胞活性(P < 0.001)。0.1及1 μg·mL-1 OMP16刺激后,细胞凋亡较少(图 2),50 μg·mL-1 OMP16处理后细胞开始大量凋亡,直至100 μg·mL-1 OMP16处理时细胞已全部凋亡,10 μg·mL-1 OMP16刺激可引起部分细胞凋亡。综上,确定10 μg·mL-1为OMP16作用于RAW264.7细胞的最佳浓度。
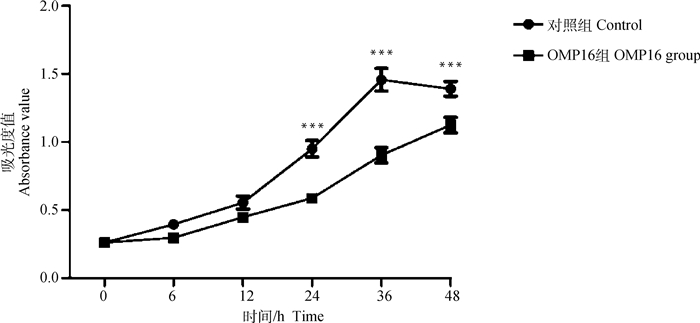
根据上述确定的浓度10 μg·mL-1,设计6个时间点,设置空白对照组及OMP16刺激组,分别将稀释好的10 μg·mL-1 OMP16培养液添加到RAW264.7细胞培养孔,作用相应时间后采用MTT法确定最佳作用时间点,如图 3所示,可以看出OMP16明显抑制RAW264.7细胞的生长;在24~36 h,OMP16处理的RAW264.7细胞与正常组细胞生长差异极显著(P < 0.001)。综上,确定36 h为OMP16作用于RAW264.7细胞的最佳时间。
|
***.P < 0.001 图 3 MTT法筛选OMP16作用于RAW264.7细胞最佳时间 Fig. 3 The optimal action time of OMP16 on RAW264.7 by MTT assay |
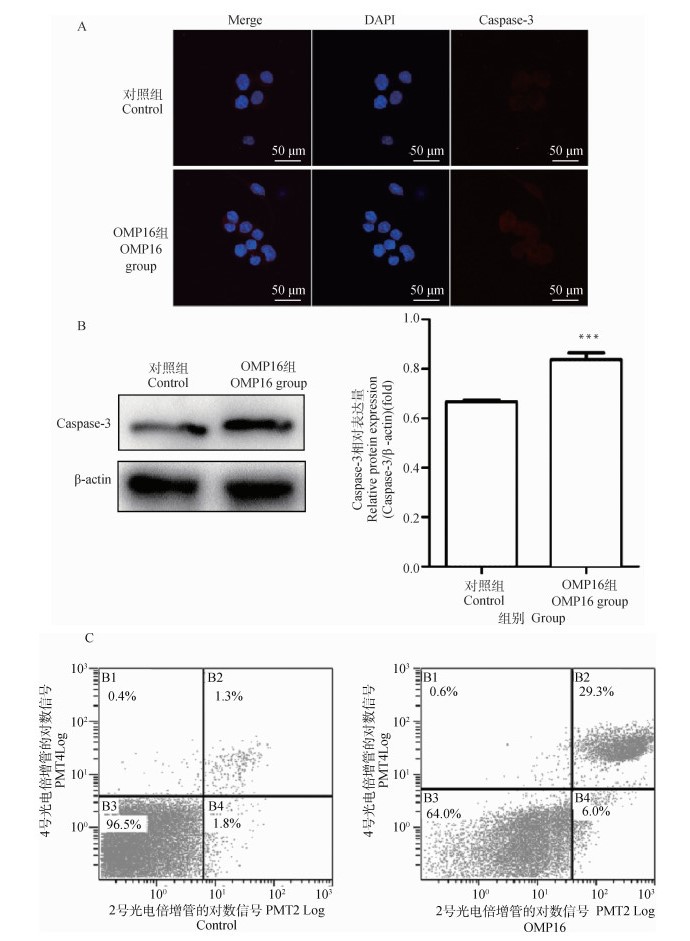
为确定OMP16对细胞凋亡通路的影响,采用免疫荧光法及Western blot检测Caspase-3蛋白的表达。如图 4 A图所示,OMP16处理后Caspase-3的总量显著增多;如图 4 B图所示,与对照组相比,OMP16组Caspase-3/β-actin比值极显著升高(P < 0.001)。流式细胞术检测结果显示,OMP16能引起RAW264.7细胞显著的早期凋亡与晚期凋亡(图 4 C,表 1)。
|
A. 细胞爬片免疫荧光法;B. Western blot法(检测Caspase-3, ***.P < 0.001); C. 流式细胞术 A. Cell immunofluorescence assay; B. Western blot assay(detect Caspase-3, ***.P < 0.001); C. FCM assay 图 4 OMP16对RAW264.7细胞凋亡的检测 Fig. 4 The detection of apoptosis in RAW264.7 stimulated by OMP16 |
|
|
表 1 流式细胞术凋亡率统计(x±s) Table 1 The apoptosis rates statistics of FCM assay (x±s) |
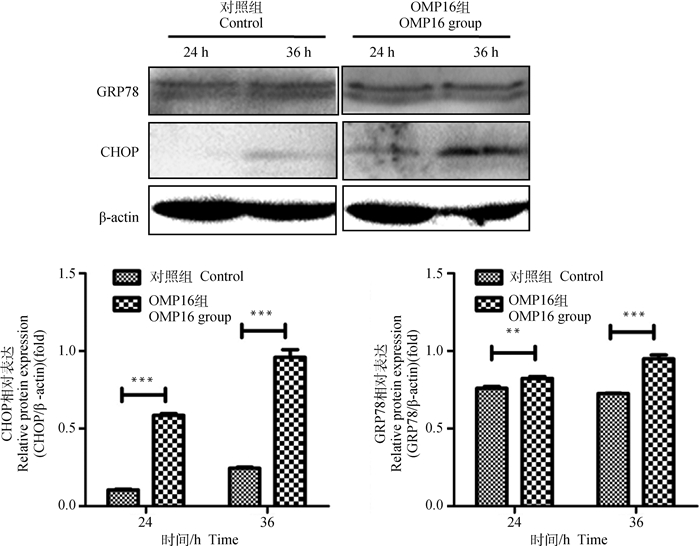
ER Stress是诱导细胞凋亡的重要通路。为了探讨OMP16引起的RAW264.7细胞凋亡是否与ER Stress有关,Wsetern blot检测了两个ER Stress与凋亡相关蛋白GRP78与CHOP的表达。如图 5所示,OMP16处理极显著的引起了CHOP表达的升高(P < 0.001),GRP78的表达在24 h(P < 0.01)和36 h(P < 0.001)同样出现显著的升高。
|
**.P < 0.01; ***.P < 0.001 图 5 RAW264.7细胞内质网应激主要因子检测结果 Fig. 5 The results of ERS' main factors in RAW264.7 |
为了探讨OMP16对巨噬细胞RAW264.7细胞的免疫活性影响,作者检测了对照组细胞与OMP16刺激组细胞IL-1β、IL-6、TNF-α mRNA的转录情况,如图 6所示,IL-1β、IL-6、TNF-α在OMP16刺激36 h后,转录量均显著上升(P < 0.01,P < 0.01,P < 0.05)。
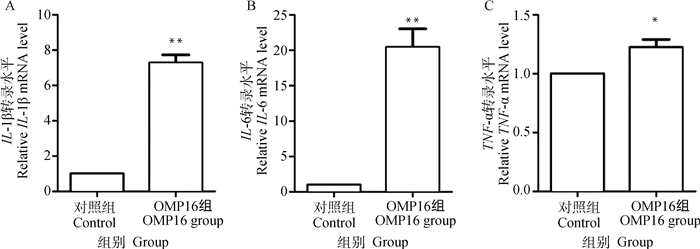
|
*.P < 0.05; **.P < 0.01 图 6 RT-qPCR检测RAW264.7细胞免疫因子转录情况 Fig. 6 The transcription of immune factors in RAW264.7 detected by RT-qPCR assay |
布鲁氏菌病是世界范围内严重威胁人类健康、公共卫生和畜牧业健康发展的重大人畜共患病。由于布鲁氏菌为胞内感染菌,体液免疫和抗生素很难发挥作用,在人尚缺乏成功的疫苗,应用于家畜的疫苗对人畜均具有残余毒力[15]。因此,深入研究其毒力因子,揭示其致病机制对于创制新的疫苗和治疗靶点均具有重要科学意义。
布鲁氏菌在吞噬细胞内长期存活是建立和维持慢性感染的基础[1]。抑制细胞凋亡是布鲁氏菌逃避免疫反应并建立慢性感染的重要策略[16]。布鲁氏菌进化出许多特有的毒力因子或毒力系统,如脂多糖、外膜蛋白、Ⅳ型分泌系统及其效应因子VceC、BspC等,调控宿主细胞的凋亡及免疫应答[6-7, 17-19]。omp16基因是布鲁氏菌存活的必需基因,OMP16蛋白位于布鲁氏菌细胞膜的外侧[20]。前期研究表明,omp16基因在不同菌株中高度保守,降低OMP16的表达,能有效降低布鲁氏菌在胞内及小鼠体内的存活[14]。本研究发现OMP16感染能够降低巨噬细胞的活性,诱导内质网应激引起的细胞凋亡。内质网是细胞各种蛋白合成、加工、运输和分泌的主要场所,对维持细胞稳态极为重要[21]。当病原菌感染细胞,胞内稳态不能及时得到恢复,就会引发内质网应激相关促凋亡分子CHOP和Caspas-3的表达活化,进而导致细胞凋亡[6, 22-23]。粗糙型布鲁氏菌能够引发巨噬细胞线粒体膜通透性的改变促进凋亡,而光滑型布鲁氏菌能够抑制巨噬细胞的自发性凋亡[24-25]。当光滑型布鲁氏菌在巨噬细胞内的增殖达到一定程度后,可以分裂成对巨噬细胞具有细胞毒性作用的粗糙型菌株进而促进布鲁氏菌的扩散[24]。而在此过程中,毒力因子发挥重要作用。效应蛋白BspJ作为核调节蛋白抑制巨噬细胞的凋亡[18],在小鼠模型中,VceC诱导胎盘滋养层细胞产生炎性因子,并导致宿主细胞的凋亡[26]。而在山羊滋养层细胞中,VceC则通过内质网应激通路抑制CHOP引起的细胞凋亡[6]。外膜蛋白OMP31则能抑制TNF-α诱导的巨噬细胞凋亡[27]。本研究表明,OMP16能够增强GRP78和CHOP的表达,促进巨噬细胞RAW264.7的凋亡。Caspase-3作为细胞凋亡中最主要的终末剪切酶,在细胞凋亡中起着不可替代的作用[3, 28]。本试验发现OMP16能够引起巨噬细胞Caspase-3表达量显著增多。不同布鲁氏菌菌株以及不同毒力因子等引起的凋亡反应差异,可能是由于菌株致病机制差异以及感染细胞不同所引起。
布鲁氏菌入侵机体后可引起促炎因子的表达释放,感染初期的炎性反应能够协助布鲁氏菌实现免疫逃逸[29]。在本研究中,OMP16诱导巨噬细胞产生IL-1β、IL-6和TNF-α。IL-1β是经典的炎症因子能够趋化、激活中性粒细胞,过量表达能诱导巨噬细胞凋亡[30]。研究表明, B. abortus感染RAW 264.7细胞增加了IL-1β的表达和分泌[31]。OMP25刺激巨噬细胞分泌大量IL-1β[28]。IL-6具有功能二象性,并强烈参与抗炎和促炎功能[32]。布鲁氏菌及其外膜蛋白OMP10、OMP19、OMP25和OMP28显著诱导巨噬细胞IL-6、TNF-α高水平表达[28, 33]。此外,流产B. abortus通过IL-6减少宿主MHC-II和CIITA的表达[34]。对细胞因子的调控,是布鲁氏菌破宿主坏免疫监视,造成持续性感染的策略之一,OMP16的发病机制有待更加深入是研究。
综上所述,布鲁氏菌OMP16能够诱导RAW264.7凋亡,OMP16显著引起内质网应激的发生,CHOP作为连接内质网应激与细胞凋亡的关键通路蛋白,其上调表达,可能是OMP16通过内质网应激调控细胞凋亡的关键分子与靶点,具体的机制需要进一步试验验证。
4 结论布鲁氏菌OMP16激活内质网应激,上调CHOP的表达,并诱导细胞凋亡。
| [1] |
BYNDLOSS M X, TSOLIS R M. Brucella spp. virulence factors and immunity[J]. Annu Rev Anim Biosci, 2016, 4: 111-127. DOI:10.1146/annurev-animal-021815-111326 |
| [2] |
LIU X F, YANG M H, SONG S N, et al. Brucella melitensis in Asian badgers, Northwestern China[J]. Emerg Infect Dis, 2020, 26(4): 804-806. |
| [3] |
GRIFFIOEN A W, NOWAK-SLIWINSKA P. A quarter century of Apoptosis[J]. Apoptosis, 2021, 26(5-6): 233-234. DOI:10.1007/s10495-021-01672-2 |
| [4] |
LU X, LI C M, LI C C, et al. Heat-labile enterotoxin-induced PERK-CHOP pathway activation causes intestinal epithelial cell apoptosis[J]. Front Cell Infect Microbiol, 2017, 7: 244. DOI:10.3389/fcimb.2017.00244 |
| [5] |
GUPTA M K, TAHRIR F G, KNEZEVIC T, et al. GRP78 interacting partner Bag5 responds to ER stress and protects cardiomyocytes from ER stress-induced apoptosis[J]. J Cell Biochem, 2016, 117(8): 1813-1821. DOI:10.1002/jcb.25481 |
| [6] |
ZHI F J, ZHOU D, BAI F R, et al. VceC mediated IRE1 pathway and inhibited CHOP-induced apoptosis to support Brucella replication in goat trophoblast cells[J]. Int J Mol Sci, 2019, 20(17): 4104. DOI:10.3390/ijms20174104 |
| [7] |
杨琴, 邓肖玉, 谢珊珊, 等. 牛种布鲁氏菌Ⅳ型分泌系统对巨噬细胞内质网应激和细胞凋亡的影响[J]. 畜牧兽医学报, 2022, 53(4): 1192-1200. YANG Q, DENG X Y, XIE S S, et al. Effects of Brucella bovis type IV secretion system on endoplasmic reticulum stress and apoptosis of macrophages[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(4): 1192-1200. (in Chinese) |
| [8] |
GŁOWACKA P, ŻAKOWSKA D, NAYLOR K, et al. Brucella - virulence factors, pathogenesis and treatment[J]. Pol J Microbiol, 2018, 67(2): 151-161. DOI:10.21307/pjm-2018-029 |
| [9] |
HUY T X N, NGUYEN T T, REYES A W B, et al. Immunization with a combination of four recombinant Brucella abortus proteins Omp16, Omp19, Omp28, and L7/L12 induces T helper 1 immune response against virulent B. abortus 544 infection in BALB/c mice[J]. Front Vet Sci, 2021, 7: 577026. DOI:10.3389/fvets.2020.577026 |
| [10] |
REZAEI M, KHORASGANI M R, ESFAHANI S H Z, et al. Production of Brucella melitensis Omp16 protein fused to the human interleukin 2 in Lactococcus lactis MG1363 toward developing a Lactococcus-based vaccine against brucellosis[J]. Can J Microbiol, 2020, 66(1): 39-45. DOI:10.1139/cjm-2019-0261 |
| [11] |
ALIZADEH H, DEZFULIAN M, RAHNEMA M, et al. Protection of BALB/c mice against pathogenic Brucella abortus and Brucella melitensis by vaccination with recombinant Omp16[J]. Iran J Basic Med Sci, 2019, 22(11): 1302-1307. |
| [12] |
PRUSTY B R, TABASSUM R, CHAUDHURI P, et al. Expression of Omp16 and L7/L12 Brucella abortus protective antigens as secretory fusion proteins in mammalian cells[J]. Indian J Biotechnol, 2017, 16(3): 289-295. |
| [13] |
ZHOU D, ZHI F J, FANG J Y, et al. RNA-Seq analysis reveals the role of Omp16 in Brucella-infected RAW264. 7 cells[J]. Front Vet Sci, 2021, 8: 646839. DOI:10.3389/fvets.2021.646839 |
| [14] |
ZHI F J, ZHOU D, LI J M, et al. Omp16, a conserved peptidoglycan-associated lipoprotein, is involved in Brucella virulence in vitro[J]. J Microbiol, 2020, 58(9): 793-804. DOI:10.1007/s12275-020-0144-y |
| [15] |
SUN S J, JIANG H, LI Q L, et al. Safety and transcriptome analysis of live attenuated brucella vaccine strain S2 on non-pregnant Cynomolgus monkeys without abortive effect on pregnant Cynomolgus monkeys[J]. Front Vet Sci, 2021, 8: 641022. DOI:10.3389/fvets.2021.641022 |
| [16] |
GOPALAKRISHNAN A, DIMRI U, SAMINATHAN M, et al. Virulence factors, intracellular survivability and mechanism of evasion from host immune response by Brucella: an overview[J]. J Anim Plant Sci, 2016, 26: 1542-1555. |
| [17] |
DEL GIUDICE M G, DÖHMER P H, SPERA J M, et al. VirJ is a Brucella virulence factor involved in the secretion of type IV secreted substrates[J]. J Biol Chem, 2016, 291(23): 12383-12393. DOI:10.1074/jbc.M116.730994 |
| [18] |
MA Z C, LI R R, HU R R, et al. Brucella abortus BspJ is a nucleomodulin that inhibits macrophage apoptosis and promotes intracellular survival of Brucella[J]. Front Microbiol, 2020, 11: 599205. DOI:10.3389/fmicb.2020.599205 |
| [19] |
JIAO H W, ZHAO Y, SHUAI X H, et al. Caspase-11 plays an important role in IL-1, IL-18 and IL-1ȃ secretion from porcine alveolar macrophage cells stimulated with Brucella suis LPS[J]. Indian J Anim Res, 2020, 54(10): 1285-1290. |
| [20] |
TIBOR A, DECELLE B, LETESSON J J. Outer membrane proteins Omp10, Omp16, and Omp19 of Brucella spp. are lipoproteins[J]. Infect Immun, 1999, 67(9): 4960-4962. DOI:10.1128/IAI.67.9.4960-4962.1999 |
| [21] |
BETTIGOLE S E, GLIMCHER L H. Endoplasmic reticulum stress in immunity[J]. Annu Rev Immunol, 2015, 33: 107-138. DOI:10.1146/annurev-immunol-032414-112116 |
| [22] |
CHOI J A, SONG C H. Insights into the role of endoplasmic reticulum stress in infectious diseases[J]. Front Immunol, 2020, 10: 3147. DOI:10.3389/fimmu.2019.03147 |
| [23] |
HU H, TIAN M X, DING C, et al. The C/EBP homologous protein (CHOP) transcription factor functions in endoplasmic reticulum stress-induced apoptosis and microbial infection[J]. Front Immunol, 2019, 9: 3083. DOI:10.3389/fimmu.2018.03083 |
| [24] |
PEI J W, KAHL-MCDONAGH M, FICHT T A. Brucella dissociation is essential for macrophage egress and bacterial dissemination[J]. Front Cell Infect Microbiol, 2014, 4: 23. |
| [25] |
FERRERO M C, FOSSATI C A, BALDI P C. Smooth Brucella strains invade and replicate in human lung epithelial cells without inducing cell death[J]. Microbes Infect, 2009, 11(4): 476-483. DOI:10.1016/j.micinf.2009.01.010 |
| [26] |
BYNDLOSS M X, TSAI A Y, WALKER G T, et al. Brucella abortus infection of placental trophoblasts triggers endoplasmic reticulum stress-mediated cell death and fetal loss via type IV secretion system-dependent activation of CHOP[J]. mBio, 2019, 10(4): e01538-19. |
| [27] |
ZHANG K, WANG H, GUO F, et al. OMP31 of Brucella melitensis 16M impairs the apoptosis of macrophages triggered by TNF-α[J]. Exp Ther Med, 2016, 12(4): 2783-2789. DOI:10.3892/etm.2016.3655 |
| [28] |
MA Q L, LIU A C, MA X J, et al. Brucella outer membrane protein Omp25 induces microglial cells in vitro to secrete inflammatory cytokines and inhibit apoptosis[J]. Int J Clin Exp Med, 2015, 8(10): 17530-17535. |
| [29] |
ROOP Ⅱ R M, BARTON I S, HOPERSBERGER D, et al. Uncovering the hidden credentials of Brucella virulence[J]. Microbiol Mol Biol Rev, 2021, 85(1): e00021-19. |
| [30] |
ZOU L T, LEI H Y, SHEN J L, et al. HO-1 induced autophagy protects against IL-1 β-mediated apoptosis in human nucleus pulposus cells by inhibiting NF-κB[J]. Aging (Albany NY), 2020, 12(3): 2440-2452. |
| [31] |
HOP H T, REYES A W B, SIMBORIO H L T, et al. Immunization of mice with recombinant Brucella abortus Organic Hydroperoxide Resistance (Ohr) protein protects against a virulent Brucella abortus 544 infection[J]. J Microbiol Biotechnol, 2016, 26(1): 190-196. DOI:10.4014/jmb.1505.05028 |
| [32] |
FLEISCHMANN R. Interleukin-6 inhibition for rheumatoid arthritis[J]. Lancet, 2017, 389(10075): 1168-1170. DOI:10.1016/S0140-6736(17)30405-1 |
| [33] |
IM Y B, PARK W B, JUNG M, et al. Comparative analysis of immune responses to outer membrane antigens OMP10, OMP19, and OMP28 of Brucella abortus[J]. Jpn J Infect Dis, 2018, 71(3): 197-204. DOI:10.7883/yoken.JJID.2017.019 |
| [34] |
VELÁSQUEZ L N, MILILLO M A, DELPINO M V, et al. Brucella abortus down-regulates MHC class Ⅱ by the IL-6-dependent inhibition of CⅡTA through the downmodulation of IFN regulatory factor-1 (IRF-1)[J]. J Leukoc Biol, 2017, 101(3): 759-773. DOI:10.1189/jlb.4A0416-196R |
(编辑 白永平)



