2. 西南大学医学研究院免疫学研究中心, 重庆 402460
2. Immunology Research Center, Medical Research Institute, Southwest University, Chongqing 402460, China
金黄色葡萄球菌(Staphylococcus aureus,简称金葡菌)是革兰阳性菌,广泛存在于动物皮肤和黏膜以及环境中,生存能力强,易产生耐药性,释放如肠毒素A、α-溶血素、凝集因子A和杀白细胞素等多种毒素,可引起多种感染性疾病,严重者可导致脓毒血症、败血症或肺炎,危及生命[1]。
IFN是宿主防御时生成的细胞因子,在免疫监视和启动对病原的免疫应答过程中发挥重要作用。IFN分为Ⅰ型、Ⅱ型和Ⅲ型,与其受体相互作用后刺激细胞内和细胞间信号转导网络,调控天然免疫和获得性免疫,触发抗感染活性。Ⅰ型IFN最初作为干扰病毒增殖的可溶性因子发现,由天然免疫细胞合成[2]。Ⅰ型IFN家族包括多个结构相似的成员,基因存在于人的9号染色体和小鼠的4号染色体,IFN-α主要由白细胞生成,如淋巴细胞、单核细胞和粒细胞,巨噬细胞源自单核细胞,因此白细胞称为天然的IFN生成细胞,IFN-α称为白细胞IFN[3]。IFN-α有13个亚型,研究非常广泛[4],其中,IFN-α4直接受IFN调节因子3(interferon regulatory factor 3,IRF3)调控[5],是微生物感染后最早生成的IFN[6]。Ⅰ型IFN的生成受到TANK结合激酶1(Tank-binding kinase 1,TBK1) /IRF3通路的调控。位于内质网的干扰素基因刺激蛋白(stimulator of IFN genes,STING)识别胞内双链DNA,募集并磷酸化TBK1,TBK1激活后与IRF3相互作用,导致IRF3磷酸化[7]和NF-κB通路激活[8],促进Ⅰ型IFN的生成。静息状态下,NF-κB与NF-κB抑制剂α(inhibitor of κBα,IκBα)结合处于失活状态,细胞受到刺激时,IκBα发生磷酸化和泛素化,NF-κB与其脱离后激活[9]。金葡菌感染后促进树突状细胞[10]和呼吸道上皮细胞[11]生成Ⅰ型IFN。金葡菌可入侵猪[12]和人[13]的中枢神经系统引起脑部感染,如脑膜炎,但该菌感染小胶质细胞后对Ⅰ型IFN通路的影响尚不清楚。本研究表明,金葡菌感染小鼠小胶质细胞BV2后促进IFN-α生成,该过程依赖于TBK1和NF-κB通路。
1 材料与方法 1.1 主要试剂和仪器BV2细胞和金葡菌由本实验室保存。
DMEM高糖培养基(C11995500BT)购自Gibco,胎牛血清(P30-3302)购自PAN,胰酶(T8150)和总RNA提取试剂盒(R1200)购自北京索莱宝生物科技有限公司,Mueller-Hinton肉汤(MHB,HB6231)和Mueller-Hinton琼脂(MHA,HB6232)购自青岛海博生物技术有限公司,化学发光液检测试剂盒(WBKlS0100)购自millipore,BX-795(14932)、IMD-0354(17290)和amlexanox(14181)购自Cayman,反转录试剂盒(R312)和ChamQ Universal SYBR qPCR Master Mix(Q711)购自南京诺唯赞生物科技股份有限公司,小鼠IFN-α ELISA试剂盒(SEKM-0149)购自Thermo Fisher。TBK1(ab235253)、p-TBK1(ab109272)抗体购自Abcam,β-actin(66009)、IκBα(10268)和IRF3(113112)抗体购自proteintech,p-IκBα(AP0614)和p-IRF3(AP0623)抗体购自Abclonal,辣根酶标记山羊抗兔IgG(ZB-2301)购自北京中杉金桥生物技术有限公司。
垂直电泳仪购自Bio-Rad,化学发光成像仪购自Vilber。
1.2 细胞、细菌培养和感染BV2细胞用含10%胎牛血清的DMEM高糖培养基置于二氧化碳培养箱培养,二氧化碳浓度5%,细胞汇合度到90%左右时传代,2 d传代一次。金葡菌在MHA平板划线,挑取单克隆接种到MHB 37 ℃过夜培养,50倍稀释培养2.5 h,12 000 r·min-1离心2 min,PBS洗涤3次,根据试验中指定的MOI加入一定体积的完全培养基,重悬后加入到细胞中,感染后30 min用37 ℃预热PBS洗涤3次,加入含100 μg·mL-1庆大霉素的完全培养基继续培养至收样。
1.3 Western blot10 μL样品加入到SDS-PAGE电泳,蛋白转印到PVDF膜上,5%脱脂奶粉37 ℃封闭1 h,一抗(TBK1和p-TBK1抗体5 000倍稀释,其他抗体1000倍稀释)4 ℃孵育过夜,TBST(NaCl 8 g,KCl 0.2 g,Tris base 3 g,Tween-20 1 mL,超纯水1 L,盐酸调pH7.4)洗涤5次,每次5 min,二抗(10 000倍稀释)37 ℃孵育1 h,TBST洗涤5次,每次5 min,滴加化学发光液,化学发光成像仪曝光。
1.4 实时荧光定量PCR按照说明书提取总RNA,反转录得到cDNA,实时荧光定量PCR体系:ChamQ Universal SYBR qPCR Master Mix 10 μL,cDNA 1 μL,上下游引物各0.4 μL,超纯水8.6 μL。引物序列如表 1所示,反应条件:95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。β-actin作为内参,相对定量法(2-ΔΔCt)分析。IFN-α分别检测IFN-α4和IFN-αn(包括5个亚型,分别为IFN-α1、α2、α7、α11和α12)[6]。
|
|
表 1 实时荧光定量PCR引物序列 Table 1 Primer sequences of Real-time quantitative PCR |
细胞培养液上清1 000 ×g离心10 min,取上清,按照试剂盒说明书检测IFN-α浓度。
1.6 数据分析Image pro plus进行蛋白灰度分析。试验数据经Excel整理,t检验分析差异,*表示差异显著(0.01 < P < 0.05), **表示差异极显著(P < 0.01),GraphaPad prism作图。
2 结果 2.1 金葡菌促进BV2表达IFN-α为探明BV2感染金葡菌后IFN-α表达水平的变化,首先检测了金葡菌感染后不同时间点IFN-α的转录水平。结果表明,感染后1 h,IFN-α转录水平没有变化,3~6 h转录水平逐渐上升,12 h降低(图 1A)。分别用MOI为8、40和200的金葡菌感染BV2时,IFN-α的转录水平上升呈现剂量依赖性(图 1B)。BV2感染金葡菌后ELISA法检测细胞培养液中IFN-α水平发现,感染后1~3 h,IFN-α水平没有变化,6~12 h释放进入培养液中的IFN-α逐渐上升(图 1C)。BV2感染不同MOI的金葡菌时,IFN-α的释放量随着MOI的升高而增加(图 1D)。
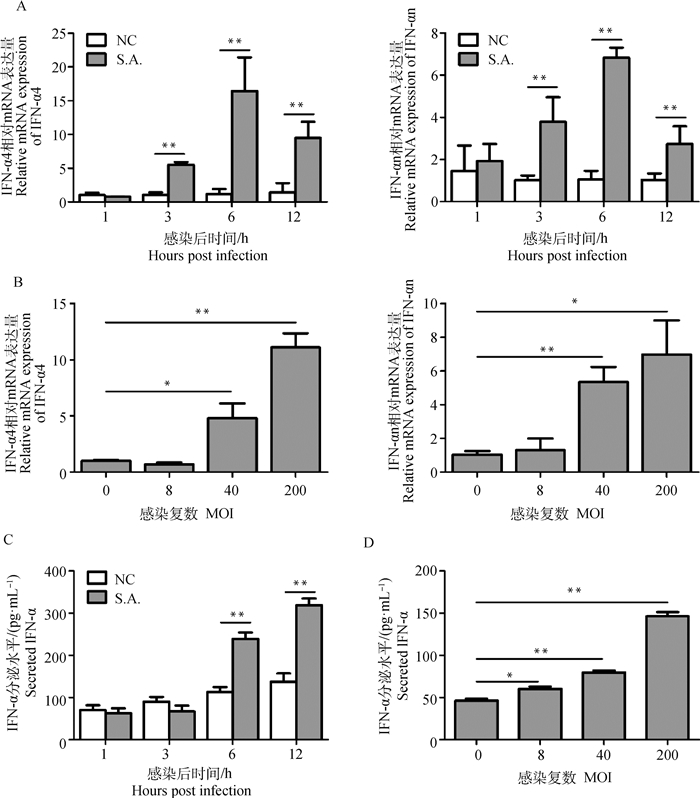
|
NC表示阴性对照;S.A.表示金葡菌;*.0.01<P < 0.05;**.P < 0.01。下图同 NC indicates negative control, S.A. indicates S. aureus, *. 0.01<P < 0.05, and **. P < 0.01. The same as below 图 1 金葡菌促进BV2表达IFN-α Fig. 1 S. aureus promotes IFN-α production in BV2 cells |
为阐明金葡菌感染BV2细胞后是否通过该通路诱导IFN-α的生成,首先检测了TBK1和IRF3的转录水平。结果表明,BV2感染金葡菌后1~12 h范围内,TBK1和IRF3的转录水平没有发生变化(图 2A、B)。Western blot检测蛋白水平结果表明,感染后1~12 h,TBK1和IRF3的蛋白水平没有变化,但感染后1 h,TBK1和IRF3磷酸化水平开始升高,在1~6 h逐渐升高,12 h下降,但均高于阴性对照组(图 2C~E)。分别用MOI为8、40和200的金葡菌感染BV2细胞,6 h后TBK1和IRF3磷酸化水平的升高呈剂量依赖性(图 2F~H)。以上结果表明,金葡菌感染BV2细胞后激活TBK1/IRF3通路。
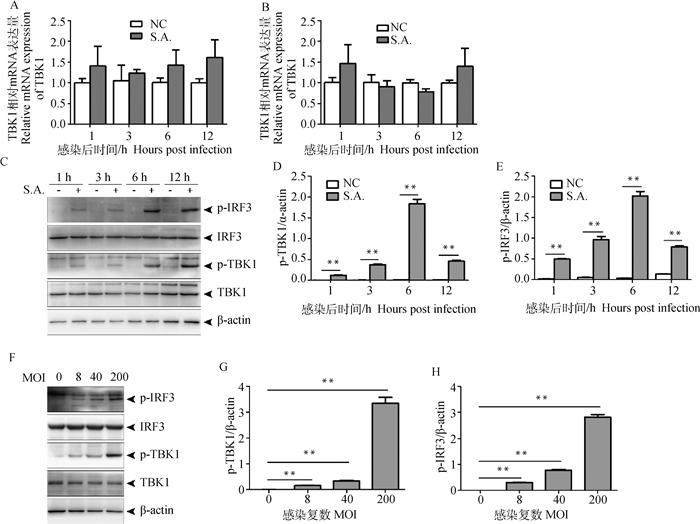
|
图 2 金葡菌感染BV2细胞后激活TBK1/IRF3通路 Fig. 2 S. aureus activates TBK1/IRF3 pathway following infection in BV2 cells |
为探究TBK1在金葡菌诱导BV2细胞生成IFN-α中的作用,分别用2种TBK1抑制剂BX-795和amlexanox处理细胞后再感染金葡菌。结果表明,BX-795抑制TBK1磷酸化后(图 3A和3B),IRF3蛋白水平没有变化,但其磷酸化水平降低(图 3A和3C),同时,IFN-α释放量减少(图 3D)。aml- exanox处理BV2后,TBK1磷酸化水平没有变化(图 3E和3F),p-IRF3蛋白水平下降(图 3E和3G),IFN-α释放量减少(图 3H)。上述结果表明,TBK1参与BV2感染金葡菌后生成IFN-α。
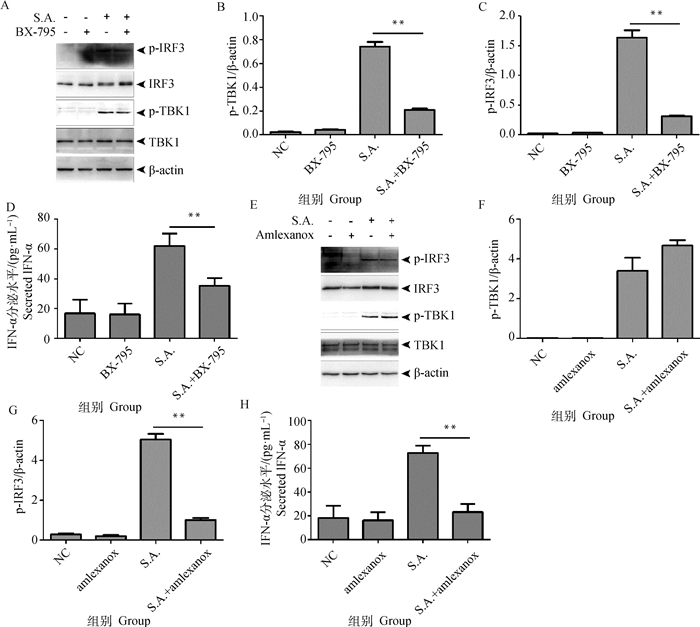
|
A~D. BX-795处理;E~H.Amlexanox处理 A-D. Treatment with BX-795; E-H. Treatment with amlexanox 图 3 金葡菌诱导BV2细胞生成IFN-α需要TBK1 Fig. 3 TBK1 is required for S. aureus-induced IFN-α production in BV2 cells |
TBK1激活后介导NF-κB通路活化,促进Ⅰ型IFN的生成[14]。为探明BV2细胞感染金葡菌后生成IFN-α是否依赖于NF-κB通路,首先检测金葡菌感染后是否激活该通路。BV2感染金葡菌后1~12 h,IκBα蛋白水平没有升高,但感染后1 h,p-IκBα蛋白水平开始上升,在1~6 h逐渐升高,12 h略有下降(图 4A、B)。为阐明感染金葡菌后IFN-α生成与NF-κB通路激活的关系,用IMD-0354处理BV2后感染金葡菌。结果表明,该抑制剂处理细胞后,p-IκBα蛋白水平降低(图 4C、D),同时伴随p-TBK1和p-IRF3蛋白水平降低(图 4C、E和F),并且IFN-α生成减少(图 4G)。以上结果表明,BV2细胞感染金葡菌后促进IFN-α生成依赖于NF-κB通路。
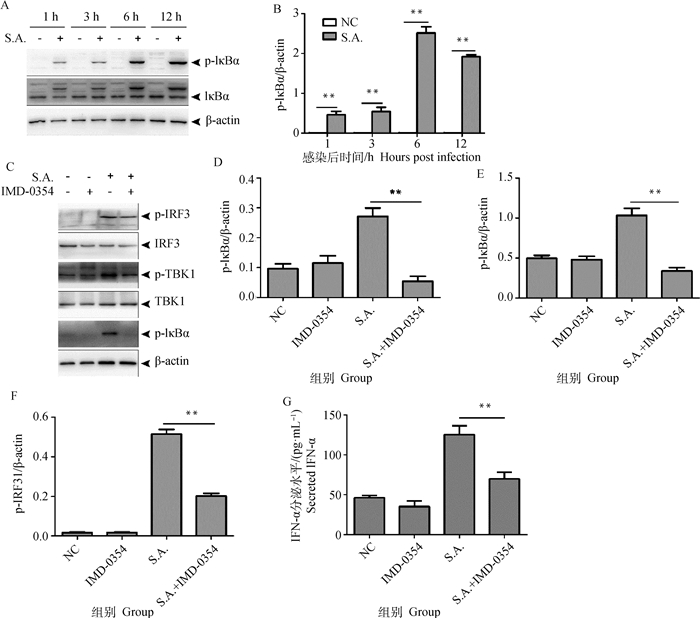
|
图 4 金葡菌促进BV2细胞生成IFN-α依赖于NF-κB通路 Fig. 4 S. aureus-induced IFN-α production is dependent on NF-κB pathway in BV2 cells |
巨噬细胞是细菌等微生物侵入机体后机体防御的第一道防线,在清除病原、维持机体稳态过程中发挥关键作用[15-16]。小胶质细胞是脑中常驻巨噬细胞,起源于骨髓单核细胞和骨髓造血干细胞,通过自我更新保持一定数量,不通过循环的血祖细胞分化[17]。BV2细胞是用携带致癌基因v-raf/v-myc的反转录病毒J2感染原代小鼠小胶质细胞获得的永生化细胞,常作为替代原代小胶质细胞研究的工具细胞[18-19]。金葡菌感染可引起人和动物中枢神经系统感染,如脑膜炎[12-13],但金葡菌对小胶质细胞的作用尚没有报道,因此本研究通过探索BV2细胞感染金葡菌后Ⅰ型干扰素通路的变化阐明BV2在机体感染金葡菌后发挥的机体防御作用。
Ⅰ型IFN在机体防御细菌感染过程中发挥重要作用。机体感染嗜肺军团菌[20]、链球菌、肺炎双球菌和大肠杆菌[21]后,Ⅰ型IFN的生成增加,抑制细菌的增殖,促进细菌从体内清除。然而,金葡菌可通过操作宿主的免疫系统促进自身的增殖,如自噬和凋亡。金葡菌能入侵吞噬细胞并利用胞内环境促进自身存活和扩散[7]。在树突状细胞中,金葡菌通过Toll样受体9(toll-like receptor 9,TLR9)激活Ⅰ型IFN通路,与野生型小鼠比较,Ⅰ型IFN受体敲除小鼠感染金葡菌后,肺中载菌量下降约20倍[10],支气管肺泡灌洗液中载菌量更低,死亡率降低70%[11]。本研究发现,金葡菌感染BV2后激活Ⅰ型IFN通路,IFN-α转录水平和释放量升高。
TBK1/IRF3通路介导Ⅰ型IFN的生成,TBK1和IRF3通过翻译后修饰——磷酸化激活。BV2感染金葡菌后1~12 h,TBK1和IRF3在mRNA和蛋白水平均没有发生变化,但感染后1 h发生磷酸化,IFN-α在感染后3 h mRNA水平升高,6 h释放量显著增加,表明金葡菌激活TBK1/IRF3通路介导IFN-α释放。与此一致的是,TLR4受体激动剂LPS和TLR3受体激动剂poly(I: C)处理小鼠骨髓源巨噬细胞(bone marrow-derived macrophage,BMDM)[22],或水疱性口炎病毒感染HEK293T细胞[23],TBK1和IRF3蛋白水平没有变化,但介导其发生磷酸化促进了IFN-α释放。
TBK1与ATP结合后促进IRF3磷酸化[24]。Amlexanox通过竞争性结合ATP抑制TBK1活性,但不降低TBK1磷酸化水平,p-IRF3水平下降[25],是临床上用于治疗癌症的候选药物[26]。Amlexanox处理BV2后感染金葡菌,p-TBK1水平没有变化,p-IRF3水平降低,IFN-α生成减少,同时,BX-795处理细胞感染金葡菌后,p-TBK1和p-IRF3水平以及IFN-α生成量均下降,表明TBK1参与金葡菌促进BV2细胞生成IFN-α。
NF-κB在不同微生物激活Ⅰ型干扰素通路中的作用存在差异。一方面,小鼠巨细胞病毒感染成纤维细胞后,M35蛋白入核,抑制NF-κB活化,从而减少Ⅰ型干扰素的表达[27]。从敲除NF-κB相关蛋白(如RelA、RelB和c-Rel)的小鼠分离的成纤维细胞感染仙台病毒或新城疫细胞,IFN-β的生成下降较少,表明NF-κB在仙台病毒或新城疫细胞诱导I型干扰素生成中的作用较小[28]。另一方面,甲型流感病毒激活NF-κB,促进细胞因子信号转导抑制蛋白3(suppressor of cytokine signaling-3,SOCS-3)表达,抑制Ⅰ型干扰素表达[29]。β-联蛋白(β-catenin)与p300转录辅因子互作,结合IFN-β启动子,促进IFN-β表达,甲型流感病毒通过激活NF-κB抑制过表达β-联蛋白诱导的IFN-β表达水平升高[30]。本研究发现,金葡菌诱导BV2细胞生成IFN-α需要NF-κB的参与。
4 结论BV2细胞感染金葡菌后,激活TBK1/IRF3和NF-κB通路,促进IFN-α的生成。
| [1] |
李新圃, 罗金印, 武小虎, 等. 金黄色葡萄球菌生物膜形成及调控机制研究进展[J]. 中国兽医学报, 2021, 41(10): 2069-2075. LI X P, LUO J Y, WU X H, et al. Research progress on formation and regulation mechanism of Staphylococcus aureus biofilm[J]. Chinese Journal of Veterinary Science, 2021, 41(10): 2069-2075. (in Chinese) |
| [2] |
NEGISHI H, TANIGUCHI T, YANAI H. The Interferon (IFN) class of cytokines and the IFN Regulatory Factor (IRF) transcription factor family[J]. Cold Spring Harb Perspect Biol, 2018, 10(11): a028423. DOI:10.1101/cshperspect.a028423 |
| [3] |
SIEGAL F P, KADOWAKI N, SHODELL M, et al. The nature of the principal type 1 interferon-producing cells in human blood[J]. Science, 1999, 284(5421): 1835-1837. DOI:10.1126/science.284.5421.1835 |
| [4] |
PLATANIAS L C. Mechanisms of type-I- and type-Ⅱ-interferon-mediated signalling[J]. Nat Rev Immunol, 2005, 5(5): 375-386. DOI:10.1038/nri1604 |
| [5] |
SAKAGUCHI S, NEGISHI H, ASAGIRI M, et al. Essential role of IRF-3 in lipopolysaccharide-induced interferon-β gene expression and endotoxin shock[J]. Biochem Biophys Res Commun, 2003, 306(4): 860-866. DOI:10.1016/S0006-291X(03)01049-0 |
| [6] |
BONJARDIM C A. Interferons (IFNs) are key cytokines in both innate and adaptive antiviral immune responses—and viruses counteract IFN action[J]. Microbes Infect, 2005, 7(3): 569-578. DOI:10.1016/j.micinf.2005.02.001 |
| [7] |
ZHOU Y, ZHAO S S, GAO X, et al. Staphylococcus aureus induces IFN-β production via a CARMA3-independent mechanism[J]. Pathogens (Basel), 2021, 10(3): 300. DOI:10.3390/pathogens10030300 |
| [8] |
YUM S, LI M H, FANG Y, et al. TBK1 recruitment to STING activates both IRF3 and NF-κB that mediate immune defense against tumors and viral infections[J]. Proc Natl Acad Sci U S A, 2021, 118(14): e2100225118. DOI:10.1073/pnas.2100225118 |
| [9] |
周洋, 郑文燕, 胡帝宇, 等. CARMA3调控NF-κB信号通路激活的研究进展[J]. 华中农业大学学报, 2019, 38(4): 149-154. ZHOU Y, ZHENG W Y, HU D Y, et al. Progress on regulation of NF-κB signaling pathway by CARMA3[J]. Journal of Huazhong Agricultural University, 2019, 38(4): 149-154. (in Chinese) |
| [10] |
PARKER D, PRINCE A. Staphylococcus aureus induces type I IFN signaling in dendritic cells via TLR9[J]. J Immunol, 2012, 189(8): 4040-4046. DOI:10.4049/jimmunol.1201055 |
| [11] |
MARTIN F J, GOMEZ M I, WETZEL D M, et al. Staphylococcus aureus activates type I IFN signaling in mice and humans through the Xr repeated sequences of protein A[J]. J Clin Invest, 2009, 119(7): 1931-1939. |
| [12] |
殷鑫欢, 杨晓宇, 徐雷, 等. 金黄色葡萄球菌和猪链球菌混合感染引发的脑膜炎[J]. 养猪, 2018(5): 92-94. YIN X H, YANG X Y, XU L, et al. Meningitis associated with the mixed infection by Staphylococcus aureus and Streptococcus suis[J]. Swine Production, 2018(5): 92-94. (in Chinese) |
| [13] |
杨宏, 郝丹丹, 陈春燕, 等. 新生儿不同病原菌化脓性脑膜炎的临床诊疗探讨[J]. 现代医学与健康研究电子杂志, 2020, 4(16): 114-116. YANG H, HAO D D, CHEN C Y, et al. Clinical diagnosis and treatment of purulent meningitis caused by different pathogens in newborns[J]. Modern Medicine and Health Research, 2020, 4(16): 114-116. (in Chinese) |
| [14] |
ABE T, BARBER G N. Cytosolic-DNA-mediated, STING-dependent proinflammatory gene induction necessitates canonical NF-κB activation through TBK1[J]. J Virol, 2014, 88(10): 5328-5341. DOI:10.1128/JVI.00037-14 |
| [15] |
陈楷文, 华承薇, 袁宸, 等. 马链球菌兽疫亚种烯醇化酶对小鼠肺泡巨噬细胞吞噬功能的影响[J]. 畜牧兽医学报, 2020, 51(10): 2576-2583. CHEN K W, HUA C W, YUAN C, et al. Effects of enolase of Streptococcus equi ssp. zooepidemicus on phagocytic functions of alveolar macrophages in mice[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(10): 2576-2583. DOI:10.11843/j.issn.0366-6964.2020.10.026 (in Chinese) |
| [16] |
CHINETTI-GBAGUIDI G, COLIN S, STAELS B. Macrophage subsets in atherosclerosis[J]. Nat Rev Cardiol, 2015, 12(1): 10-17. DOI:10.1038/nrcardio.2014.173 |
| [17] |
SOUSA C, BIBER K, MICHELUCCI A. Cellular and molecular characterization of microglia: a unique immune cell population[J]. Front Immunol, 2017, 8: 198. |
| [18] |
涂健, 杨利峰, 祁克宗, 等. PrP106-126及Aβ1-42同步诱导BV-2小胶质细胞趋化及增殖活性的研究[J]. 畜牧兽医学报, 2014, 45(10): 1699-1710. TU J, YANG L F, QI K Z, et al. PrP106-126 and Aβ1-42 peptides induce simultaneously BV-2 microglia chemotaxis and proliferation[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(10): 1699-1710. DOI:10.11843/j.issn.0366-6964.2014.10.017 (in Chinese) |
| [19] |
DAS A, KIM S H, ARIFUZZAMAN S, et al. Transcriptome sequencing reveals that LPS-triggered transcriptional responses in established microglia BV2 cell lines are poorly representative of primary microglia[J]. J Neuroinflammation, 2016, 13(1): 182. DOI:10.1186/s12974-016-0644-1 |
| [20] |
SCHIAVONI G, MAURI C, CARLEI D, et al. Type I IFN protects permissive macrophages from Legionella pneumophila infection through an IFN-γ-independent pathway[J]. J Immunol, 2004, 173(2): 1266-1275. DOI:10.4049/jimmunol.173.2.1266 |
| [21] |
MANCUSO G, MIDIRI A, BIONDO C, et al. Type I IFN signaling is crucial for host resistance against different species of pathogenic bacteria[J]. J Immunol, 2007, 178(5): 3126-3133. DOI:10.4049/jimmunol.178.5.3126 |
| [22] |
DU M, LIU J H, CHEN X, et al. Casein kinase Ⅱ controls TBK1/IRF3 activation in IFN response against viral infection[J]. J Immunol, 2015, 194(9): 4477-4488. DOI:10.4049/jimmunol.1402777 |
| [23] |
ZHENG Q L, HOU J, ZHOU Y, et al. Siglec1 suppresses antiviral innate immune response by inducing TBK1 degradation via the ubiquitin ligase TRIM27[J]. Cell Res, 2015, 25(10): 1121-1136. DOI:10.1038/cr.2015.108 |
| [24] |
JOUNG S M, PARK Z, RANI S, et al. Akt contributes to activation of the TRIF-dependent signaling pathways of TLRs by interacting with TANK-binding kinase 1[J]. J Immunol, 2011, 186(1): 499-507. DOI:10.4049/jimmunol.0903534 |
| [25] |
REILLY S M, CHIANG S H, DECKER S J, et al. An inhibitor of the protein kinases TBK1 and IKK-ε improves obesity-related metabolic dysfunctions in mice[J]. Nat Med, 2013, 19(3): 313-321. DOI:10.1038/nm.3082 |
| [26] |
MUVAFFAK A, PAN Q, YAN H Y, et al. Evaluating TBK1 as a therapeutic target in cancers with activated IRF3[J]. Mol Cancer Res, 2014, 12(7): 1055-1066. DOI:10.1158/1541-7786.MCR-13-0642 |
| [27] |
CHAN B C, GONÇALVES MAGALHÃES V, LEMMERMANN N A W, et al. The murine cytomegalovirus M35 protein antagonizes type I IFN induction downstream of pattern recognition receptors by targeting NF-κB mediated transcription[J]. PLoS Pathog, 2017, 13(5): e1006382. DOI:10.1371/journal.ppat.1006382 |
| [28] |
WANG X Y, HUSSAIN S, WANG E J, et al. Lack of essential role of NF-κB p50, RELA, and cRel subunits in virus-induced type 1 IFN expression[J]. J Immunol, 2007, 178(11): 6770-6776. DOI:10.4049/jimmunol.178.11.6770 |
| [29] |
PAULI E K, SCHMOLKE M, WOLFF T, et al. Influenza a virus inhibits type I IFN signaling via NF-κB-dependent induction of SOCS-3 expression[J]. PLoS Pathog, 2008, 4(11): e1000196. DOI:10.1371/journal.ppat.1000196 |
| [30] |
HILLESHEIM A, NORDHOFF C, BOERGELING Y, et al. β-catenin promotes the type I IFN synthesis and the IFN-dependent signaling response but is suppressed by influenza A virus-induced RIG-I/NF-κB signaling[J]. Cell Commun Signal, 2014, 12(1): 29. DOI:10.1186/1478-811X-12-29 |
(编辑 白永平)



