2. 中国农业科学院上海兽医研究所, 上海 200241
2. Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Shanghai 200241, China
本实验室前期研究发现,C11orf96在猫杯状病毒(feline calicivirus,FCV)感染猫后显著上调。C11orf96为11号染色体上的第96个开放阅读框所编码的蛋白,该基因虽有文献报道,但该蛋白功能未被鉴定[1]。在C11orf96的研究中,基因的克隆与表达是分子生物学研究的重要组成部分,而且特异性抗体也是一项重要的研究工具,这些均有助于挖掘蛋白质的生物学功能[2-3]。
基于此,本实验室克隆了猫源C11orf96基因,并以pET-32a(+)载体为基础,结合本团队已制备的羊口疮病毒F1L融合Fe蛋白多克隆抗体的基础[4],构建了融合铁蛋白的原核表达质粒pET-32a(+)-fC11orf96-Fe,并进行转化得到重组蛋白fC11orf96-Fe,然后用它来免疫新西兰大白兔制备fC11orf96-Fe的多克隆抗体,为其后续研究C11orf96蛋白的生物学功能提供重要工具。
1 材料与方法 1.1 材料1.1.1 细胞和菌株 pET-32a(+)、pCMV-HA、pCMV-Myc、猫肾细胞(Crandell Reese Feline Kidney cells,CRFK),Fe基因质粒由中国农业科学院上海兽医研究所伴侣动物生物安全风险预警及防控技术团队保存。
1.1.2 主要试剂 pEASY®-Blunt Zero Cloning Kit vector购自北京全式金生物技术有限公司,LipofectamineTM3000脂质体转染试剂盒购自Invitrogen公司,ClonExpress® Ultra One Step Cloning Kit与ClonExpress® MultiS One Step Cloning Kit购自南京诺唯赞生物科技股份有限公司,BamHⅠ、HindⅢ、EcoRⅠ和Bgl Ⅱ限制性内切酶购自NEB公司,文中使用的抗体均购自Cell Signaling Technology(CST)生物技术有限公司,其余试剂均为分析纯。
1.1.3 实验动物 6周龄新西兰大白兔购自上海杰思捷实验动物有限公司[许可证号码:SCXX(沪) 2020-0123]。
1.2 方法1.2.1 基因及载体构建 根据NCBI提供猫C11orf96的基因预测序列,利用Primer 6.0软件设计特异性引物用于扩增猫C11orf96基因以及构建相应的原核表达和真核表达载体,引物序列(由苏州金唯智生物科技有限公司合成)见表 1。
|
|
表 1 本研究所用引物序列 Table 1 Sequences of primers used in this study |
首先用CRFK的cDNA扩增猫源C11orf96基因CDS区片段,经胶回收-连接-转化-培养-摇菌-并送测序,将测序结果正确的菌液进行小提质粒即得猫源C11orf96基因,并命名为Felis catus-C11orf96,简写为fC11orf96。
以fC11orf96质粒为模板,扩增fC11orf96基因真核表达与原核表达目的基因片段;以Fe质粒为模板,扩增得到含pET-32a(+)载体同源臂与C11orf96同源臂的Fe基因;用内切酶双酶切pET-32a(+)、pCMV-HA、pCMV-Myc质粒,经胶回收-连接-转化-培养-摇菌-并送测序,将测序结果正确的菌液小提质粒即得重组原核表达质粒和真核表达质粒,并分别命名为pET-32a(+)-fC11orf96-Fe、pHA-fC11orf96和pMYC-fC11orf96。
1.2.2 fC11orf96-Fe蛋白的诱导表达及纯化 将上述提取得到的重组质粒pET-32a(+)-fC11orf96-Fe转化于感受态细胞BL21(DE3)中,经LB平板培养后,挑菌于LB培养基培养至OD600 nm值为0.6~0. 8时,加入终浓度为1 mmol·L-1 (异丙基-β-D-硫代半乳糖苷)于37 ℃、220 r·min-1诱导6 h,取菌液离心,沉淀加PBS重悬,反复冻融3次,超声裂解,然后离心,SDS- PAGE电泳分析沉淀和上清液。结果表明,fC11orf96-Fe蛋白主要以包涵体的形式存在,因此采用包涵体粗纯化的方式进行纯化,最后获得目的重组蛋白。
1.2.3 兔源fC11orf96-Fe多克隆抗体的制备与鉴定 以fC11orf96-Fe重组蛋白为免疫原乳化完全后免疫6周龄新西兰大白兔,背部皮下多点注射进行4次免疫,7 d·次-1,第4次免疫后从心取血收集抗血清,即得fC11orf96-Fe兔源多克隆抗体,分装后, 置-80 ℃冻存。
将构建的真核表达质粒分别转染至CRFK细胞内,24 h后收取细胞,并用RIPA裂解液进行裂解收取细胞蛋白样,然后进行Western blot试验,用制备的fC11orf96-Fe抗血清作为一抗(稀释比1∶350)37 ℃孵育3 h;鼠源β-actin抗体(稀释比1∶1 000) 为内参对照,分别以HA和Myc标签抗体作为阳性对照一抗,4 ℃孵育过夜。然后分别对应添加山羊抗兔IgG二抗(稀释比1∶10 000)与山羊抗鼠IgG二抗(稀释比1∶10 000)室温孵育1 h。最后进行曝光和显影。
1.2.4 fC11orf96蛋白亚细胞定位 转染前1 d,将CRFK细胞接种于放有细胞爬片的12孔培养板中,待细胞长至汇合度为70%~90%时利用转染试剂进行质粒转染,均设阳性对照、阴性对照组等,37 ℃、5% CO2培养约24 h。收取细胞进行间接免疫荧光(indirect immunofluorescence assay,IFA)试验,用5% BSA稀释一抗(抗体HA,1∶1 000;fC11orf96多克隆抗体,1∶200)在4 ℃下孵育10~12 h;然后用5% BSA稀释二抗[Alexa Fluor 488山羊抗兔IgG(H+L)],避光孵育1 h后,再用PBS稀释4’, 6-二氨基-2-苯林多尔(DAPI,1∶5 000)染色4~5 min。最后进行封片于激光共聚焦显微镜下获取图像,拍照并分析结果。
2 结果 2.1 fC11orf96-Fe蛋白以包涵体方式存在结果表明,表达质粒pET-32a(+)-fC11orf96-Fe经IPTG诱导后出现了特异性蛋白条带,相对分子质量大小约49 ku(Fe蛋白大小约19 ku,fC11orf96蛋白大小约14 ku,pET-32a(+)蛋白大小约为17 ku),与预期相符合,而且fC11orf96-Fe蛋白主要出现在沉淀中,说明重组fC11orf96-Fe蛋白主要以包涵体的方式存在,因此使用尿素纯化该包涵体蛋白。
2.2 fC11orf96-Fe多克隆抗体具有反应性和特异性Western blot检测结果显示,该多克隆抗体对CRFK细胞内源性fC11orf96蛋白(17 ku,位于15~25 ku)具有反应性(图 1A);同样对转染了该蛋白的真核表达质粒的细胞裂解液也具有良好的反应性(图 1B),而且与分别使用HA和Myc标签抗体孵育真核表达质粒的细胞裂解液蛋白大小均一致(图 1D和1E);以阴性血清作为阴性对照,未见条带(图 1C)。鉴定结果表明,获得的fC11orf96-Fe蛋白兔源多克隆抗体能够与fC11orf96内源性蛋白和外源蛋白表达发生特异性反应,而且特异性条带大小正确,证明抗体有较好的反应性和特异性,可以用于后续的试验研究。
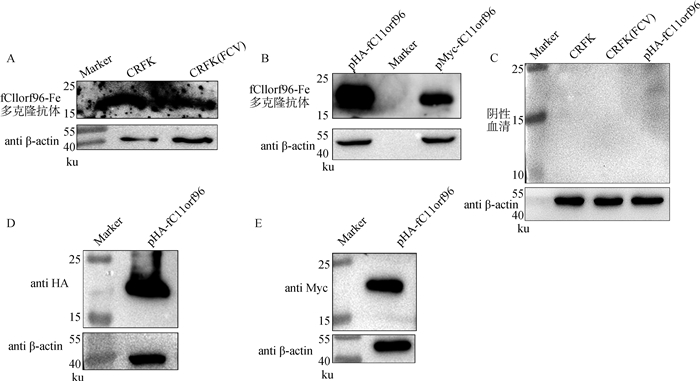
|
A.fC11orf96-Fe多克隆抗体孵育CRFK与感染FCV的CRFK细胞裂解液显影结果;B. fC11orf96-Fe多克隆抗体孵育真核表达质粒的细胞蛋白裂解液显影结果;C. 以阴性血清作为阴性对照孵育对应的细胞蛋白裂解液样品显影结果;D. HA标签抗体孵育pHA-fC11orf96真核表达质粒的细胞裂解液显影结果;E. Myc标签抗体孵育pHA-fC11orf96真核表达质粒的细胞裂解液显影结果 A. ECL results of fC11orf96-Fe polyclonal antibody incubates protein lysate about CRFK cells infected with FCV and uninfected samples; B. ECL results of fC11orf96-Fe polyclonal antibody incubates protein lysate about the constructed eukaryotic expression plasmid; C. ECL results of protein samples incubated with negative serum as negative control; D. ECL results of anti HA incubates protein lysate about pHA-fC11orf96; E. ECL results of anti Myc incubates protein lysate about pMyc-fC11orf96 图 1 Western blot检测fC11orf96-Fe多克隆抗体特异性结果 Fig. 1 Specificity of fC11orf96-Fe polyclonal antibody detected by Western blot |
从图 2中结果显示,对照pCMV-HA空载体在CRFK细胞内未见绿色荧光,只有瞬时表达pHA-fC11orf96质粒和未转染质粒的CRFK细胞在细胞质中能看到绿色荧光,未在细胞核(蓝色)内发现绿色荧光,表明fC11orf96-Fe蛋白多克隆抗体与转入真核表达fC11orf96质粒发生特异性反应,同时说明未转染质粒的CRFK细胞内看到的绿色荧光即为fC11orf96蛋白,进一步证明该蛋白不具有跨膜蛋白结构,严格定位在细胞质中。
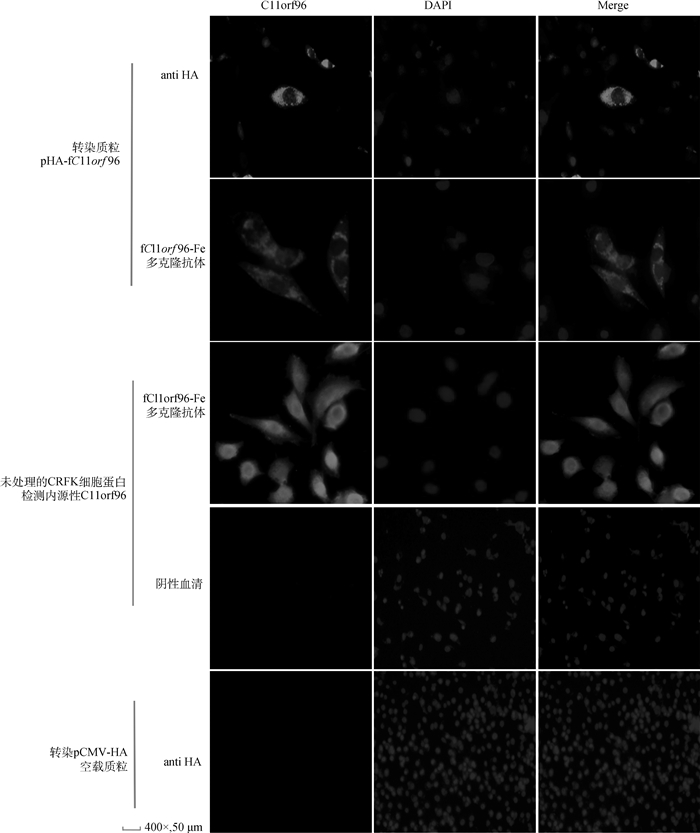
|
图 2 fC11orf96蛋白亚细胞定位于细胞质 Fig. 2 Localization of fC11orf96 subcellular protein in cytoplasm |
病毒作为最小的病原体,必须依靠活细胞内的物质进行增殖,而且其基因资源有限,因此病毒必须利用多种宿主细胞因子才能生存并产生新的病毒颗粒[5]。病毒在感染细胞后,通过“劫持”细胞的翻译途径,从而进行自身蛋白质的翻译和合成,促进病毒的复制和增殖;宿主细胞的翻译系统则因此受到抑制,从而导致宿主细胞的翻译水平持续下降,而病毒的复制和蛋白质的合成水平则能够持续上升[6-8]。因此,鉴定调控病毒增殖的宿主蛋白,对阻断病毒感染,抑制病毒复制具有重要意义。本文所关注的宿主蛋白C11orf96在病毒感染后显著上调,推测其可能调控病毒复制,而该蛋白目前功能未知。因此,人们首先急需获得针对该蛋白的一种灵敏度高、特异性良好的抗体,为后续研究提供关键工具。
蛋白质分子量是蛋白质定性甚至定量的重要工具,在蛋白质研究领域发挥重要作用[9-10]。蛋白质理论分子量和表观分子量不一致是很正常的[11],本文的fC11orf96预测蛋白分子量约为13.9 ku,但在使用Western blot检测CRFK内源性C11orf96以及构建的不同标签的真核质粒的细胞蛋白裂解液时,发现其ECL显影的特异性条带均位于17 ku (15~25 ku)左右,同时结合猫源C11orf96蛋白质结构预测结果,发现该蛋白很可能存在一定的蛋白翻译后修饰,但具体是何种修饰有待后续研究。
4 结论成功克隆得到猫源C11orf96基因CDS区,通过WB与IFA亚细胞定位于细胞质,结果表明,该抗体具有较高的反应性和特异性,为后续研究不同种源C11orf96的生物学功能奠定基础。
| [1] |
HAUPTMAN N, BOSTJANCIC E, LAJPAH M, et al. Bioinformatics analysis reveals most prominent gene candidates to distinguish colorectal adenoma from adenocarcinoma[J]. Biomed Res Int, 2018, 2018: 9416515. |
| [2] |
NI N, JIA R L, GUO Y Q, et al. Expression and functional studies of INS-5, an insulinase-like protein in Cryptosporidium parvum[J]. Front Microbiol, 2020, 11: 719. DOI:10.3389/fmicb.2020.00719 |
| [3] |
PASSOS V, ZILLINGER T, CASARTELLI N, et al. Characterization of endogenous SERINC5 protein as anti-HIV-1 factor[J]. J Virol, 2019, 93(24): e01221-19. |
| [4] |
邢雪, 王元红, 李传峰, 等. 羊口疮病毒F1L融合Fe蛋白的表达与鉴定[J]. 江苏农业学报, 2020, 36(1): 130-135. XING X, WANG Y H, LI C F, et al. Expression and identification of orf virus F1L fused with Fe protein[J]. Jiangsu Journal of Agricultural Sciences, 2020, 36(1): 130-135. (in Chinese) |
| [5] |
曾宗波, 马旭升, 罗志宽, 等. 程序性细胞死亡因子10抑制Ⅰ型干扰素表达并促进FMDV复制[J]. 畜牧兽医学报, 2021, 52(2): 450-459. ZENG Z B, MA X S, LUO Z K, et al. Programmed cell death factor 10 inhibits type Ⅰ interferon expression and promotes the replication of foot-and-mouth disease virus[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(2): 450-459. (in Chinese) |
| [6] |
刘丹华, 郑世民, 刘晓静, 等. 禽网状内皮组织增生病病毒感染对SPF雏鸡血液和局部淋巴组织CD4+/CD8+细胞及相关细胞因子表达的影响[J]. 畜牧兽医学报, 2020, 51(6): 1447-1454. LIU D H, ZHENG S M, LIU X J, et al. Effects of avian reticuloendotheliosis virus infection on the CD4+/CD8+ ratio and the expression of related cytokines in SPF chicks[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(6): 1447-1454. (in Chinese) |
| [7] |
高泽乾, 朱学亮, 张志东, 等. 病毒感染激活炎症小体的分子机制[J]. 畜牧兽医学报, 2016, 47(11): 2167-2174. GAO Z Q, ZHU X L, ZHANG Z D, et al. The mechanisms of inflammasomes activation by viral components[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(11): 2167-2174. (in Chinese) |
| [8] |
李永涛, 王川庆. 流感病毒逃避宿主天然免疫抗病毒应答研究进展[J]. 畜牧兽医学报, 2015, 46(4): 526-533. LI Y T, WANG C Q. Evasion of host innate immune antiviral responses by influenza viruses[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(4): 526-533. (in Chinese) |
| [9] |
CAO Y M, CHEN Z L, ZHANG M, et al. Maternal exposure to bisphenol A induces fetal growth restriction via upregulating the expression of estrogen receptors[J]. Chemosphere, 2022, 287: 132244. |
| [10] |
李丽娟. 对一种蛋白质分子量计算方法的思考[J]. 考试周刊, 2017(74): 116. LI L J. Reflection on a method for calculating molecular weight of protein[J]. Examination Weekly, 2017(74): 116. (in Chinese) |
| [11] |
李红卫, 袁志良, 夏斌. 扩散序谱(DOSY)实验测定缓冲体系中蛋白质表观分子量[J]. 波谱学杂志, 2018, 35(3): 280-286. LI H W, YUAN Z L, XIA B. Determination of apparent protein molecular weight in solution by diffusion ordered NMR spectroscopy[J]. Chinese Journal of Magnetic Resonance, 2018, 35(3): 280-286. (in Chinese) |
(编辑 白永平)



