2. 山西农业大学体育部, 太原 030000;
3. 山西农业大学实验动物管理中心, 太原 030000
2. Department of physical education, Shanxi Agricultural University, Taiyuan 030000, China;
3. Laboratory Animal Center, Shanxi Agricultural University, Taiyuan 030000, China
在“饲料禁抗、养殖减抗”的大背景下,寻找抗生素的替代品成为了研究的热点。苦参碱是从苦参中提取的一种生物碱,具有抗炎[1]、抗氧化[2]和抗肿瘤[3]等多种药理作用。实验室前期研究发现,苦参碱具有抗猪心肌炎[4]、猪圆环病毒Ⅱ型[5]、猪繁殖与呼吸综合征[6]等病毒的作用。有研究证明,苦参碱在治疗新型冠状病毒肺炎方面,也具有较好的临床效果[7]。实验室前期研究发现,苦参碱亦可调节昆明小鼠肠道菌群结构,增加益生菌嗜酸乳杆菌在肠道菌群的丰度及在各段肠道的定植[8]。
非靶向代谢组学是通过定性和相对定量生物体系中的代谢物,最大程度反映总的代谢物信息,从而揭示组间代谢物的差异。利用非靶向血液代谢组学,发现了与糖尿病发生发展密切相关的代谢通路,并诠释了银杏叶提取物干预糖尿病大鼠的作用机制[9]。非靶向代谢组学技术与16S rDNA高通量测序技术联合分析,可以将差异菌群与差异代谢物联系起来,进一步阐明疾病或者药物对机体产生影响的机理。Wu等[10]通过16S rDNA肠道菌群测序联合非靶代谢组学技术揭示了中药活性成分大黄酸治疗溃疡性结肠炎的机制;Yang等[11]使用微生物组与代谢组技术系统揭示了结直肠癌中的肠道菌群与代谢组之间的关系,为直肠癌的诊断与治疗提供了理论依据。
苦参碱具有多种药理作用,且具有临床应用价值。但苦参碱在体内的代谢情况如何?是否和其药理作用有关?苦参碱对肠道菌群的调节与苦参碱在体内的代谢有什么关系?为了阐释以上问题,本研究利用非靶向代谢组学分析苦参碱对昆明小鼠粪便和血浆代谢物的影响,并通过16S rDNA测序与代谢组学联合分析,探究苦参碱药理作用发挥的可能机理,解析苦参碱在体内的代谢情况。
1 材料与方法 1.1 试验材料清洁级昆明小鼠,雌性,18~22 g,购自北京维通利华实验动物技术有限公司;苦参碱购自南京泽朗生物科技有限公司,其纯度为98.7%。
1.2 试验设计将20只昆明小鼠随机分为两组,每组10只,分别是苦参碱处理组(MT)和生理盐水处理组(NC)。适应性饲养1周后,按照每10 g体重0.2 mL剂量,腹腔注射40 mg·kg-1的苦参碱,连续给药5 d,每日2次,生理盐水组等体积腹腔注射生理盐水。给药第6天,收集各组小鼠粪便及血浆,进行非靶向代谢组学分析,并通过此前的16S rDNA测序结果与代谢组学联合分析,探究菌群与代谢物之间的相互关系。
1.3 小鼠粪便收集与样品处理给药第6天,对小鼠腹部按摩,促使其排便,迅速将粪便收集至无菌管中,液氮速冻后-80 ℃保存。-80 ℃取出样品,称量60 mg,分别加入200 μL水匀浆后涡旋60 s,加入800 μL甲醇乙腈溶液(1∶1,v/v),涡旋60 s,低温超声30 min,重复2次,-20 ℃放置1 h沉淀蛋白,14 000×g,4 ℃离心20 min,取上清进样。
1.4 小鼠血浆收集与样品处理给药第6天,通过眼球采血,收集全血于肝素抗凝管中,上下轻轻颠倒混匀后,室温静置30 min,2 000×g离心10 min分离得到上层血浆样本,随后将血浆转移至1.5 mL离心管中,液氮速冻后,-80 ℃保存。-80 ℃取出样品,4 ℃缓慢溶解后分别取各组样品100 μL,加入400 μL预冷的甲醇乙腈溶液(1∶1,v/v),涡旋60 s,-20 ℃放置1 h沉淀蛋白,14 000×g,4 ℃离心20 min,取上清进样。
1.5 色谱-质谱分析色谱条件:样品采用Agilent 1290 Infinity LC超高效液相色谱系统(HILIC)色谱柱进行分离;柱温25 ℃;流速0.3 mL·min-1;流动相组成A:水+25 mmol·L-1乙酸铵+25 mmol·L-1氨水,B:乙腈;梯度洗脱程序如下:0~0.5 min,95% B;0.5~7 min,B从95%线性变化至65%;7~8 min,B从65%线性变化至40%;8~9 min,B维持在40%;9~9.1 min,B从40%线性变化至95%;9.1~12 min,B维持在95%;整个分析过程中样品置于4 ℃自动进样器中。为避免仪器检测信号波动而造成的影响,采用随机顺序进行样本的连续分析。样本队列中插入QC样品,用于监测和评价系统的稳定性及试验数据的可靠性。
质谱条件:采用AB Triple TOF 6600质谱仪采集样品的一级、二级谱图。分别采用电喷雾电离(ESI)正离子和负离子模式进行检测。ESI源设置参数如下:雾化气辅助加热气(Gas1):60,辅助加热气2(Gas1):60,气帘气(CUR)30 psi,离子源温度600 ℃,喷雾气压(ISVF)±5 500 V(正负两种模式);一级质荷比检测范围:60~1 000 u,二级子离子质荷比检测范围:25~1 000 u,一级质谱扫描累计时间:0.2 s/spectra,二级质谱扫描累计时间0.05 s/spectra。二级质谱采用数据依赖型采集模式(IDA)获得,并且采用峰强度值筛选模式,去簇电压(DP):±60 V(正负两种模式),碰撞能:35±15 eV。IDA设置如下:动态排除同位素离子范围:4 u,每次扫描采集10个碎片图谱。
1.6 差异菌群与差异代谢物的相关性分析课题组前期通过16S rDNA高通量测序技术,从苦参碱作用后的昆明小鼠粪便中筛选出显著性差异菌种嗜酸乳杆菌[8],利用Spearman统计方法分析显著性差异的菌群与显著性差异的代谢物之间的相关系数,通过R语言和Cytoscape软件进行层次聚类、相关性网络分析。
1.7 数据分析原始数据经ProteoWizard转换成mzXML格式,然后采用XCMS程序进行峰对齐、保留时间校正和提取峰面积。数据经Pareto-scaling预处理后,进行多维统计分析,试验结果以FC>1.5、P<0.05、VIP>1时表示为差异显著。
2 结果 2.1 粪便及血浆差异代谢物的筛选图 1为粪便及血浆代谢物中正、负离子模式数据的火山图,图中红色点为筛选的差异代谢物(FC>1.5,P<0.05),结果表明在苦参碱作用下,粪便及血浆中的代谢物均存在差异。采用正交偏最小二乘判别分析(OPLS-DA)进行组间差异分析,在OPLS-DA得分图上,横坐标t1为预测主成分,主要反映组间差异;纵坐标为正交主成分,主要反映组内差异。图 2直观显示了粪便及血浆正、负离子模式下代谢物之间的差异,图中苦参碱组样品与生理盐水组样品分别聚为两簇,表明在苦参碱作用下粪便及血浆中存在特异性的代谢组。选择OPLS-DA模型得到的变量权重值VIP(variable importance for the projection)>1,同时P<0.05作为显著差异代谢物。粪便显著差异代谢物如表 1所示,粪便中共鉴定出L-精氨酸(L-arginine)、组胺(histamine)、羟喹啉(oxyquinoline)、水杨酸(salicylic acid)等97种显著差异代谢物;血浆显著差异代谢物如表 2所示,血浆中共鉴定出牛磺胆酸盐(taurocholate)、黄豆苷元(daidzein)、酪胺(tyramine)等44种显著差异代谢物。
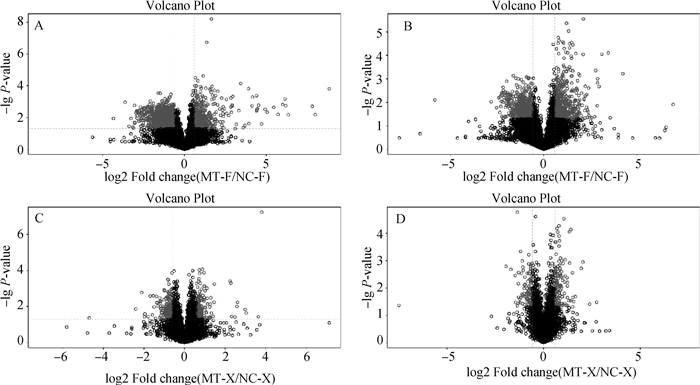
|
图 1 粪便正(A)、负(B)离子模式及血浆正(C)、负(D)离子模式下火山图 Fig. 1 Volcano plots in positive (A), negative (B) ion modes of feces and positive (C), negative (D) ion modes of plasma |
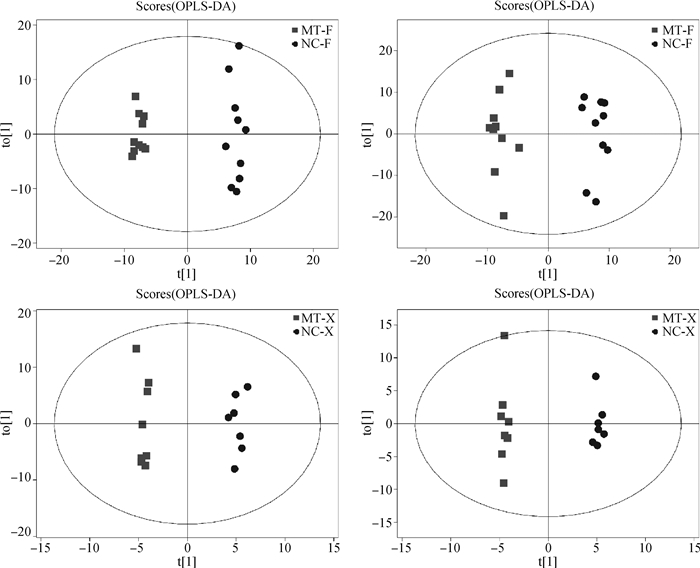
|
图 2 粪便正(A)、负(B)离子模式及血浆正(C)、负(D)离子模式下OPLS-DA得分图 Fig. 2 OPLS-DA score charts in positive (A), negative (B) ion modes of feces and positive (C), negative (D) ion modes of plasma |
|
|
表 1 粪便差异代谢物鉴定表 Table 1 Identification table of significantly differential metabolites in feces |
|
|
表 2 血浆差异代谢物鉴定表 Table 2 Identification table of significantly differential metabolites in plasma |
分别将从粪便及血浆中筛选出来的正(图 3)、负(图 4)离子模式下的差异代谢物进行聚类分析,结果显示,粪便中共鉴定出苦参碱组有35种代谢物上调,分别为Vitamin E、L-Palmitoylcarnitine等脂质和类脂质分子,Deoxyadenosine、Deoxyinosine等核苷、核苷酸和类似物,Purine、Cytosine、Thymine及Isoetharine、Indole-2-carboxylic acidl、Quadrone、L-Glutamine等杂环化合物。苦参碱组中下调了104种代谢物,分别为L-Proline、L-Arginine、L-Phenylalanine、L-Methionine、L-Citrulline、Arg-Thr、Pro-Ala、Phe-Ser等氨基酸和二肽,N-Acetylmannosamine、Maltotriose、Stachyose、L-Arabinose等有机氧化物,Taurocholate、Taurodeoxycholic acid等脂质和类脂质分子。

|
图 3 正离子模式下粪便差异代谢物聚类分析结果 Fig. 3 Hierarchical clustering results of differential fecal metabolites in positive ion mode |
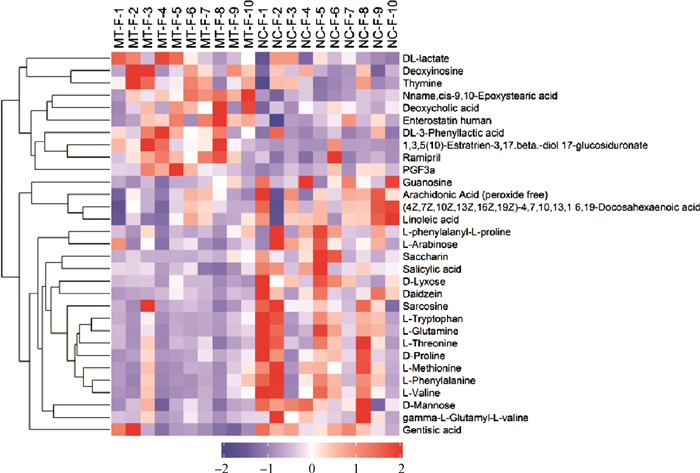
|
图 4 负离子模式下粪便差异代谢物聚类分析结果 Fig. 4 Hierarchical clustering results of different fecal metabolites in negative ion mode |
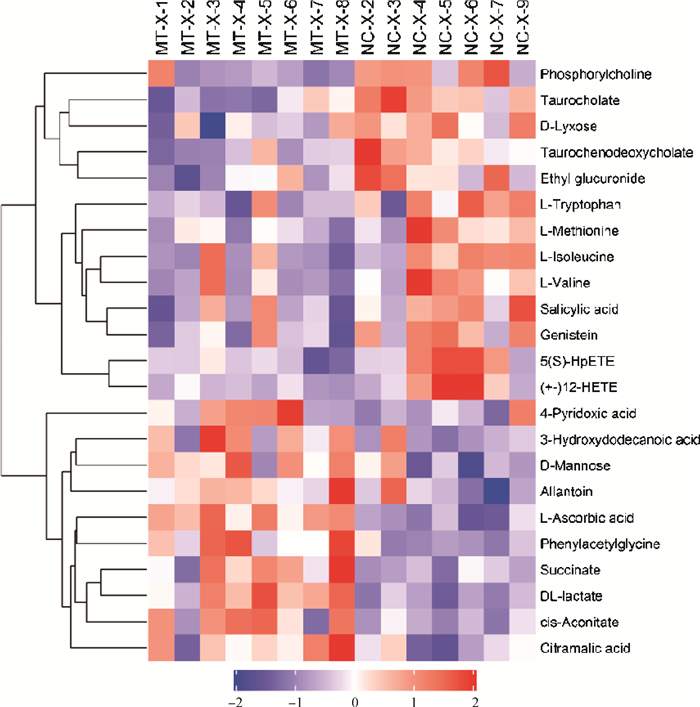
血浆正(图 5)、负(图 6)离子模式下差异代谢物聚类分析结果显示,血浆中共鉴定出苦参碱组上调了20种代谢物,分别是Dimethylglycine、Succinate、cis-Aconitate、DL-lactate等羧酸及其衍生物,1-Methylnicotinamide、Allantoin、4-Pyridoxic acid等有机杂环化合物,Citramalic acid、Cholic acid等脂质和类脂质分子。苦参碱组下调了35种代谢物,分别是Daidzein、Genistein等苯丙烷和聚酮化合物,Tyramine、Salicylic acid等苯甲酸盐,Diethanolamine、Phosphorylcholine等有机氮化合物,D-Proline、L-Methionine、L-Arginine、L-Citrulline等氨基酸、肽和类似物,Indole-3-pyruvic acid、L-Tryptophan等有机杂环化合物,Taurocholate、Taurochenodeoxycholate、Arachidonic Acid(peroxide free)等脂质和类脂质分子。
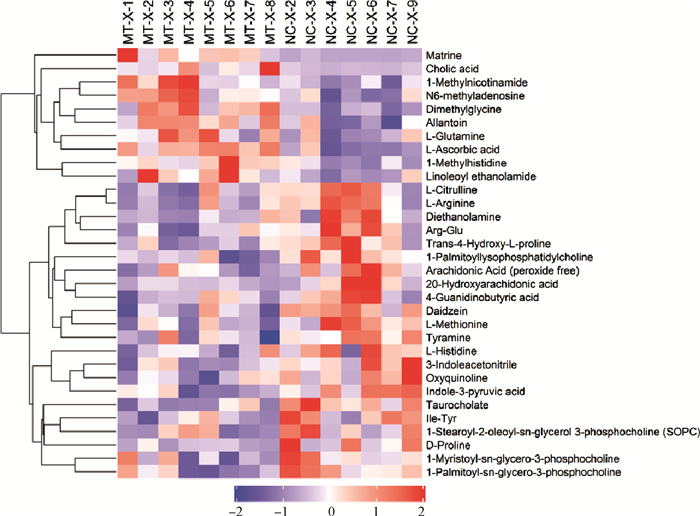
|
图 5 正离子模式下血浆差异代谢物聚类分析结果 Fig. 5 Hierarchical clustering results of differential plasma metabolites in positive ion mode |
|
图 6 负离子模式下血浆差异代谢物聚类分析结果 Fig. 6 Hierarchical clustering results of differential plasma metabolites in negative ion mode |
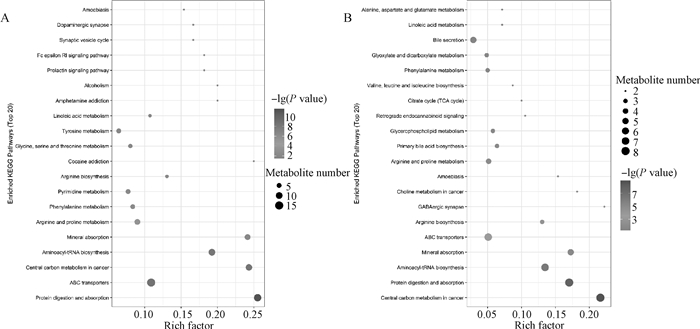
通过KEGG通路分析发现,粪便及血浆差异代谢物分别被映射到Protein digestion and absorption、Central carbon metabolism in cancer、Aminoacyl-tRNA biosynthesis、Mineral absorption、Arginine and proline metabolism等KEGG代谢途径。经比对分析发现苦参碱处理组粪便(图 7A)及血浆(图 7B)中Protein digestion and absorption、ABC transporters、Central carbon metabolism in cancer,Aminoacyl-tRNA biosynthesis和Mineral absorption等重要通路发生了显著变化。
|
图 7 粪便(A)和血浆(B)差异代谢物的KEGG通路分析结果 Fig. 7 The results of KEGG pathway analysis of the differential metabolites of feces (A) and plasma (B) |
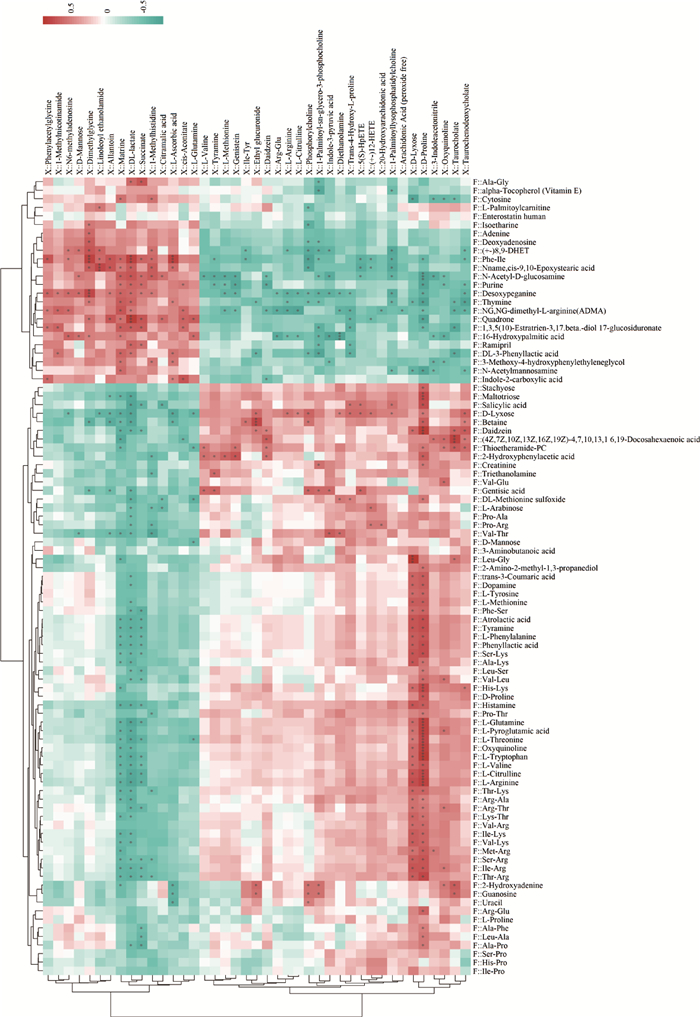
血浆差异代谢物中L-Ascorbic acid、Dimethylglycine、Allantoin、1-Methylhistidine、L-Glutamine、DL-lactate、Phenylacetylglycine、Succinate、D-Mannose等代谢物与粪便差异代谢物中Desoxypeganine、Quadrone、Purine、Adenine、alpha-Tocopherol (Vitamin E)、Cytosine、L-Palmitoylcarnitine、Ramipril、DL-3-Phenyllactic acid、Thymine等代谢物呈正相关,与粪便差异代谢物中Atrolactic acid、Phenyllactic acid、Guanosine、Tyramine、L-Phenylalanine、Daidzein、Betaine、Oxyquinoline、Dopamine等呈负相关;血浆差异代谢物中Indole-3-pyruvic acid、Trans-4-Hydroxy-L-proline、3-Indoleacetonitrile、L-Methionine、L-Arginine、D-Proline、Oxyquinoline、Phosphorylcholine等代谢物与粪便代谢物中L-Arginine、L-Citrulline、Ser-Arg、Histamine、L-Pyroglutamic acid、DL-Methionine sulfoxide、Atrolactic acid、Phenyllactic acid、Guanosine等呈正相关,与粪便差异代谢物中Desoxypeganine、Indole-2-carboxylic acid、Isoetharine、N-Acetylmannosamine、Purine、Adenine、alpha-Tocopherol (Vitamin E)、Cytosine、L-Palmitoylcarnitine、Thymine、Enterostatin human等代谢物呈负相关,以上结果表明血浆代谢物与粪便代谢物之间存在相关性(图 8)。
|
图 8 粪便差异代谢物与血浆差异代谢物相关性分析 Fig. 8 Correlation analysis of different metabolites in feces and plasma |
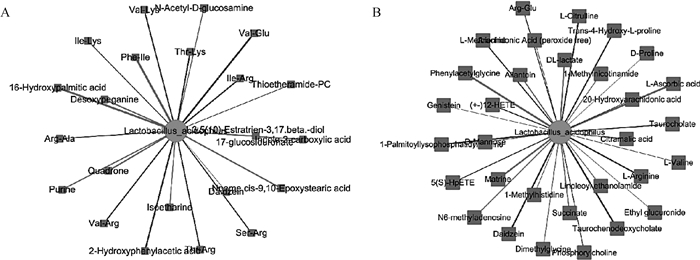
将经过16S rDNA测序分析得到的显著差异菌种嗜酸乳杆菌(Lactobacillus acidophilus)(LDA>4,P<0.05)分别与粪便(图 9A)、血浆(图 9B)显著性差异代谢物(VIP>1,P<0.05)进行关联分析。图中圆圈代表显著性差异的菌属,矩形代表显著性差异的代谢物。蓝色线条代表负相关,红色线条代表正相关,线条的粗细与相关系数的绝对值成正比。结果显示嗜酸乳杆菌与粪便中Ile-Arg、Val-Glu、Thr-Lys等二肽、羧酸及其衍生物呈负相关,与Phe-Ile、Isoetharine、Purine等呈正相关(图 9A);与血浆中D-Proline、L-Citrulline、L-Arginine、L-Valine、L-Methionine、Arg-Glu等二肽、氨基酸及5(S)-HpETE、Genistein、Taurochenodeoxycholate等呈负相关,与1-Methylnicotinamide、DL-lactate、Succinate、Dimethylglycine、Phenylacetylglycine等呈正相关(图 9B),以上结果表明粪便及血浆代谢物与肠道菌群嗜酸乳杆菌存在相关性。
|
图 9 粪便(A)、血浆(B)显着差异代谢物与嗜酸乳杆菌的Spearman相关分析 Fig. 9 Spearman correlation analysis of significant differential metabolites in feces (A), plasma (B) with Lactobacillus acidophilus |
现代研究已证实,苦参碱具有抗炎、抗癌、抗病毒等多种药理作用,而发挥这些药理作用的机制尚未阐释清楚。本试验通过非靶向代谢组学,分别检测了腹腔注射苦参碱后昆明小鼠粪便和血浆的代谢产物。结果显示,苦参碱对昆明小鼠的体内代谢造成了影响,在粪便和血浆中均存在显著差异代谢物。其中,二甲基甘氨酸(Dimethylglycine)、尿囊素(Allantoin)、L-谷氨酰胺(L-Glutamine)、L-抗坏血酸(L-Ascorbic acid)、维生素E(Vitamin E)、柠檬酸(Citramalic acid)等含量增多。研究表明,二甲基甘氨酸、二甲基甘氨酸钠盐在抗氧化及自由基清除方面有重要价值[12-14]。尿囊素对卵白蛋白(OVA)诱导的肺部炎症具有保护作用,可以减轻因哮喘而导致的气道炎症细胞浸润[15]。谷氨酰胺可减轻细胞凋亡,提高机体总抗氧化能力,发挥有效的抗氧化和抗炎作用[16-18],还可以增强肠道固有免疫力,抑制肠毒素性大肠杆菌的感染[19]。L-抗坏血酸在许多酶反应中起辅助因子的作用[20]。柠檬酸在提高抗病能力及成活率,调节免疫细胞功能等方面有重要意义[21]。维生素E在抗炎、抗氧化等方面具有重要的作用[22-23]。胆酸可以显著抑制CVB3病毒感染HeLa细胞[24]。这些研究结果表明,苦参碱药理作用的发挥可能与以上代谢产物有关,其深入的调控机制仍需进一步研究。
在对苦参碱差异代谢物分析时,发现在血浆的代谢产物中有苦参碱的存在,但粪便代谢产物中并未检测到苦参碱。在粪便与血浆差异代谢物关联分析时,发现血浆中苦参碱与粪便中脱氧鸭嘴花碱(Desoxypeganine)呈正相关。脱氧鸭嘴花碱是一种吡咯[2, 1-b]并喹唑啉类生物碱,具有抗炎、抗氧化应激和调节神经递质等药理作用[25]。苦参碱药理作用的发挥是否与脱氧鸭嘴花碱有关,仍需设计试验进一步探究。研究表明,肠道菌群与中药活性成分的互作,在发挥中药疗效中有重要作用[26]。结合差异代谢物与嗜酸乳杆菌的关联分析,还发现粪便中嗜酸乳杆菌的含量与脱氧鸭嘴花碱呈正相关。因此推测,苦参碱通过腹腔注射进入腹腔后,经过腹膜血管、淋巴和肝吸收入血,引起血浆代谢物的改变,苦参碱入血后经过肝代谢转化,代谢物进入肠道,与肠道菌群互作,在调节肠道菌群的同时,被菌群进一步代谢,从而引起粪便代谢物的变化。
综上,苦参碱可调节昆明小鼠的体内代谢,在粪便和血浆中均存在显著差异代谢物。这些差异代谢物之间以及与肠道菌群间存在相关性。苦参碱的体内差异代谢物及与菌群之间的互作可能是其发挥药理作用的关键。
4 结论腹腔注射苦参碱可以调节昆明小鼠的体内代谢,在粪便和血浆中均存在显著差异代谢物。苦参碱的体内差异代谢物及与肠道菌群之间的互作可能是其发挥药理作用的关键。本试验为苦参碱发挥抗病毒等药理作用的机制研究奠定了数据基础。
| [1] |
孙盼盼. 苦参碱抑制PAMs分泌IL-1β的机理及联合用药研究[D]. 晋中: 山西农业大学, 2019. SUN P P. Study on the mechanism of Matrine inhibiting PAMs secrete IL-1β and its combined effect with antibiotics[D]. Jinzhong: Shanxi Agricultural Univers, 2019. (in Chinese) |
| [2] |
王登科, 田兴仓, 王小萍. 苦参碱对高脂血症大鼠血脂代谢和抗氧化能力的影响[J]. 青海医学院学报, 2008, 29(4): 260-262. WANG D K, TIAN X C, WANG X P. Effects of Matrine on the metabolization of serum lipid and anti-oxidation ability in hyperlipidemic rats[J]. Journal of Qinghai Medical College, 2008, 29(4): 260-262. DOI:10.3969/j.issn.1006-8252.2008.04.014 (in Chinese) |
| [3] |
金光虎, 高吉, 毛小强, 等. 苦参碱诱导人前列腺癌pc-3m细胞凋亡及对骨桥蛋白表达的影响[J]. 中国老年学杂志, 2009, 29(21): 2758-2759. JING G H, GAO J, MAO X Q, et al. Matrine induces apoptosis of human prostate cancer pc-3m cells and its effect on the expression of osteopontin[J]. Chinese Journal of Gerontology, 2009, 29(21): 2758-2759. DOI:10.3969/j.issn.1005-9202.2009.21.025 (in Chinese) |
| [4] |
ZHENG J G, XU Y L, KHAN A, et al. In vitro screening of traditional Chinese medicines compounds derived with anti-encephalomyocarditis virus activities[J]. Biotechnol Bioprocess Eng, 2020, 25(2): 181-189. DOI:10.1007/s12257-019-0354-5 |
| [5] |
SUN N, YU T, ZHAO J X, et al. Antiviral activities of natural compounds derived from traditional Chinese medicines against porcine circovirus type 2 (PCV2)[J]. Biotechnol Bioprocess Eng, 2015, 20(1): 180-187. DOI:10.1007/s12257-014-0520-8 |
| [6] |
SUN N, WANG Z W, WU C H, et al. Antiviral activity and underlying molecular mechanisms of Matrine against porcine reproductive and respiratory syndrome virus in vitro[J]. Res Vet Sci, 2014, 96(2): 323-327. DOI:10.1016/j.rvsc.2013.12.009 |
| [7] |
丁园园, 张荣生, 张冬华, 等. 基于网络药理学和分子对接探讨苦参碱抗新冠病毒机制研究[J]. 中药药理与临床, 2020, 36(4): 18-23. DING Y Y, ZHANG R S, ZHANG D H, et al. Mechanism study of Matrine against SARS-CoV-2 based on network pharmacology and molecular docking[J]. Pharmacology and Clinics of Chinese Materia Medica, 2020, 36(4): 18-23. (in Chinese) |
| [8] |
曹志刚, 王弘, 张华, 等. 基于16S rDNA测序分析腹腔注射苦参碱的昆明小鼠肠道菌群结构[J]. 畜牧兽医学报, 2022, 53(2): 618-627. CAO Z G, WANG H, ZHANG H, et al. Influence of Matrine on intestinal flora of Kunming mice through intraperitoneal injection based on 16S rDNA sequencing[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(2): 618-627. (in Chinese) |
| [9] |
张帆, 胡勋秀, 李丁香, 等. 非靶向血液代谢组学研究糖尿病大鼠发生发展及银杏叶提取物干预的作用机制[J]. 药学学报, 2021, 56(4): 1127-1136. ZHANG F, HU X X, LI D X, et al. Ginkgo biloba extract ameliorates streptozotocin-induced diabetes in rats as measured by non-targeted metabolomics[J]. Acta Pharmaceutica Sinica, 2021, 56(4): 1127-1136. (in Chinese) |
| [10] |
WU J W, WEI Z H, CHENG P, et al. Rhein modulates host purine metabolism in intestine through gut microbiota and ameliorates experimental colitis[J]. Theranostics, 2020, 10(23): 10665-10679. DOI:10.7150/thno.43528 |
| [11] |
YANG Y Z, MISRA B B, LIANG L, et al. Integrated microbiome and metabolome analysis reveals a novel interplay between commensal bacteria and metabolites in colorectal cancer[J]. Theranostics, 2019, 9(14): 4101-4114. DOI:10.7150/thno.35186 |
| [12] |
TAKAHASHI T, SASAKI K, SOMFAI T, et al. N, N-Dimethylglycine decreases oxidative stress and improves in vitro development of bovine embryos[J]. J Reprod Dev, 2016, 62(2): 209-212. DOI:10.1262/jrd.2015-149 |
| [13] |
FENG C C, BAI K W, WANG A N, et al. Effects of dimethylglycine sodium salt supplementation on growth performance, hepatic antioxidant capacity, and mitochondria-related gene expression in weanling piglets born with low birth weight[J]. J Anim Sci, 2018, 96(9): 3791-3803. DOI:10.1093/jas/sky233 |
| [14] |
BAI K W, XU W, ZHANG J F, et al. Assessment of free radical scavenging activity of dimethylglycine sodium salt and its role in providing protection against lipopolysaccharide-induced oxidative stress in mice[J]. PLoS One, 2016, 11(5): e0155393. DOI:10.1371/journal.pone.0155393 |
| [15] |
LEE M Y, LEE N H, JUNG D, et al. Protective effects of allantoin against ovalbumin (OVA)-induced lung inflammation in a murine model of asthma[J]. Int Immunopharmacol, 2010, 10(4): 474-480. DOI:10.1016/j.intimp.2010.01.008 |
| [16] |
LIU N, MA X S, LUO X, et al. L-glutamine attenuates apoptosis in porcine enterocytes by regulating glutathione-related redox homeostasis[J]. J Nutr, 2018, 148(4): 526-534. DOI:10.1093/jn/nxx062 |
| [17] |
VICENTINI G E, MARTINS H A, FRACARO L, et al. Does L-glutamine-supplemented diet extenuate NO-mediated damage on myenteric plexus of Walker 256 tumor-bearing rats?[J]. Food Res Int, 2017, 101: 24-34. DOI:10.1016/j.foodres.2017.08.054 |
| [18] |
DURANTE W. The emerging role of L-glutamine in cardiovascular health and disease[J]. Nutrients, 2019, 11(9): 2092. DOI:10.3390/nu11092092 |
| [19] |
LIU G, REN W K, FANG J, et al. L-glutamine and L-arginine protect against enterotoxigenic Escherichia coli infection via intestinal innate immunity in mice[J]. Amino Acids, 2017, 49(12): 1945-1954. DOI:10.1007/s00726-017-2410-9 |
| [20] |
VAN GORKOM G N Y, LOOKERMANS E L, VAN ELSSEN C H M J, et al. The effect of Vitamin C (ascorbic acid) in the treatment of patients with cancer: A systematic review[J]. Nutrients, 2019, 11(5): 977. DOI:10.3390/nu11050977 |
| [21] |
WILLIAMS N C, O'NEILL L A J. A role for the Krebs cycle intermediate citrate in metabolic reprogramming in innate immunity and inflammation[J]. Front Immunol, 2018, 9: 141. DOI:10.3389/fimmu.2018.00141 |
| [22] |
WONG W Y, WARD L C, FONG C W, et al. Anti-inflammatory γ- and δ-tocotrienols improve cardiovascular, liver and metabolic function in diet-induced obese rats[J]. Eur J Nutr, 2017, 56(1): 133-150. DOI:10.1007/s00394-015-1064-1 |
| [23] |
MIYAZAWA T, BURDEOS G C, ITAYA M, et al. Vitamin E: Regulatory redox interactions[J]. IUBMB Life, 2019, 71(4): 430-441. DOI:10.1002/iub.2008 |
| [24] |
HAN J Y, JEONG H I, PARK C W, et al. Cholic acid attenuates ER stress-induced cell death in coxsackievirus-B3 infection[J]. J Microbiol Biotechnol, 2018, 28(1): 109-114. DOI:10.4014/jmb.1708.08009 |
| [25] |
邓钢. 脱氧鸭嘴花碱改善学习记忆作用及其药物动力学研究[D]. 上海: 上海中医药大学, 2019. DENG G. Studies on the mechanism of improving learning and memory and pharmacokinetics of deoxyvasicine[D]. Shanghai: Shanghai University of Traditional Chinese Medicine, 2019. (in Chinese) |
| [26] |
LIN T L, LU C C, LAI W F, et al. Role of gut microbiota in identification of novel TCM-derived active metabolites[J]. Protein Cell, 2021, 12(5): 394-410. DOI:10.1007/s13238-020-00784-w |
(编辑 范子娟)



