肝是主要的代谢器官,它在运动和饥饿期间将血液中的葡萄糖、脂肪酸和氨基酸转化为肝外组织必需的代谢燃料[1]。此外,肝中关键的生物转化过程也会转化内源性和外源性化合物,以加速它们从体内的清除[2]。肝损伤可能由药物、感染或遗传疾病引起[3]。这些肝毒性物质会产生过量的活性氧(ROS)[4],从而诱发炎症、免疫调节、肝硬化和肝部疾病[5-6]。肝病已成为影响人类健康的最常见疾病之一[7]。CCl4是一种可导致化学性肝损伤的化合物,包括炎症和纤维化[8],通常用于诱导小鼠模型的急性肝损伤[9]。CCl4的毒性作用会导致肝组织局部坏死;受损的肝细胞、肝窦内皮细胞和活化的库普弗细胞释放促炎细胞因子,如TNF-α、IL-1β、IL-6等细胞因子,导致炎症反应[10]。长期以来,急性肝损伤是全球关注的热点。在保护肝损伤方面,中医药一直是临床和试验研究的关注焦点。
茵山莲是由东汉医圣张仲景治疗黄疸病名方“茵陈蒿汤”加减化裁而来,由茵陈、栀子、半枝莲、板蓝根、五味子、甘草等6味中药组成,用于治疗急慢性肝炎、胆囊炎、胰腺炎等,研究发现, 茵山莲能显著升高急性胰腺炎患者外周血T-SOD,降低血清丙二醛(MDA)、IL-2、TNF-α水平[11-12]。茵陈是治疗各种肝病和黄疸的方剂中最重要和最常用的中药之一,已有研究报道茵陈可迅速降低转氨酶,抑制肝细胞变性和坏死,保护肝组织[13];甘草、五味子有效成分可抑制肝中胶原的合成,防止肝纤维增生,降低肝硬化发生率,网络药理学分析还发现,甘草和五味子可通过抗氧化、细胞凋亡、炎症反应和加速新陈代谢等多靶点减轻药物肝毒性,缓解肝损伤[14-15]。茵陈蒿汤可通过促进抗氧化酶T-SOD的表达和活性来减弱肝脂质过氧化并降低MDA和GST水平,从而改善CCl4诱导的肝损伤[16-17]。但是目前尚未有研究报道茵山莲对急性肝损伤的作用机制,因此, 本研究旨在探讨茵山莲水提物对CCl4所致急性肝损伤的保护作用,并揭示其作用机制,为治疗肝损伤提供试验依据。
1 材料和方法 1.1 试剂和仪器四氯化碳(CCl4,Sigma,C805332,纯度>98%),玉米油购自麦克林公司;联苯双酯滴丸(国药准字H11020980)购自北京协和药厂;茵山莲药材(茵陈、半枝莲、五味子、栀子、甘草、板蓝根按2∶5∶1∶1∶1∶1比例配伍)购自中国北京同仁堂(集团)有限责任公司;谷胱甘肽-S转移酶(GST)测定试剂盒(A004-1-1)、总超氧化物歧化酶(T-SOD)测定试剂盒(A001-1)、过氧化氢酶(CAT)测定试剂盒(A007-1-1)和总蛋白定量(TP)测定试剂盒(A045-3)购自南京建成生物工程研究所有限公司;琥珀酸脱氢酶(SDH)活性检测试剂盒(BC0955),Massson三色染色液(固绿法,G1343)、苏木精染色液(G1140)、伊红染色液(G1100),SDS-PAGE凝胶制备试剂盒(P1200)购自北京索莱宝科技有限公司;Page Ruler Prestained Protein Ladder(#26618)购自赛默飞世尔科技(中国)有限公司;即用型SABC-AP(小鼠/兔IgG)试剂盒(SA1050)购自博士德生物工程有限公司(武汉);NF-κBp65抗体(ab32536)、IKK抗体(ab3204)、VEGFA抗体(ab1316)、p38MAPK抗体(ab170099)、IL-1β抗体(ab9722)、TNF-α抗体(ab6671)、MMP9抗体(ab228402)、β-actin(ab8227)抗体购自Abcam公司;山羊抗兔抗体HRP标记(S0101)购自兰博利德公司;化学发光液(HY-K1005)购自MCE公司。全波长酶标仪(Infinite 200 pro,TECAN, 奥地利),光学显微镜(DS-Ri2, Nikon, 日本),多功能成像仪(Amersham ImageQuant 800 imaging system,Cytiva, 美国)。
1.2 实验动物分组及处理60只8周龄SPF级ICR小鼠,购自斯贝福(北京)实验动物科技有限公司(生产许可证:SCXK(京)2019-0010)。小鼠适应性饲养1周,每日给予光照、黑暗各12 h,饲养环境温度保持在(25±0.5)℃,湿度50%~60%,自由采食和饮水。之后随机分为6组(n=10),分别为A、B、C、D、E、F组。A组为空白对照组,每只小鼠灌胃0.2 mL生理盐水;B组为模型对照组,每只小鼠灌胃0.2 mL生理盐水;C组为联苯双酯对照组,每只小鼠按200 mg·kg-1 (BW)剂量灌胃等体积联苯双酯溶液;D、E、F组分别为茵山莲低、中、高剂量组,分别按1.17、2.34、4.68 mg·g-1茵山莲水提物灌胃给药,连续灌胃7 d。剂量参考人医临床给药剂量3 g,低、中、高剂量分别按人药剂量的3、6和12倍给药,并由人和小鼠体表面积折算系数9.01计算所得。末次给药1 h后,用药组小鼠按0.1 mL每10 g(BW)剂量腹腔注射0.2% CCl4溶液,使用玉米油进行CCl4的原液稀释,空白对照组腹腔注射等量玉米油,12 h后眼球采血,分离血清,收集肝组织,一半固定于10%福尔马林,一半冻存于-80 ℃(图 1)。本研究中动物处理过程通过中国农业大学实验动物管理和使用委员会的动物伦理学审查。
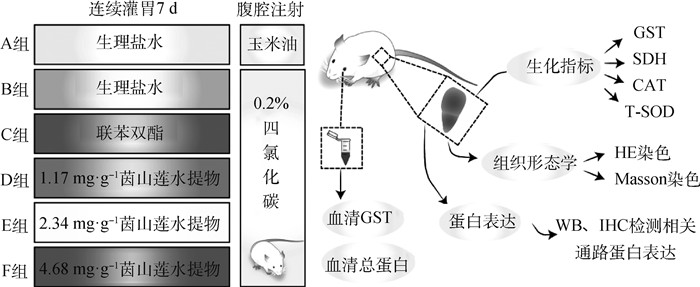
|
图 1 茵山莲水提物对四氯化碳诱导小鼠急性肝损伤作用的试验流程 Fig. 1 Procedure and methods of the study of YSL aqueous extract effect on acute liver injury induced by CCl4 |
1.3.1 血清总蛋白含量测定 小鼠眼球采血后,3 500×g离心15 min,吸取上层澄清血清,按血清∶生理盐水=1∶49比例稀释,参考血清总蛋白含量测定试剂盒说明书加入工作液,562 nm波长检测OD值,计算血清总蛋白浓度[18-19]。
1.3.2 血清和肝GST活力测定 常规制备10%组织匀浆和待测血清。按南京建成GST活力检测试剂盒说明书分别加入基质液,血清或组织匀浆样本,应用液等试剂,412 nm波长检测OD值,计算GST酶活力[20]。
1.3.3 肝SDH活性检测 取10%肝组织匀浆,按生产商试剂盒说明书加入相关试剂后,37 ℃孵育10 min,在600 nm波长下记录OD值。按相应公式计算SDH活性[21]。
1.3.4 肝CAT和T-SOD测定 取10%肝组织匀浆,分别按CAT和T-SOD测定试剂盒使用说明书加入样品和试剂,于405 nm和550 nm波长下检测吸光度,计算CAT和T-SOD活力[18-19]。
1.3.5 肝组织病理学及肝纤维化观察 常规方法制备石蜡切片,二甲苯和梯度酒精进行脱蜡至水,苏木精染色10 min后,盐酸酒精分化,氨水复蓝,伊红染色2 min,梯度酒精和二甲苯脱水透明后封片,于光学显微镜下进行组织病理学观察。
切片脱蜡至水后,用Weigert铁苏木素染色10 min,酸性乙醇适度分化,水洗后用Masson蓝化液返蓝,蒸馏水洗,丽春红品红染色7 min,弱酸液和磷钼酸溶液分别洗1 min,进入固绿染色液中染色2 min,弱酸水洗后,用95%乙醇和无水乙醇快速脱水,透明封片。于光学显微镜下观察肝纤维化水平。肝纤维化水平参考Ishak评分系统(表 1)。
|
|
表 1 肝纤维化Ishak评分系统 Table 1 Ishak scoring system for liver fibrosis |
1.3.6 肝组织炎性因子相关蛋白表达检测 使用总蛋白提取试剂盒提取肝组织蛋白,通过BCA法测得蛋白浓度。每孔40 μg蛋白上样后进行电泳,以将等量的蛋白质提取物分离到10%聚丙烯酰胺凝胶上并转移至PVDF膜。在阻断非特异性结合位点后,将膜与NF-κBp65抗体(1∶1 000)、IKK抗体(1∶1 000)、VEGFA抗体(1∶1 000)、p38MAPK抗体(1∶1 000)、IL-1β抗体(1∶1 000)、TNF-α抗体(1:1 000)、MMP9抗体(1∶1 000)、β-actin(1∶1 000) 4 ℃孵育过夜。TBST清洗5 min×3次后,山羊抗兔抗体室温孵育3 h,TBST清洗5 min×3次后用化学发光液在显影仪中进行显影。
1.3.7 肝组织NF-κBp65、IKK、VEGFA蛋白定位观察 常规方法制备石蜡切片,脱蜡至水后按照即用型SABC-AP(小鼠/兔IgG)试剂盒说明进行抗原修复,抗体孵育等操作,使用BCIP/NBT体系进行显色,在光学显微镜下观察深紫色阳性表达区域。
1.4 数据统计使用IBM SPSS Statistics 26.0软件进行统计学分析。多重比较经方差齐性检验后进行单因素方差分析,方差不齐时,采用独立样本T检验。采用SNK事后检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 茵山莲水提物对CCl4诱导的急性肝损伤生化指标的影响与空白对照组相比,CCl4腹腔注射后,小鼠血清总蛋白(TP)水平显著升高(P<0.05),联苯双酯药物、中和低剂量的茵山莲水提物处理后,血清TP与空白对照组和模型对照组均没有显著差异(P>0.05),与空白对照组相比,高剂量茵山莲组小鼠血清总蛋白水平显著提高(P<0.05)。与空白对照组相比,模型对照组血清GST活力显著升高(P<0.05),而与模型对照组相比,联苯双酯和高、中、低剂量茵山莲均能显著降低血清GST活力,其中低剂量茵山莲水提物组与空白组无显著差异(P>0.05)。而肝组织中,空白对照组GST与模型对照组、联苯双酯组以及中、低剂量茵山莲组GST活性无显著差异(P>0.05),但高剂量茵山莲能显著提高肝GST活力且与空白组有显著差异(P<0.05)。0.2% CCl4能显著降低肝SDH和CAT活力(P<0.05),而与模型对照组相比,联苯双酯和中剂量茵山莲水提物均能显著提高CAT活力(P<0.05),并且中剂量茵山莲组与空白组和联苯双酯组均没有显著差异(P>0.05)。肝组织内T-SOD活力在各组间没有显著差异(P>0.05,图 2)。
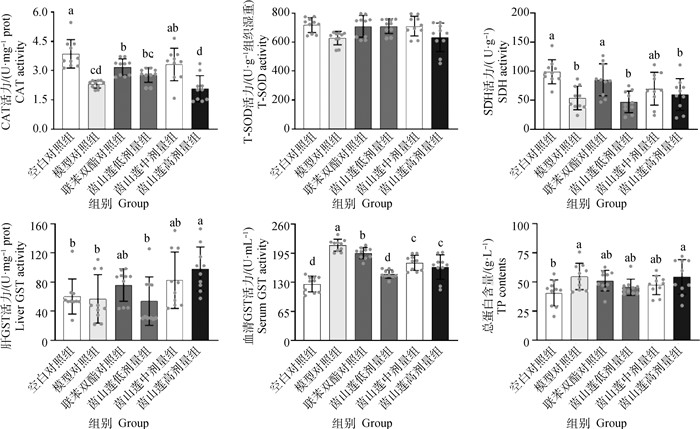
|
不同小写字母表示组间有显著差异(P<0.05),下同 Different lowercase letters showed significant differences among groups (P < 0.05), the same as below 图 2 茵山莲水提物对CCl4诱导的急性肝损伤生化指标的影响 Fig. 2 Effects of YSL aqueous extract on biochemical parameters in acute liver injury induced by CCl4 |
观察HE染色结果发现,空白组小鼠肝索排列整齐,肝细胞结构完整。0.2% CCl4腹腔注射后,小鼠肝内有淤血沉积,坏死部位的肝细胞形态肿胀,失去正常的细胞结构和大小,细胞间界限不清楚,出现似疤痕样变化,肝索放射样排列遭到破坏,Masson染色也可观察到肝纤维组织增生。而联苯双酯和高、中、低茵山莲处理后,肝细胞的形态得到一定恢复,疤痕样变化减轻,肝纤维组织的增生也得到了一定遏制(图 3a、3b),并且肝纤维化评分降低(图 4)。

|
a. HE染色;b. Masson染色。A.空白对照组;B. CCl4模型组;C. 联苯双酯组;D. 茵山莲低剂量组;E茵山莲中剂量组;F. 茵山莲高剂量组。→表示结构受损的肝细胞;▲表示纤维组织 a. HE staining; b. Masson staining. A. Blank control group; B. CCl4 model group; C. Biphenyl diester group; D. YSL low dose group; E. YSL medium dose group; F. YSL high dose group. → indicates structurally damaged hepatocytes; ▲ indicates fibrous tissue 图 3 茵山莲水提物对CCl4诱导急性肝损伤的组织学和纤维化水平观察 Fig. 3 Observation of YSL aqueous extract on histology and fibrosis in acute liver injury induced by CCl4 |
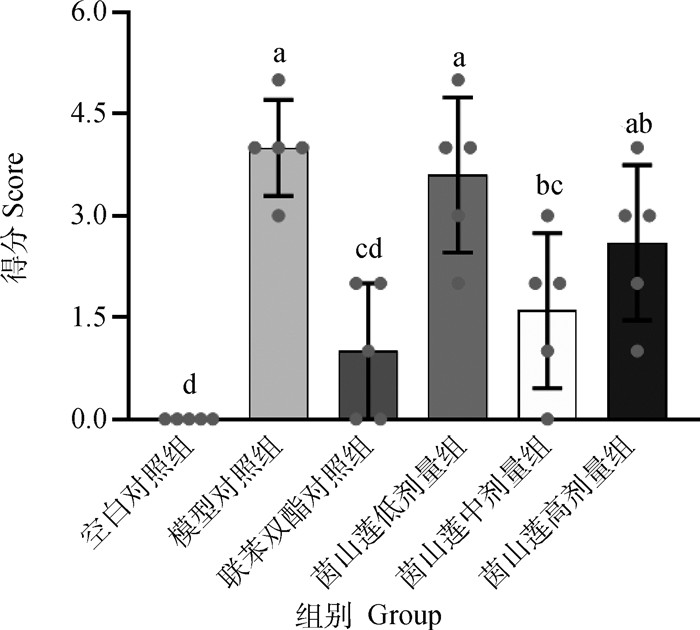
|
图 4 茵山莲水提物对CCl4诱导急性肝损伤的组织纤维化水平Ishak评分 Fig. 4 Ishak score of YSL aqueous extract on histology and fibrosis in acute liver injury induced by CCl4 |
CCl4腹腔注射后肝组织炎性蛋白TNF-α、IL-1β、p38MAPK、NF-κBp65、IKK和组织基质相关蛋白VEGFA、MMP9与空白对照组相比表达均显著升高(P<0.05)。与模型对照组相比,联苯双酯和中剂量茵山莲水提物显著降低了TNF-α、IL-1β、p38MAPK、NF-κBp65、IKK和组织基质相关蛋白VEGFA、MMP9的表达(P<0.05,图 5)。
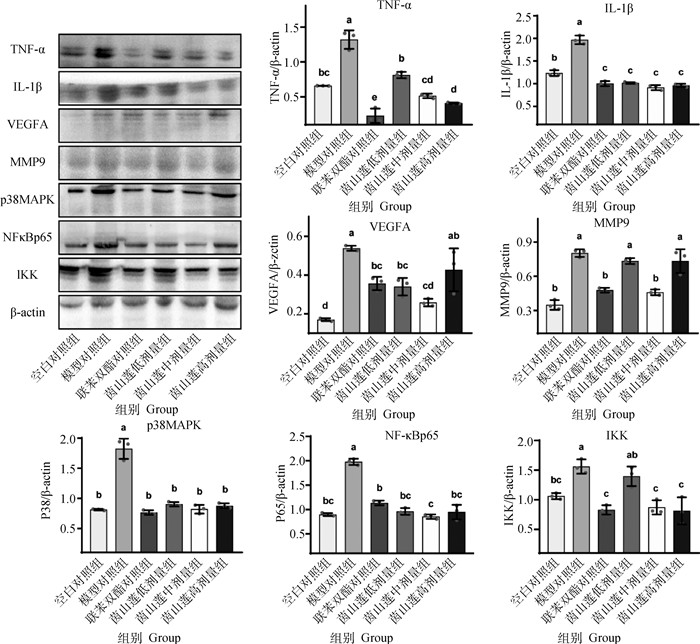
|
图 5 茵山莲水提物对急性肝损伤小鼠肝炎性及组织基质相关蛋白表达的影响 Fig. 5 Effects of YSL aqueous extract on hepatic inflammatory and tissue matrix related proteins expression in acute liver injury |
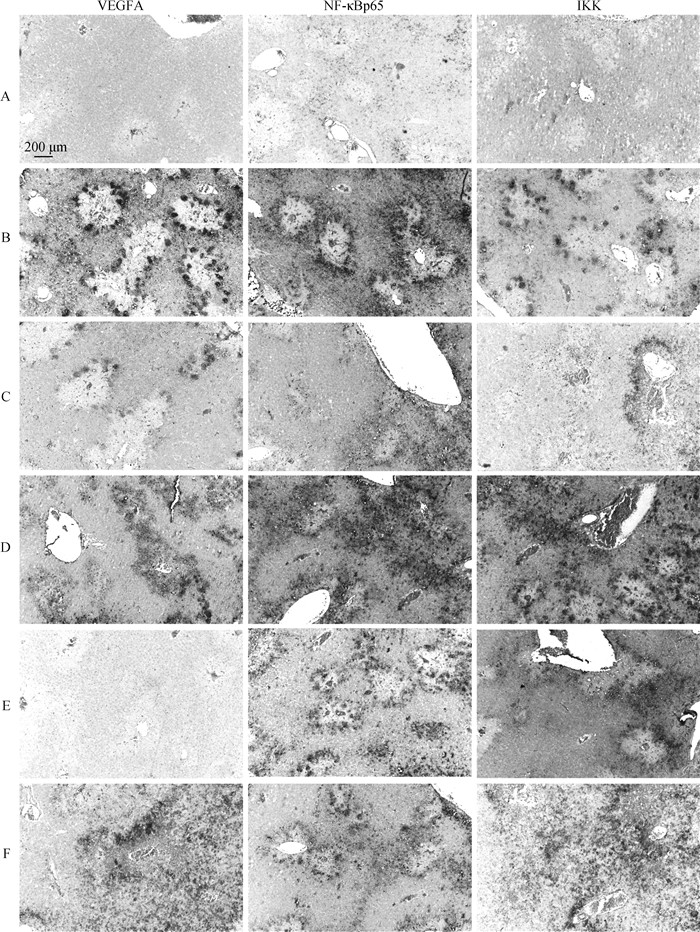
如图 6所示,与空白组相比,CCl4对照组VEGFA、NF-κBp65和IKK蛋白表达均增加,且集中在肝细胞坏死,纤维组织附近。联苯双酯和各个剂量茵山莲水提物不同程度地减少了VEGFA、NF-κBp65和IKK蛋白表达。
|
A.空白对照组;B. CCl4模型组;C. 联苯双酯组;D. 茵山莲低剂量组;E茵山莲中剂量组;F. 茵山莲高剂量组 A. Blank control group; B. CCl4 model group; C. Biphenyl diester group; D. YSL low dose group; E. YSL medium dose group; F. YSL high dose group 图 6 茵山莲水提物对急性肝损伤小鼠肝VEGFA、NFκBp65和IKK蛋白表达及定位的影响 Fig. 6 Effects of YSL aqueous extract on the protein expression and localization of VEGFA, NFκBp65 and IKK in acute liver injury induced by CCl4 |
本研究讨论了茵山莲水提物对CCl4诱导肝损伤的保护作用及可能机制。组织学观察显示CCl4引起了肝细胞广泛的坏死和纤维化,但预先给小鼠灌胃联苯双酯或2.34 mg·g-1茵山莲水提物,其病理变化极大减少。纤维化本质上是一种伤口愈合反应,其特征是细胞外基质(ECM)的长期积累。ECM的过度沉积会引起不可逆的纤维化反应,并导致永久性纤维化疤痕的形成,最终导致器官衰竭[22]。作为最常见的组织纤维化类型之一,肝纤维化与肝功能障碍有关,几乎可以在所有类型的急慢性肝病中观察到,无论病因如何,在很大程度上,肝组织炎症和肝星状细胞激活是肝纤维化的基本反应,它导致一系列变化,如纤维化基因的表达、血管和器官的收缩以及细胞因子的产生[23]。因此,试验中2.34 mg·g-1茵山莲水提物显著抑制了肝纤维化进程,为后续缓解急性肝损伤奠定了组织基础。
此外,肝和血清生化指标检测也显示不同剂量茵山莲水提物具有护肝作用:小鼠暴露于0.2% CCl4后,血清GST活力和总蛋白水平均异常升高,而肝GST活力却没有显著变化。GST是一类广泛分布于生物体的多功能解毒酶系,主要存在于肝、肾中,参与许多内外源有毒物质的代谢,并可转运一些重要的亲脂性化合物,具有修复氧化破坏的大分子如DNA、蛋白质等的功能[20]。由于肝细胞结构受到破坏,肝内GST酶活失去反应性,因此血清中GST酶活可能发生了代偿性异常升高,而预先灌胃联苯双酯或不同剂量茵山莲水提物则可显著降低其水平,恢复肝内GST活力。同理,肝细胞膜破坏,肝内重要的氧化还原酶和代谢酶T-SOD、SDH、CAT等酶的活性或含量出现了不同程度的下降[24],而外漏的各类酶使血清总蛋白含量升高,2.34 mg·g-1茵山莲水提物抑制了肝T-SOD、SDH、CAT的流失和活力降低,从而也能降低血清总蛋白含量。
为了进一步探究茵山莲水提物的保肝作用,运用蛋白免疫印迹和免疫组织化学技术检测了茵山莲水提物对重要信号传导反应因子的影响,以便讨论茵山莲水提物护肝作用的分子机理。氧化应激与肝疾病的发生和发展过程中的炎症密切相关[25]。茵山莲水提物的抗氧化和抗炎机理可能是减轻肝损伤的关键机制,氧化应激能促进Toll样受体(TLR) 介导的炎症反应,这些反应通路对于肝疾病的发病机制至关重要。NF-κB信号通路是最重要的TLR激活下游转录因子之一,可驱动炎性细胞因子和趋化因子的表达。一旦TLR被激活,IKK就会磷酸化并激活NF-κB的抑制剂(IκB),导致IκB泛素化并进一步降解,致使NF-κB亚型p65和p50的释放、核易位,从而激活炎症反应[26]。与前人研究相一致[20, 27-28],本研究发现不同剂量茵山莲水提物能够降低CCl4诱导急性肝损伤肝组织纤维化周围NF-κBp65、IKK的蛋白表达,并能显著降低肝内p38MAPK凋亡相关蛋白因子和VEGFA、MMP9等基质沉积相关因子表达。剂量依赖性抑制TNF-α和IL-1β在肝的表达。
4 结论茵山莲水提物对CCl4诱导肝损伤的保护作用主要表现在抗氧化和抗炎作用,其可以通过p38 MAPK和NF-κB信号转导缓解CCl4急性肝损伤作用。
| [1] |
RUI L. Energy metabolism in the liver[J]. Compr Physiol, 2014, 4(1): 177-197. |
| [2] |
ALMAZROO O A, MIAH M K, VENKATARAMANAN R. Drug metabolism in the liver[J]. Clin Liver Dis, 2017, 21(1): 1-20. DOI:10.1016/j.cld.2016.08.001 |
| [3] |
XU L J, ZHENG R Y, XIE P, et al. Dysregulation of UDP-glucuronosyltransferases in CCl4 induced liver injury rats[J]. Chem Biol Interact, 2020, 325: 109115. DOI:10.1016/j.cbi.2020.109115 |
| [4] |
AYAZ M, JUNAID M, AHMED J, et al. Phenolic contents, antioxidant and anticholinesterase potentials of crude extract, subsequent fractions and crude saponins from Polygonum hydropiper L[J]. BMC Complement Altern Med, 2014, 14: 145. DOI:10.1186/1472-6882-14-145 |
| [5] |
SUN B, KARIN M. NF-κB signaling, liver disease and hepatoprotective agents[J]. Oncogene, 2008, 27(48): 6228-6244. DOI:10.1038/onc.2008.300 |
| [6] |
KANG R, TIAN W, CAO W, et al. Ligustroflavone ameliorates CCl4-induced liver fibrosis through down-regulating the TGF-β/Smad signaling pathway[J]. Chin J Nat Med, 2021, 19(3): 170-180. |
| [7] |
TRIVEDI P J, HIRSCHFIELD G M. Recent advances in clinical practice: epidemiology of autoimmune liver diseases[J]. Gut, 2021, 70(10): 1989-2003. DOI:10.1136/gutjnl-2020-322362 |
| [8] |
DOMITROVIĆ R, JAKOVAC H, MARCHESI V V, et al. Differential hepatoprotective mechanisms of rutin and quercetin in CCl4-intoxicated BALB/cN mice[J]. Acta Pharmacol Sin, 2012, 33(10): 1260-1270. DOI:10.1038/aps.2012.62 |
| [9] |
MA J Q, DING J, ZHANG L, et al. Hepatoprotective properties of sesamin against CCl4 induced oxidative stress-mediated apoptosis in mice via JNK pathway[J]. Food Chem Toxicol, 2014, 64: 41-48. DOI:10.1016/j.fct.2013.11.017 |
| [10] |
ZHAO J Y, HU H X, WAN Y, et al. Pien Tze Huang Gan Bao ameliorates carbon tetrachloride-induced hepatic injury, oxidative stress and inflammation in rats[J]. Exp Ther Med, 2017, 13(5): 1820-1826. DOI:10.3892/etm.2017.4174 |
| [11] |
刘兴超. 茵山莲颗粒质量控制方法及药物动力学研究[D]. 沈阳: 沈阳药科大学, 2007. LIU X C. Study on quality control method and pharmacokinetics of Yinshanlian granules[D]. Shenyang: Shenyang Pharmaceutical University, 2007. (in Chinese) |
| [12] |
陈俊, 周翔宇, 杨辉. 茵山莲颗粒对急性胰腺炎患者外周血MDA、SOD及IL-2、TNF-α水平的影响[J]. 湖南师范大学学报: 医学版, 2020, 17(1): 43-46. CHEN J, ZHOU X Y, YANG H. Effect of Yinshanlian granules on peripheral blood MDA, SOD, IL-2 and TNF-α levels in patients with acute pancreatitis[J]. Journal of Hunan Normal University: Medical Science, 2020, 17(1): 43-46. DOI:10.3969/j.issn.1673-016X.2020.01.013 (in Chinese) |
| [13] |
CAI Y J, ZHENG Q, SUN R, et al. Recent progress in the study of Artemisiae Scopariae Herba (Yin Chen), a promising medicinal herb for liver diseases[J]. Biomed Pharmacother, 2020, 130: 110513. DOI:10.1016/j.biopha.2020.110513 |
| [14] |
MAN Q, DENG Y, LI P J, et al. Licorice ameliorates cisplatin-induced hepatotoxicity through antiapoptosis, antioxidative stress, anti-inflammation, and acceleration of metabolism[J]. Front Pharmacol, 2020, 11: 563750. DOI:10.3389/fphar.2020.563750 |
| [15] |
LI X K, YANG H J, XIAO J C, et al. Network pharmacology based investigation into the bioactive compounds and molecular mechanisms of Schisandrae Chinensis Fructus against drug-induced liver injury[J]. Bioorg Chem, 2020, 96: 103553. DOI:10.1016/j.bioorg.2019.103553 |
| [16] |
LIU F, SUN Z L, HU P, et al. Determining the protective effects of Yin-Chen-Hao Tang against acute liver injury induced by carbon tetrachloride using 16S rRNA gene sequencing and LC/MS-based metabolomics[J]. J Pharm Biomed Anal, 2019, 174: 567-577. DOI:10.1016/j.jpba.2019.06.028 |
| [17] |
王磊, 刘平, 王春树, 等. 不同功效古典方剂对肝硬化大鼠肝组织氧化应激反应的影响[J]. 中国中西医结合杂志, 2008, 28(5): 435-439. WANG L, LIU P, WANG C S, et al. Effects of 5 classical recipes on anti-oxidative stress in rat liver with cirrhosis[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2008, 28(5): 435-439. DOI:10.3321/j.issn:1003-5370.2008.05.015 (in Chinese) |
| [18] |
HAN C, WEI Y Y, CUI Y Q, et al. Florfenicol induces oxidative stress and hepatocyte apoptosis in broilers via Nrf2 pathway[J]. Ecotoxicol Environ Saf, 2020, 191: 110239. DOI:10.1016/j.ecoenv.2020.110239 |
| [19] |
HAN C, CUI Y Q, GUO Y W, et al. Proteome and transcriptome analysis revealed florfenicol via affected drug metabolism and lipid metabolism induce liver injury of broilers[J]. Poult Sci, 2021, 100(9): 101228. DOI:10.1016/j.psj.2021.101228 |
| [20] |
MATSUI R, FERRAN B, OH A, et al. Redox regulation via glutaredoxin-1 and protein S -glutathionylation[J]. Antioxid Redox Signal, 2020, 32(10): 677-700. DOI:10.1089/ars.2019.7963 |
| [21] |
NEUMAN M G, COHEN L B, STEENKAMP V. Pyrrolizidine alkaloids enhance alcohol-induced hepatocytotoxicity in vitro in normal human hepatocytes[J]. Eur Rev Med Pharmacol Sci, 2017, 21(1 Suppl): 53-68. |
| [22] |
WYNN T A, RAMALINGAM T R. Mechanisms of fibrosis: therapeutic translation for fibrotic disease[J]. Nat Med, 2012, 18(7): 1028-1040. DOI:10.1038/nm.2807 |
| [23] |
LIU X, ZHAO X X. Scoparone attenuates hepatic stellate cell activation through inhibiting TGF-β/Smad signaling pathway[J]. Biomed Pharmacother, 2017, 93: 57-61. DOI:10.1016/j.biopha.2017.06.006 |
| [24] |
HUANG Q F, ZHANG S J, ZHENG L, et al. Hepatoprotective effects of total saponins isolated from Taraphochlamys affinis against carbon tetrachloride induced liver injury in rats[J]. Food Chem Toxicol, 2012, 50(3-4): 713-718. DOI:10.1016/j.fct.2011.12.009 |
| [25] |
LIANG N J, KITTS D D. Role of chlorogenic acids in controlling oxidative and inflammatory stress conditions[J]. Nutrients, 2016, 8(1): 16. |
| [26] |
WANG W D, WANG S J, LIU J P, et al. Sesquiterpenoids from the root of Panax Ginseng protect CCl4-induced acute liver injury by anti-inflammatory and anti-oxidative capabilities in mice[J]. Biomed Pharmacother, 2018, 102: 412-419. DOI:10.1016/j.biopha.2018.02.041 |
| [27] |
EL-SISI A E, ZAKARIA S. Daclatasvir and sofosbuvir mitigate hepatic fibrosis through downregulation of TNF-α/NF-κB signaling pathway[J]. Curr Mol Pharmacol, 2020, 13(4): 318-327. DOI:10.2174/1874467213666200116114919 |
| [28] |
HAMID M, LIU D D, ABDULRAHIM Y, et al. Amelioration of CCl4-induced liver injury in rats by selenizing Astragalus polysaccharides: role of proinflammatory cytokines, oxidative stress and hepatic stellate cells[J]. Res Vet Sci, 2017, 114: 202-211. DOI:10.1016/j.rvsc.2017.05.002 |
(编辑 范子娟)



