2. 中国农业科学院兰州兽医研究所, 家畜疫病病原生物学国家重点实验室, 兰州 730046
2. State Key Laboratory of Veterinary Etiological Biology, Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046, China
小反刍兽疫病毒(peste des petits ruminants virus,PPRV)属于副黏病毒科麻疹病毒属[1],是一种有囊膜的单股负链RNA病毒,在我国被列为一类病原微生物。PPRV感染山羊、绵羊等引起的小反刍兽疫(PPR)具有较高的发病率和死亡率,在非洲、中东和亚洲等地区流行并造成重大经济损失,被OIE列为法定上报的动物传染病,在我国属于一类动物疫病。2007年, 我国西藏首次暴发PPR,2013― 2014年, 该病迅速传播、流行于22个省区[2-3],2018年,在我国甘肃西北部造成少量绵羊死亡[4]。鉴于该病对养殖业尤其是养羊业的影响,OIE和FAO制定了为期15年(2015―2030年)的全球小反刍兽疫根除计划。目前,PPR尚无有效的治疗方法,防控的主要措施是疫苗免疫,但是传统的减毒活疫苗存在无法区分自然感染动物和免疫动物、热稳定性低等缺陷,限制了其使用范围,重组标记疫苗的开发虽大有成效,但要普遍应用还为时尚早,因而探索影响PPRV复制的因素对于兽医学研究以及经济意义至关重要。
组蛋白去乙酰化酶(histone deacetylases,HDACs)是一类蛋白酶,通过调控组蛋白和非组蛋白的乙酰化状态调控基因的表达,进而调控细胞内多种生命活动过程,其中,包括炎症反应和抗病毒免疫反应。组蛋白去乙酰化酶有18个家族成员[5],分为4类:Ⅰ类包括HDAC1、HDAC2、HDAC3、HDAC8;II类可以细分为IIa类(HDAC4、HDAC5、HDAC7和HDAC9)和IIb类(HDAC6和HDAC10)[6];III类为Sirtuins家族,属于NAD+依赖性的Sir2超蛋白家族,含有SIRT1~SIRT7七个成员;IV类仅有HDAC11。
HDACs抑制剂是一类小分子化合物,通过抑制HDACs活性调控蛋白质的乙酰化水平,已被广泛应用以揭示HDACs的作用机制。HDACs抑制剂能够调控病毒复制,如SAHA、PCI-34051能够抑制丙肝病毒(HCV)复制[7],Tubastatin A能够抑制日本脑炎病毒(JEV) 复制[8]。然而,HDACs抑制剂在PPRV感染过程中的作用尚未见报道。因此, 本研究选用不同作用谱的HDACs抑制剂Nicotinamide(NIC,SIRT家族的抑制剂)、Vorinostat(SAHA,广谱HDAC家族抑制剂)、Trichostatin A(TSA,广谱HDAC家族抑制剂)、Mocetinostat(MGCD0103,Ⅰ类HDACs抑制剂,主要作用于HDAC1/2/3/11)、TMP269(Ⅱa类HDACs抑制剂,作用于HDAC4/5/7/9)、Tubastatin A(HDAC6抑制剂)和PCI-34051(HDAC8抑制剂),分析其对PPRV复制的影响,为进一步研究HDACs调控PPRV感染机制奠定基础。
1 材料与方法 1.1 材料Vero细胞和PPRV Nigeria75/1毒株由本实验室保存;Mocetinostat(MGCD0103)、TrichostatinA(TSA)、Vorinostat(SAHA)、TMP269、PCI-34051、Tubastatin A、NIC购自SELLECK公司;CCK-8试剂盒购自APExBIO公司;Anti-N Antibody由本实验室提供;鼠源抗β-Actin Antibody购自Proteintech公司;Rabbit Anti-Mouse Antibody购自Bioss ANTIBODIES公司;PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)、TB Green® Premix Ex TaqTM II(Tli RNaseH Plus)、One Step TB Green® PrimeScriptTM RT-PCR Kit (Perfect Real Time)、TaKaRa MiniBEST Universal RNA Extraction Kit、TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0购自宝生物工程(大连)有限公司;DMEM购自甘肃健顺生物科技有限公司;胎牛血清、青链霉素购自Biological industries公司。
1.2 方法1.2.1 细胞培养和病毒感染 Vero细胞培养于含有胎牛血清(100 mL·L-1)、青链霉素(10 mL·L-1) 的DMEM培养基中,在50 mL·L-1CO2、37 ℃细胞培养箱中培养。细胞密度达到80%左右时接种PPRV(0.01 MOI),吸附2 h后, 更换新鲜的含10 mL·L-1胎牛血清、10 mL·L-1青链霉素的DMEM培养基培养,于50 mL·L-1CO2、37 ℃细胞培养箱培养。
1.2.2 CCK-8细胞增殖-毒性检测试验 100 μL Vero细胞悬液(细胞数2×104~3×104)接种于96孔板,培养24 h后加入10 μL不同浓度HDACs抑制剂NIC、SAHA、TSA、MGCD0103、TMP269、Tubastatin A、PCI-34051(溶剂为DMSO),以DMSO为对照,孵育48 h后每孔加入10 μL CCK-8溶液,继续孵育3 h,用酶标仪测定450 nm吸光度值。根据CCK-8试剂盒说明书计算细胞存活率。
1.2.3 RNA提取和RT-qPCR 按照TaKaRa MiniBEST Universal RNA Extraction Kit说明书提取RNA,按照PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)说明书进行反转录,根据TB Green® Premix Ex TaqTM II (Tli RNaseH Plus)试剂盒说明书设置反应体系和反应程序,测定HDACs基因相对水平。反应体系:Ex Taq II(Tli RNaseH Plus)(2×) 10 μL,cDNA 2 μL,上、下游引物(20 μmol·L-1)各0.2 μL,ROX Reference Dye II(50×)0.4 μL,ddH2O 7.2 μL,共20 μL。反应程序:95 ℃预变性30 s; 95 ℃变性3 s,60 ℃延伸34 s,共40个循环。利用TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0提取病毒RNA,根据One Step TB Green® PrimeScriptTM RT-PCR Kit (Perfect Real Time)说明书设置反应体系和反应程序,测定PPRV N基因相对水平。反应体系:2× One Step TB Green RT-PCR Buffer Ⅲ 10 μL,TaKaRa Ex Taq HS(5 U·μL-1) 0.4 μL,PrimeScript RT enzyme Mix Ⅱ0.4 μL,RNA 2 μL,上、下游引物(20 μmol·L-1)各0.2 μL,ROX Reference Dye II(50×)0.4 μL,ddH2O 6.4 μL,共20 μL。反转录反应:42 ℃5 min,95 ℃10 s。PCR:95 ℃预变性5 s,60 ℃延伸34 s,共40个循环。根据NCBI中PPRV N基因序列和绿猴(Chlorocebus sabaeus)HDAC1~11以及β-Actin基因序列设计引物,引物序列见表 1。每个样本设置2个重复孔,采用2-ΔΔCt法计算相对基因水平,根据数据类型选择GraphPad Prism8.2.1软件t test或Multiple t tests方法进行差异性分析。
|
|
表 1 RT-qPCR引物序列 Table 1 The primers for RT-qPCR |
1.2.4 Western blot检测 弃去细胞培养基,PBS洗涤后加入预冷的RIPA裂解细胞,提取细胞总蛋白,测定蛋白浓度后进行SDS-PAGE凝胶电泳、转膜,50 g·L-1脱脂奶粉室温封闭2 h,PPRV N蛋白抗体(1∶1 000)、β-Actin抗体(1∶5 000)4 ℃孵育过夜,HRP标记的Rabbit Anti-Mouse Antibody(1∶5 000)室温孵育1 h,化学发光显色后,在超灵敏多功能成像仪(GE Amersham Imager 600)中曝光成像。
1.2.5 TCID50试验 用无血清DMEM培养基将病毒原液进行倍比稀释,10-1~10-5,稀释好的病毒液依次加入到96孔板中,每孔100 μL,每稀释度重复接种8孔,无血清DMEM培养基作为对照;向每孔加入细胞悬液100 μL(细胞数2×104~3×104)。37 ℃培养5~7 d,逐日观察细胞病变情况,并记录细胞病变孔数,按照Reed-Muench两氏法计算TCID50。
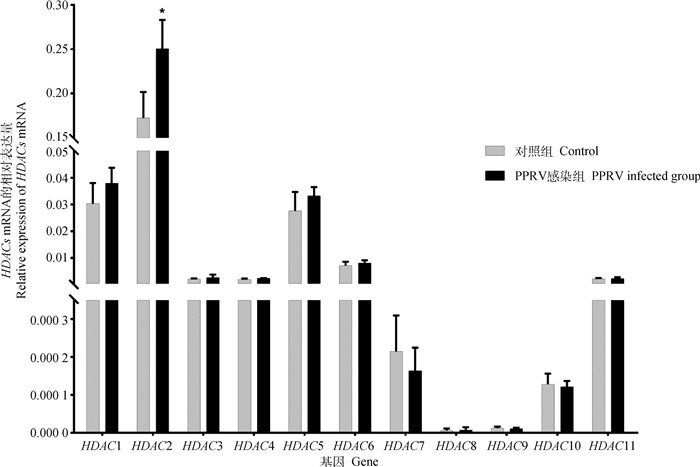
2 结果 2.1 PPRV感染对HDACs转录的影响为了验证HDACs是否参与PPRV感染过程,Vero细胞密度达到80%左右时接种PPRV(0.01 MOI),吸附2 h后更换新鲜培养基,培养2 d后收集细胞,提取细胞内RNA,通过RT-qPCR方法检测不同HDACs mRNA的表达水平。结果显示,PPRV感染显著增加了HDAC2的转录,但对其余HDAC家族成员的转录量没有明显作用(图 1)。
|
*.P < 0.05 图 1 PPRV感染后HDACs mRNA表达的变化 Fig. 1 The mRNA expression of HDACs after PPRV infection |
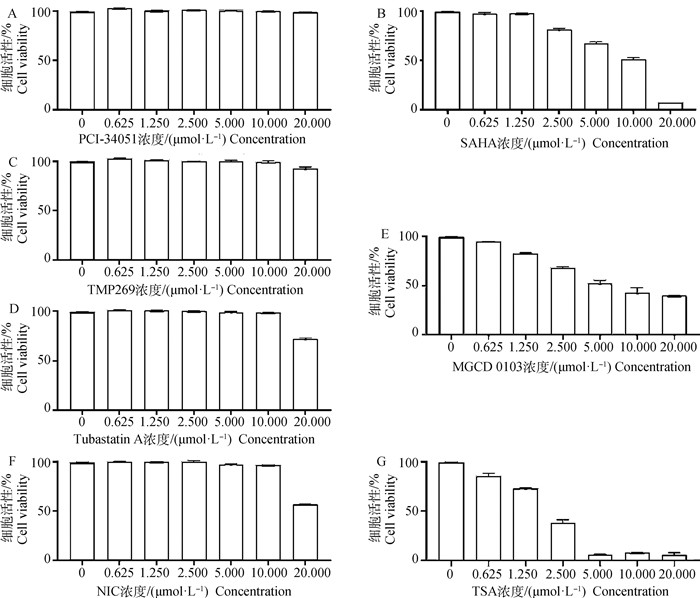
为了确定HDACs抑制剂的最适使用浓度,使用CCK-8试剂盒对NIC、SAHA、TSA、MGCD0103、TMP269、TubastatinA、PCI-34051的细胞毒性进行分析。结果显示,终浓度为0.625~20.000 μmol·L-1的PCI-34051基本无细胞毒性,TMP269有轻微细胞毒性;终浓度为0.625~10.000 μmol·L-1的NIC和TubastatinA没表现出细胞毒性;SAHA、TSA和MGCD0103的细胞毒性较强(图 2)。据此结果,确定了HDACs抑制剂的使用浓度,PCI-34051和TMP269为20 μmol·L-1;NIC和Tubastatin A为10 μmol·L-1;SAHA为1 μmol·L-1;TSA和MGCD0103为0.5 μmol·L-1。
|
A.PCI-34051; B.SAHA; C.TMP269;D.Tubastatin A; E.MGCD0103; F.NIC; G.TSA 图 2 不同的HDACs抑制剂对Vero细胞活性的影响 Fig. 2 Effect of different HDACs inhibitors on Vero cell viability |
Vero细胞密度达到80%左右时接种PPRV(0.01 MOI),吸附2 h后,更换新鲜培养基,并加入HDACs抑制剂处理,MGCD0103终浓度为0.25和0.5 μmol·L-1,其余抑制剂终浓度见“2.2”,培养48 h后收集细胞,提取细胞总蛋白,进行Western blot检测。与对照组(DMSO处理组)相比,TMP269和SAHA能明显抑制PPRV N蛋白的表达;0.5 μmol·L-1MGCD0103对PPRV N蛋白的下调作用较0.25 μmol·L-1的明显(图 3)。

|
A.Western blot; B.灰度值分析。*.P < 0.05, **.P < 0.01, ***.P < 0.001, 下图同 A.Western blot; B.Gray value analysis. *.P < 0.05, **.P < 0.01, ***.P < 0.001, the same as below 图 3 不同HDACs抑制剂对PPRV复制的影响 Fig. 3 Effect of different HDACs inhibitors on PPRV replication |
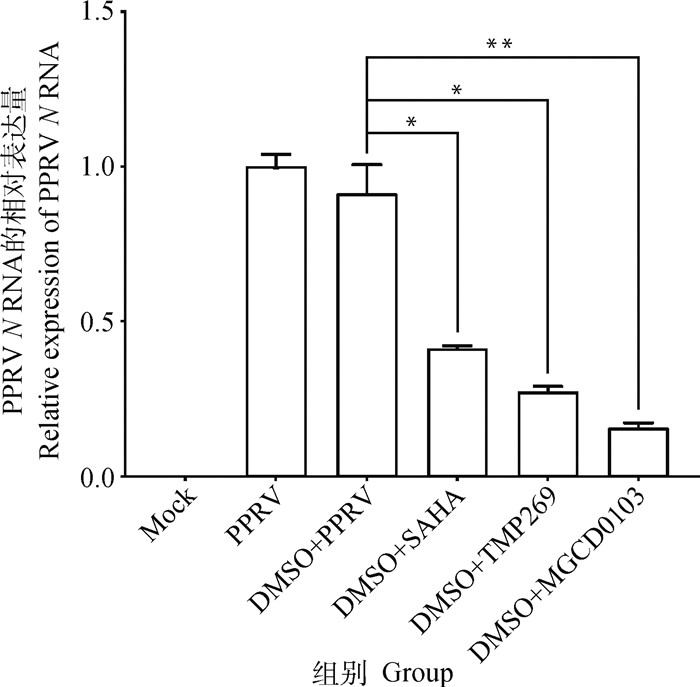
2.4.1 RT-qPCR分析 分别用SAHA、TMP269、MGCD0103处理感染PPRV的Vero细胞(处理方法同“2.3”,终浓度见“2.2”),培养120 h后收集样品,提取病毒RNA进行RT-qPCR检测。结果显示,SAHA、TMP269、MGCD0103能显著(P < 0.05, P < 0.05, P < 0.01)降低PPRV N RNA水平(图 4)。
|
*.P < 0.05;**.P < 0.01 图 4 SAHA、TMP269、MGCD0103处理PPRV感染的Vero细胞后,PPRV N RNA相对表达量 Fig. 4 Relative expression of PPRV N RNA in PPRV-infected Vero cells treated with SAHA, TMP269, MGCD0103 |
2.4.2 Western blot分析 SAHA、TMP269、MGCD0103处理感染PPRV的Vero细胞(同“2.4.1”),分别培养24、48、72、96、120、144 h后收集样品,Western blot检测。结果显示,SAHA、TMP269、MGCD0103对PPRV N蛋白的表达均表现出显著的抑制作用,其中, TMP269和MGCD0103的抑制作用较SAHA的更强(图 5)。
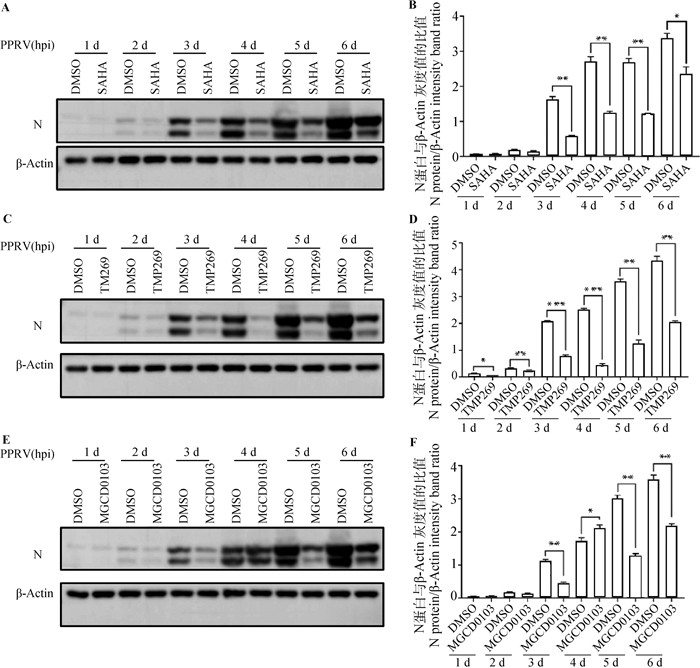
|
A、B.SAHA; C、D.TMP269; E、F.MGCD0103; A、C、E.Western blot; B、D、F.灰度值分析 A, B.SAHA; C, D. TMP269; E, F.MGCD0103; A, C, E.Western blot; B, D, F.Gray value analysis 图 5 SAHA、TMP269、MGCD0103处理不同时间对PPRV N蛋白表达的抑制 Fig. 5 Inhibition of PPRV N protein expression by SAHA, TMP269 and MGCD0103 at the different time of PPRV infection |
为了进一步分析SAHA、TMP269、MGCD0103对PPRV复制的抑制作用,以不同浓度抑制剂处理PPRV感染细胞(处理方法同“2.4.1”),培养48 h后, Western blot检测。结果发现,SAHA、TMP269、MGCD0103对PPRV N蛋白表达的影响具有明显的剂量负相关性(图 6)。

|
A、D.SAHA; B、E.TMP269;C、F.MGCD0103; A~C. Western blot; D~F.灰度值分析 A, D.SAHA; B, E.TMP269;C、F.MGCD0103; A-C. Western blot; D-F. Gray value analysis 图 6 不同浓度的SAHA、TMP269、MGCD0103对PPRV N蛋白表达的抑制 Fig. 6 Inhibition of different concentrations of SAHA, TMP269 and MGCD0103 on PPRV N protein expression |
2.4.3 TCID50检测 SAHA、TMP269、MGCD0103处理感染PPRV的Vero细胞(同“2.4.1”),培养120 h收样,TCID50法检测病毒滴度。结果显示,SAHA、TMP269、MGCD0103均可显著降低病毒TCID50(图 7)。

|
*.P < 0.05;**.P < 0.01 图 7 SAHA、TMP269、MGCD0103处理PPRV感染的Vero细胞后,PPRV病毒滴度的变化 Fig. 7 Changes of PPRV virus titers in PPRV-infected Vero cells treated with SAHA, TMP269, MGCD0103 |
组蛋白乙酰化修饰是基因转录调控的重要机制[9],主要由组蛋白乙酰化酶(histoneacetylases,HATs)和组蛋白去乙酰化酶(histonedeacetylases,HDACs)共同催化完成[10]。HDACs在多种病毒感染中调控病毒复制和机体发病,比如疱疹病毒(herpesviruses)、流感病毒(influenzavirus)、柯萨奇病毒(coxsackievirus)、乙肝病毒(HBV)、丙肝病毒(HCV)和人类免疫缺陷病毒(HIV)、呼吸道合胞病毒(RSV)等[11]。本试验发现PPRV感染能够诱导HDAC2 mRNA的表达,表明HDAC2可能参与调控PPRV的复制过程。HDAC2表达水平的升高可影响Ⅰ型IFN受体和IRF9、STAT2的乙酰化水平,抑制ISGs的表达,从而抑制Ⅰ型IFN的抗病毒作用,促进病毒复制[12]。这与本试验中Ⅰ类HDACs抑制剂MGCD0103抑制PPRV RNA水平、蛋白水平的表达,降低病毒滴度的结果相吻合,推测PPRV诱导表达HDAC2以抑制Ⅰ型IFN信号通路可能是PPRV逃避宿主抗病毒反应的机制之一。与PPRV同属于副黏病毒科的RSV感染也能够上调HDAC2的表达,降低组蛋白H3的乙酰化水平,应用HDACs抑制剂SAHA和TSA处理后,组蛋白乙酰化水平升高,RIG-I、IFN-β1表达显著增加,不但抑制RSV的感染,还能减轻感染导致的气道炎症[11]。这是病毒逃避宿主先天抗病毒反应的另一种机制,即下调模式识别受体(RIG-I、TLR、MDA5等)或减少病原相关模式分子以避免被宿主识别,或者抑制IFN产生[13]。HDAC1和HDAC2也能通过调控细胞周期影响病毒复制,其特异性抑制剂FK228处理HBV感染的HepAD38细胞和HepG2细胞后,抑制细胞周期正调节因子(cyclin A、cyclin B1、cyclin D1、cyclin E、p-Rb、p-CDK2)的表达,诱导细胞周期阻滞,从而促进HBV的复制[14]。此外,PPRV感染后Vero细胞中其余HDAC家族成员的表达也有一定变化,HDAC1和HDAC5的表达有增加趋势,只是不显著,这可能与这些家族成员的表达量有关,尤其是HDAC8和HDAC9,在Vero细胞中几乎检测不到。因为HDACs表达具有组织特异性,人基因转录组中HDACs的组织分布显示,正常肾组织中仅有HDAC2表达量最高,HDAC1、HDAC3次之,约为HDAC2的四分之一,Ⅱa类HDACs表达量无数据或检测不到[5, 15]。本试验中Ⅱa类HDACs抑制剂TMP269能够显著下调PPRV RNA和蛋白表达,显著降低PPRV TCID50,说明Ⅱa类HDACs(HDAC4-5、HDAC7、HDAC9)可能也参与调控PPRV感染,促进病毒复制。HDAC4能够抑制TBK1和IKKε对IRF3的磷酸化,进而阻止IRF3转移到细胞核内,降低IRF3介导的IFN-β表达[16]。HDAC4也能够促进IFN-α诱导的JAK-STAT信号通路和ISGs的表达,是痘苗病毒(VACV)复制的限制因子,被C6蛋白降解[17]。HDAC5与HDAC4同源性最高,也能限制VACV复制,被C6蛋白降解[18]。后续试验中,作者将通过构建Ⅰ类和Ⅱa类HDACs敲除细胞系,进一步探究HDACs调控PPRV复制的机制。
目前,对PPR的防控、根除仍是以养羊业为主要经济来源地区和国家的一大难题,今年以来,我国新疆、青海部分地区仍有散发疫情。抗病毒药物可以作为疫苗防疫的补充措施,降低PPR引起的经济损失,有助于全球小反刍兽疫根除计划。现已证实,合欢属植物提取物和一些合成的化合物、银纳米颗粒等具有抑制PPRV作用[19-26]。抗病毒药物的靶点主要是病毒相关分子和宿主相关分子,病毒对作用于宿主分子的抗病毒药物更难产生抗性。Favipiravir是病毒RdRp的抑制剂,能够抑制PPRV吸附、侵入、复制和子代病毒颗粒的释放[27]。而brequinar、leflunomide、6-azauracil、ribavirin、mycophenolic acid是细胞内嘧啶核苷酸和嘌呤核苷酸合成所需酶的抑制剂,通过阻碍核苷酸合成进而抑制病毒DNA/RNA合成[28-29]。作用于宿主细胞HDACs的抑制剂已表现出清除病毒感染的作用[30-31]。随着对HDACs与病毒感染研究的不断深入,HDACs抑制剂为治疗病毒感染及相关疾病提供了一种新的选择。本试验中,Ⅱa类HDACs抑制剂TMP269的细胞毒性低,且对PPRV病毒复制的抑制作用显著,在后续试验中进一步探究其作用机制,或许可以为抗PPRV感染提供新的思路。
4 结论PPRV感染能够诱导HDAC2的表达,HDACs抑制剂SAHA、TMP269、MGCD0103在PPRV RNA、蛋白水平和病毒滴度方面均表现出明显的抑制作用,表明Ⅰ类HDACs和Ⅱa类HDACs在PPRV复制过程中发挥重要作用。
| [1] |
GIBBS E P, TAYLOR W P, LAWMAN M J P, et al. Classification of peste des petits ruminants virus as the fourth member of the genus Morbillivirus[J]. Intervirology, 1979, 11(5): 268-274. DOI:10.1159/000149044 |
| [2] |
MANTIP S E, SHAMAKI D, FAROUGOU S. Peste des petits ruminants in Africa: Meta-analysis of the virus isolation in molecular epidemiology studies[J]. Onderstepoort J Vet Res, 2019, 86(1): e1-e15. |
| [3] |
LIU F, LI J, LI L, et al. Peste des petits ruminants in China since its first outbreak in 2007:A 10-year review[J]. Transbound Emerg Dis, 2018, 65(3): 638-648. DOI:10.1111/tbed.12808 |
| [4] |
LI L X, CAO X A, WU J Y, et al. Epidemic and evolutionary characteristics of peste des petits ruminants virus infecting Procapra przewalskii in Western China[J]. Infect Genet Evol, 2019, 75: 104004. DOI:10.1016/j.meegid.2019.104004 |
| [5] |
DE RUIJTER A J M, VAN GENNIP A H, CARON H N, et al. Histone deacetylases (HDACs): characterization of the classical HDAC family[J]. Biochem J, 2003, 370(Pt 3): 737-749. |
| [6] |
YANG X J, GRÉGOIRE S. Class Ⅱ histone deacetylases: from sequence to function, regulation, and clinical implication[J]. Mol Cell Biol, 2005, 25(8): 2873-2884. DOI:10.1128/MCB.25.8.2873-2884.2005 |
| [7] |
ZHOU Y, WANG Q, YANG Q, et al. Histone deacetylase 3 inhibitor suppresses hepatitis c virus replication by regulating Apo-A1 and LEAP-1 expression[J]. Virol Sin, 2018, 33(5): 418-428. DOI:10.1007/s12250-018-0057-7 |
| [8] |
LU C Y, CHANG Y C, HUA C H, et al. Tubacin, an HDAC6 Selective inhibitor, reduces the replication of the japanese encephalitis virus via the decrease of viral RNA synthesis[J]. Int J Mol Sci, 2017, 18(5): 954. DOI:10.3390/ijms18050954 |
| [9] |
SEWACK G F, ELLIS T W, HANSEN U. Binding of TATA binding protein to a naturally positioned nucleosome is facilitated by histone acetylation[J]. Mol Cell Biol, 2001, 21(4): 1404-1415. DOI:10.1128/MCB.21.4.1404-1415.2001 |
| [10] |
KOUZARIDES T. Histone acetylases and deacetylases in cell proliferation[J]. Curr Opin Genet Dev, 1999, 9(1): 40-48. DOI:10.1016/S0959-437X(99)80006-9 |
| [11] |
FENG Q Q, SU Z L, SONG S Y, et al. Histone deacetylase inhibitors suppress RSV infection and alleviate virus-induced airway inflammation[J]. Int J Mol Med, 2016, 38(3): 812-822. DOI:10.3892/ijmm.2016.2691 |
| [12] |
TANG X L, GAO J S, GUAN Y J, et al. Acetylation-dependent signal transduction for type i interferon receptor[J]. Cell, 2007, 131(1): 93-105. DOI:10.1016/j.cell.2007.07.034 |
| [13] |
RANDALL R E, GOODBOURN S. Interferons and viruses: an interplay between induction, signalling, antiviral responses and virus countermeasures[J]. J General Virol, 2008, 89(1): 1-47. DOI:10.1099/vir.0.83391-0 |
| [14] |
YANG Y, YAN Y, CHEN Z, et al. Histone deacetylase inhibitors romidepsin and vorinostat promote Hepatitis B virus replication by inducing cell cycle arrest[J]. J Clin Transl Hepatol, 2021, 9(2): 160-168. |
| [15] |
GROZINGER C M, HASSIG C A, SCHREIBER S L. Three proteins define a class of human histone deacetylases related to yeast Hda1p[J]. Proc Natl Acad Sci U S A, 1999, 96(9): 4868-4873. DOI:10.1073/pnas.96.9.4868 |
| [16] |
YANG Q, TANG J L, PEI R J, et al. Host HDAC4 regulates the antiviral response by inhibiting the phosphorylation of IRF3[J]. J Mol Cell Biol, 2019, 11(2): 158-169. DOI:10.1093/jmcb/mjy035 |
| [17] |
LU Y X, STUART J H, TALBOT-COOPER C, et al. Histone deacetylase 4 promotes type I interferon signaling, restricts DNA viruses, and is degraded via vaccinia virus protein C6[J]. Proc Natl A Sci U S A, 2019, 116(24): 11997-12006. DOI:10.1073/pnas.1816399116 |
| [18] |
SODAY L, LU Y X, ALBARNAZ J D, et al. Quantitative temporal proteomic analysis of vaccinia virus infection reveals regulation of histone deacetylases by an interferon antagonist[J]. Cell Rep, 2019, 27(6): 1920-1933. DOI:10.1016/j.celrep.2019.04.042 |
| [19] |
RAHEEL R, ASHRAF M, EJAZ S, et al. Assessment of the cytotoxic and anti-viral potential of aqueous extracts from different parts of Acacia nilotica (Linn) Delile against Peste des petits ruminants virus[J]. Environ Toxicol Pharmacol, 2013, 35(1): 72-81. DOI:10.1016/j.etap.2012.11.005 |
| [20] |
YADAV P, CHOUDHURY S, BARUA S, et al. Polyalthia longifolia leaves methanolic extract targets entry and budding of viruses-an in vitro experimental study against paramyxoviruses[J]. J Ethnopharmacol, 2020, 248: 112279. DOI:10.1016/j.jep.2019.112279 |
| [21] |
KHANDELWAL N, KAUR G, CHAUBEY K K, et al. Silver nanoparticles impair Peste des petits ruminants virus replication[J]. Virus Res, 2014, 190: 1-7. DOI:10.1016/j.virusres.2014.06.011 |
| [22] |
SUJATHA K, SHANTHI G, SELVAM N P, et al. Synthesis and antiviral activity of 4, 4'-(arylmethylene)bis(1H-pyrazol-5-ols) against peste des petits ruminant virus (PPRV)[J]. Bioorg Med Chem Lett, 2009, 19(15): 4501-4503. DOI:10.1016/j.bmcl.2009.02.113 |
| [23] |
EL-SABBAGH O I, EL-SADEK M E, EL-KALYOUBI S, et al. Synthesis, DNA binding and antiviral activity of new uracil, xanthine, and pteridine derivatives[J]. Arch Pharm (Weinheim), 2007, 340(1): 26-31. DOI:10.1002/ardp.200600149 |
| [24] |
KHANDELWAL N, CHANDER Y, RAWAT K D, et al. Emetine inhibits replication of RNA and DNA viruses without generating drug-resistant virus variants[J]. Antiviral Res, 2017, 144: 196-204. DOI:10.1016/j.antiviral.2017.06.006 |
| [25] |
SAADH M. Epigallocatechin gallate (EGCG) combined with zinc sulfate inhibits Peste des petits ruminants virus entry and replication[J]. Saudi J Biol Sci, 2021, 28(11): 6674-6678. DOI:10.1016/j.sjbs.2021.07.035 |
| [26] |
KUMAR N, KHANDELWAL N, KUMAR R, et al. Inhibitor of sarco/endoplasmic reticulum calcium-ATPase impairs multiple steps of paramyxovirus replication[J]. Front Microbiol, 2019, 10: 209. DOI:10.3389/fmicb.2019.00209 |
| [27] |
ZHANG W F, DENG H L, LIU Y F, et al. Antiviral effectivity of favipiravir against peste des petits ruminants virus is mediated by the JAK/STAT and PI3K/AKT pathways[J]. Front Vet Sci, 2021, 8: 722840. DOI:10.3389/fvets.2021.722840 |
| [28] |
JIN L, LI Y C, PU F Y, et al. Inhibiting pyrimidine biosynthesis impairs Peste des Petits Ruminants Virus replication through depletion of nucleoside pools and activation of cellular immunity[J]. Vet Microbiol, 2021, 260: 109186. DOI:10.1016/j.vetmic.2021.109186 |
| [29] |
CHANG Q Y, GUO F C, LI X R, et al. The IMPDH inhibitors, ribavirin and mycophenolic acid, inhibit peste des petits ruminants virus infection[J]. Vet Res Commun, 2018, 42(4): 309-313. DOI:10.1007/s11259-018-9733-1 |
| [30] |
KOBAYASHI Y, GÉLINAS C, DOUGHERTY J P. Histone deacetylase inhibitors containing a benzamide functional group and a pyridyl cap are preferentially effective human immunodeficiency virus-1 latency-reversing agents in primary resting CD4+ T cells[J]. J General Virol, 2017, 98(4): 799-809. DOI:10.1099/jgv.0.000716 |
| [31] |
ARCHIN N M, LIBERTY A L, KASHUBA A D, et al. Administration of vorinostat disrupts HIV-1 latency in patients on antiretroviral therapy[J]. Nature, 2012, 487(7408): 482-485. DOI:10.1038/nature11286 |
(编辑 白永平)



