牛传染性胸膜肺炎(contagious bovine pleuropneumonia, CBPP),又称牛肺疫,是由丝状支原体丝状亚种(Mycoplasma mycoides subsp.Mycoides, Mmm)引起的牛的一种高度接触性传染病[1-2],严重危害动物健康,被世界动物卫生组织(World Organization for Animal Health, OIE)列为必须报告的动物疫病[3]。该病的急性型至亚急性型以严重的纤维素性支气管肺炎和胸腔积液为特征,暴发性流行时发病率和死亡率极高;而慢性或隐性感染时,潜伏期范围较大,短则1周,长则2~4周,更有甚者可达半年,且发病过程和病理变化很轻微或无临床症状,容易被人们所忽视[4-6]。该病在20世纪50—70年代给我国养牛业造成重大经济损失,随后通过大面积免疫及采用检疫、隔离、扑杀等综合防控措施被成功消灭[7-8]。
近些年,CBPP重新出现并且扩散到已宣布消灭的地区,例如:大部分的撒哈拉地区、肯尼亚、坦桑尼亚、卢旺达及部分欧洲国家等,引发新一轮大规模的努力去控制或消灭该病的流行[9-13]。我国虽然已成功消灭CBPP,但由于我国周边国家CBPP的流行状况不明以及活牛非法入境数目较大等原因,CBPP跨境传入我国的风险日益增加。CBPP一旦重新传入,将对我国养牛业生产带来毁灭性的打击。本实验室作为国家牛传染性胸膜肺炎参考实验室,每年承担农业农村部下达的在全国范围内开展CBPP流行病学监测的任务,亟需建立一种敏感、特异的检测方法为我国CBPP的早期诊断和有效防控提供技术支撑。
本实验室前期对Mmm分离株Ben-1的不同传代株进行全基因组测序[14],比较了不同代次菌株的基因组差异,通过生物信息学分析以及文献检索,初步筛选到13个Mmm特异性膜蛋白。根据前期研究结果最终选定膜蛋白M0071用于本研究,利用原核表达系统表达纯化其重组蛋白rM0071,作为免疫原用于单抗制备。通过有限稀释法亚克隆和间接ELISA法测定,获得一株抗Mmm的特异性单克隆抗体3C4A1(MAb 3C4A1),经测定发现其具有良好的特异性和反应性,可作为CBPP病原免疫学诊断的工具。
1 材料与方法 1.1 材料1.1.1 菌株、细胞和实验动物 Mmm分离株Ben-1、牧1及其模式株PG1菌种均由国家牛传染性胸膜肺炎参考实验室保存,并按照高级别生物安全实验室从事高致病性动物病原微生物实验活动批复的内容开展相关试验;山羊支原体山羊肺炎亚种、丝状支原体山羊亚种、牛鼻支原体、无乳支原体、牛支原体、leachii支原体等菌种由本实验室保存;牛A型巴氏杆菌由中国农业科学院哈尔滨兽医研究所牛羊病创新团队姜志刚副研究员赠送;SP2/0细胞、胎牛肺细胞(embryonic bovine lung, EBL)由本实验室保存;CBPP阳性牛血清、阴性牛血清由本实验室保存;6~8周龄雌性BALB/c小鼠购自北京维通利华实验动物技术有限公司。
1.1.2 试验材料 表达载体pET-32a(+)由本实验室保存;限制性核酸内切酶BamH Ⅰ、Sal Ⅰ购自NEB公司;T4 DNA Ligase购自宝生物工程有限公司;感受态细胞DH5α及BL21(DE3)购自Vazyme公司;质粒小提试剂盒、核酸凝胶回收试剂盒购自OMEGA生物科技有限公司;BCA蛋白浓度测定试剂盒(增强型)、特超敏ECL化学发光试剂盒购自碧云天生物技术有限公司;SDS-PAGE凝胶制备试剂盒购自索莱宝生物科技有限公司;Ni-NTA纯化树脂GE公司;NC膜购自PALL公司;10 ku规格超滤管购自Merck公司;Protein G亲和层析柱购自武汉汇研生物科技股份有限公司;HRP标记山羊抗小鼠IgG购自北京中杉金桥生物技术有限公司;弗氏完全佐剂和弗氏不完全佐剂、HAT和HT、融合剂PEG、FITC标记山羊抗小鼠IgG抗体、HRP标记兔抗牛IgG抗体、TMB底物显色液均购自Sigma公司;RPMI 1640培养基、胎牛血清购自Gibco公司;SBA Clonotyping System-HRP抗体亚类鉴定试剂盒购自Southern Biotech公司。
1.2 试验方法1.2.1 重组质粒pET-32a-M0071的构建 Mmm 0071基因由北京华大基因科技有限公司进行密码子优化、合成,并亚克隆至pUC 57载体,然后转入到大肠杆菌DH5α保存。将其按照1∶100比例接种于5 mL新鲜LB(含终浓度为100 μg · mL-1 Amp+)培养基中,37 ℃振荡培养8~10 h后再转接扩大培养,利用质粒小提试剂盒提取质粒。pUC 57-M0071质粒和pET-32a(+)空载体分别经BamHⅠ和SalⅠ双酶切,将酶切产物进行琼脂糖凝胶电泳并进行胶回收,利用T4连接酶连接回收的pET-32a(+)片段和M0071基因片段,采用热激法将连接产物转化至大肠杆菌DH5α,涂布于含Amp+的LB琼脂平板培养。挑取3~5个单克隆进行菌落PCR鉴定,将PCR阳性的克隆扩大培养,提取质粒进行双酶切鉴定,并送长春库美生物科技有限公司测序鉴定,将测序正确的重组质粒命名为pET-32a-M0071。
1.2.2 rM0071蛋白的表达纯化及Western blot鉴定 将鉴定正确的重组质粒pET-32a-M0071转化至大肠杆菌BL21(DE3)表达菌中,涂布于含Amp+的LB琼脂平板培养。挑取单克隆菌落接种于含Amp+的LB培养基中过夜培养,以1%的比例转接于500 mL LB培养基中(Amp+),37 ℃,200 r · min-1振荡培养至对数生长期(即OD600 nm为0.4~0.6),加入终浓度为0.1 mmol · L-1的IPTG于16 ℃,120 r · min-1诱导12 h。离心收集菌体,PBS洗涤两次,再用适量PBS重悬菌体沉淀进行超声破碎,4 ℃,8 000 r · min-1离心30 min,分别收集上清和沉淀,通过SDS-PAGE进行蛋白表达形式分析。选取可溶性的重组蛋白采用镍柱亲和层析法纯化,将洗脱收集的目的蛋白用PBS反复超滤3~4次,超滤管中剩余的最终液体即为纯化得到的rM0071蛋白。将纯化的rM0071蛋白进行SDS-PAGE检测蛋白纯度,并用BCA蛋白定量试剂盒测定rM0071蛋白浓度,小量分装,然后于-80 ℃保存备用。对纯化的rM0071蛋白进行Western blot鉴定,即rM0071蛋白经SDS-PAGE电泳后转印至NC膜上,用5%鱼明胶于室温条件下封闭2 h,PBST洗涤3次;分别以1∶100稀释的CBPP阳性牛血清、阴性牛血清作为一抗,于4 ℃孵育16 h,PBST洗涤3次;以1∶8 000稀释的HRP标记兔抗牛IgG抗体作为二抗,于室温条件下孵育1 h,PBST洗涤3次;最后经ECL显色法分析rM0071蛋白的免疫反应性。
1.2.3 小鼠免疫 将纯化后的rM0071蛋白按每只小鼠100 μg的剂量与弗氏佐剂1∶1混合并充分乳化,采用背部皮下多点注射法免疫6周龄小鼠。首次免疫使用弗氏完全佐剂与rM0071混合,间隔2周后使用弗氏不完全佐剂与rM0071混合继续免疫。第3次免疫后,用间接ELISA方法测定小鼠的血清抗体效价,当小鼠血清效价达到1∶51 200以上时,选择抗体滴度最高的小鼠,在融合前3~5 d用不加佐剂的抗原(每只小鼠100 μg)采用腹腔注射的方法加强免疫1次。
1.2.4 间接ELISA检测方法的建立 采用方阵滴定法,用碳酸盐缓冲液将纯化的rM0071蛋白分别稀释至10、5、2.5、1.25、0.625、0.3 125 μg·mL-1浓度包被酶标板,免疫小鼠血清(作为阳性血清)和未免疫小鼠血清(作为阴性血清)分别以1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800稀释作为一抗,HRP标记的山羊抗小鼠IgG二抗作1∶8 000稀释。其他步骤按常规ELISA反应程序进行,选取阳性血清OD450 nm值/阴性血清OD450 nm值> 2.1,且阳性血清OD450 nm值接近1.0时所对应的抗原浓度、一抗稀释度作为抗原最佳包被浓度和血清最佳稀释度。
1.2.5 细胞融合及阳性杂交瘤细胞的筛选 融合前1 d,取空白小鼠的腹腔巨噬细胞于HAT选择培养基中,按照100 μL·孔-1将细胞悬液加入到96孔培养板中培养作为饲养层细胞,于含5% CO2的37 ℃细胞培养箱中培养。第2天,取加强免疫小鼠的脾细胞与对数生长期的SP2/0细胞在PEG促融剂作用下进行融合,用HAT选择培养基轻轻悬浮融合细胞,并以100 μL·孔-1将细胞悬液添加至饲养层细胞中培养。培养5~6 d后,用HT培养基进行半换液。待细胞培养基颜色变黄,每孔取100 μL细胞培养上清用间接ELISA方法进行检测。
以纯化的rM0071蛋白为包被抗原,采用已建立的间接ELISA方法筛选分泌抗rM0071抗体的阳性克隆。采用有限稀释法对抗体效价高、细胞团单一的阳性细胞孔进行3~4次亚克隆,直至抗体分泌稳定、阳性孔的比例>95%时,进行扩大培养、冻存保种。
1.2.6 单克隆抗体腹水的制备及纯化 取10~12周龄的雌性BALB/c小鼠10只,腹腔注射0.5 mL弗氏不完全佐剂。致敏1周后,将处于对数生长期的1×105~1×106个杂交瘤细胞注射到小鼠腹腔,同时设置SP2/0细胞作为阴性对照组。每天观察小鼠腹部变化,待小鼠腹部明显膨大后使用引流针采集腹水(多次采集直至小鼠死亡),于8 000 r · min-1、4 ℃离心30 min,收集中间的腹水层,于-80 ℃保存备用。收集的腹水作适当稀释后使用Protein G柱子进行纯化,具体纯化操作步骤参照汇研生物Protein G柱子纯化使用说明书。将纯化后的腹水抗体进行SDS-PAGE分析,并用小型分光光度计测定纯化抗体的浓度。
1.2.7 单克隆抗体性质鉴定1.2.7.1 单克隆抗体的特异性鉴定 采用Western blot鉴定单克隆抗体的特异性。本试验选取可引起反刍动物呼吸道疾病的其他病原,包括山羊支原体山羊肺炎亚种、丝状支原体山羊亚种、牛鼻支原体、无乳支原体、牛支原体、Leachii支原体、牛A型巴氏杆菌、丝状支原体丝状亚种分离株(Ben-1和牧1)及其模式株PG1的全菌体蛋白,与纯化的rM0071蛋白同时进行SDS-PAGE凝胶电泳,然后转印至NC膜上,用5%鱼明胶于室温条件下封闭2 h,PBST洗涤3次;加入1∶ 500稀释的单克隆抗体于4 ℃孵育16 h,PBST洗涤3次;以1∶8 000稀释的HRP标记山羊抗小鼠IgG为二抗进行反应,于室温条件下孵育1 h;PBST洗涤3次后,经ECL显色法观察结果。Mmm分离株(Ben-1和牧1)及其标准株PG1均在高级别生物安全实验室培养和灭活后制备全菌体蛋白。
1.2.7.2 单克隆抗体亚类的鉴定 采用SBA Clonotyping System-HRP抗体亚类鉴定试剂盒对MAb 3C4A1进行亚类鉴定,具体操作方法参考说明书。
1.2.7.3 间接ELISA方法测定MAb抗体效价 以常规的间接ELISA方法测定MAb抗体效价,将纯化的单克隆抗体设置10个不同稀释倍数(分别为1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000、1∶256 000、1∶512 000),每个稀释度设3个重复孔,以免疫小鼠血清作为阳性对照,SP2/0腹水作为阴性对照。稀释样品孔OD450 nm /阴性对照OD450 nm > 2.1时所对应的最大单抗稀释倍数,即为抗体效价。
1.2.8 间接免疫荧光(IFA)检测 以制备的MAb 3C4A1作为一抗,FITC标记的山羊抗小鼠IgG为二抗,进行间接免疫荧光试验。用108 CCU · mL-1的Ben-1、牧1、牛鼻支原体、无乳支原体、牛支原体等培养物1 mL,离心收集菌体沉淀,无菌PBS洗涤3次后,用12 mL DMEM细胞完全培养基重悬菌体沉淀。按照500 μL·孔-1将重悬的菌体纯培养物接种于铺有EBL细胞的24孔细胞培养板中,同时设置未感染细胞为空白对照,于37 ℃恒温箱培养6 h。PBS洗涤2次,洗去未黏附的菌体,用4%多聚甲醛于室温条件下固定细胞30 min;PBST洗涤3次,加入5%鱼明胶于室温条件下封闭1 h;PBST洗涤3次,每孔加入1∶100稀释的单克隆抗体(设置免疫小鼠血清作为阳性对照;未免疫小鼠血清作为阴性对照),于室温条件下孵育1 h;PBST洗涤3次,加入1∶800稀释的FITC标记的山羊抗小鼠IgG抗体,于室温下避光孵育1 h;PBST洗涤3次后,置于倒置荧光显微镜下观察、分析并采集图像。Ben-1和牧1感染EBL细胞及其IFA检测均在高级别生物安全实验室操作。
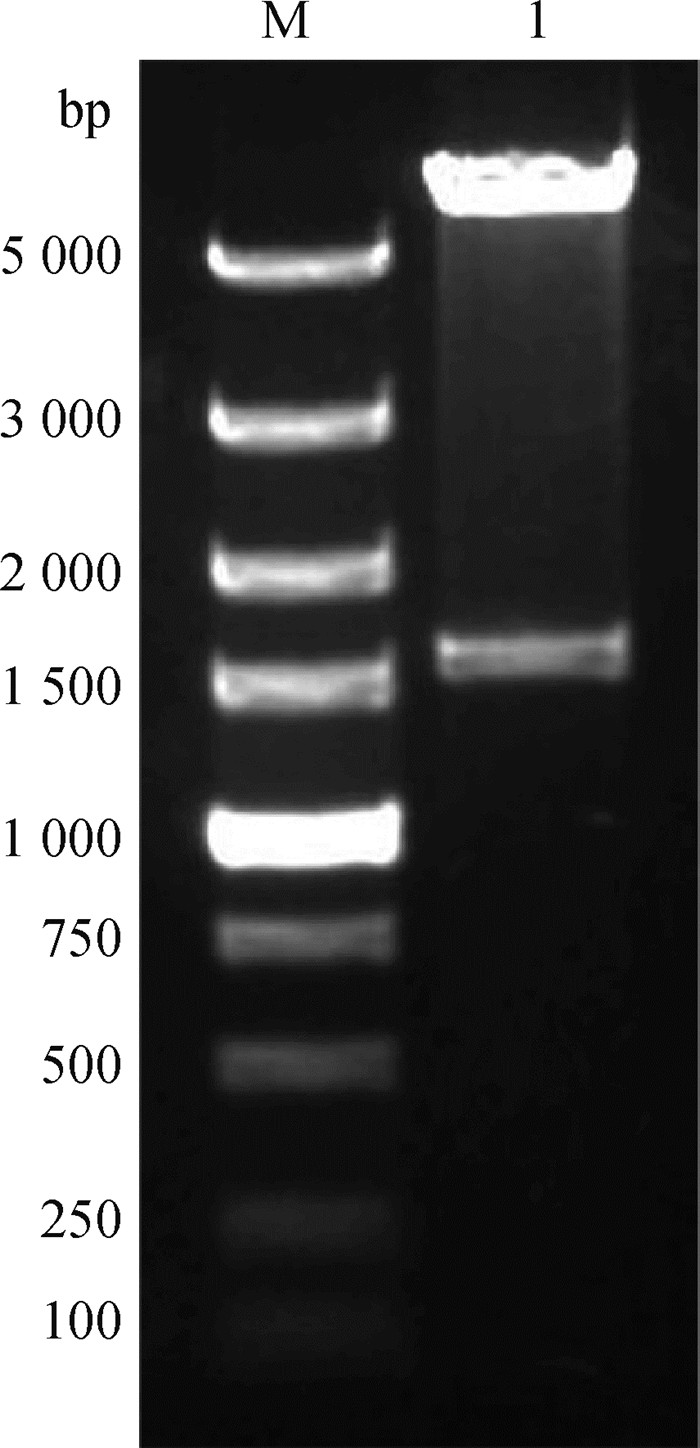
2 结果 2.1 重组质粒pET-32a-M0071的构建与鉴定按照“1.2.1”中描述的方法,构建重组质粒pET-32a-M0071。使用内切酶BamHⅠ和SalⅠ对提取的重组质粒进行双酶切鉴定,鉴定结果如图 1所示,获得约5 900 bp的载体片段和约1 500 bp的基因片段,与目的基因大小相符。
|
M. DL5000 DNA相对分子质量标准;1. 重组质粒pET-32a-M0071的BamH Ⅰ和Sal Ⅰ双酶切产物 M. DL5000 DNA marker; 1. Double digestion products of recombinant plasmid pET-32a-M0071 (BamH Ⅰ, Sal Ⅰ) 图 1 重组质粒pET-32a-M0071的双酶切鉴定 Fig. 1 Double digestion identification of recombinant plasmid pET-32a-M0071 |
基因测序结果表明,插入的基因序列与Ben-1株的M0071基因序列完全一致,表明pET-32a-M0071重组质粒构建成功。
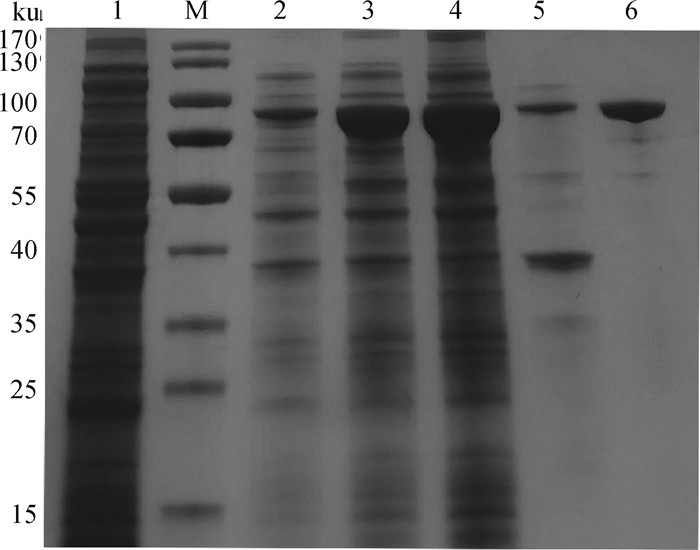
2.2 rM0071蛋白的可溶性分析及纯化鉴定将鉴定正确的重组质粒pET-32a-M0071转入表达菌BL21(DE3)中进行诱导表达,SDS-PAGE电泳检测结果如图 2所示,rM0071蛋白在上清和沉淀中均有表达,以可溶性表达为主,且在约73 ku位置出现目的条带,与目的蛋白预期大小相符。诱导表达的重组蛋白经镍柱亲和层析纯化,获得了纯度较高的rM0071目的蛋白,可用于后续研究。
|
M. 蛋白质相对分子质量标准;1. 经IPTG诱导的pET-32a-BL21空载体;2. 未经IPTG诱导的pET-32a-M0071-BL21全菌;3. 经IPTG诱导的pET-32a-M0071-BL21全菌;4. 经IPTG诱导的pET-32a-M0071-BL21重组菌裂解上清;5. 经IPTG诱导的pET-32a-M0071-BL21重组菌裂解沉淀;6. 纯化的rM0071蛋白 M. Protein molecular weight marker; 1. pET-32a-BL21 empty carrier induced by IPTG; 2. pET-32a-M0071-BL21 whole bacteria without IPTG induction; 3. pET-32a-M0071-BL21 whole bacteria induced by IPTG; 4. IPTG induced pET-32a-M0071-BL21 recombinant bacteria lysate supernatant; 5. IPTG induced pET-32a-M0071-BL21 recombinant bacteria lysate precipitation; 6. Purified rM0071 protein 图 2 重组蛋白M0071诱导表达及纯化鉴定 Fig. 2 Induced expression and purification of recombinant protein M0071 |
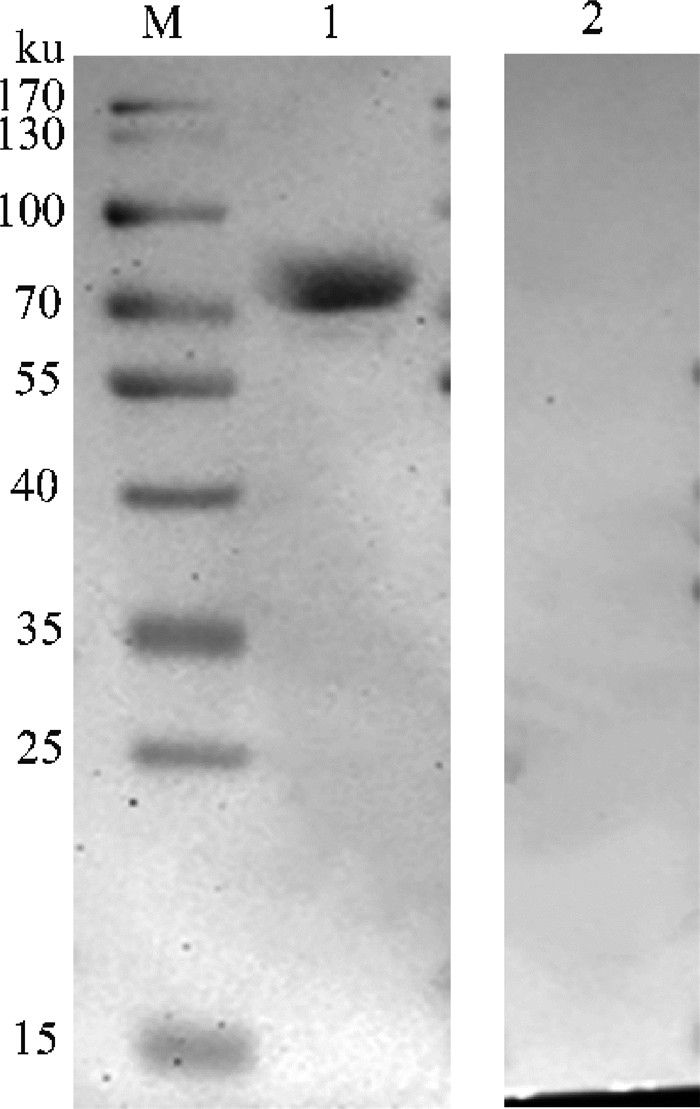
利用Western blot鉴定rM0071纯化蛋白的免疫反应性,结果如图 3所示,该融合蛋白与CBPP阳性牛血清可以发生特异性反应,在约73 ku位置出现特异性条带,而与CBPP阴性牛血清不发生特异性反应。表明该蛋白具有良好的免疫反应性。
|
M. 蛋白质相对分子质量标准;1. CBPP阳性牛血清;2. CBPP阴性牛血清 M. Protein molecular weight marker; 1. CBPP positive bovine sera; 2. CBPP negative bovine sera 图 3 重组蛋白M0071免疫反应性鉴定 Fig. 3 Immune reactivity detection of recombinant protein M0071 |
根据方阵滴定法结果,rM0071蛋白以2.5 μg · mL-1包被酶标板,待检血清作1∶3 200稀释,HRP标记山羊抗小鼠IgG作1∶8 000稀释,按照常规反应程序进行间接ELISA试验。用已建立的间接ELISA方法对融合后8~10 d孔内细胞培养基颜色变黄的杂交瘤细胞培养上清进行检测,在阴、阳性对照成立的条件下,杂交瘤细胞培养上清OD450 nm值/阴性对照OD450 nm值> 2.1即判定其对应细胞孔为阳性孔。将抗体效价高、细胞团单一的阳性细胞孔进行3次亚克隆,最终获得1株能稳定分泌抗rM0071蛋白抗体的阳性杂交瘤细胞株,命名为3C4A1。
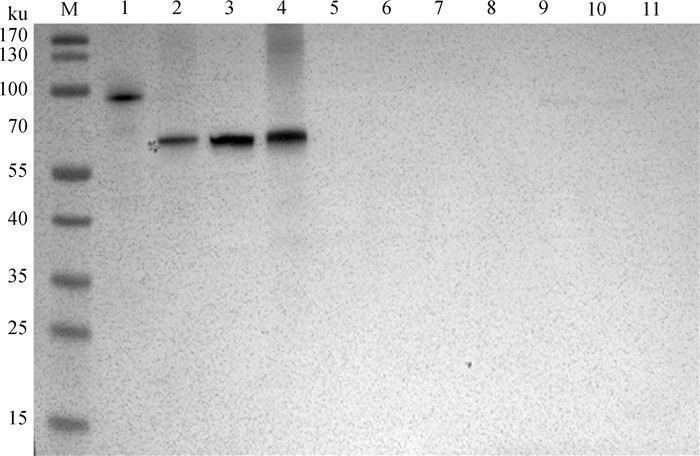
2.5 单克隆抗体特异性鉴定Western blot试验结果如图 4所示,MAb 3C4A1能与rM0071蛋白和Mmm分离株Ben-1、牧1及其标准株PG1发生特异性反应,而不与山羊支原体山羊肺炎亚种、丝状支原体山羊亚种、牛鼻支原体、无乳支原体、牛支原体、Leachii支原体和牛A型巴氏杆菌等发生反应。说明制备的单抗具有很高的特异性,可用于鉴别Mmm与其他病原。
|
M. 蛋白质相对分子质量标准;1. rM0071蛋白;2. Mmm分离株Ben-1;3. Mmm分离株牧1;4. Mmm模式株PG1;5. 山羊支原体山羊肺炎亚种;6. 丝状支原体山羊亚种;7. 牛鼻支原体;8. 无乳支原体;9. 牛支原体;10. Leachii支原体;11. 牛A型巴氏杆菌 M. Protein molecular weight marker; 1. rM0071 protein; 2. Mmm isolate Ben-1; 3. Mmm isolate Mu 1; 4. Mmm type strain PG1; 5. Mycoplasma capricolum subsp. capripneumoniae, Mccp; 6. Mycoplasma mycoides subsp. capri, Mmc; 7. Mycoplasma bovirhinis; 8. Mycoplasma agalactiae; 9. Mycoplasma bovis; 10. Mycoplasma leachii; 11. Bovine pasteurella type A 图 4 单克隆抗体3C4A1特异性鉴定 Fig. 4 Specificity identification of monoclonal antibody 3C4A1 |
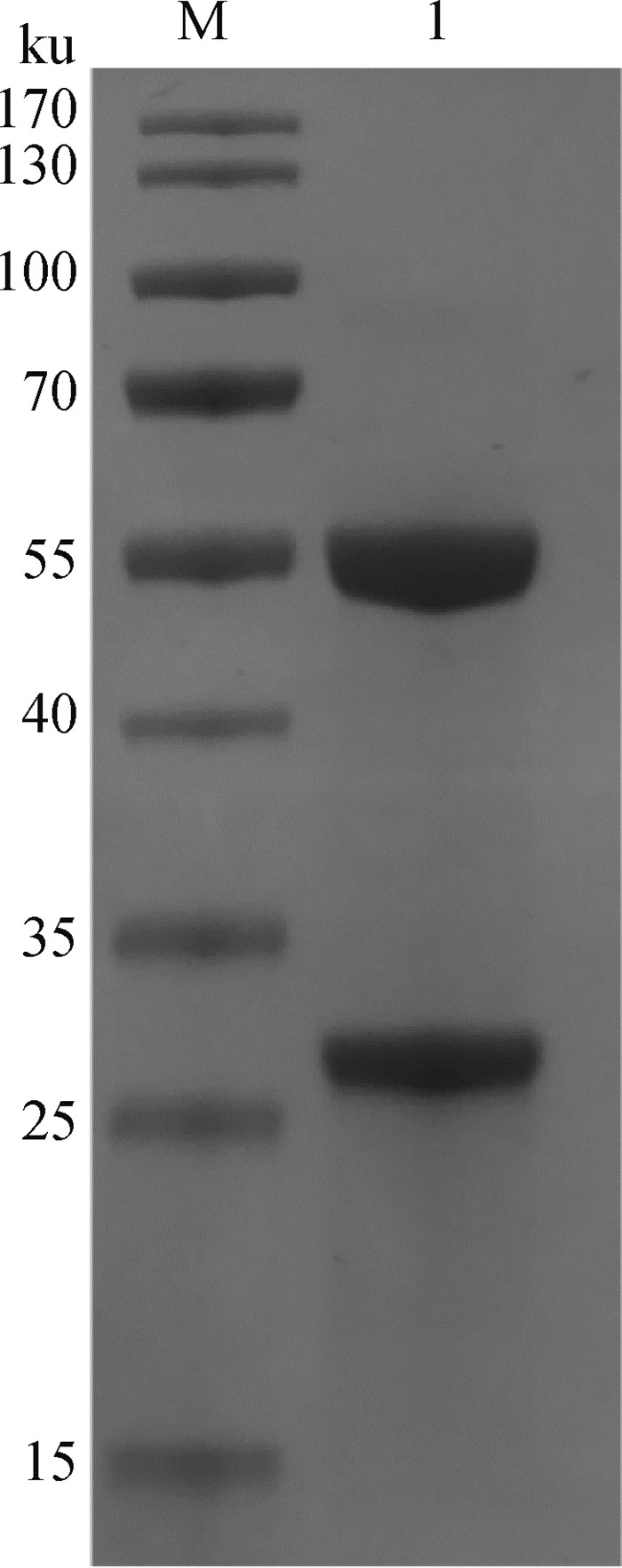
单克隆抗体经亚类鉴定显示MAb 3C4A1属于IgG1亚类,轻链为κ链。对MAb 3C4A1腹水采用Protein G亲和层析纯化,如图 5所示,纯化后的单克隆抗体可见一条大小约55 ku的重链和一条大小约25 ku的轻链,条带大小正确且清晰,与IgG结构一致,纯化效果良好。采用间接ELISA方法测定MAb 3C4A1纯化抗体的效价可达到1∶256 000,表明MAb 3C4A1具有较高的亲和力。
|
M. 蛋白质相对分子质量标准;1. 纯化的3C4A1单克隆抗体 M. Protein molecular weight marker; 1. Purified monoclonal antibody 3C4A1 图 5 单克隆抗体3C4A1纯化鉴定 Fig. 5 Purification of monoclonal antibody 3C4A1 |
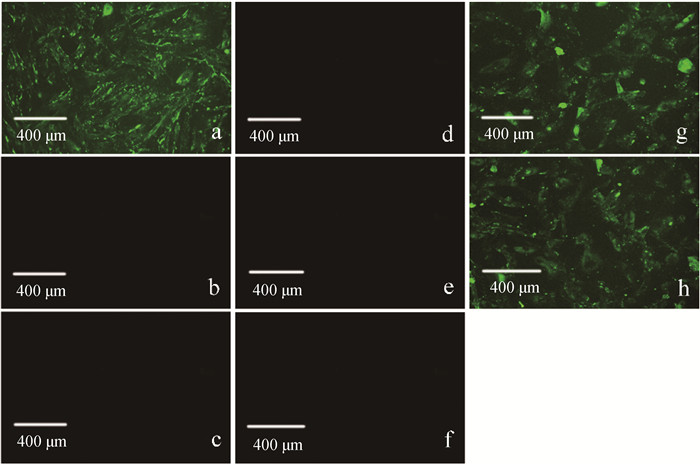
将已接种Ben-1、牧1、牛鼻支原体、无乳支原体和牛支原体的EBL细胞培养孔及阳性对照孔、阴性对照孔和空白对照孔,置于倒置荧光显微镜下观察。结果如图 6所示,除接种Ben-1、牧1的细胞孔和阳性对照孔有明显的绿色荧光外,牛鼻支原体、无乳支原体、牛支原体感染细胞孔和阴性对照孔、空白对照孔均未出现绿色荧光,说明MAb 3C4A1能够特异性识别感染EBL细胞的Mmm,与其他支原体不发生交叉反应。上述结果表明,该单抗是Mmm特异性单克隆抗体,可将其作为IFA检测的一抗用于Mmm感染的诊断。
|
a. 阳性对照(免疫小鼠血清);b. 阴性对照(未免疫小鼠血清);c. 空白对照(未感染细胞);d. 牛鼻支原体;e. 无乳支原体;f. 牛支原体;g. Mmm分离株Ben-1;h. Mmm分离株牧1 a. Positive control (immunized mouse serum); b. Negative control (serum of nonimmunized mouse); c. Blank control(uninfected EBL cells); d. Mycoplasma bovirhinis; e. Mycoplasma agalactiae; f. Mycoplasma bovis; g. Mmm isolate Ben-1; h. Mmm isolate Mu 1 图 6 单抗3C4A1用于IFA检测感染EBL细胞的不同支原体 Fig. 6 IFA detection of different mycoplasma from infected EBL cells by using MAb 3C4A1 |
我国经过几十年的努力,于2011年5月被OIE认证为无CBPP的国家[15]。为保持我国无疫状态,本实验室每年对全国重点地区牛群进行CBPP病原学监测。目前,我国对CBPP的病原学诊断主要以病原分离培养和核酸检测为主。其中,病原分离培养是鉴别诊断的金标准,但支原体营养要求苛刻、生长周期长,容易被其他细菌污染,分离鉴定困难,而且病原分离培养需获得农业农村部批复方可在高级别生物安全实验室内开展,不能满足CBPP早期快速诊断和风险预警的需求[16-17]。基于PCR方法的核酸检测灵敏度高,但需要特殊的仪器设备,对试验条件及操作人员要求较高,同时也需要对病料样本进行复杂的处理,不能满足高通量检测的需求[18-19]。因此,亟需建立一种快速准确的病原检测方法以满足CBPP早期精准诊断和及时防控的需求。
根据OIE“陆生动物诊断和疫苗手册”规定,CBPP可通过免疫荧光试验和生长抑制试验等免疫学试验诊断,其病原培养物或感染的组织、器官组织液可使用IFA进行确诊,但需要使用抗Mmm的高免血清为一抗[20]。IFA的特异性与所用的一抗密切相关,因Mmm与丝状支原体家族的其他成员如山羊支原体山羊亚种、山羊支原体山羊肺炎亚种、丝状支原体山羊亚种、Leachii亲缘关系很近[20],Mmm不同菌株的多肽谱高度相似,而OIE推荐的抗Mmm的高免血清为多抗,使用时可能出现交叉反应,甚至假阳性[21-24]。而抗Mmm的特异单克隆抗体可以避免这种交叉反应,能提高IFA的特异性和敏感性[25-26]。特异性强的单克隆抗体已被证明可用于支原体物种鉴定,是建立快速准确的病原及抗体检测方法必不可少的工具[27-28]。国外Brooks等[29]和Rodriguez等[30]已分别成功研制出针对Mmm的特异性单克隆抗体MAb 6E3和MAb 3H12,并基于这两株单抗建立了双抗体夹心ELISA方法用于Mmm病原的快速检测和鉴定,显示出良好的特异性和敏感性,取得了良好的效果。Le等[31]也成功制备出Mmm特异的单克隆抗体MAb 117/5,基于该单抗的竞争ELISA方法,具有较高特异性和敏感性,是当前OIE推荐的也是国际上适用的CBPP血清学检测方法。由于我国为CBPP无疫国家,Mmm检测技术的研究相对缓慢和滞后,目前我国尚无可用于CBPP病原诊断的特异性单克隆抗体。
鉴于此,本研究依据实验室前期研究结果,选取能与CBPP阳性牛血清发生免疫反应的rM0071蛋白制备单克隆抗体。经筛选获得1株针对rM0071蛋白的单克隆抗体MAb 3C4A1,Western blot试验证明该抗体能与Mmm发生特异性反应,而不与其他病原发生反应,与Brooks等[29]制备的MAb 6E3显示出相似的特异性,表明MAb 3C4A1具有针对Mmm的良好特异性。进一步,将MAb 3C4A1作为一抗用于IFA试验,分别检测感染细胞中的Mmm、牛鼻支原体、无乳支原体和牛支原体,结果显示MAb 3C4A1仅对Mmm感染的EBL细胞显示特异性荧光反应,与其他的支原体没有交叉反应,表明基于MAb 3C4A1的IFA检测方法可用于Mmm感染的检测。综上所述,本研究制备的MAb 3C4A1是Mmm高度特异的单克隆抗体,可以作为CBPP病原免疫学诊断的工具抗体,为进一步研制CBPP病原鉴别诊断试剂盒提供了基础材料。
4 结论获得1株抗丝状支原体丝状亚种(Mmm)的单克隆抗体MAb 3C4A1,该抗体只与Mmm发生特异性免疫反应,而不与其他病原发生反应;并能识别EBL细胞中的Mmm,可将其用于实验室对CBPP病原的免疫学诊断。
| [1] |
ABDO E M, NICOLET J, MISEREZ R, et al. Humoral and bronchial immune responses in cattle experimentally infected with Mycoplasma mycoides subsp. mycoides small colony type[J]. Vet Microbiol, 1998, 59(2-3): 109-122. DOI:10.1016/S0378-1135(97)00184-3 |
| [2] |
吴移谋, 叶元康. 支原体学[M]. 2版. 北京: 人民卫生出版社, 2008: 237-242. WU Y M, YE Y K. Mycoplasmology[M]. 2nd ed. Beijing: People's Medical Publishing House, 2008: 237-242. (in Chinese) |
| [3] |
DI TEODORO G, MARRUCHELLA G, DI PROVVIDO A, et al. Contagious bovine pleuropneumonia: A comprehensive overview[J]. Vet Pathol, 2020, 57(4): 476-489. DOI:10.1177/0300985820921818 |
| [4] |
DUDEK K, SZACAWA E, NICHOLAS R A J. Recent developments in vaccines for bovine mycoplasmoses caused by Mycoplasma bovis and Mycoplasma mycoides subsp. mycoides[J]. Vaccines, 2021, 9(6): 549. DOI:10.3390/vaccines9060549 |
| [5] |
REGALLA J, CAPORALE V, GIOVANNINI A, et al. Manifestation and epidemiology of contagious bovine pleuropneumonia in Europe[J]. Rev Sci Tech, 1996, 15(4): 1309-1329. DOI:10.20506/rst.15.4.979 |
| [6] |
ARFI Y, MINDER L, DI PRIMO C, et al. MIB-MIP is a mycoplasma system that captures and cleaves immunoglobulin G[J]. Proc Natl Acad Sci U S A, 2016, 113(19): 5406-5411. DOI:10.1073/pnas.1600546113 |
| [7] |
叶德成, 吴海杰. 牛传染性胸膜肺炎研究进展[J]. 中国畜牧兽医文摘, 2018, 34(6): 194. YE D C, WU H J. Research progress of contagious bovine pleuropneumonia[J]. China Veterinary Animal Husbandry Digest, 2018, 34(6): 194. (in Chinese) |
| [8] |
沈青春, 韩明远, 王芳, 等. 牛传染性胸膜肺炎研究进展[J]. 中国奶牛, 2010(8): 48-51. SHEN Q C, HAN M Y, WANG F, et al. Progress on containions bovine pleuropneumonia[J]. China Dairy Cattle, 2010(8): 48-51. DOI:10.3969/j.issn.1004-4264.2010.08.018 (in Chinese) |
| [9] |
WINDSOR R S. The eradication of contagious bovine pleuropneumonia from south western Africa: a plan for action[J]. Ann N Y Acad Sci, 2000, 916: 326-332. |
| [10] |
TARDY F, GAURIVAUD P, MANSO-SILVÁN L, et al. Extended surveillance for CBPP in a free country: challenges and solutions regarding the potential Caprine reservoir[J]. Prev Vet Med, 2011, 101(1-2): 89-95. DOI:10.1016/j.prevetmed.2011.04.017 |
| [11] |
BÖLSKE G, MSAMI H M, GUNNARSSON A, et al. Contagious bovine pleuropneumonia in northern Tanzania, culture confirmation and serological studies[J]. Trop Anim Health Prod, 1995, 27(4): 193-201. DOI:10.1007/BF02250690 |
| [12] |
ABDELA N, YUNE N. Seroprevalence and distribution of contagious bovine pleuropneumonia in Ethiopia: Update and critical analysis of 20 years (1996-2016) reports[J]. Front Vet Sci, 2017, 4: 100. DOI:10.3389/fvets.2017.00100 |
| [13] |
VARELA F, INÁCIO J, BOTELHO A. Molecular diversity assessed by VNTR and IS1296 typing of historical Mycoplasma mycoides subsp. mycoides SC strains[J]. Vet Microbiol, 2010, 146(3-4): 295-302. DOI:10.1016/j.vetmic.2010.05.030 |
| [14] |
LI Y, WANG Y, WANG R, et al. Changes in pathogenicity and immunogenicity of Mycoplasma mycoides subsp. mycoides strains revealed by comparative genomics analysis[J]. Sci Rep, 2016, 6: 19081. DOI:10.1038/srep19081 |
| [15] |
XIN J Q, LI Y, NICHOLAS R A J, et al. A history of the prevalence and control of contagious bovine pleuropneumonia in China[J]. Vet J, 2012, 191(2): 166-170. DOI:10.1016/j.tvjl.2011.02.011 |
| [16] |
陈金水, 翟旭久. 牛传染性胸膜肺炎的血清学诊断[J]. 中国兽医科技, 1990(9): 38-39. CHEN J S, ZHAI X J. Serological diagnosis of contagious bovine pleuropneumonia[J]. Chinese Journal of Veterinary Science and Technology, 1990(9): 38-39. (in Chinese) |
| [17] |
MUSA J A, BALE J O O, KAZEEM H M, et al. Molecular detection of Nigerian field isolates of Mycoplasma mycoides subsp. mycoides as causative agents of contagious bovine pleuropneumonia[J]. Int J Vet Sci Med, 2016, 4(2): 46-53. DOI:10.1016/j.ijvsm.2016.10.007 |
| [18] |
MAIR G, VILEI E M, WADE A, et al. Isothermal loop-mediated amplification (LAMP) for diagnosis of contagious bovine pleuropneumonia[J]. BMC Vet Res, 2013, 9: 108. DOI:10.1186/1746-6148-9-108 |
| [19] |
PILO P, FREY J, VILEI E M. Molecular mechanisms of pathogenicity of Mycoplasma mycoides subsp. mycoides SC[J]. Vet J, 2007, 174(3): 513-521. DOI:10.1016/j.tvjl.2006.10.016 |
| [20] |
世界动物卫生组织(OIE). OIE陆生动物诊断试验与疫苗手册[M]. 农业部兽医局, 译. 7版. 北京: 中国农业出版社, 2012. The World Organization for Animal Health (OIE). OIE handbook of diagnostic tests and vaccines for terrestrial animals[M]. Veterinary Bureau of the Ministry of Agriculture, trans. 7th ed. Beijing: China Agriculture Press, 2012. (in Chinese) |
| [21] |
纪燕, 熊祺琰, 韦艳娜, 等. 猪鼻支原体黏附宿主细胞间接免疫荧光检测方法的建立[J]. 中国人兽共患病学报, 2014, 30(3): 239-243. JI Y, XIONG Q Y, WEI Y N, et al. Establishment of an indirect immunofluorescence assay for detection of adherence of Mycoplasma hyorhinis to host cells[J]. Chinese Journal of Zoonoses, 2014, 30(3): 239-243. DOI:10.3969/cjz.j.issn.1002-2694.2014.03.004 (in Chinese) |
| [22] |
AYE R, MWIRIGI M K, FREY J, et al. Cyto-adherence of Mycoplasma mycoides subsp. mycoides to bovine lung epithelial cells[J]. BMC Vet Res, 2015, 11: 27. DOI:10.1186/s12917-015-0347-3 |
| [23] |
辛九庆. 牛传染性胸膜肺炎诊断技术与分子流行病学研究[D]. 长春: 吉林农业大学, 2007. XIN J Q. Study of diagnosis technique and molecular epidemiology of contagious bovine pleuropneumonia[D]. Changchun: Jilin Agricultural University, 2007. (in Chinese) |
| [24] |
HIRAI Y, KANATANI T, ONO M, et al. An indirect immunofluorescence method for detection of Mycoplasma hominis in vaginal smears[J]. Microbiol Immunol, 1991, 35(10): 831-839. DOI:10.1111/j.1348-0421.1991.tb02023.x |
| [25] |
NASEEM S, MEENS J, JORES J, et al. Phage display-based identification and potential diagnostic application of novel antigens from Mycoplasma mycoides subsp. mycoides small colony type[J]. Vet Microbiol, 2010, 142(3-4): 285-292. DOI:10.1016/j.vetmic.2009.09.071 |
| [26] |
GAO Y L, HUANG X X, ZHU Y B, et al. A brief review of monoclonal antibody technology and its representative applications in immunoassays[J]. J Immunoassay Immunochem, 2018, 39(4): 351-364. DOI:10.1080/15321819.2018.1515775 |
| [27] |
RODRÍGUEZ F, FERNÁNDEZ A, BALL H J. Detection of Mycoplasma mycoides subspecies mycoides by growth-inhibition using monoclonal antibodies[J]. Res Vet Sci, 1997, 63(1): 91-92. DOI:10.1016/S0034-5288(97)90165-X |
| [28] |
HWANG Y S, PANANGALA V S, ROSSI C R, et al. Monoclonal antibodies that recognize specific antigens of Mycoplasma gallisepticum and M. synoviae[J]. Avian Dis, 1989, 33(1): 42-52. DOI:10.2307/1591066 |
| [29] |
BROOKS C, FINLAY D, BLACKBURN P, et al. Detection of Mycoplasma mycoides subspecies mycoides small colony by a specific capture/enrichment monoclonal antibody-based sandwich ELISA[J]. Res Vet Sci, 2009, 87(2): 200-203. DOI:10.1016/j.rvsc.2009.03.007 |
| [30] |
RODRIGUEZ F, BALL H J, FINLAY D, et al. Detection of Mycoplasma mycoides subspecies mycoides by monoclonal antibody-based sandwich ELISA[J]. Vet Microbiol, 1996, 51(1-2): 69-76. DOI:10.1016/0378-1135(96)00018-1 |
| [31] |
LE GOFF C, THIAUCOURT F. A competitive ELISA for the specific diagnosis of contagious bovine pleuropneumonia (CBPP)[J]. Vet Microbiol, 1998, 60(2-4): 179-191. DOI:10.1016/S0378-1135(98)00156-4 |
(编辑 白永平)



