陕西省是我国山羊养殖大省,近年来,致病性大肠杆菌(Escherichia coli,E. coli)已成为养羊业主要的致病性细菌之一[1]。致病性E. coli携带多种毒素导致人和动物腹泻、脑膜炎、流产等一系列临床症状,给养殖业和公众健康带来严重威胁[2]。在兽医临床上,随着抗生素几十年以来的反复使用、甚至滥用,导致细菌耐药问题日益严峻[3]。与此同时,与动物密切接触的兽医、养殖户等也常常检测到相关耐药细菌。目前,细菌耐药已不仅是畜牧养殖领域关注的重点,同样是医学、生态等领域共同面临的挑战。在“one-health”背景下,人、环境及动物形成紧密关联的整体,耐药基因得以在此整体环境中不断转移、进化和传播,形成错综复杂的网络,成为细菌耐药性快速发展的遗传基础[4]。
相对于其他动物源细菌耐药性而言,羊源致病性E. coli耐药性报道较少,而关于陕西地区的羊源E. coli耐药性及毒力基因情况未见报道。因此,为加强陕西省羊源致病性E. coli耐药性监测,促进规模化养殖场合理用药,保障动物源性食品和公共卫生安全。本研究对陕西省部分规模化养殖场进行致病性E. coli分离鉴定,并测定其对12种抗生素的耐药谱、检测11种耐药基因以及16种毒力基因,以明确陕西省羊源致病性E. coli耐药谱及毒力基因携带情况,为陕西地区今后临床合理用药、有效防控羊源致病性E. coli感染提供依据。
1 材料与方法 1.1 菌株来源肛门拭子样品来源于陕西省西安市(15份)、宝鸡市(15份)、咸阳市(15份)和渭南市(9份)等地区10个规模化养殖场,54份样品于采集后24 h内在4 ℃条件下送至西北农林科技大学动物医学院传染病实验室。
1.2 主要试剂普通营养琼脂、麦康凯和伊红美蓝等培养基等购自青岛高科园海博生物技术有限公司和英国OXOID公司;12种抗生素购自北京索莱宝科技有限公司;细菌基因组DNA提取试剂盒、DL2000 Marker和2×Taq Mix购自宝生物工程(大连)有限公司。
1.3 引物设计本研究中所检测的主要毒力基因:sfa、cnf1、papC、hlyA、rfc、sepA、etrA、aer、faeG、fasA、eltA、estA、eaeA、exhA、stx1和stx2,引物序列参考文献[5],主要耐药基因:Sul1、Sul2、Sul3[6]、TetA、TetB、TetC[7]、blaCTX-M、blaOXA、blaTEM、blaSHV[8]和mcr-1[9],引物序列参考相关文献。引物由西安擎科生物科技有限公司合成。
1.4 细菌的分离与纯化将采集的样品分别放到10 mL的LB营养肉汤液体培养基中,在37 ℃摇床中180 r·min-1过夜后,在伊红美蓝和麦康凯培养基相互传代,将纯化后的菌落利用16S特异性引物进行鉴定。将鉴定、纯化后的细菌保存于西北农林科技大学动物医学院传染病实验室。
1.5 药敏试验采用96孔板琼脂稀释法对兽医和人医临床常用抗感染的大观霉素、庆大霉素、氨苄西林、头孢他啶、头孢噻呋、氟苯尼考、磺胺异噁唑、乙酰甲喹、四环素、恩诺沙星、多黏菌素和美罗培南12种抗生素进行药敏试验。以ATCC 25922作为质控菌株,按照美国临床实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)和国家耐抗菌素监测系统(National antimicrobial resistance monitoring system, NARMS)推荐标准进行试验操作和结果判断。
1.6 耐药基因和毒力基因检测挑单克隆菌落于无菌LB肉汤中200 r·min-1,37 ℃过夜振荡培养,取1 mL细菌培养液于无菌EP管内,12 000 r·min-1离心3 min,弃上清液,利用细菌基因组提取试剂盒制备菌株DNA模板。其反应体系为25 μL,其中,2×Taq Mix 12.5 μL、上下游引物各1 μL、DNA模板1 μL,ddH2O补足至25 μL。反应条件:94 ℃预变性1 min;94 ℃变性30 s,根据不同的引物选择相应的退火温度,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳成像,并进行测序鉴定。
2 结果 2.1 大肠杆菌分离鉴定及耐药情况54份样品中共分离鉴定得到50株致病性E. coli,总分离率为92.6%(50/54)。12种抗生素的耐药性结果显示,E. coli分离株对氨苄西林、氟苯尼考和磺胺异噁唑耐药率达90%以上,对大观霉素、庆大霉素、头孢噻呋、乙酰甲喹、四环素和恩诺沙星的耐药率达60%以上,对头孢他啶和多黏菌素B耐药率为40%以上,未发现对美罗培南耐药的菌株。
2.2 分离菌株多重耐药情况多重耐药情况显示(图 1),在50株羊源致病性E. coli中有49株呈现多重耐药,其中,对11种抗生素耐药的菌株有14株(28%),对9~10种抗生素耐药的菌株有13株(26%),对7~8种抗生素耐药的菌株有11株(22%),对3~6种抗生素耐药的菌株有11株(22%)。
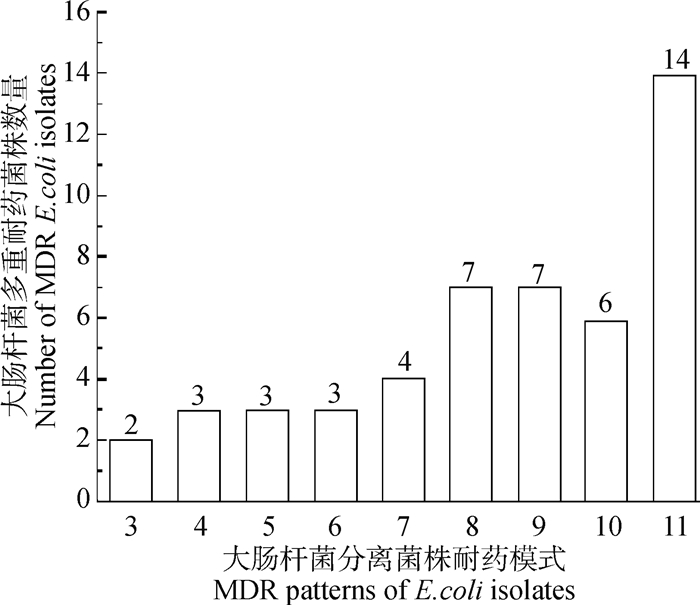
|
图 1 50株致病性E.coli分离菌株多重耐药情况检测 Fig. 1 Detection for multidrug resistance of the 50 pathogenic E. coli isolates |
按照细菌基因组DNA提取试剂盒说明书提取50株致病性E. coli分离株基因组DNA。然后利用Nanodrop检测DNA样品纯度和浓度。利用PCR检测分离菌的耐药基因,结果显示,50株分离菌分别检测出1~6种耐药基因,其中,磺胺类耐药基因Sul2(64%)、四环素类耐药基因TetA(34%)、β-内酰胺类耐药基因blaCTX-M(32%)检出率较高,此外。耐药基因Sul1、Sul3、TetB、TetC、blaTEM、blaOXA和mcr-1检出率分别为18%(9/50)、14%(7/50)、8%(4/50)、16%(8/50)、22%(11/50)、4%(2/50)和10%(5/50),未检出β-内酰胺类耐药基因blaSHV(图 2)。
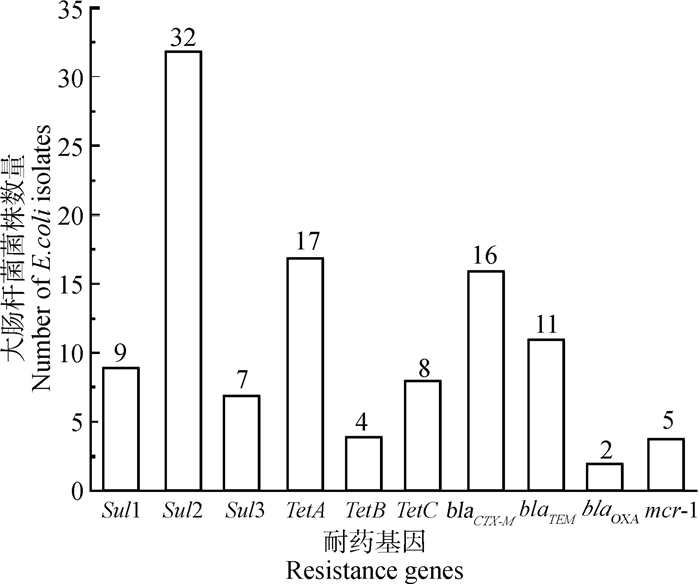
|
图 2 50株致病性E.coli耐药基因情况检测 Fig. 2 Detection of resistance genes in 50 pathogenic E. coli isolates |
根据携带毒力基因的不同可将致病性E. coli分为肠外型(extraintestinal pathogenic E. coli, EXPEC)、肠黏附型(enteroaggregative E. coli, EAEC)、肠侵袭型(enteroinvasive E. coli, EIEC)、肠毒素型(enterotoxigenic E. coli, ETEC)、肠致病型(enteropathogenic E. coli, EPEC)和肠出血型(enterohemorrhagic E. coli, EHEC)6种致病型。结果显示,6种致病型均被检出。毒力基因检测结果显示共检测到11种毒力基因,其中, etrA基因携带率最高,为80%(40/50),aer为36%(18/50),eaeA为32%(16/50),exhA为34%(14/50),fasA为26%(13/50),sepA为18%(9/50),estA为18%(9/50),faeG为6%(3/50),stx2为4%(2/50),papC为2%(1/50),eltA为2%(1/50),未检测到sfa、cnf1、hlyA、rfc和stx1基因。50株致病性E. coli中有49株携带至少1种及以上的毒力基因,其中,携带1种毒力基因有10株,2种毒力基因14株,3种毒力基因12株,4种毒力基因9株,5种毒力基因4株。
3 讨论致病性E. coli作为最重要的人兽共患致病菌之一,可引起人和动物的腹泻、肠炎等。E. coli作为条件性致病菌,可广泛存在羊、猪、家禽肠道,并可以通过食物链传播,引起人类疾病。本研究从陕西省不同地区规模化养羊场采集54份腹泻羊肛门拭子,共分离到50株E. coli,总分离率92.6%,高于其他报道。宋晓莉[10]在江苏部分地区75份腹泻羊肛门拭子样品分离出56株致病性E. coli,分离率为74.7%;刘晨阳[11]从宁夏回族自治区和青海高原牧区采集145份羊源样品,分离出131株E. coli,宁夏回族自治区分离率为91.0%、青海高原牧区分离率为88.9%。本研究中陕西省羊源E. coli分离率较高,其原因可能是饲养模式、养殖规模和样本数量等原因导致不同省份E. coli流行程度不同。
世界卫生组织曾报告,如今每年有70万人死于抗生素耐药,到2050年,抗生素耐药将会导致每年1000万人死亡,“超级细菌”的出现引人担忧[12]。在后抗生素时代,耐药性是全球最紧迫的公共卫生问题之一。E. coli耐药基因可通过质粒、转座子、整合子、插入序列共同区和噬菌体等可移动原件进行水平转移[13]。当毒力基因和耐药基因存在同一可移动原件上时,在抗生素的选择压力下,可引起基因共转移,导致耐药性和致病性增强[14]。本研究分离的50株羊源致病性E. coli药敏试验结果显示,E. coli多重耐药性和交叉耐药性严重,耐药谱复杂,除美罗培南外,对其他11种抗生素都已产生耐药性。对氨苄西林、氟苯尼考和磺胺异噁唑耐药率达90%以上,对大观霉素、庆大霉素、头孢噻呋、乙酰甲喹、四环素和恩诺沙星的耐药率达60%以上,对头孢他啶和多黏菌素B耐药率也达40%以上,这与目前报道的E. coli多重耐药情况一致。刘润春等[15]对华东华北地区羊源E. coli多重耐药性检测发现,该菌对氨苄西林、利福平、克林霉素、阿莫西林、苯唑西林耐药率都达到90%以上;刘正明等[16]对内蒙古地区108株羊源E. coli进行13种抗菌药物药敏试验,结果发现对阿莫西林、头孢噻吩、磺胺甲噁唑、黏菌素的耐药率均达100.0%。此外,首次在羊源产ESBLs大肠杆菌发现mcr-1基因。本研究与上述报道的结果均反映出E. coli多重耐药现象严峻,这可能是由于抗生素的长期不合理使用、甚至是滥用的结果。提示在治疗和预防羊源E. coli时,应筛选高效敏感的药物进行合理用药,以提高治愈率,减少耐药菌株的出现。
本研究对50株羊源致病性E. coli进行毒力基因检测,结果显示在16种毒力基因中共检测到11种,总检出率高达98% (49/50),表明携带毒力因子的致病性E. coli菌株正在陕西省流行和传播。其中etrA基因携带率最高,为80%,Rehman等[17]对青海牦牛源E. coli毒力基因调查发现,etrA基因携带率为24.3%。另外检测到aer为36%,eaeA为32%,exhA为34%,fasA为26%,sepA为18%,estA为18%,faeG为6%,stx2为4%,papC为2%,eltA为2%。宁夏地区奶牛乳房炎大肠杆菌astA、escV、eaeA、sepA、hlyA 5种毒力基因的检出率分别是20.30%、14.72%、8.12%、2.03%、1.02%[18]。与已报道的相比,本研究分离的致病性E. coli毒力基因情况较复杂,不同毒力基因的组合可能是导致羊腹泻和肠外病变的主要原因。此外,还检测到较多的eaeA和aer组合,eaeA基因编码外膜蛋白紧密素,参与黏膜细胞产生黏附,aer基因具有溶血活性、细胞毒性,能够改变细胞膜的通透性。目前,这种毒力组合尚未见报道,还需要进一步深入探索E. coli对宿主的致病机制。由于羊源致病性E. coli携带毒力基因及对抗生素产生耐药性,对E. coli病防治带来困难,因此对其防治过程中应注意科学用药的同时,注意预防“超级耐药细菌”向人的传播。
4 结论陕西省羊养殖场致病性E. coli分离率较高,分离株多重耐药现象严重,毒力基因分布广泛,致病能力较强。因此,在规模化羊养殖场,应谨慎使用抗生素,尤其是氨苄西林、氟苯尼考和磺胺异噁唑,同时应加强羊源致病性E. coli的耐药性及毒力基因监测。
| [1] |
SHAHZAD A, ULLAH F, IRSHAD H, et al. Molecular detection of Shiga toxin-producing Escherichia coli (STEC) O157 in sheep, goats, cows and buffaloes[J]. Mol Biol Rep, 2021, 48(10): 6113-6121. DOI:10.1007/s11033-021-06631-3 |
| [2] |
HABOURIA H, POKHAREL P, MARIS S, et al. Three new serine-protease autotransporters of Enterobacteriaceae (SPATEs) from extra-intestinal pathogenic Escherichia coli and combined role of SPATEs for cytotoxicity and colonization of the mouse kidney[J]. Virulence, 2019, 10(1): 568-587. DOI:10.1080/21505594.2019.1624102 |
| [3] |
WANG Y, XU C Y, ZHANG R, et al. Changes in colistin resistance and mcr-1 abundance in Escherichia coli of animal and human origins following the ban of colistin-positive additives in China: an epidemiological comparative study[J]. Lancet Infect Dis, 2020, 20(10): 1161-1171. DOI:10.1016/S1473-3099(20)30149-3 |
| [4] |
HERNANDO-AMADO S, COQUE T M, BAQUERO F, et al. Defining and combating antibiotic resistance from One Health and Global Health perspectives[J]. Nat Microbiol, 2019, 4(9): 1432-1442. DOI:10.1038/s41564-019-0503-9 |
| [5] |
ZHAO X L, LV Y Y, ADAM F E A, et al. Comparison of antimicrobial resistance, virulence genes, phylogroups, and biofilm formation of Escherichia coli isolated from intensive farming and free-range sheep[J]. Front Microbiol, 2021, 12: 699927. DOI:10.3389/fmicb.2021.699927 |
| [6] |
MA M G, WANG H N, YU Y, et al. Detection of antimicrobial resistance genes of pathogenic Salmonella from swine with DNA microarray[J]. J Vet Diagn Invest, 2007, 19(2): 161-167. DOI:10.1177/104063870701900204 |
| [7] |
MATTER D, ROSSANO A, LIMAT S, et al. Antimicrobial resistance profile of Actinobacillus pleuropneumoniae and Actinobacillus porcitonsillarum[J]. Vet Microbiol, 2007, 122(1-2): 146-156. DOI:10.1016/j.vetmic.2007.01.009 |
| [8] |
PEREZ F, HUJER A M, HUJER K M, et al. Global challenge of multidrug-resistant Acinetobacter baumannii[J]. Antimicrob Agents Chemother, 2007, 51(10): 3471-3484. DOI:10.1128/AAC.01464-06 |
| [9] |
LIU Y Y, WANG Y, WALSH T R, et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study[J]. Lancet Infect Dis, 2016, 16(2): 161-168. DOI:10.1016/S1473-3099(15)00424-7 |
| [10] |
宋晓莉. 江苏部分地区肉羊源大肠杆菌的分子流行病学及其部分特性研究[D]. 扬州: 扬州大学, 2019. SONG X L. Molecular epidemiology of Escherichia coli from fleshy sheep in parts of Jiangsu and its characteristics[D]. Yangzhou: Yangzhou University, 2019. (in Chinese) |
| [11] |
刘晨阳. 羊源大肠杆菌的分离鉴定及耐药性与致病性分析[D]. 杨凌: 西北农林科技大学, 2019. LIU C Y. Isolation and identification of Escherichia coli from goats and analysis of drug resistance and pathogenicity[D]. Yangling: Northwest A & F University, 2019. (in Chinese) |
| [12] |
SHATALIN K, NUTHANAKANTI A, KAUSHIK A, et al. Inhibitors of bacterial H2S biogenesis targeting antibiotic resistance and tolerance[J]. Science, 2021, 372(6547): 1169-1175. DOI:10.1126/science.abd8377 |
| [13] |
ZHANG S Q, ABBAS M, REHMAN M U, et al. Updates on the global dissemination of colistin-resistant Escherichia coli: an emerging threat to public health[J]. Sci Total Environ, 2021, 799: 149280. DOI:10.1016/j.scitotenv.2021.149280 |
| [14] |
VILLA L, GARCIA-FERNÁNDEZ A, FORTINI D, et al. Replicon sequence typing of IncF plasmids carrying virulence and resistance determinants[J]. J Antimicrob Chemother, 2010, 65(12): 2518-2529. DOI:10.1093/jac/dkq347 |
| [15] |
刘润春, 张梦洁, 恽佳蕾, 等. 华东华北规模化羊场细菌耐药性的调查研究[J]. 中国兽医科学, 2021, 51(12): 1599-1608. LIU R C, ZHANG M J, YUN J L, et al. Investigation of antimicrobial susceptibilities of bacterial on East China and North China sheep farms[J]. Chinese Veterinary Science, 2021, 51(12): 1599-1608. (in Chinese) |
| [16] |
刘正明, 李金泉, 黄德浩, 等. 内蒙古地区羊源大肠杆菌耐药性研究[J]. 中国畜牧兽医, 2017, 44(3): 839-846. LIU Z M, LI J Q, HUANG D H, et al. Study on the drug-resistance of Escherichia coli isolated from sheep in Inner Mongolia[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(3): 839-846. (in Chinese) |
| [17] |
REHMAN M UR, ZHANG H, IQBAL M K, et al. Antibiotic resistance, serogroups, virulence genes, and phylogenetic groups of Escherichia coli isolated from yaks with diarrhea in Qinghai Plateau, China[J]. Gut Pathog, 2017, 9(1): 24. DOI:10.1186/s13099-017-0174-0 |
| [18] |
张金宝, 马春芳, 余婷, 等. 宁夏地区奶牛乳房炎大肠杆菌毒力基因检测和耐药性分析[J]. 畜牧兽医学报, 2016, 47(1): 177-182. ZHANG J B, MA C F, YU T, et al. Detection of virulence genes and antimicrobial resistance analysis of Escherichia coli isolated from dairy cow mastitis in Ningxia[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(1): 177-182. (in Chinese) |
(编辑 白永平)



