2. 福建农林大学,中西兽医结合与动物保健福建省高校重点实验室,福州 350002;
3. 福建农林大学,福建省兽医中药与动物保健重点实验室,福州 350002
2. University Key Laboratory for Integrated Chinese Traditional and Western Veterinary Medicine and Animal Healthcare in Fujian Province, Fuzhou 350002, China;
3. Fujian Key Laboratory of Traditional Chinese Veterinary Medicine and Animal Health, Fujian Agriculture and Forestry University, Fuzhou 350002, China
霉菌毒素是丝状真菌的有毒次生代谢物,常见于农作物、谷物和食品污染,其中,玉米赤霉烯酮(zearalenone,ZEA)的污染问题尤为严重[1]。Lee等[2]综合2006—2016年霉菌毒素调查报道发现,世界范围内谷物原料中ZEA的污染率及平均污染水平为46%和3 049 μg·kg-1,其中,非洲、亚洲和北美污染最严重。我国学者在2018年检测了从19个省市收集的422份饲料样品,发现饲料中ZEA的检出率高达95%,超标率为7.9%,远高于国家饲料卫生标准(GB13078—2017)的限量要求[3]。ZEA又称F-2毒素,在动物体内可以被转化为还原性代谢产物,如α-玉米赤霉烯醇、β-玉米赤霉烯醇、α-玉米赤霉醇、β-玉米赤霉醇等[4]。ZEA及其代谢物具有类雌激素作用,并能扰乱动物的内分泌功能[5]。摄入霉菌毒素可以引起动物的生产性能下降,引发急性或慢性的中毒反应,进而威胁动物和人类健康,并给畜禽养殖业造成巨大的损失[6]。
ZEA除了具有雌激素活性外,还通过多种损伤机制发挥毒性作用,包括氧化应激、内质网应激、线粒体损伤、细胞周期阻滞、炎症反应、细胞凋亡和坏死等。ZEA能降低草鱼幼鱼的生长性能,损害草鱼肠道结构完整性,使草鱼肠道细胞发生凋亡和坏死,产生肠道毒性[7]。采用腹腔注射的方式给小鼠注射50 mg·kg-1剂量的ZEA,可观察到肝坏死、肝细胞变性和肾上皮细胞肿胀变性;组织细胞的氧化损伤是目前普遍接受的ZEA引起肝肾损伤机制之一[8]。体内外研究表明,ZEA对免疫应答也有显著影响,有免疫刺激或免疫抑制作用[9]。李欣虹等[10]研究发现,ZEA能诱导鸡脾淋巴细胞发生细胞凋亡和细胞坏死,抑制细胞增殖。此外,ZEA对多种类型细胞具有时间和剂量依赖性的负效应,如ZEA及其衍生物会对大鼠支持细胞和小鼠卵巢颗粒细胞产生毒性作用[11-12];40 μmol·L-1 ZEA能抑制猪小肠上皮细胞增殖,并在24 h内降低所有浓度(ZEA浓度 < 100 μmol·L-1) 的细胞活力[13];Wang等[14]研究发现,不同剂量的ZEA能通过线粒体途径诱导大鼠原代睾丸间质细胞凋亡。
虽然目前ZEA对禽类的毒性作用已有报道,但关于ZEA对禽类的毒性作用机制研究仍不完善。利用内分泌细胞和生殖细胞来评估ZEA的毒理学效应,但成纤维细胞的潜在影响一直被忽视,成纤维细胞在组织发育、维持和修复方面具有重要作用[15]。鸡胚成纤维细胞(DF-1)是一种稳定的、无肿瘤基因、自发无限增殖的细胞系,被广泛用于动物病毒研究、疫苗研制、癌症研究等诸多领域。因此,本试验选用DF-1作为供试细胞,探究ZEA对DF-1细胞的毒性作用,旨在进一步探讨ZEA的毒性作用机制与禽类疾病的确切关系,为正确指导农业生产、畜牧养殖和防控霉菌毒素中毒提供理论基础。
1 材料与方法 1.1 主要试剂胎牛血清、DMEM细胞培养基、PBS和青霉素-链霉素溶液等均购自美国Hyclone公司;二甲基亚砜(DMSO)和玉米赤霉烯酮(ZEA)均购自美国Sigma公司;甲基噻唑蓝MTT购自北京索莱宝科技有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自南京凯基生物科技有限公司;LDH检测试剂盒购自南京建成生物工程研究所;Caspase-3、ROS、线粒体膜电位检测试剂盒均购自上海茁彩生物科技有限公司;TRIzol试剂购自美国Ambion有限公司;反转录试剂盒和荧光定量试剂盒均购自宝生物工程(大连)有限公司。鸡胚成纤维细胞DF-1(ATCC; CRL-12203)购自武汉普诺赛生命科技有限公司。
1.2 ZEA对DF-1细胞活力的影响DF-1细胞按4.5×103个·孔-1接种至96孔板中,置于37 ℃ 5% CO2细胞培养箱中孵育,当细胞生长至70%~80%时,弃培养基,加入含不同浓度ZEA(ZEA终浓度分别为12.5、25.0和50.0 μg·mL-1) 的培养基。以不加ZEA的细胞作为对照组,继续培养6、12、24、48 h后,采用MTT法检测细胞活力。每个浓度设6个复孔,试验重复3次,试验结果以平均值表示。根据以下公式计算细胞的存活率:细胞存活率=(处理组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100。
1.3 ZEA对DF-1细胞形态的影响DF-1细胞按7×104个·孔-1接种至6孔板中,置于37 ℃ 5% CO2细胞培养箱中孵育,当细胞生长至70%~80%时,弃培养基,加入含不同浓度ZEA(ZEA终浓度分别为12.5、25.0和50.0 μg·mL-1) 的培养基。以不加ZEA的细胞作为对照组,继续培养24 h后,在倒置显微镜下观察拍照。
1.4 ZEA对DF-1细胞上清液中LDH的影响DF-1细胞按7×104个·孔-1接种至6孔板中,置于37 ℃ 5% CO2细胞培养箱中孵育,当细胞生长至70%~80%时,弃培养基,加入ZEA终浓度为25.0 μg·mL-1的培养基。以不加ZEA的细胞作为对照组,各设置6个复孔,继续培养24 h后收集细胞上清液,按照LDH检测试剂盒说明书步骤操作检测上清液中LDH的活性。试验重复3次。
1.5 ZEA对DF-1细胞上清液中Caspase-3含量的影响细胞接种和药物处理方法同“1.4”,继续培养24 h后收集细胞上清液,按照ELISA试剂盒说明书测定上清液中Caspase-3的含量。
1.6 Annexin V-FITC/PI双染法检测ZEA对DF-1细胞凋亡的影响细胞接板和药物处理方法同“1.4”,继续培养24 h后,按照细胞凋亡检测试剂盒说明书步骤操作,准备好细胞样品,流式细胞仪检测。
1.7 ZEA对DF-1细胞中活性氧水平的影响细胞接种和药物处理方法同“1.4”,加入含DCFH-DA荧光染料的培养液,37 ℃避光孵育20 min,PBS洗涤3次后用荧光倒置显微镜观察并拍照。
1.8 ZEA对DF-1细胞线粒体膜电位的影响细胞接种和药物处理方法同“1.4”,继续培养24 h后,加入含JC-1荧光染料的培养液,37 ℃避光孵育20 min,用JC-1 Buffer (1×)洗涤2次,用荧光倒置显微镜观察并拍照。
1.9 ZEA处理对DF-1细胞凋亡相关基因转录水平的影响细胞接种和药物处理方法同“1.4”,继续培养24 h后,3 000 r·min-1 4 ℃离心10 min收集细胞,使用TRIzol法提取总RNA,并反转录获得cDNA。以cDNA为模板,进行RT-qPCR反应。检测细胞凋亡(Bcl-2、Caspase-3、Bax)和内质网应激相关基因(ATF4、ATF6、GRP78、CHOP、IRE1、PERK)的mRNA转录水平。具体引物序列见表 1,引物均由生工生物工程(上海)股份有限公司合成。以β-actin为内参基因,采用2-ΔΔCt法计算分析结果。
|
|
表 1 荧光定量PCR引物序列信息 Table 1 RT-qPCR primer sequences information |
采用SPSS25.0对试验数据进行单因素方差分析,试验结果均以“平均值±标准差(x±s)”表示,P < 0.05为差异具有统计学意义。采用Grapher16.5软件作图。
2 结果 2.1 ZEA对DF-1细胞形态和活力的影响ZEA对DF-1细胞形态的影响结果见图 1。与对照组相比,ZEA浓度越高,细胞形态越差、皱缩、欠规则、呈圆形或卵圆形、折光性差、贴壁细胞减少,死亡细胞增多。细胞活力检测结果见图 2。与对照组相比,随着ZEA浓度增加、作用时间增长,ZEA对DF-1细胞活力的抑制作用增强,呈时间和剂量依赖性关系,25.0 μg·mL-1 ZEA处理DF-1细胞24 h后细胞活力约为50%,因此试验选取25.0 μg·mL-1 ZEA处理DF-1细胞24 h进行后续试验。
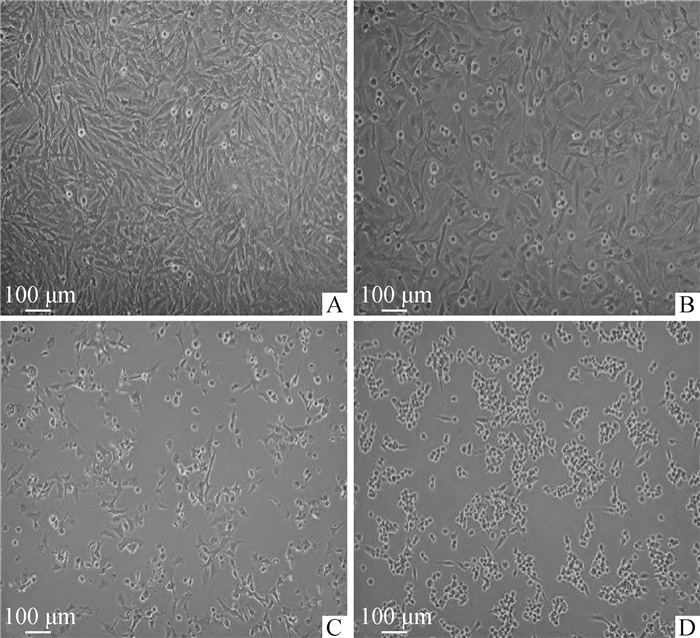
|
A.对照组;B. 12.5 μg·mL-1 ZEA处理组;C. 25.0 μg·mL-1 ZEA处理组;D. 50.0 μg·mL-1 ZEA处理组。扫描文章首页OSID码可查看彩图 A. Control group; B. 12.5 μg·mL-1 ZEA group; C. 25.0 μg·mL-1 ZEA group; D. 50.0 μg·mL-1 ZEA group. The color pictures can be found by scanning the OSID code on the front page of the article 图 1 不同浓度ZEA处理24 h对DF-1细胞形态的影响(标尺=100 μm) Fig. 1 Observation of cell growth after treatment with ZEA in different concentrations for 24 h (Scale bar=100 μm) |
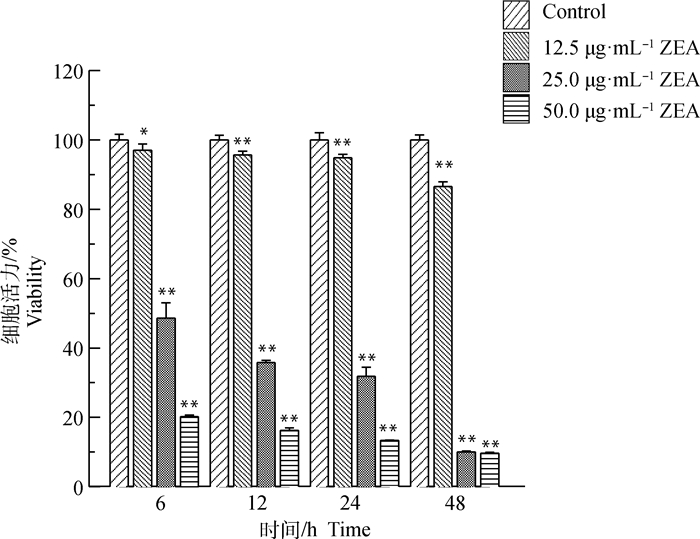
|
与对照组相比,*. P<0.05;**. P<0.01。下同 Compared with control, *. P < 0.05;**. P < 0.01. The same as below 图 2 ZEA对DF-1细胞活力的影响 Fig. 2 Effect of DF-1 cell viability in stimulation of ZEA with different concentrations at various time |
由图 3可知,与对照组相比,25.0 μg·mL-1 ZEA处理组LDH活性极显著升高(P < 0.01),约为正常细胞的6倍。表明25.0 μg·mL-1 ZEA作用于DF-1细胞后会产生细胞毒性,从而导致细胞凋亡。
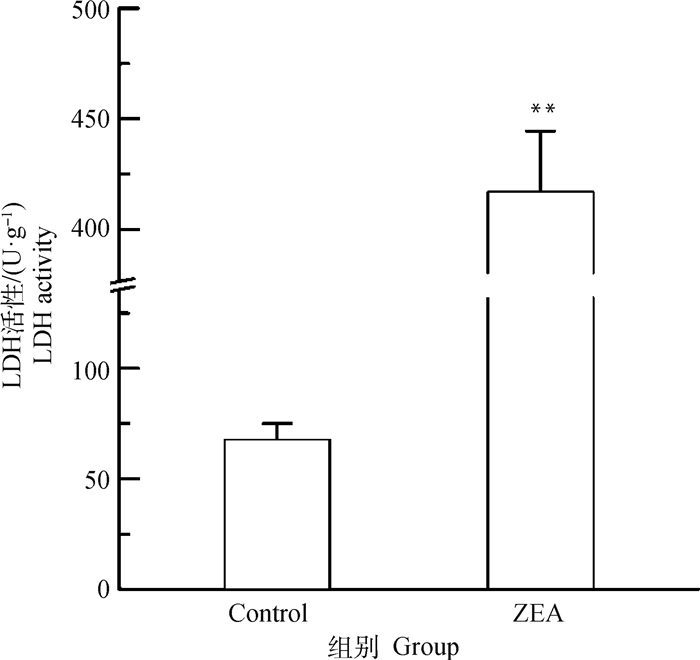
|
图 3 ZEA对DF-1细胞上清液中LDH活性的影响 Fig. 3 Effect of ZEA on lactate dehydrogenase release in supernatant of DF-1 cells |
由图 4可知,与对照组相比,25.0 μg·mL-1 ZEA处理DF-1细胞24 h后,细胞上清液中Caspase-3含量极显著升高(P < 0.01),约为正常细胞的2倍。表明25.0 μg·mL-1 ZEA作用于DF-1细胞后会发生细胞凋亡。
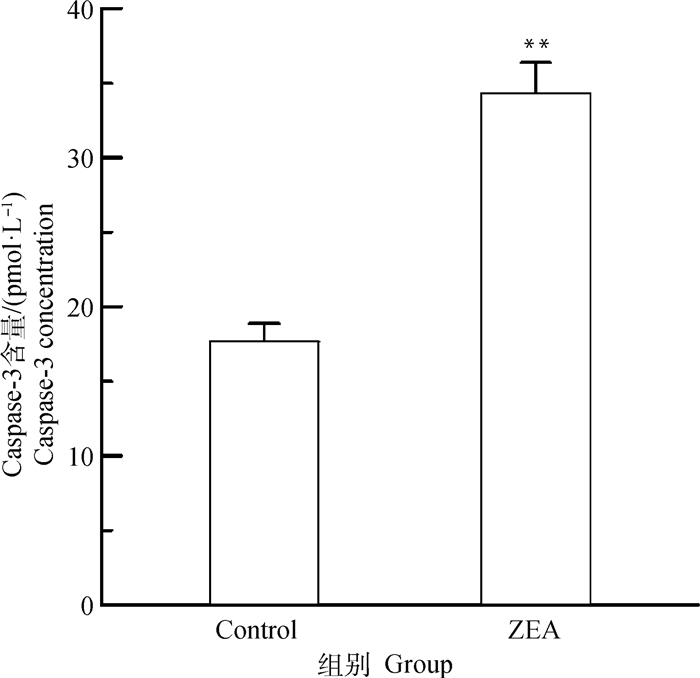
|
图 4 ZEA对DF-1细胞上清液中Caspase-3含量的影响 Fig. 4 Effect of ZEA on Caspase-3 content in supernatant of DF-1 cells |
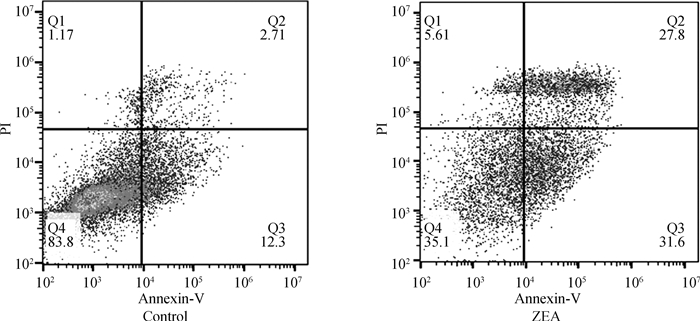
由图 5可知,Q1表示坏死细胞,Q2表示晚期凋亡细胞,Q3表示早期凋亡细胞、Q4表示活细胞。与对照组相比,25.0 μg·mL-1 ZEA处理组的早凋(Q3)和晚凋(Q2)细胞数显著增加,表明25.0 μg·mL-1 ZEA作用于DF-1细胞后会发生细胞凋亡。
|
图 5 ZEA对DF-1细胞凋亡的影响(扫描文章首页OSID码可查看彩图) Fig. 5 Effect of ZEA on the apoptosis of DF-1 cells (The color pictures can be found by scanning the OSID code on the front page of the article) |
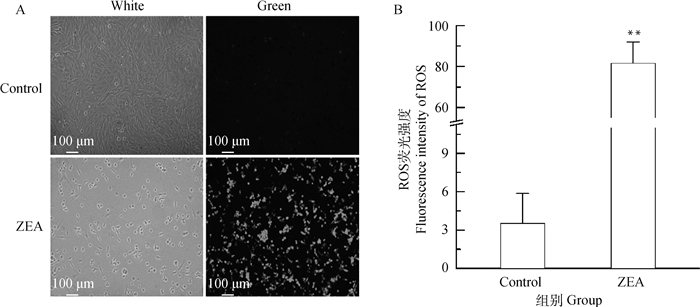
由图 6A可知,与对照组相比,25.0 μg·mL-1 ZEA处理组绿色荧光强度明显增强,细胞核呈浓缩、致密浓染。由图 6B可知,与对照组相比较,25.0 μg·mL-1 ZEA处理后的DF-1细胞ROS水平极显著增加(P<0.01),约为正常细胞的20倍,对细胞产生毒害作用。
|
A. 细胞内ROS水平变化的荧光染色结果(标尺=100 μm, 扫描文章首页OSID码可查看彩图);B. ROS荧光强度分析 A. The detection of intracellular ROS variation by fluorescence (Scale bar=100 μm, the color pictures can be found by scanning the OSID code on the front page of the article); B. ROS fluorescence intensity analysis 图 6 ZEA对DF-1细胞活性氧水平的影响 Fig. 6 Effect of ZEA on reactive oxygen species level of DF-1 cells |
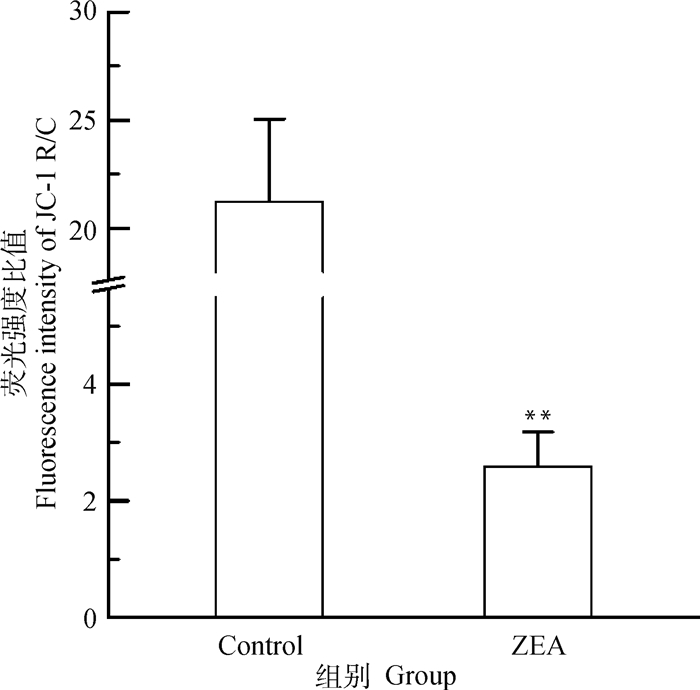
由图 7可知,与对照组相比,25.0 μg·mL-1 ZEA处理组红色荧光明显减弱,绿色荧光明显增强,由图 8可知,与对照组相比较,25.0 μg·mL-1 ZEA处理后的DF-1细胞线粒体膜电位极显著降低(P<0.01),约为正常细胞的1/7,说明ZEA能造成DF-1细胞线粒体损伤。

|
图 7 线粒体膜电位荧光染色结果(标尺=100 μm,扫描文章首页OSID码可查看彩图) Fig. 7 The fluorescence staining of mitochondrial membrane potential(Scale bar=100 μm, the color pictures can be found by scanning the OSID code on the front page of the article) |
|
图 8 线粒体膜电位红绿荧光强度比值分析 Fig. 8 Ratio analysis of red-green fluorescence intensity of mitochondrial membrane potential |
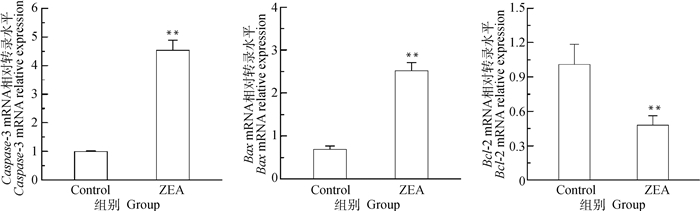
通过RT-qPCR检测凋亡相关基因Caspase-3、Bax、Bcl-2的转录水平,由图 9可知,与对照组相比,25.0 μg·mL-1 ZEA组的促凋亡基因Caspase-3 mRNA转录水平极显著上调(P < 0.01)、Bax mRNA转录水平极显著上调(P < 0.01);抑凋亡基因Bcl-2 mRNA转录水平极显著下调(P < 0.01)。从mRNA转录水平表明ZEA能诱导细胞凋亡。
|
图 9 ZEA对DF-1细胞凋亡相关基因mRNA转录水平的影响 Fig. 9 Effect of apoptosis-related gene mRNA expression in DF-1 cells after incubation with ZEA |
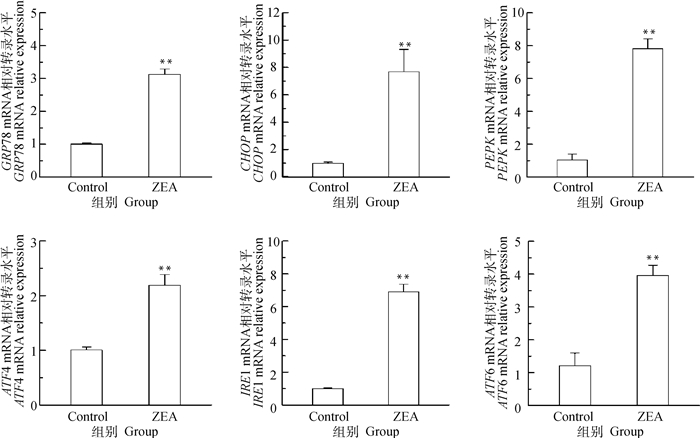
通过RT-qPCR检测ERs相关基因CHOP、GRP78、PERK、ATF6、ATF4、IRE1的mRNA转录水平,由图 10可知,与对照组相比,25.0 μg·mL-1 ZEA组CHOP、GRP78、PERK、ATF6、ATF4、IRE1 mRNA转录水平极显著上调(P < 0.01)。从mRNA转录水平表明ZEA能诱导发生内质网应激。
|
图 10 ZEA对DF-1细胞ERs相关基因mRNA转录水平的影响 Fig. 10 Effect of endoplasmic reticulum stress-related gene mRNA expression in DF-1 cells after incubation with ZEA |
人或畜禽通过饮食将ZEA摄入体内,会产生免疫毒性、生殖毒性、肠道毒性、肝肾毒性、细胞毒性、甚至致癌性,严重危害人类和畜禽健康,降低动物生产性能,带来不可估量的经济损失[16]。成纤维细胞代谢旺盛、增殖能力强,具有合成和分泌蛋白质的功能[17]。而DF-1是一种鸡的典型成纤维细胞模型,常用来研究鸡细胞的功能和变化,因此,本试验以DF-1为模型研究ZEA的毒性作用机制。
乳酸脱氢酶(LDH)是细胞内一种稳定的酶,LDH的释放是检测细胞毒性和细胞膜完整性的重要指标,当细胞凋亡时会破坏细胞膜结构从而导致细胞质内的LDH释放到培养液中[18]。本研究通过细胞活力及LDH的检测表明ZEA对DF-1细胞产生毒性作用,并抑制DF-1细胞的活力。与此一致,陈新亮[19]研究发现,ZEA使MODE-K细胞膜发生脂质氧化,细胞破损,使细胞内的LDH活性显著升高。
活性氧(ROS)是氧化应激反应中的重要信号分子,ROS的过度积累可破坏细胞内稳态,导致线粒体功能障碍,直接或间接(或同时)影响内质网稳态和蛋白质折叠[20]。大量体外研究表明,ZEA通过ROS的产生诱导细胞毒性,导致脂质过氧化、DNA损伤和细胞凋亡[21]。线粒体是细胞的发电站,消耗氧气以产生足够的能量来维持正常的细胞过程,其电位变化可以反映出细胞的状态。此外,线粒体膜电位是检测细胞凋亡早期的重要标志,也是检测细胞凋亡早期阶段的方式之一[22]。张心怡等[23]研究发现,ZEA处理小鼠T淋巴细胞可以提高细胞内活性氧的水平,同时降低T淋巴细胞线粒体膜电位。本研究使用25.0 μg·mL-1 ZEA处理DF-1细胞24 h后,与对照组相比,ZEA组ROS显著升高,线粒体膜电位降低,引起线粒体损伤。与张心怡等[23]研究结果一致,这一结果也表明ZEA对多种类型细胞具有毒性作用。
内质网在蛋白质折叠、蛋白质运输和细胞内Ca2+调控中发挥重要作用,内质网生理功能的损伤,如未折叠蛋白的积累、腔内钙稳态的紊乱和氧化应激会引发内质网应激(ERs),进而触发未折叠蛋白反应(UPR)[24]。UPR是一种适应性反应,通过激活3个近端传感器IRE1、ATF6和PERK来恢复内质网稳态。但是,如果内质网应激严重或延长,UPR通过激活下游效应因子,包括CHOP、JNK、Caspases和Bcl-2家族成员,从而导致细胞凋亡[25]。王宗捷等[26]研究发现,ZEA可以通过ERs通路调控山羊ESCs细胞的凋亡进程。在DF-1细胞中,作者发现ZEA处理细胞后,ERs相关基因CHOP、GRP78、PERK、ATF6、ATF4、IRE1 mRNA转录水平上调,表明该霉菌毒素诱导的内质网应激足以激活UPR的促凋亡通路。GRP78是ERs的标志物之一,GRP78上调表明ERs增加[27],而ATF6是GRP78的最佳表达伴侣[28]。有报道称其他霉菌毒素也会引起不同细胞的ERs,比如木霉菌素、HT-2毒素等[29-30]。说明诱导ERs可能是霉菌毒素毒性的一个共同特征。
由于ROS的增加,线粒体膜电位的降低和ERs的发生,试验进一步检测ZEA处理后DF-1细胞是否发生细胞凋亡。细胞凋亡是ZEA造成细胞毒性的重要途径,是细胞程序性死亡的过程,主要分为两类转导途径,1)线粒体或内质网参与的内源性途径,2)死亡受体介导的外源性途径[31]。本研究通过流式细胞术分析表明,ZEA处理后DF-1细胞凋亡率显著升高。Bcl-2家族蛋白分为促凋亡和抑凋亡两种,在细胞线粒体凋亡途径中至关重要[32]。接收到凋亡信号后,Bcl-2在线粒体外膜通过抑制细胞色素C的释放来抑制细胞凋亡,而Bax进入线粒体使线粒体膜通透性增加、去极化,释放细胞色素C,激活线粒体通路,导致细胞凋亡[33]。抑凋亡基因Bcl-2和促凋亡基因Bax的比例能决定细胞是否凋亡[34]。Caspase-3蛋白家族在凋亡的启动中十分重要,其中,Caspase-3是主要的启动子,它活化会使DNA断裂、染色质凝聚、最终生成凋亡小体[35]。本研究用ZEA处理DF-1细胞后上清中Caspase-3含量显著增加,抑凋亡基因Bcl-2的mRNA转录水平下调,Bax和Caspase-3 mRNA转录水平上调,这表明ZEA会导致DF-1细胞发生细胞凋亡。
4 结论ZEA主要通过内质网应激诱导细胞凋亡和激活细胞凋亡途径对DF-1细胞发挥毒性作用。本研究为深入探讨ZEA的毒性作用机制、与人畜疾病的确切关系及相关疾病治疗奠定基础。
| [1] |
闫昭明, 陈清华, 陈凤鸣. 玉米赤霉烯酮毒性研究[J]. 动物营养学报, 2018, 30(9): 3453-3458. YAN Z M, CHEN Q H, CHEN F M. Study on toxicity of zearalenone[J]. Chinese Journal of Animal Nutrition, 2018, 30(9): 3453-3458. DOI:10.3969/j.issn.1006-267x.2018.09.014 (in Chinese) |
| [2] |
LEE H J, RYU D. Worldwide occurrence of mycotoxins in cereals and cereal-derived food products: public health perspectives of their co-occurrence[J]. J Agric Food Chem, 2017, 65(33): 7034-7051. DOI:10.1021/acs.jafc.6b04847 |
| [3] |
黄俊恒, 黄广明. 2018年19省市饲料及饲料原料霉菌毒素污染状况分析[J]. 养猪, 2019(3): 6-8. HUANG J H, HUANG G M. Analysis on mycotoxin contamination of feed and feed materials in 19 provinces and cities in 2018[J]. Swine Prod, 2019(3): 6-8. DOI:10.3969/j.issn.1002-1957.2019.03.009 (in Chinese) |
| [4] |
BELHASSEN H, JIMÉNEZ-DÍAZ I, GHALI R, et al. Validation of a UHPLC-MS/MS method for quantification of zearalenone, α-zearalenol, β-zearalenol, α-zearalanol, β-zearalanol and zearalanone in human urine[J]. J Chromatogr B, 2014, 962: 68-74. DOI:10.1016/j.jchromb.2014.05.019 |
| [5] |
ZHENG W L, FENG N N, WANG Y, et al. Effects of zearalenone and its derivatives on the synthesis and secretion of mammalian sex steroid hormones: a review[J]. Food Chem Toxicol, 2019, 126: 262-276. DOI:10.1016/j.fct.2019.02.031 |
| [6] |
HAQUE A, WANG Y H, SHEN Z Q, et al. Mycotoxin contamination and control strategy in human, domestic animal and poultry: a review[J]. Microb Pathog, 2020, 142: 104095. DOI:10.1016/j.micpath.2020.104095 |
| [7] |
WANG Y L, ZHOU X Q, JIANG W D, et al. Effects of dietary zearalenone on oxidative stress, cell apoptosis, and tight junction in the intestine of juvenile grass carp (Ctenopharyngodon idella)[J]. Toxins, 2019, 11(6): 333. DOI:10.3390/toxins11060333 |
| [8] |
梁梓森, 马勇江, 刘长永, 等. 玉米赤霉烯酮对小鼠肝脏及肾脏的毒性作用[J]. 中国兽医学报, 2010, 30(5): 673-676. LIANG Z S, MA Y J, LIU C Y, et al. In vivo toxicity of zearalenone on liver and kidney in mice[J]. Chinese Journal of Veterinary Science, 2010, 30(5): 673-676. (in Chinese) |
| [9] |
BULGARU C V, MARIN D E, PISTOL G C, et al. Zearalenone and the immune response[J]. Toxins, 2021, 13(4): 248. DOI:10.3390/toxins13040248 |
| [10] |
李欣虹, 郑若愚, 辜彦霏, 等. 玉米赤霉烯酮对体外培养鸡脾脏淋巴细胞凋亡的影响[J]. 动物营养学报, 2018, 30(8): 3285-3292. LI X H, ZHENG R Y, GU Y F, et al. Effects of zearalenone on apoptosis of chicken splenic lymphocytes in vitro[J]. Chinese Journal of Animal Nutrition, 2018, 30(8): 3285-3292. DOI:10.3969/j.issn.1006-267x.2018.08.048 (in Chinese) |
| [11] |
CAI G D, SI M X, LI X, et al. Zearalenone induces apoptosis of rat Sertoli cells through Fas-Fas ligand and mitochondrial pathway[J]. Environ Toxicol, 2019, 34(4): 424-433. DOI:10.1002/tox.22696 |
| [12] |
裴亚萍, 赵瑾, 孙娜, 等. 咖啡酸对玉米赤霉烯酮诱导小鼠卵巢颗粒细胞凋亡的保护作用[J]. 畜牧兽医学报, 2020, 51(12): 3068-3075. PEI Y P, ZHAO J, SUN N, et al. The effect of caffeic acid on zearalenone-induced ovarian granulosa cell apoptosis in mice[J]. Acta Veterinaria et Zootechnica Scinia, 2020, 51(12): 3068-3075. DOI:10.11843/j.issn.0366-6964.2020.12.016 (in Chinese) |
| [13] |
WANG X, YU H, FANG H T, et al. Transcriptional profiling of zearalenone-induced inhibition of IPEC-J2 cell proliferation[J]. Toxicon, 2019, 172: 8-14. DOI:10.1016/j.toxicon.2019.10.004 |
| [14] |
WANG Y J, ZHENG W L, BIAN X J, et al. Zearalenone induces apoptosis and cytoprotective autophagy in primary Leydig cells[J]. Toxicol Lett, 2014, 226(2): 182-191. DOI:10.1016/j.toxlet.2014.02.003 |
| [15] |
杨桂然, 王福科, 李彦林. 成纤维细胞的生物学特性及分化潜能[J]. 中国组织工程研究, 2020, 24(13): 2114-2119. YANG G R, WANG F K, LI Y L. Biological characteristics and differentiation potential of fibroblasts[J]. Chinese Journal of Tissue Engineering Research, 2020, 24(13): 2114-2119. DOI:10.3969/j.issn.2095-4344.2052 (in Chinese) |
| [16] |
许巧. 镰刀菌毒素对动物毒性作用的研究进展[J]. 中国畜牧杂志, 2021, 57(4): 61-67. XU Q. Research progress on toxicity of fusarium mycotoxins in animals[J]. Chinese Journal of Animal Science, 2021, 57(4): 61-67. (in Chinese) |
| [17] |
LYNCH M D, WATT F M. Fibroblast heterogeneity: implications for human disease[J]. J Clin Invest, 2018, 128(1): 26-35. DOI:10.1172/JCI93555 |
| [18] |
FANTIN V R, ST-PIERRE J, LEDER P. Attenuation of LDH-A expression uncovers a link between glycolysis, mitochondrial physiology, and tumor maintenance[J]. Cancer Cell, 2006, 9(6): 425-434. DOI:10.1016/j.ccr.2006.04.023 |
| [19] |
陈新亮. 原花青素对玉米赤霉烯酮致MODE-K细胞氧化损伤及内质网应激凋亡保护作用研究[D]. 沈阳: 沈阳农业大学, 2018. CHEN X L. Protective effect of proanthocyanidins on the oxidative damage and apoptosis of endoplasmic reticulum stress of MODE-K cells induced by zearalenone[D]. Shenyang: Shenyang Agricultural University, 2018. (in Chinese) |
| [20] |
ZOROV D B, JUHASZOVA M, SOLLOTT S J. Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release[J]. Physiol Rev, 2014, 94(3): 909-950. DOI:10.1152/physrev.00026.2013 |
| [21] |
HASSEN W, AYED-BOUSSEMA I, OSCOZ A A, et al. The role of oxidative stress in zearalenone-mediated toxicity in Hep G2 cells: oxidative DNA damage, gluthatione depletion and stress proteins induction[J]. Toxicology, 2007, 232(3): 294-302. DOI:10.1016/j.tox.2007.01.015 |
| [22] |
SINHA K, DAS J, PAL P B, et al. Oxidative stress: the mitochondria-dependent and mitochondria-independent pathways of apoptosis[J]. Arch Toxicol, 2013, 87(7): 1157-1180. DOI:10.1007/s00204-013-1034-4 |
| [23] |
张心怡, 吴云平, 蔡国栋, 等. 玉米赤霉烯酮对小鼠T淋巴细胞活性氧及线粒体膜电位的影响[J]. 畜牧与兽医, 2018, 50(8): 90-94. ZHANG X Y, WU Y P, CAI G D, et al. Effects of ZEA on reactive oxygen species and mitochondrial membrane potential in T lymphocytes of mice[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(8): 90-94. (in Chinese) |
| [24] |
RON D, WALTER P. Signal integration in the endoplasmic reticulum unfolded protein response[J]. Nat Rev Mol Cell Biol, 2007, 8(7): 519-529. DOI:10.1038/nrm2199 |
| [25] |
COLEMAN O I, HALLER D. ER stress and the UPR in shaping intestinal tissue homeostasis and immunity[J]. Front Immunol, 2019, 10: 2825. DOI:10.3389/fimmu.2019.02825 |
| [26] |
王宗捷, 张瑞雪, 刘守勤, 等. 玉米赤霉烯酮诱导山羊子宫内膜基质细胞凋亡的研究[J]. 畜牧兽医学报, 2021, 52(2): 535-542. WANG Z J, ZHANG R X, LIU S Q, et al. The apoptotic effect of zearalenone on goat endometrial stromal cells[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(2): 535-542. (in Chinese) |
| [27] |
PARK S W, OZCAN U. Potential for therapeutic manipulation of the UPR in disease[J]. Semin Immunopathol, 2013, 35(3): 351-373. DOI:10.1007/s00281-013-0370-z |
| [28] |
BAUMEISTER P, LUO S Z, SKARNES W C, et al. Endoplasmic reticulum stress induction of the Grp78/BiP promoter: activating mechanisms mediated by YY1 and its interactive chromatin modifiers[J]. Mol Cell Biol, 2005, 25(11): 4529-4540. DOI:10.1128/MCB.25.11.4529-4540.2005 |
| [29] |
杨方晓, 李莲, 赵若含, 等. 褪黑素对HT-2毒素诱导的牛卵巢颗粒细胞内质网应激与自噬的影响[J]. 南京农业大学学报, 2020, 43(1): 143-150. YANG F X, LI L, ZHAO R H, et al. Effects of melatonin on endoplasmic reticulum stress and autophagy in bovine ovarian granulosa cells induced by HT-2 toxin[J]. Journal of Nanjing Agricultural University, 2020, 43(1): 143-150. (in Chinese) |
| [30] |
SU C M, WANG S W, LEE T H, et al. Trichodermin induces cell apoptosis through mitochondrial dysfunction and endoplasmic reticulum stress in human chondrosarcoma cells[J]. Toxicol Appl Pharmacol, 2013, 272(2): 335-344. DOI:10.1016/j.taap.2013.06.010 |
| [31] |
GAN Z, JIANG K F, WU H C, et al. Polydatin reduces Staphylococcus aureus lipoteichoic acid-induced injury by attenuating reactive oxygen species generation and TLR2-NFκB signalling[J]. J Cell Mol Med, 2017, 21(11): 2796-2808. DOI:10.1111/jcmm.13194 |
| [32] |
PEÑA-BLANCO A, GARCÍA-SÁEZ A G. Bax, Bak and beyond — mitochondrial performance in apoptosis[J]. FEBS J, 2018, 285(3): 416-431. DOI:10.1111/febs.14186 |
| [33] |
NAIM S, KAUFMANN T. The multifaceted roles of the BCL-2 family member BOK[J]. Front Cell Dev Biol, 2020, 8: 574338. DOI:10.3389/fcell.2020.574338 |
| [34] |
VARDIYAN R, EZATI D, ANVARI M, et al. Effect of L-carnitine on the expression of the apoptotic genes Bcl-2 and Bax[J]. Clin Exp Reprod Med, 2020, 47(3): 155-160. DOI:10.5653/cerm.2019.03440 |
| [35] |
SURESH K, CARINO K, JOHNSTON L, et al. A nonapoptotic endothelial barrier-protective role for caspase-3[J]. Am J Physiol-Lung Cell Mol Physiol, 2019, 316(6): L1118-L1126. DOI:10.1152/ajplung.00487.2018 |
(编辑 白永平)



