2. 西南大学医学研究院免疫学研究中心,重庆 402460;
3. 国家生猪技术创新中心,重庆 402460
2. Imunology Research Center, Medical Research Institute, Southwest University, Chongqing 402460, China;
3. National Center to Technology Innovation for Pigs, Changqing 402460, China
自2008年Overhage等[1]首次报道人源抗菌肽LL-37能抑制细菌生物被膜形成以来,陆续发现一些抗菌肽具有杀灭生物被膜细菌、干扰胞外基质(extracellular polymeric substance,EPS)产生和稳定性、抑制群体感应(quorum sensing,QS)依赖性生物被膜形成等活性,将这些具有抗生物被膜活性的抗菌肽称之为抗生物被膜肽(anti-biofilm peptides)[2-3]。抗生物被膜肽因其独特的作用机制、良好的EPS渗透性和低诱导耐药等特性有望成为控制生物被膜感染的有力武器,但是潜在的细胞毒性、溶血性、稳定性等问题亟待解决[2, 4]。
CRAMP是在小鼠髓系细胞中被发现的第一个抗菌肽[5],其结构和功能与LL-37极为相似[6],其Gly16到Leu33的两亲性α螺旋区域在跨脂质双分子层及其抗菌活性中起着重要作用,基于这种结构可以开发出具有强抗菌活性、无溶血作用的新型抗菌肽[7]。前期作者对13种具有潜在抗生物被膜活性的抗菌肽进行系统研究,发现仅有CRAMP对铜绿假单胞菌(Pseudomonas aeruginosa,P. aeruginosa)标准株,P. aeruginosa 27853成熟生物被膜有显著清除作用,清除率达50%[8]。后又发现CRAMP联用部分抗生素抑制P. aeruginosa生物被膜的形成有明显的协同作用,且对QS系统相关基因表达有明显的影响,抗菌肽CRAMP亦称为抗生物被膜肽[9]。近期,作者对其进行了结构修饰,利用转录组学方法初步探究了CRAMP干预P. aeruginosa成熟生物被膜的作用机制[10]。本文主要对该修饰肽的安全性、稳定性及其对铜绿假单胞菌野生株PAO1成熟生物被膜的清除作用进一步考察。
1 材料与方法 1.1 菌株和药品铜绿假单胞菌PAO1野生株购自中国普通微生物菌种保藏管理中心。CRAMP和LL-37由苏州强耀生物科技有限公司合成,CRAMP的合成和修饰详见国家发明专利(201810701474.7)。恩诺沙星(enrofloxacin,ENR)含量为98.9%;乳酸环丙沙星(ciprofloxacin lactate,CIP)含量为93.4%,硫酸庆大霉素(gentamicinsulfate,GM)含量为620 IU·mg-1,购自上虞京新药业有限公司;LDH Cytotoxicity Assay Kit试剂盒购自英国Cayman Chemical公司。
1.2 主要试剂小鼠腹腔巨噬细胞RAW264.7、胃蛋白酶、木瓜蛋白酶、胰蛋白酶均购自索莱宝生物科技有限公司。MHB、TSA培养基等购自青岛海博生物技术有限公司。1%结晶紫、Triton X-100购自北京索莱宝科技有限公司。96孔细胞培养板(3599)、6孔细胞培养板(3516)购自美国康宁公司。Lab-TekTMⅡ腔室盖玻片、FilmTracerTM LIVE/DEAD Biofilm Viability Kit购自赛默飞世尔科技(中国)有限公司。
1.3 溶血率检测参考Mohanram和Bhattachariya[11]的试验方法并改进,采集新鲜兔血制备4%的红细胞悬液,取100 μL红细胞悬液和100 μL CRAMP等体积混合,CRAMP终浓度为500、250、125、62.5、31.25、15.625、7.812和3.906 mg·L-1,设置阴性对照组(PBS缓冲液),阳性对照组(1%Triton X-100);37 ℃恒温培养1 h,4 ℃离心(1 000 r·min-1 5 min),取100 μL的上清液,测OD570 nm值。溶血率的计算公式:
| $ \text { ( } \mathrm{AE}-\mathrm{A} \text { 阴性) } / \text { ( A 阳性 }-\mathrm{A} \text { 阴性 }) \times 100 \% $ |
AE:CRAMP组的OD值;A阴性:阴性对照PBS缓冲液组OD值;A阳性:阳性对照1%Triton X-100组OD值。试验独立重复3次,下同。
1.4 细胞毒性检测参考Kumar等[12]的试验方法以及LDH Cytotoxicity Assay Kit试剂盒说明书进行试验,先将小鼠腹腔巨噬细胞RAW264.7接种于96孔细胞培养板,每孔100 μL,37 ℃ 5% CO2细胞培养箱中培养14 h,加DMEM为背景对照;再在每孔加20 μL CRAMP溶液,使终浓度为500、250、125、62.5 mg·L-1,设置阴性对照组(DMEM培养基)、阳性对照组(1%Triton X-100),37 ℃培养箱培养1 h,取100 μL上清液,加入至新的96孔板中,加100 μL LDH反应液,37 ℃振荡培养30 min,用酶标仪测OD490 nm。LDH释放率的计算公式:
| $ \mathrm{LDH}$ 释放率 $(\%)=\left(\mathrm{OD}_{\text {test }}-\mathrm{OD}_{\text {blank }}\right) /\left(\mathrm{OD}_{\text {positive }}-\right.\left(\mathrm{OD}_{\text {blank }}\right) \times 100 $ |
ODtest:CRAMP组的OD值;ODpositive:Triton X-100阳性对照组(最大释放量);ODblank:DMEM培养基阴性对照组(自然释放量)。
1.5 热处理对CRAMP抗菌活性的影响参考Thery等[13]的方法,将浓度为2 000 mg·L-1的CRAMP在25、50、75、100 ℃的恒温水浴锅中保温30 min,未经处理的CRAMP为对照组,分别测定不同温度处理后CRAMP的MIC。
1.6 盐离子对CRAMP抗菌活性的影响参考Sun等[14]报道的方法,配制浓度为50~250 mmol·L-1的NaCl和KCl溶液,分别与2 000 mg·L-1的CRAMP等体积混合,未经盐离子处理的CRAMP为对照组,测定不同盐离子处理后CRAMP的MIC,分析盐离子处理对CRAMP抑菌活性的影响。
1.7 蛋白酶对CRAMP抗菌活性的影响参考Kim等[15]报道的方法,按照3种酶(胃蛋白酶、木瓜蛋白酶、胰蛋白酶)说明书配制储备液。取2 000 mg·L-1的CRAMP溶液分别加入3种不同的酶,使酶的反应终浓度为1 000 mg·L-1,在37 ℃恒温水浴锅中加热30 min,未经酶处理的CRAMP为对照组,测定不同酶处理后CRAMP的MIC,分析酶处理对CRAMP抑菌活性的影响。
1.8 不同pH对CRAMP稳定性的影响参考Wu等[16]报道的方法,将CRAMP溶液调pH为3、4、5、6、7、8、9和10,高压灭菌(121 ℃ 30 min)后备用,分别配制8个pH条件下的初浓度为2 000 mg·L-1的CRAMP,未经pH调整处理的CRAMP为对照组,测定不同pH调整处理后CRAMP的MIC,分析不同pH值对CRAMP抑菌活性的影响。
1.9 CRAMP对PAO1成熟生物被膜的影响参考课题组之前报道的方法[10],将PAO1菌株隔夜培养,调整OD600 nm=0.1,并稀释100倍,作为工作菌液。将1.2 mL工作菌液加入6孔细胞板中,37 ℃培养24 h,形成成熟生物被膜。弃去培养基,用PBS缓冲液洗净浮游菌,加入前期试验中筛选出的最佳作用浓度,即4倍MIC的CRAMP干预1 h后进行后续试验,同法设置LL-37和3种抗菌药(乳酸环丙沙星、恩诺沙星、硫酸庆大霉素)为对照。
参考课题组之前报道的方法考察生物被膜量和生物被膜活菌数[10]。用PBS缓冲液洗涤生物被膜3次。加入甲醇固定10 min。吸净甲醇,待甲醇挥发后加入结晶紫溶液染色20 min。洗涤生物被膜后加入醋酸溶液溶解生物被膜,在630 nm处测定OD值,检测生物被膜量(Biomass)。同法洗涤生物被膜,加入Triton,吹打混匀,充分破坏生物被膜,进行10倍梯度稀释。最后取100 μL涂布于TSA板上进行生物被膜活菌计数(lg CFU·mL-1)。
1.10 胞外基质(EPS)的检测参考陈园园和彭党聪[17]报道的方法进行EPS提取与定量,将生物被膜样品中加入PBS溶液重悬至8 mL,80 ℃ 800 r·min-1下,反应1 h,高速冷冻离心机(4 ℃)离心10 min,10 000 r·min-1,上清液用0.22 μm滤膜过滤后得EPS样品溶液。EPS组分中的多糖采用苯酚-硫酸比色法测定,以葡萄糖配制标准溶液(20、25、30、35、40 mg·L-1) 并绘制标准曲线;蛋白质采用Folin-酚试剂法测定,以牛蛋白血清配制标准溶液(50、100、150、200、250 mg·L-1) 并绘制标准曲线;两者之和为EPS总量。
1.11 激光共聚焦扫描显微镜(CLSM)表征生物被膜形态参考课题组之前报道的方法[10],用MHB培养基培养铜绿假单胞菌过夜,调整其OD600 nm=0.1。将500 μL的菌悬液加入Lab-TekTMⅡ腔室盖玻片中。在37 ℃恒温培养箱中静置培养5 d,每隔24 h更换MHB培养基,加入等量的新鲜MHB肉汤。培养5 d后,吸净培养基并用0.9% NaCl溶液洗去未附着的细菌。加入500 μL的药液干预1 h,洗涤生物被膜2次,在暗室中用FilmtracerTM LIVE/DEADTM Biofilm Viability Kit[终浓度为5 μmol·L-1 SYTO和30 μmol·L-1 propidium iodide(PI)]染色20 min。用灭菌水洗去多余的染料,在Zeiss-800共聚焦激光显微镜10倍物镜和63倍物镜下观察生物被膜。激发波长分别为488 nm(SYTO)和561 nm(PI),发射波长分别为450~560 nm(SYTO)和400~700 nm(PI)。独立重复3次试验,空白组、药物组每次均平行操作3个以上技术性重复。在10倍物镜下随机选取视野,并进行Z-stack,每个组合计不少于18个视野,最后进行荧光强度统计分析。
1.12 统计学处理数据采用SPSS 22.0统计软件,数据以“x±s”表示,采用One-way ANOVA分析,并用Duncan比较各数据间的差异。P<0.05视为两组数据间存在显著性差异。
2 结果 2.1 对PAO1的最小抑菌浓度(MIC)CRAMP及对照药物对PAO1的MIC结果见表 1。结果显示,CRAMP和LL-37对PAO1的MIC值均为15.625 mg·L-1,对PAO1浮游菌的抗菌效果明显低于恩诺沙星、环丙沙星和庆大霉素。
|
|
表 1 CRAMP及对照药物对PAO1的MIC Table 1 MIC of CRAMP and control drugs on PAO1 |
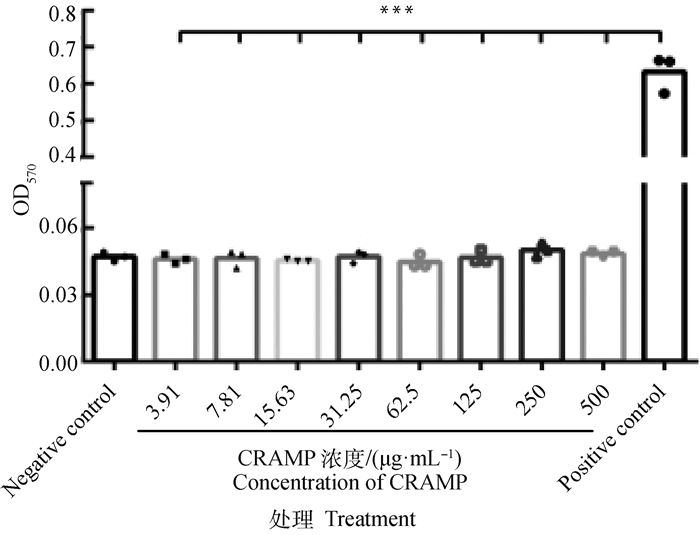
CRAMP对兔红细胞的溶血性如图 1所示。所有受试浓度CRAMP的溶血性检测的OD值与阴性对照组(PBS缓冲液)无差异显著性(P>0.05),均极显著低于阳性对照组(1%Triton X-100)(P<0.001)。经计算所有受试浓度的CRAMP的溶血率均小于1.5%,即未呈现溶血性。
|
试验组与阴性或阳性对照比较,*.P<0.05,**.P<0.01,***.P<0.001;数据均为“平均值±标准差”,下图同 Compared with negative or positive controls, *.P < 0.05, **. P < 0.01, ***.P < 0.001; the data are mean ± standard deviation, the following figure is the same 图 1 CRAMP的溶血性 Fig. 1 Hemolysis of CRAMP |
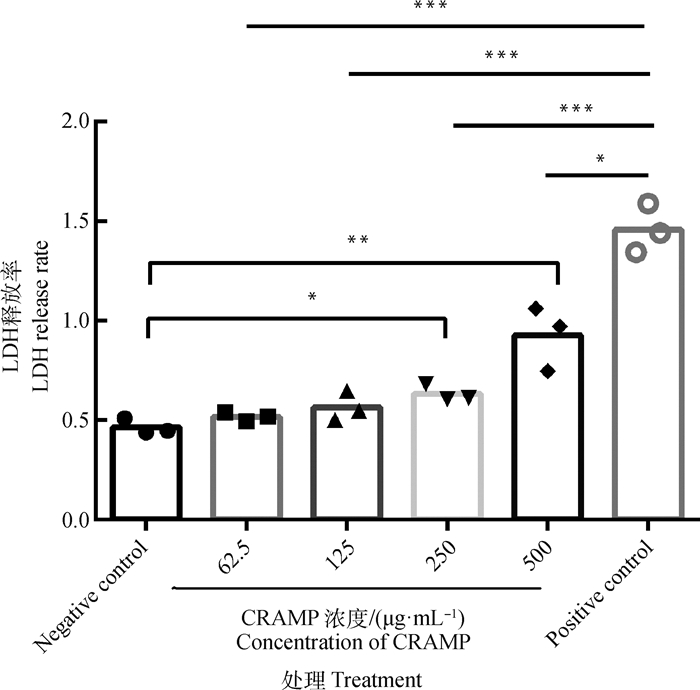
CRAMP作用于小鼠腹腔巨噬细胞RAW264.7后的LDH释放率如图 2所示。随着CRAMP浓度的增加,RAW264.7细胞LDH释放率呈上升趋势。CRAMP组的LDH释放率与阴性对照组相比,在62.5、125 mg·L-1浓度时无显著性差异,但250和500 mg·L-1均有差异显著性。所有测试浓度均显著低于阳性对照组的LDH释放率。表明当CRAMP浓度高于250 mg·L-1时,随着浓度增加,对小鼠腹腔巨噬细胞RAW264.7的毒性逐步增大,但在62.5、125 mg·L-1时无细胞毒性。
|
图 2 CRAMP对RAW264.7细胞LDH释放率的影响 Fig. 2 Effect of CRAMP on the release rate of lactate dehydrogenase (LDH) in RAW264.7 cells |
CRAMP在25、50、75、100 ℃水浴加热30 min后,对PAO1的MIC值如表 2所示。与对照组相比较,CRAMP经过高温加热后,25~75 ℃的MIC值仍为15.625 mg·L-1,100 ℃时MIC增大至下一个浓度梯度。说明CRAMP具有较高的热稳定性。
|
|
表 2 温度对CRAMP抗菌活性的影响 Table 2 The influence of temperature on the antibacterial activity of CRAMP |
CRAMP经过Na+、K+离子的5种浓度(50~250 mmol·L-1)处理后对PAO1的MIC值如表 3所示。两种离子的所有测试浓度处理CRAMP后对PAO1的MIC值均未发生变化。
|
|
表 3 盐离子对CRAMP抗菌活性的影响 Table 3 The influence of saline ions on CRAMP antibacterial activity |
CRAMP经过3种不同的蛋白酶(胃蛋白酶、木瓜蛋白酶、胰蛋白酶)处理后对PAO1的MIC值如表 4所示。胃蛋白酶处理后,CRAMP的MIC上升为125 mg·L-1(即8MIC),但仍具有一定的抗菌活性;木瓜蛋白酶和胰蛋白酶对CRAMP的抑菌活性影响最大,MIC已经分别上升至500 mg·L-1和大于500 mg·L-1,此时的CRAMP几乎没有抑菌活性。
|
|
表 4 蛋白酶对CRAMP抗菌活性的影响 Table 4 Effect of protease on CRAMP antibacterial activity |
CRAMP经过不同的pH的酸碱处理后对PAO1的MIC值如表 5所示,在pH≥5的条件下,CRAMP的抗菌活性不受影响,在pH为3和4时,CRAMP的MIC分别为31.25和62.5 mg·L-1,降低了CRAMP的抗菌活性。
|
|
表 5 不同pH对CRAMP抗菌活性的影响 Table 5 The effect of pH on the antibacterial activity of CRAMP |
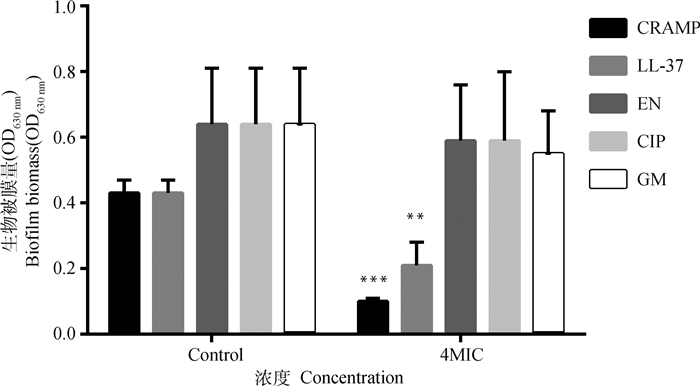
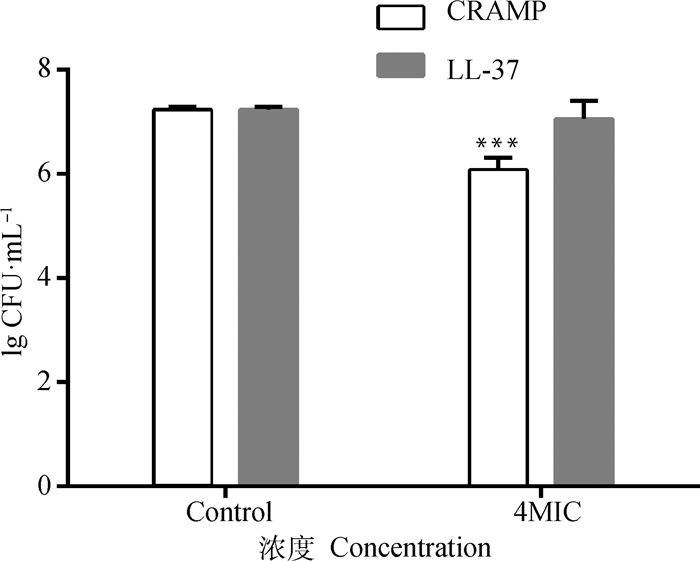
CRAMP(4MIC)组与空白对照孔比较,能有效减少生物被膜量(P<0.001,生物被膜量减少率为76.74%);LL-37(4MIC)组与空白对照孔比较,也能有效的减少生物被膜量(P<0.01,生物被膜量减少率为51.16%)。3种抗菌药物均未呈现显著性变化,初步表明该浓度下的3种抗菌药物(4MIC)对PAO1成熟生物被膜没有抑制作用,因此后续活菌计数仅在CRAMP和LL-37中开展。CRAMP组与空白对照孔比较,能极显著的减少PAO1生物被膜的活菌数量(P<0.001,减少了1.2个lg CFU·mL-1),而LL-37组与空白对照孔比较,生物被膜活菌数未见显著性变化(P>0.05)。结果详见图 3、4。
|
CRAMP. 抗菌肽CRAMP;LL-37. 抗菌肽LL-37;EN. 恩诺沙星;CIP. 乳酸环丙沙星;GM. 硫酸庆大霉素;与本试验组的空白对照孔比较,*.P<0.05, **.P<0.01, ***.P < 0.001。下同 CRAMP. Antimicrobial peptide CRAMP; LL-37. Antimicrobial peptide LL-37; EN. Enrofloxacin; CIP. ciprofloxacin lactate; GM. Gentamicin sulfate; compared with blank control well in the experimental group, *.P < 0.05, **.P < 0.01, ***.P < 0.001. The same as below 图 3 6孔细胞培养板中各试验组的生物被膜量 Fig. 3 Biofilm biomass in 6-well cell culture plate |
|
图 4 6孔细胞培养板中各试验的生物被膜活菌计数 Fig. 4 The number of viable bacteria in the biofilm in 6-well cell culture plate |
将EPS样品中的多糖和蛋白质含量合并,并将空白对照归一到1后进行统计学分析,CRAMP组与空白对照孔比较,EPS含量显著下降(P<0.05);LL-37与空白对照孔比较差异不显著(P>0.05);两试验组间比较,CRAMP组的EPS含量显著小于LL-37组(P<0.05),表明CRAMP(4MIC)能明显减少PAO1成熟生物被膜胞外基质的产生,效果优于LL-37。结果见表 6。
|
|
表 6 PAO1生物被膜的胞外基质的含量(x±s) Table 6 Exopolysaccharide content of PAO1 biofilms (x±s) |
通过对所有Z-stack的图像文件进行荧光强度统计学分析,CRAMP(4MIC)组与空白对照孔比较,能显著地减少细菌总荧光强度(SYTO和PI荧光强度合计,反映死菌活菌总量)(P<0.05,减少了42.41%),LL-37(4MIC)组与空白对照孔比较,差异不显著(P>0.05);且CRAMP(4MIC)组的细菌总荧光强度显著低于LL-37(4MIC)组(P<0.05)。结果表明,CRAMP对PAO1成熟生物被膜的死菌和活菌总量有显著清除作用,且效果优于LL-37。CRAMP(4MIC)组与空白对照孔比较,PI/SYTO(死菌荧光强度/活菌荧光强度)比值极显著增大(P<0.01),LL-37(4MIC)组与空白对照孔比较也存在差异显著性(P<0.01),但死菌的荧光强度较CRAMP组略低。进一步表明,CRAMP对PAO1成熟生物被膜具有明显的清除作用,对生物被膜活菌也有显著的抑杀作用,且效果优于LL-37,结果详见表 7。代表性的CLSM图见图 5。
|
|
表 7 CLSM的荧光强度分析(x±s) Table 7 The fluorescence intensity of CLSM (x±s) |

|
A. Control组的正交图;B. Control组3D图;C. CRAMP组的正交图;D. CRAMP组3D图;E. LL-37的正交图;F. LL-37组3D图 A. Orthogonal diagram of control group; B. 3D diagram of control group; C. Orthogonal diagram of CRAMP group; D. CRAMP group 3D diagram; E. Orthogonal graph of LL-37; F. LL-37 group 3D drawings 图 5 代表性的PAO1生物被膜CLSM图(10×物镜) Fig. 5 CLSM pictures of PAO1 biofilms (10×objective lens) |
我国从2020年开始在饲料中全面禁止添加抗生素,开发替代传统抗生素的安全、高效的新型抗菌剂已是全球性共识[18]。抗菌肽被广泛誉为抗生素替代品,但是当前限制抗菌肽临床应用的主要因素包括溶血性、细胞毒性以及不稳定性,在已发现的众多抗菌肽中,尽管有些具有较强的抑菌活性,但往往也具有较高的溶血性和较强的细胞毒性[19],通常情况下5%以下的家兔红细胞溶血率即可认为是无溶血性,本试验中所有测试浓度的CRAMP对兔红细胞的溶血率均未超过1.5%,表明所测试浓度的CRAMP对家兔红细胞未呈现溶血性,与文献报道具有一致性,如Gallo等[5]报道CRAMP在浓度为50 μmol·L-1(约194 mg·L-1)时对人和羊红细胞无溶血活性,CRAMP-18的类似物具有抗菌活性但没有溶血性[20]。CRAMP的低溶血性可能是因为具有最高疏水性水平的脂肪族和芳香族氨基酸异亮氨酸(Ile)和苯丙氨酸(Phe)有关[21]。另外,脯氨酸(Pro)和赖氨酸(Lys)的存在也能降低其溶血性[22-23]。另外,本试验中CRAMP浓度低于125 mg·L-1时对RAW264.7细胞无毒性,此浓度远高于最小抑菌浓度,当CRAMP在250 mg·L-1时出现了一定的细胞毒性。与文献报道也具有一致性,如李杨[24]报道20 mg·kg-1剂量的CRAMP经腹腔注射小鼠并不会对小鼠造成明显的毒性反应和器官损伤。Winderickx等[25]报道了CRAMP的衍生物对HepG2细胞没有毒性。Nagaram等[26]报道了抗菌肽MF18对RAW 264.7的细胞毒性以及人红细胞的溶血性,表现出低细胞毒性和溶血性,并分析该肽富含带正电荷的赖氨酸对细菌细胞膜具有很强的亲和力,因此降低了对真核细胞的毒性,CRAMP也富含大量的赖氨酸,因此推测其低细胞毒性与此相关。
高盐、高热等外界因素以及复杂的体内环境通常会影响抗菌肽的稳定性。作者发现,高盐、高热和高pH条件对CRAMP的抗菌活性均未产生明显影响,但是低pH(< 4),尤其是3种蛋白酶(胃蛋白酶、胰蛋白酶、木瓜蛋白酶)能明显降低CRAMP的抗菌活性。魏晓晓等[27]报道了75~100 ℃的高温、80~100 mmol·L-1的高浓度NaCl和pH4.0及pH10.0的高酸碱性对人工合成抗菌肽JH-3的抑菌活性没有明显的影响。Starr和Wimley[28]发现多种抗菌肽能被人红细胞蛋白酶降解,通常认为抗菌肽具有蛋白酶的酶切位点就容易被酶解失活。而将抗菌肽进行环化处理,可以形成限制性构象而增强与靶分子的结合性能和对受体的选择性,具有低毒、易于穿透细胞膜、抵抗外肽酶和内肽酶的水解等特点,较线性肽具有更多生物学活性和医药价值[29]。
总之,天然抗菌肽存在抗菌活性不高、会对宿主细胞产生一定的毒性和溶血性等缺陷,一定程度上阻碍了抗菌肽的临床应用,可采用改变其多肽链电荷量或疏水性的方式对天然抗菌肽进行分子改造,以获得具有良好抑菌活性、且细胞毒性较小的抗菌肽类似物[26]。本文采用的CRAMP(34个氨基酸)是在天然CRAMP(38个氨基酸)基础上修饰改造而得,提高了其安全性和稳定性,但是蛋白酶稳定性还有待改善,本课题组近期也成功设计合成了环状多肽Cyclic-CRAMP,另外采用纳米修饰等来提高CRAMP的蛋白酶稳定性,但其生物学活性还有待深入考察。
P. aeruginosa也称绿脓杆菌,是一种常见的人畜共患条件性致病菌[30-31]。近年来,随着全国各地养殖规模、饲养方式、畜禽贸易以及防制措施等方面的变化,铜绿假单胞菌病发病率显著上升,往往造成幼小畜禽的铜绿假单胞菌病大群暴发[32]。2017年,世界卫生组织将P. aeruginosa列为最严重威胁的12种细菌之一,并列为急需开发新型抗菌药物的病原体[33]。总之,该菌对大部分常见抗生素耐药,感染易反复发作, 难以清除,究其原因主要是极易形成生物被膜,因此也常作为生物被膜研究的模式菌株[33-35]。当前,已有大量围绕干预P. aeruginosa生物被膜的研究报道,为防控P. aeruginosa生物被膜感染奠定了坚实的基础,但是这些研究主要集中在抑制P. aeruginosa生物被膜的形成阶段。而随着生物被膜不断堆积,发育成具有典型蘑菇样结构的成熟生物被膜时,传统的抗生素很难渗透进入已经高度结构化的成熟生物被膜杀死生物被膜内细菌,即使能进入一部分,但对生物被膜内低生长率和低代谢活性的细菌,尤其是持留菌更是束手无策。但实际上在临床中,常常面临的是已经形成的生物被膜,即成熟生物被膜。因此,加速对成熟生物被膜清除的研究已经成为迫切需要解决的问题[30]。前期,作者通过96孔细胞板筛选发现CRAMP对于PAO1成熟生物被膜呈浓度依赖性抑制,在4MIC浓度,即62.5 mg·L-1时达到最高(抑制率56.56%)[10],本试验以1.2 mL的培养体系在6孔细胞板中建立24 h成熟生物被膜,并设置了4倍MIC的LL-37和3种抗菌药(乳酸环丙沙星、恩诺沙星、硫酸庆大霉素)为对照,结果显示,CRAMP能显著减少生物被膜量,减少率达76.74%,同时极显著地减少了PAO1生物被膜的活菌数量,减少了1.2个lg CFU·mL-1,即90%以上的生物被膜细菌被抑杀,表明CRAMP对PAO1成熟生物被膜具有明显的清除作用,效果优于LL-37和3种抗菌药。另外,CRAMP也能明显减少PAO1成熟生物被膜胞外基质的产生,效果也优于LL-37。
另外,本试验在前期试验基础上对激光共聚焦显微镜观察PAO1生物被膜时的染色条件进行了优化,并进行了3D结构重构,更加直观地反映出了生物被膜的厚度和整体密度。对多次独立重复的不同视野进行Z-stack扫描,并将扫描文件的荧光强度进行统计学分析后发现,CRAMP干预生物被膜后除了总荧光强度显著降低外,死菌的比例也显著升高了,进一步验证了CRAMP对PAO1成熟生物被膜具有明显的清除作用,对生物被膜活菌有显著的抑杀作用,且效果优于LL-37。与前面的生物被膜量和生物被膜活菌数的研究结果相吻合。
综上表明,CRAMP对临床控制P. aeruginosa生物被膜感染具有一定的指导意义,同时也为后续开展其作用机制研究奠定了坚实基础。
4 结论CRAMP具有低溶血性、低细胞毒性,除蛋白酶作用不稳定外,具有较好的稳定性,对PAO1成熟生物被膜具有明显的清除作用,且效果优于LL-37和常见的抗菌药。
| [1] |
OVERHAGE J, CAMPISANO A, BAINS M, et al. Human host defense peptide LL-37 prevents bacterial biofilm formation[J]. Infect Immun, 2008, 76(9): 4176-4182. DOI:10.1128/IAI.00318-08 |
| [2] |
BATONI G, MAISETTA G, ESIN S. Therapeutic potential of antimicrobial peptides in polymicrobial biofilm-associated infections[J]. Int J Mol Sci, 2021, 22(2): 482. DOI:10.3390/ijms22020482 |
| [3] |
张阳, 程鹏, 李晓芬, 等. 抗生物膜肽研究进展[J]. 生物技术通报, 2021, 37(2): 216-223. ZHANG Y, CHENG P, LI X F, et al. Research progress on anti-biofilm peptides[J]. Biotechnology Bulletin, 2021, 37(2): 216-223. (in Chinese) |
| [4] |
STARR C G, GHIMIRE J, GUHA S, et al. Synthetic molecular evolution of host cell-compatible, antimicrobial peptides effective against drug-resistant, biofilm-forming bacteria[J]. Proc Natl Acad Sci U S A, 2020, 117(15): 8437-8448. DOI:10.1073/pnas.1918427117 |
| [5] |
GALLO R L, KIM K J, BERNFIELD M, et al. Identification of CRAMP, a cathelin-related antimicrobial peptide expressed in the embryonic and adult mouse[J]. J Biol Chem, 1997, 272(20): 13088-13093. DOI:10.1074/jbc.272.20.13088 |
| [6] |
ZHOU Q L, PAN L L, XUE R C, et al. The anti-microbial peptide LL-37/CRAMP levels are associated with acute heart failure and can attenuate cardiac dysfunction in multiple preclinical models of heart failure[J]. Theranostics, 2020, 10(14): 6167-6181. DOI:10.7150/thno.46225 |
| [7] |
YU K, PARK K, KANG S W, et al. Solution structure of a cathelicidin-derived antimicrobial peptide, CRAMP as determined by NMR spectroscopy[J]. J Pept Res, 2002, 60(1): 1-9. |
| [8] |
CHEN H W, WUBBOLTS R W, HAAGSMAN H P, et al. Inhibition and eradication of Pseudomonas aeruginosa biofilms by host defence peptides[J]. Sci Rep, 2018, 8(1): 10446. DOI:10.1038/s41598-018-28842-8 |
| [9] |
ZHANG Y, HE X, CHENG P, et al. Effects of a novel anti-biofilm peptide CRAMP combined with antibiotics on the formation of Pseudomonas aeruginosa biofilms[J]. Microb Pathog, 2021, 152: 104660. DOI:10.1016/j.micpath.2020.104660 |
| [10] |
张阳, 程鹏, 熊静, 等. 基于RNA-Seq技术分析鼠源宿主防御肽对铜绿假单胞菌成熟生物被膜的清除作用[J]. 微生物学报, 2021, 61(9): 2843-2853. ZHANG Y, CHENG P, XIONG J, et al. Eradication effect of Pseudomonas aeruginosa biofilms by mouse host defense peptide based on RNA-Seq technology[J]. Acta Microbiologica Sinica, 2021, 61(9): 2843-2853. (in Chinese) |
| [11] |
MOHANRAM H, BHATTACHARJYA S. Resurrecting inactive antimicrobial peptides from the lipopolysaccharide trap[J]. Antimicrob Agents Chemother, 2014, 58(4): 1987-1996. DOI:10.1128/AAC.02321-13 |
| [12] |
KUMAR P, NAGARAJAN A, UCHIL P D. Analysis of cell viability by the lactate dehydrogenase assay[J]. Cold Spring Harb Protoc, 2018, 2018(6). DOI:10.1101/pdb.prot095497 |
| [13] |
THERY T, O'CALLAGHAN Y, O'BRIEN N, et al. Optimisation of the antifungal potency of the amidated peptide H-Orn-Orn-Trp-Trp-NH2 against food contaminants[J]. Int J Food Microbiol, 2018, 265: 40-48. DOI:10.1016/j.ijfoodmicro.2017.10.024 |
| [14] |
SUN C B, LI Y Y, CAO S S, et al. Antibacterial activity and mechanism of action of bovine lactoferricin derivatives with symmetrical amino acid sequences[J]. Int J Mol Sci, 2018, 19(10): 2951. DOI:10.3390/ijms19102951 |
| [15] |
KIM H, JANG J H, KIM S C, et al. De novo generation of short antimicrobial peptides with enhanced stability and cell specificity[J]. J Antimicrob Chemother, 2014, 69(1): 121-132. DOI:10.1093/jac/dkt322 |
| [16] |
WU G Q, DING J X, LI H, et al. Effects of cations and pH on antimicrobial activity of thanatin and s-thanatin against Escherichia coli ATCC25922 and B. subtilis ATCC 21332[J]. Curr Microbiol, 2008, 57(6): 552-557. DOI:10.1007/s00284-008-9241-6 |
| [17] |
陈园园, 彭党聪. 生物膜中EPS与微生物的分布及测定[J]. 中国给水排水, 2017, 33(15): 25-30, 35. CHEN Y Y, PENG D C. Distribution and determination of EPS and microorganisms in biofilm[J]. China Water & Wastewater, 2017, 33(15): 25-30, 35. (in Chinese) |
| [18] |
王安田, 黄靖, 宋炳晓, 等. 猪β防御素-2对猪链球菌感染小鼠的治疗效果评价[J]. 畜牧兽医学报, 2020, 51(12): 3160-3170. WANG A T, HUANG J, SONG B X, et al. Evaluation of therapeutic effect of porcine β-defensin-2 on Streptococcus suis infection[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(12): 3160-3170. DOI:10.11843/j.issn.0366-6964.2020.12.025 (in Chinese) |
| [19] |
杨磊, 杭柏林, 徐彦召, 等. 牛源抗菌肽BSN-37的生物活性[J]. 中国兽医学报, 2018, 38(11): 2088-2093. YANG L, HANG B L, XU Y Z. Biological activity of a novel bovine-born antimicrobial peptide BSN-37[J]. Chinese Journal of Veterinary Science, 2018, 38(11): 2088-2093. (in Chinese) |
| [20] |
SHIN S Y, KANG S W, LEE D G, et al. CRAMP analogues having potent antibiotic activity against bacterial, fungal, and tumor cells without hemolytic activity[J]. Biochem Biophys Res Commun, 2000, 275(3): 904-909. DOI:10.1006/bbrc.2000.3269 |
| [21] |
ABBASSI F, LEQUIN O, PIESSE C, et al. Temporin-SHf, a new type of phe-rich and hydrophobic ultrashort antimicrobial peptide[J]. J Biol Chem, 2010, 285(22): 16880-16892. DOI:10.1074/jbc.M109.097204 |
| [22] |
SUN T Y, ZHAN B, GAO Y Y. A novel cathelicidin from Bufo bufo gargarizans Cantor showed specific activity to its habitat bacteria[J]. Gene, 2015, 571(2): 172-177. DOI:10.1016/j.gene.2015.06.034 |
| [23] |
COSTA G A, ROSSATTO F C P, MEDEIROS A W, et al. Evaluation antibacterial and antibiofilm activity of the antimicrobial peptide P34 against Staphylococcus aureus and Enterococcus faecalis[J]. An Acad Bras Cienc, 2018, 90(1): 73-84. DOI:10.1590/0001-3765201820160131 |
| [24] |
李杨. Cathelicidin相关抗菌肽(CRAMP)在炎性肠病及哮喘小鼠模型中的免疫调控作用与机制[D]. 北京: 北京协和医学院, 2016. LI Y. The inmunomodulation effects and mechanisms of cathelicidin-related antimicrobial peptide (CRAMP) in mouse models of intestinal colitis and asthma[D]. Beijing: Peking Union Medical College, 2016. (in Chinese) |
| [25] |
WINDERICKX S, DE BRUCKER K, BIRD M J, et al. Structure-activity relationship study of the antimicrobial CRAMP-derived peptide CRAMP20-33[J]. Peptides, 2018, 109: 33-38. DOI:10.1016/j.peptides.2018.08.013 |
| [26] |
NAGARAM P, PASUPULETI M, AROCKIARAJ J. CxxC zinc finger protein derived peptide, MF18 functions against biofilm formation[J]. Protein J, 2020, 39(4): 337-349. DOI:10.1007/s10930-020-09904-1 |
| [27] |
魏晓晓, 杭柏林, 马翠, 等. 抗菌肽JH-3的抑菌活性及其稳定性分析[J]. 畜牧兽医学报, 2016, 47(2): 361-366. WEI X X, HANG B L, MA C, et al. Analysis of antimicrobial activity and stability of antibacterial peptide JH-3[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(2): 361-366. (in Chinese) |
| [28] |
STARR C G, WIMLEY W C. Antimicrobial peptides are degraded by the cytosolic proteases of human erythrocytes[J]. Biochim Biophys Acta Biomembr, 2017, 1859(12): 2319-2326. DOI:10.1016/j.bbamem.2017.09.008 |
| [29] |
戈家傲, 刘畅, 龚建刚, 等. 抗菌环肽的研究进展[J]. 中国生物工程杂志, 2018, 38(11): 76-83. GE J A, LIU C, GONG J G. Research progress of antibacterial cyclopeptides[J]. China Biotechnology, 2018, 38(11): 76-83. (in Chinese) |
| [30] |
VINGOPOULOU E I, DELIS G A, BATZIAS G C, et al. Prevalence and mechanisms of resistance to fluoroquinolones in Pseudomonas aeruginosa and Escherichia coli isolates recovered from dogs suffering from otitis in Greece[J]. Vet Microbiol, 2018, 213: 102-107. DOI:10.1016/j.vetmic.2017.11.024 |
| [31] |
YAN S M, WU G. Can biofilm be reversed through quorum sensing in Pseudomonas aeruginosa?[J]. Front Microbiol, 2019, 10: 1582. DOI:10.3389/fmicb.2019.01582 |
| [32] |
李玲. 鸡铜绿假单胞菌的分离鉴定及生物学特性研究[D]. 保定: 河北农业大学, 2013. LI L. Isolation and identification and biological characteristics of pseudomonas aeruginosa isolted from chicken[D]. Baoding: Hebei Agricultural University, 2013. (in Chinese) |
| [33] |
AZAM M W, KHAN A U. Updates on the pathogenicity status of Pseudomonas aeruginosa[J]. Drug Discov Today, 2019, 24(1): 350-359. DOI:10.1016/j.drudis.2018.07.003 |
| [34] |
RUMBAUGH K P, SAUER K. Biofilm dispersion[J]. Nat Rev Microbiol, 2020, 18(10): 571-586. DOI:10.1038/s41579-020-0385-0 |
| [35] |
ZHAO K, TSENG B S, BECKERMAN B, et al. Psl trails guide exploration and microcolony formation in Pseudomonas aeruginosa biofilms[J]. Nature, 2013, 497(7449): 388-391. DOI:10.1038/nature12155 |
(编辑 白永平)



