细粒棘球绦虫(Echinococcus granulosus sensu lato)属于带科(Taeniidae)棘球属(Echinococcus),其中绦期幼虫寄生于人和多种动物的组织器官内时会引起囊型包虫病(cystic echinococcosis, CE)[1]。该病呈世界性分布,南美、东欧、中东、南非、亚洲以及地中海地区为主要流行区域,其中,中国也是全球范围内包虫病流行最为严重的国家之一,造成巨大的经济损失和公共卫生安全问题[2]。囊型包虫病的主要特征是在肝、肺等组织器官内形成多个大小不等的包囊,包囊由囊壁和囊液组成。囊壁包括内部的生发层(germinal layer)和外部的角质层(laminated layer)。此外,囊壁外还有一层致密的纤维组织层(adventitial layer)。包囊分为育囊和不育囊,育囊内含大量的原头蚴,不育囊内无原头蚴存在,因此不育囊不能感染终末宿主,但仍能对中间宿主组织器官造成严重损伤[3-4]。目前,不育囊的形成机制尚不明确,但有研究显示细胞凋亡可能与不育囊形成之间有着密切联系[5],因此,调控细胞凋亡的相关基因可能在此过程中起至关重要的作用。
BAG3属于Bcl-2结合抗凋亡基因(Bcl-2 associated athanogene,BAG)家族,该家族的成员均含有一个位于C端的BAG结构域,BAG蛋白通过该结构域可与热休克蛋白70(heat shock protein, HSP70)的ATP酶结构域结合,作为HSP70的共-分子伴侣从而发挥抗细胞凋亡的作用[6-7]。内吞蛋白B1(endophilin B1,EB1),又称作Bax蛋白互作因子1(Bax-interacting factor 1, Bif-1),为内吞蛋白家族(endophilin)的一员,广泛参与细胞凋亡、自噬、线粒体功能调控等细胞生理学过程,EB1蛋白作为Bax蛋白的激活因子,目前其促凋亡作用已被研究证实[8-9]。细粒棘球绦虫基因组中存在BAG3和EB1基因[10-11],但目前尚无细粒棘球绦虫BAG3和EB1基因功能的研究报道,二者在虫体细胞凋亡过程中是否具有调控作用也不清楚。为此,本研究通过克隆、表达了Eg-BAG3和Eg-EB1基因,对其蛋白分子特性及其在原头蚴细胞凋亡中的作用进行了探究,以期为细粒棘球蚴不育囊的形成机制提供参考资料。
1 材料与方法 1.1 主要试剂动物组织总RNA提取试剂盒、质粒小提试剂盒、DNA纯化回收试剂盒、大肠杆菌DH5α和BL21(DE3)感受态细胞购自北京天根生物科技有限公司;PrimeScriptTM Double Strand cDNA Synthesis Kit、pMD19-T载体、限制性内切酶(BamH Ⅰ、EcoR Ⅰ、Sac Ⅰ)及T4 DNA连接酶购自大连宝生物工程有限公司;TUNEL细胞凋亡检测试剂盒购自瑞士Roche公司;总蛋白提取试剂盒购自上海贝博生物科技公司;HRP Conjugated Goat Anti-rabbit IgG (H+L)及FITC Conjugated Goat Anti-rabbit IgG (H+L) 购自武汉博士德生物工程有限公司;RNA转染试剂EntransterTM-R4000、RPMI1640培养基及胎牛血清分别购自上海吉玛制药技术有限公司和美国Hyclone公司;pET-28a (+)、pET-32a (+)载体和弗氏(不)完全佐剂分别购自美国Invitrogen和Sigma公司;Ni2+亲和层析柱和HiTrap Protein A预装柱购自美国Bio-Rad公司。PCR引物合成及质粒测序交由上海生工生物工程有限公司完成,siRNA由上海吉玛公司合成。免疫印迹对照蛋白:西氏贝蛔虫(Baylisascaris schroederi)重组硫氧还蛋白过氧化物酶(rBs-Tpx)由四川农业大学动物寄生虫病研究中心提供。
1.2 动物伦理学声明本研究得到四川农业大学动物伦理委员会的审查和批准,所有实验动物的饲养及试验操作程序严格按照“四川农业大学动物伦理委员会实验动物护理指南”(SYXK2014-187,中国成都)的相关规定进行。
1.3 虫体、血清及动物细粒棘球蚴包囊采自四川某屠宰场自然感染囊型包虫病绵羊的肝或肺。在实验室无菌条件下利用无菌注射器抽出包囊液并于普通光学显微镜下进行镜检,根据是否含有原头蚴将包囊鉴定为育囊和不育囊,随后将从育囊中获得的囊液经4 000 r·min-1离心10 min,无菌PBS清洗3次后分离得到原头蚴。细粒棘球绦虫45日龄成虫由四川农业大学动物寄生虫病研究中心提供。绵羊阳性血清和阴性血清分别来自于自然感染细粒棘球蚴的绵羊和非包虫病流行区域的健康绵羊,二者通过尸体剖解确定。4只2.0~2.5 kg健康雄性新西兰兔购自成都达硕实验动物有限公司。
1.4 生物信息学分析通过NCBI数据库获得Eg-BAG3(登录号:XM_024490124.1)和Eg-EB1(登录号: CDS21096.1)基因的全长编码序列并对其进行生物信息学分析。利用Expasy(http://web.expasy.org/protparam/)预测蛋白基本理化性质,包括氨基酸数目、分子量和等电点;蛋白信号肽、跨膜区、亚细胞定位、结构域及二级结构分别利用SignalP-5.0(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)、TMHMM-2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)、WOLFPSORT(https://wolfpsort.hgc.jp/)、InterPro(http://www.ebi.ac.uk/interpro/search/sequence/)和SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html) 进行预测。此外,利用DNAMAN软件和MEGA软件(version 5.05)分别对Eg-BAG3、Eg-EB1及其同源基因进行多序列比对并采用邻接法(Neighbor-joining, NJ)构建系统进化树。
1.5 Eg-BAG3和Eg-EB1的克隆、表达与纯化利用动物组织RNA提取试剂盒提取原头蚴总RNA并反转录为cDNA,参考数据库中Eg-BAG3和Eg-EB1基因的全长编码序列设计特异性引物,其中Eg-BAG3上游和下游引物分别是5′-CGCGGATCCATGTCGGTGCCTCACGTT-3′(下划线为BamH Ⅰ酶切位点)和5′-CCGGAATTCCTAAGCATCGCTTTCCTTTG-3′ (下划线为EcoR Ⅰ酶切位点);Eg-EB1上游和下游引物分别是5′-CGCGGATCCATGAATTACTTGTTCATCGTTTTC-3′(下划线为BamH Ⅰ酶切位点)和5′-CGAGCTCCTACTCGCCCAGCATCATAC-3′ (下划线为Sac Ⅰ酶切位点),随后利用提取的原头蚴cDNA为模板进行PCR扩增,反应条件,95 ℃预变性4 min,95 ℃变性45 s,58 ℃退火1 min, 72 ℃延伸45 s,35个循环,72 ℃延伸10 min,4 ℃保存。PCR产物经胶回收后克隆导入pMD19-T载体并转入DH5α感受态细胞,挑取单个菌落,经PCR鉴定为阳性后提取质粒送上海生物工程有限公司测序。将构建成功的pMD19-T-Eg-BAG3及pMD19-T-Eg-EB1质粒双酶切回收后分别亚克隆入pET-28a (+)和pET-32a (+)载体中,随后将构建成功的pET-28a (+)-Eg-BAG3和pET-32a (+)-Eg-EB1转入大肠杆菌BL21(DE3)表达菌中,于37 ℃条件下加入IPTG诱导表达6 h,收集菌体并超声破碎菌体,离心后收集上清液及沉淀,二者均进行SDS-PAGE以验证重组蛋白的主要表达形式,随后利用Ni2+亲和层析柱纯化上清或者沉淀中的表达产物,12% SDS-PAGE验证蛋白表达及纯化效果。
1.6 多克隆抗体制备兔抗rEg-BAG3 IgG和兔抗rEg-EB1 IgG按照以下步骤制备:首次免疫时,将200 μg纯化后的重组蛋白利用等体积的完全弗氏佐剂充分乳化,然后以皮下注射方式对4只新西兰兔进行免疫,每种蛋白免疫2只。随后利用不完全弗氏佐剂和重组蛋白连续加强免疫3次,每次间隔一周,最后一次免疫一周后采血分离血清,并利用HiTrap Protein A预装柱纯化获得IgG。此外,免疫前对4只新西兰兔进行采血获得阴性血清。
1.7 免疫印迹利用贝博总蛋白提取试剂盒提取原头蚴总蛋白,制备12%SDS-PAGE电泳凝胶,对纯化的rEg-BAG3、rEg-EB1、西氏贝蛔虫重组硫氧还蛋白过氧化物酶(rBs-Tpx)及原头蚴总蛋白进行电泳后转至硝酸纤维素膜(NC膜)上,TBST洗膜3次(每次5 min)后加入5%脱脂奶粉室温封闭2 h,封闭完成后,加入绵羊阴性血清、绵羊阳性血清(1∶100稀释)、兔阴性血清、兔抗rEg-BAG3 IgG或兔抗rEg-EB1 IgG(1∶400稀释),4 ℃孵育过夜。TBST洗膜3次后加入HRP标记的兔抗绵羊IgG(1∶1 000稀释)或山羊抗兔IgG(1∶2 000稀释)室温孵育2 h,然后根据Metal Enhanced DAB Substrate Kit(20×)说明加入显色液避光显色至条带出现,加入双蒸水终止反应。
1.8 免疫荧光定位原头蚴、育囊、不育囊及45日龄成虫在4%多聚甲醛中固定24 h后,制成石蜡切片(5 μm),切片进行脱蜡复水后在0.01 mol·L-1枸橼酸缓冲液中95 ℃加热20 min进行抗原修复,随后在组织上滴加5%山羊血清并于37 ℃孵育1 h,对组织上的非特性位点进行封闭。在组织上滴加兔阴性血清、兔抗rEg-BAG3 IgG或兔抗rEg-EB1 IgG(1∶400稀释),于4 ℃孵育过夜。第二天经PBS清洗3次后加入FITC conjugated goat anti-rabbit IgG(H+L)(1∶2 000稀释) 避光孵育1 h,PBS清洗3次后加入DAPI染液染色3~5 min,再次清洗后滴加抗荧光淬灭封片剂封片,并利用荧光显微镜采集图像并拍照。
1.9 H2O2诱导原头蚴细胞凋亡及Eg-BAG3、Eg-EB1转录水平的变化将新鲜采集的原头蚴利用无菌PBS清洗3次后,利用0.4%台盼蓝染液进行染色,确保原头蚴存活率大于95%。随后,将原头蚴加入含10%胎牛血清、100 U·mL-1青霉素、100 μg·mL-1硫酸链霉素的RPMI1640培养基中重悬计数,调整数目为约3 000个·mL-1, 按照每孔3 mL原头蚴悬液接种于6孔细胞培养板并置于37 ℃、5% CO2的培养箱中培养24 h。原头蚴分为处理组(T group)和空白组(NC group),每组3个重复,24 h后处理组加入10 mmol·L-1 H2O2处理8 h,对照组加入等体积PBS, 以处理前作为0 h, 分别于处理后2、4、6及8 h收集原头蚴并通过光学显微镜和透射电子显微镜对原头蚴形态及超微结构进行观察,同时,利用qRT-PCR对Eg-BAG3和Eg-EB1的转录水平进行分析,以actin (NCBI登录号:XM_024497550.1)为内参基因[12],设计引物:Eg-BAG3上下游引物:5′-AGATGGTCAGGACAGCGTTC-3′和5′-GAGGTGTCTTCAACCGCATT-3′;Eg-EB1上下游引物:5′-GTATGGCCACTGCCAGAAAG-3′和5′-CTCCTCCAGCTTGGTCTTTG-3′;actin上下游引物: 5′-ATGGTTGGTATGGGACAAAAGG-3′和5′-TTCGTCACAATACCGTGCTC-3′。反应程序: 95 ℃预变性30 s;两步法扩增95 ℃ 5 s,56 ℃ 30 s,40个循环;熔解95 ℃ 5 s,56 ℃ 60 s,95 ℃ 1 s,反应结束后结果采用2-ΔΔCt法分析。
1.10 原头蚴Eg-BAG3和Eg-EB1基因RNA干扰分析为了进一步探究Eg-BAG3和Eg-EB1在调控H2O2诱导的原头蚴细胞凋亡中可能起到的作用,本研究首先通过siRNA转染原头蚴的方式抑制Eg-BAG3和Eg-EB1在原头蚴中的表达水平。根据Eg-BAG3和Eg-EB1基因序列,利用在线软件siRNA Target Finder针对两个基因序列的3个不同区域,分别设计出3对特异性的siRNA,同时设计1对与细粒棘球绦虫任何基因均无关的siRNA作为阴性对照。此外,每段引物的3′末端均添加TT以增强siRNA的稳定性,阴性对照siRNA的5′末端还添加FAM荧光标记,用于检测siRNA的转染效率,具体序列如表 1所示。将原头蚴分为8个组,分别是6个不同siRNA试验组、阴性对照组(siRNA-CON)以及空白对照组(不做任何处理),每组3个重复孔,每孔3 mL培养基,约含原头蚴4 000个。向500 pmol siRNA中加入25 μL RPMI1640培养基,制成siRNA稀释液,然后取10 μL转染试剂EntransterTM-R4000加入15 μL RPMI1640培养基,充分混匀,制成终体积为25 μL的转染试剂稀释液,将25 μL转染试剂稀释液和25 μL siRNA稀释液充分混匀后全部加入到含有2.45 mL完全培养基的原头蚴中,放于37 ℃、5% CO2培养箱中培养24 h,随后更换新的培养液按照上述步骤再次进行转染,24 h后在荧光显微镜下随机选取不同视野,分别计数其中带有和不带有荧光标记的原头蚴估算转染效率。离心收集虫体,提取虫体总RNA并合成cDNA,利用qRT-PCR对Eg-BAG3和Eg-EB1的转录水平进行分析从而筛选出干扰效率最高的siRNA。
|
|
表 1 siRNAs序列 Table 1 Sequences of siRNAs |
将干扰效率最高的siRNA处理后的原头蚴(BAG3-IG及EB1-IG)、未干扰组(NIG)原头蚴(仅转染siRNA-CON)利用10 mmol·L-1 H2O2于37 ℃、5% CO2的培养箱中作用8 h,空白对照组(NCG)原头蚴既不经siRNA处理,也不经H2O2处理,同样于37 ℃、5% CO2的培养箱中培养8 h,随后收集所有组的原头蚴并制作石蜡切片(4 μm)。根据dUTP缺口末端标记(terminal deoxynucleotidyl transferase dUTP nick end labelling, TUNEL)细胞凋亡检测试剂盒的说明对组织进行标记,并加入DAPI染液作用3~5 min对细胞核进行染色,PBS清洗后滴加抗荧光淬灭封片剂封片。随后在荧光显微镜下随机选取400倍镜下的3个视野对切片进行拍照,并应用Image-Pro Plus 6.0软件对细胞进行计数分析。其中绿色荧光细胞被判定为阳性细胞,蓝色荧光为DAPI染色后的细胞核,将每张照片的阳性细胞数和总细胞数进行计数后,按照阳性细胞数/总细胞数×100%计算出原头蚴细胞凋亡率。
1.11 统计学分析所有数据均表示为“x±s”,对于组间比较,使用SPSS 20.0软件并利用One-way ANOVA分析法进行统计分析,P < 0.05被认为具有统计学意义。
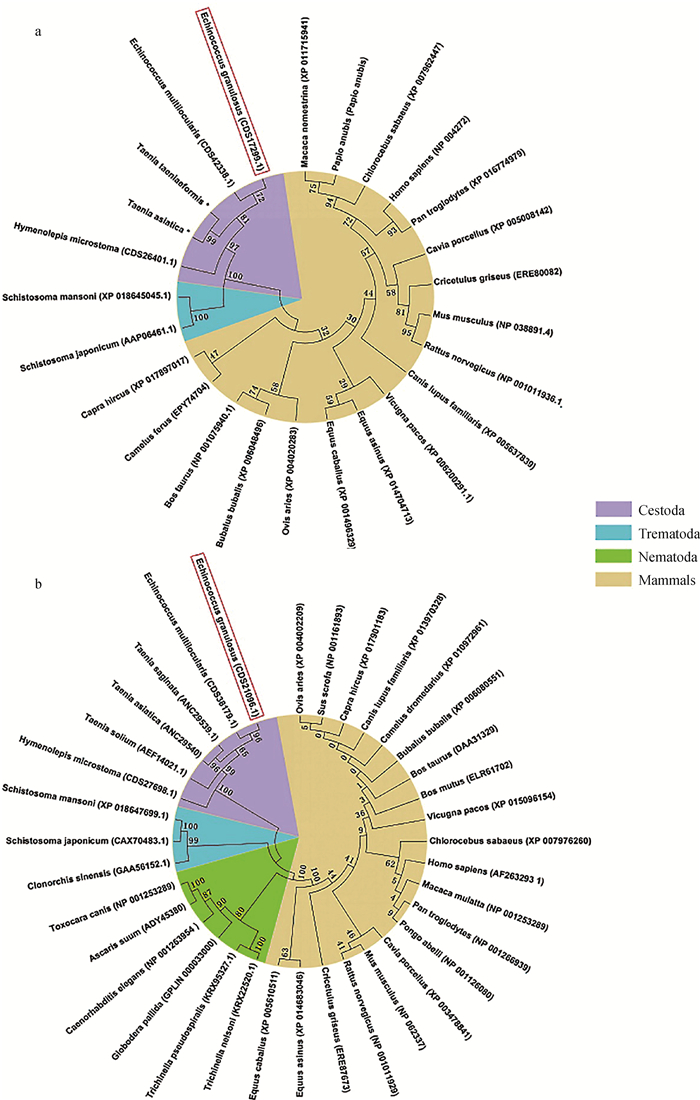
2 结果 2.1 Eg-BAG3和Eg-EB1的扩增与生物信息学分析Eg-BAG3和Eg-EB1基因编码序列全长分别为699和759 bp,无信号肽和跨膜区且主要分布于细胞质中。结构域预测显示Eg-BAG3有1个位于N端的WW结构域(aa 7―41)和1个位于C端的BAG结构域(aa 125―202),Eg-EB1有1个BAR(Bin/Amphiphysin/Rvs,BAR) 结构域(aa 19―252)。二级结构预测显示Eg-BAG3主要是无规则卷曲,其次是α螺旋和β折叠(图 1a),Eg-EB1二级结构则以α螺旋为主,无规则卷曲和β折叠则较少(图 1b)。通过与其他物种BAG3和EB1的氨基酸序列进行比对分析,结果显示,Eg-BAG3在不同物种之间具有较高的变异性,仅与多房棘球绦虫(E. multilocularis)BAG3的相似性最高(95.69%),而与其他绦虫如微口膜壳绦虫(Hymenolepis microstoma)BAG3的相似性较低,仅为49.16%,与日本血吸虫(Schistosoma japonicum)和曼氏血吸虫(S. mansoni)BAG3的相似性则更低,均小于30%(图 1a)。Eg-EB1在物种之间的保守性较高,尤其是绦虫,Eg-EB1与多房棘球绦虫(E. multilocularis)、亚洲带绦虫(Taenia asiatica)、牛带绦虫(T.saginata)、猪带绦虫(T. solium)EB1的相似性均高达70%以上,而与吸虫EB1的相似性相对较低(图 1b)。进化树结果显示,Eg-BAG3和Eg-EB1均与多房棘球绦虫(E. multilocularis)、亚洲带绦虫(T. asiatica)、微口膜壳绦虫(H. microstoma)的BAG3或EB1属于同一分支,具有较近的亲缘关系,而与其他吸虫、线虫或哺乳动物的BAG3或EB1亲缘关系较远(图 2)。

|
GenBank accession numbers: Echinococcus granulosus BAG3(CDS17299.1); Echinococcus multilocularis BAG3(CDS42338.1); Hymenolepis microstoma BAG3(CDS26401.1); Schistosoma mansoni BAG3 (XP_018645045.1); Schistosoma japonicum BAG3(AAP06461.1); Echinococcus granulosus EB1 (CDS21096.1); Echinococcus multilocularis EB1(CDS38179.1); Taenia asiatica EB1(ANC29539.1); Taenia saginata EB1(ANC29539.1); Taenia solium EB1(AEF14021.1); Hymenolepis microstoma EB1(CDS27698.1); Schistosoma mansoni EB1(XP_018647699.1); Schistosoma japonicum EB1(CAX70483.1); Clonorchis sinensis EB1(GAA56152.1) 图 1 Eg-BAG3(a)和Eg-EB1(b)的基序分析 Fig. 1 Motif analysis of Eg-BAG3 (a) and Eg-EB1 (b) |
|
图 2 Eg-BAG3(a)和Eg-EB1(b)系统进化树 Fig. 2 The phylogenetic trees of Eg-BAG3(a)和Eg-EB1 (b) |
|
|
表 2 Eg-BAG3和Eg-EB1基本分子特征分析 Table 2 Basic molecular characteristics analysis of Eg-BAG3 and Eg-EB1 |
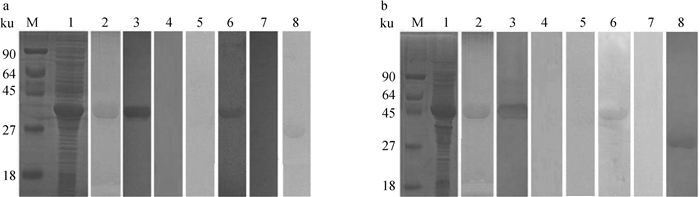
rEg-BAG3和rEg-EB1均成功表达于E. coli BL21(DE3)中,蛋白分子大小分别约为30 ku(图 3a)和46 ku(图 3b),大小与预期相符且二者都以上清形式存在。免疫印迹结果显示,rEg-BAG3和rEg-EB1都可以被自然感染细粒棘球蚴绵羊的阳性血清特异性识别,而与健康绵羊阴性血清不反应,说明Eg-BAG3和Eg-EB1都具有较好的免疫反应性;兔抗rEg-BAG3 IgG和兔抗rEg-EB1 IgG分别可以特异性识别rEg-BAG3和rEg-EB1,但无法识别rBs-Tpx,说明兔抗rEg-BAG3 IgG和rEg-EB1 IgG仅可以和rEg-BAG3及rEg-EB1特异性结合,而与其他蛋白不反应。此外,兔抗rEg-BAG3 IgG和兔抗rEg-EB1 IgG在原头蚴总蛋白中特异性识别出天然蛋白Eg-BAG3和Eg-EB1,大小分别约为26和29 ku(图 3),表明Eg-BAG3和Eg-EB1表达于原头蚴中且可能参与调控原头蚴的生长发育过程。
|
M. 蛋白质相对分子质量标准品;1. IPTG诱导后rEg-BAG3/rEg-EB1的表达;2. 纯化后的rEg-BAG3/rEg-EB1;3. 兔抗rEg-BAG3 IgG/rEg-EB1 IgG识别rEg-BAG3/rEg-EB1;4. 兔阴性血清识别rEg-BAG3/rEg-EB1;5. 兔抗rEg-BAG3 IgG/兔抗rEg-EB1 IgG识别rBs-Tpx;6. 自然感染细粒棘球蚴病的绵羊阳性血清识别rEg-BAG3/rEg-EB1;7. 健康绵羊阴性血清识别rEg-BAG3/rEg-EB1;8. 兔抗rEg-BAG3 IgG/rEg-EB1 IgG识别原头蚴粗蛋白 M. Protein molecular weight marker; 1. rEg-BAG3/rEg-EB1 induced by IPTG; 2. Purified rEg-BAG3/rEg-EB1; 3. rEg-BAG3/rEg-EB1probed with anti-rEg-BAG3/rEg-EB1 rabbit IgG; 4. rEg-BAG3/rEg-EB1 probed with pre-immune rabbit sera; 5. Purified rBs-Tpx probed with anti-rEg-BAG3/anti-rEg-EB1 rabbit IgG; 6. rEg-BAG3/rEg-EB1 probed with CE positive sheep sera; 7. rEg-BAG3/rEg-EB1 probed with healthy sheep sera; 8. Extracted total proteins of PSCs probed with anti-Eg-BAG3/rEg-EB1 rabbit IgG 图 3 rEg-BAG3(a) 和rEg-EB1 (b)表达、纯化及免疫印迹 Fig. 3 Expression, purification and Western blot analysis of rEg-BAG3 (a) and rEg-EB1 (b) |
Eg-BAG3和Eg-EB1在原头蚴、成虫、育囊与不育囊的免疫荧光定位分析显示Eg-BAG3在细粒棘球绦虫各个发育时期均有分布,且主要分布于生发层以及原头蚴和成虫的皮层和实质组织(图 4a)。Eg-EB1主要分布于原头蚴的皮层、顶突和吸盘以及包囊生发层,但在成虫未见特异性分布(图 4b)。

|
LL. 角质层;GL. 生发层;Teg. 皮层;PR. 实质组织;S. 吸盘;R. 顶突。标尺:50 μm LL. Laminated layer; GL. Germinal layer; Teg. Tegument; PR. Parenchymal tissue; S. Suckers; R. Rostellum. Scale bars: 50 μm 图 4 Eg-BAG3(a)和Eg-EB1(b)在细粒棘球绦虫不同发育时期的免疫荧光定位 Fig. 4 Immunolocalization of Eg-BAG3(a)and Eg-EB1(b)in different life stages of E. granulosus |
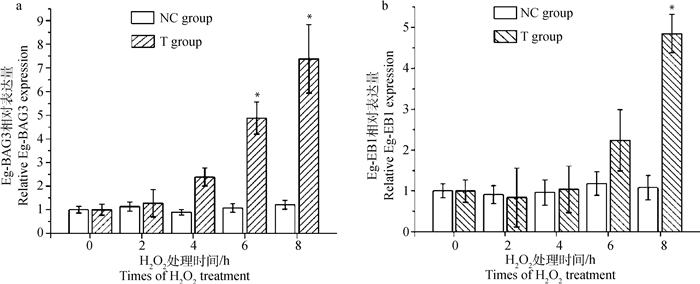
在利用10 mmol·L-1 H2O2连续作用原头蚴8 h后,原头蚴形态及超微结构均出现明显的凋亡相关的变化,光学显微镜下H2O2处理组原头蚴头节出现肿胀、塌陷甚至破裂的现象,原头蚴体积缩小、钙颗粒变小或模糊不清(图 5 d),而空白组原头蚴结构仍旧清晰、完整,钙颗粒清亮而明显(图 5a)。透射电镜结果显示H2O2处理组原头蚴细胞呈现典型的凋亡相关变化,如胞体变小、皱缩,染色质凝集,甚至出现细胞核破裂等变化(图 5e、f),而空白组原头蚴细胞核结构正常(图 5b、c)。qRT-PCR结果显示,处理组原头蚴Eg-BAG3的相对转录水平随着H2O2处理时间的延长而逐渐上升,在6和8 h的相对转录水平与0 h相比,差异显著(P < 0.05)(图 6a)。Eg-EB1的相对转录水平也随着H2O2处理时间的延长而逐渐上升,在8 h的相对转录水平与0 h相比统计学差异显著(P < 0.05)(图 6b)。空白组原头蚴在0~8 h的Eg-BAG3和Eg-EB1相对转录水平均无显著差异(P>0.05)。综上,提示Eg-BAG3和Eg-EB1可能均参与调控H2O2诱导的原头蚴细胞凋亡。

|
a. 光学显微镜下的空白组原头蚴(10×);b、c.透射电镜下的空白组原头蚴;d.光学显微镜下的H2O2处理组原头蚴(10×);e、f.透射电镜下的H2O2处理组原头蚴。箭头代表原头蚴细胞凋亡的典型变化 a. PSCs of the negative control group observed by light microscope (10×); b, c. PSCs of the negative control group observed by TEM; d. PSCs of the H2O2 treatment group observed by light microscope (10×); e, f. PSCs of the H2O2 treatment group observed by TEM. Arrows indicate typical morphological changes associated with apoptosis 图 5 光学显微镜和透射电镜观察原头蚴形态及超微结构 Fig. 5 Morphology and ultrastructure of PSCs observed by light microscope and transmission electron microscope |
|
数据为三次试验的“ ±s”,每组0 h和其他时间点之间的统计学上的显著差异用One-way ANOVA分析来确定(*.P < 0.05) Data were presented as the "x±s" of triplicate experiments. Statistically significant differences between the 0 h and other time points were determined using One-way ANOVA analysis (*. P < 0.05) 图 6 H2O2处理前后Eg-BAG3(a)和Eg-EB1(b)相对表达量分析 Fig. 6 Expression profile analysis of Eg-BAG3 (a) and Eg-EB1 (b) in response to H2O2treatment |
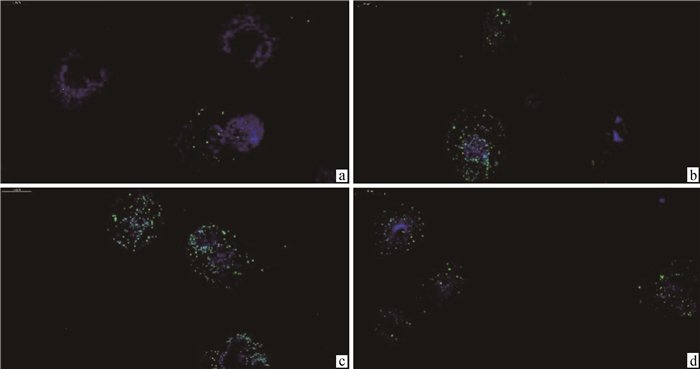
为了进一步探究Eg-BAG3和Eg-EB1在H2O2诱导的原头蚴细胞凋亡中起到的具体作用,本研究分别以3对针对Eg-BAG3或Eg-EB1不同位点区域的siRNA以及无关siRNA通过浸染法转染原头蚴,通过siRNA上带有的FAM荧光标记在荧光显微镜下估算转染效率约为60%,说明成功将siRNA导入了原头蚴体内。qRT-PCR结果显示,针对Eg-BAG3的3对siRNA干扰组原头蚴(BAG-108、BAG-181和BAG-486)的Eg-BAG3相对转录水平均降低,分别为siRNA-CON组原头蚴的52.24%、32.68%和57.57%;针对Eg-EB1的3对siRNA干扰组原头蚴(EB-91、EB-360和EB-476) 的Eg-EB1的相对转录水平也都降低,分别为siRNA-CON组原头蚴的39.87%、66.59%和64.62%,表明BAG-181和EB-91的干扰效率最高。通过进一步利用H2O2处理干扰效率最高的siRNA转染后的原头蚴, 并应用TUNEL法对原头蚴细胞的凋亡情况进行检测,结果显示Eg-BAG3干扰组原头蚴细胞凋亡率(72.68%±10.00%)显著高于未干扰组(63.87%±6.10%),P < 0.05,而Eg-EB1干扰组原头蚴细胞凋亡率(50.43%±9.14%)低于未干扰组(63.87%±6.10%),P < 0.05(表 3,图 7)。值得注意的是,未干扰组原头蚴的总细胞数相对于空白组及Eg-BAG3和Eg-EB1干扰组较少,可能是由于虫体在制作石蜡切片时,各组虫体不同切面的细胞数不同引起的。
|
|
表 3 TUNEL法测定原头蚴细胞凋亡率 Table 3 Apoptosis rates of PSCs determined by TUNEL |
|
a. 空白组原头蚴;b. 未干扰组原头蚴;c. Eg-BAG3干扰组原头蚴;d. Eg-EB1干扰组原头蚴 a. PSCs in the negative control group (NCG); b. PSCs in the non-interference group (NIG); c. PSCs in the Eg-BAG3 siRNA interference group (BAG3-IG); d. PSCs in the Eg-EB1 siRNA interference group (EB1-IG) 图 7 TUNEL法检测原头蚴细胞凋亡情况 Fig. 7 TUNEL assay of PSCs following RNA interference |
BAG3属于BAG蛋白家族,该蛋白家族成员的基本特征是在C末端存在保守的BAG结构域且该结构域可形成3个平行的短α螺旋结构,此外,某些BAG蛋白还有WW结构域、富含脯氨酸的PXXP结构域、核定位信号(nuclear localization signal,NLS)、泛素样(ubiquitin-like,UBL)结构域,其中WW结构域仅见于BAG3蛋白[6]。Eg-BAG3含有1个BAG结构域和1个WW结构域,且BAG结构域形成3个明显的短α螺旋结构,表明Eg-BAG3具有BAG蛋白家族的基本结构特征。BAG蛋白正是通过这些结构域与细胞内各种信号分子蛋白相互作用,从而参与调控各种生理活动,目前, 已被研究证实BAG蛋白可以通过BAG结构域和HSP70的ATP酶结构域结合从而作为HSP70的共分子伴侣调节多种生理活动,如细胞凋亡、自噬、迁移、黏附等[13]。内吞蛋白B1由位于N端的BAR结构域,中间的可变区以及C端的SH3(SRC homology-3)结构域构成[14],其中,BAR结构域具有绑定磷脂双分子层并使膜弯曲的特性,参与囊泡的形成;SH3结构域可以结合多种内吞蛋白,在细胞内吞方面起到重要的调控作用[15-16]。从结构域预测分析结果来看,Eg-EB1含典型的BAR结构域, 但缺少SH3结构域,具体原因目前尚不清楚。免疫荧光定位显示,Eg-BAG3广泛分布于细粒棘球绦虫的各个发育时期,包括原头蚴、成虫以及包囊生发层,提示Eg-BAG3可能在虫体的整个生长发育过程中均扮演重要角色。Eg-EB1在细粒棘球绦虫中曾被鉴定为一个大小约为29 ku的抗原分子(P-29),且主要定位于原头蚴的皮层和顶突以及包囊生发层,但在包囊液或成虫提取物中不存在[17-18]。同样,Eg-EB1在本研究也被发现主要定位于原头蚴皮层、顶突以及包囊生发层,而在成虫则未见分布,推测Eg-EB1可能主要参与调节细粒棘球绦虫幼虫阶段的生长发育[19]。
细粒棘球蚴包囊可以在中间宿主体内长期存在并产生大量原头蚴,在此过程中宿主调动自身的免疫系统,通过各种免疫细胞的直接或者间接作用攻击虫体,其中,宿主免疫细胞产生的活性氧(reactive oxygen species, ROS)是一个重要的可以有效诱导原头蚴细胞凋亡的物质[20]。ROS包括过氧化氢(H2O2)、超氧阴离子自由基(O2-)、羟基自由基(-OH)等代谢产物,高浓度的ROS将严重损伤细胞DNA、蛋白质及脂质,从而引起细胞凋亡[21],目前,H2O2已被用于诱导多房棘球绦虫和细粒棘球绦虫的细胞凋亡[22-23]。有研究报道显示,BAG3具有抑制细胞凋亡的作用,当细胞受到活性氧等多种外界因素刺激时,BAG3将被激活,表达量显著上升,细胞凋亡被抑制,而当BAG3的表达受到抑制时,细胞凋亡将增加[24];在人骨肉瘤细胞和黑色素瘤细胞中,BAG3可以阻止IKK-γ进入蛋白酶体依赖的蛋白降解途径,维持NF-κB的持续激活从而促进细胞存活[25];在人胶质母细胞瘤细胞中,BAG3可以将BAX蛋白保留在细胞质中,阻止其在线粒体外膜上形成孔道,起到抑制细胞凋亡的作用[26];在人髓系U937细胞中,BAG3蛋白表达水平的下调将显著促进DEM诱导的细胞凋亡[27]。本研究中,H2O2被用于诱导原头蚴细胞凋亡,H2O2处理后原头蚴体内Eg-BAG3的相对转录水平随着H2O2处理时间的延长显著上调,且在利用siRNA抑制Eg-BAG3表达水平后,原头蚴细胞凋亡率相对于未干扰组原头蚴而言显著上调,这表明抑制Eg-BAG3基因的表达将会促进原头蚴细胞凋亡,即Eg-BAG3具有抗凋亡作用。EB1蛋白作为Bax蛋白的激活因子,研究发现其可能具有促凋亡作用,如在HeLa细胞中过表达EB1能够促进细胞凋亡,而下调EB1的表达则可以抑制细胞色素C的释放从而抑制细胞凋亡[8-9];在前列腺癌细胞中过表达EB1可以显著抑制细胞增殖,促进癌细胞凋亡[28]。在本研究中Eg-EB1的相对转录水平随着H2O2处理时间的延长而显著上调,且在利用siRNA抑制Eg-EB1表达水平后,原头蚴细胞凋亡率相对于未干扰组原头蚴而言显著降低,意味着抑制Eg-EB1的表达将会抑制原头蚴细胞凋亡,即Eg-EB1具有促凋亡作用。
不育囊的产生是细粒棘球蚴存在的一种独特的生物学现象,目前研究发现不育囊的形成是多种因素共同作用下的结果,包括宿主的种类、年龄、生活环境、包囊在宿主体内的寄生部位、基因型及宿主免疫反应等[29-30],此外也有研究报道细胞凋亡可能与不育囊形成之间有着密切联系。研究人员通过TUNEL分析和琼脂糖凝胶电泳发现不育囊生发层中的DNA片段化水平显著高于可育囊,且不育囊生发层中caspase 3的酶活性也高于可育囊,提示细胞凋亡可能是诱导不育囊形成的原因之一[5];此外,相比于可育囊生发层而言,不育囊生发层表现出更严重的DNA氧化损伤[31],而且不育囊生发层中凋亡相关配体如TNF相关的凋亡诱导配体(TRAIL)及Fas-L的表达水平显著高于可育囊[32]。鉴于细胞凋亡与细粒棘球蚴不育囊形成之间的密切联系,且原头蚴细胞来源于生发层细胞,Eg-BAG3和Eg-EB1分别对原头蚴细胞凋亡起着抑制和促进作用,因此Eg-BAG3和Eg-EB1也可能参与调控生发层细胞的凋亡,从而进一步调控不育囊的形成。
4 结论Eg-BAG3和Eg-EB1分别属于典型的BAG蛋白和内吞蛋白。Eg-BAG3广泛分布于虫体的各个发育阶段,而Eg-EB1仅分布于原头蚴和包囊生发层,成虫无分布,提示二者可能在细粒棘球绦虫生长发育过程中起不同的作用。Eg-BAG3和Eg-EB1在H2O2诱导原头蚴细胞凋亡的过程中转录水平显著上调,当二者表达被抑制后,Eg-BAG3干扰组原头蚴细胞凋亡率明显上升,而Eg-EB1干扰组原头蚴细胞凋亡率下降,表明Eg-BAG3和Eg-EB1在H2O2诱导的原头蚴细胞凋亡过程中分别起着抗凋亡和促凋亡作用,且二者可能进一步参与调控不育囊的形成。
| [1] |
WOOLSEY I D, MILLER A L. Echinococcus granulosus sensu lato and Echinococcus multilocularis: a review[J]. Res Vet Sci, 2021, 135: 517-522. DOI:10.1016/j.rvsc.2020.11.010 |
| [2] |
DEPLAZES P, RINALDI L, ROJAS C A A, et al. Chapter Six-Global distribution of alveolar and cystic echinococcosis[J]. Adv Parasitol, 2017, 95: 315-493. |
| [3] |
WEN H, VUITTON L, TUXUN T, et al. Echinococcosis: advances in the 21 st century[J]. Clin Microbiol Rev, 2019, 32(2): e00075-e00018. |
| [4] |
吴茂迪, 宋星桔, 闫敏, 等. 细粒棘球绦虫半胱氨酸蛋白酶抑制剂基因的克隆、表达及诊断价值的初步评价[J]. 畜牧兽医学报, 2018, 49(3): 572-579. WU M D, SONG X J, YAN M, et al. Cloning, expression and preliminary evaluation diagnostic value of Echinococcus granulosus cystatin gene[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(3): 572-579. (in Chinese) |
| [5] |
PAREDES R, JIMÉNEZ V, CABRERA G, et al. Apoptosis as a possible mechanism of infertility in Echinococcus granulosus hydatid cysts[J]. J Cell Biochem, 2007, 100(5): 1200-1209. DOI:10.1002/jcb.21108 |
| [6] |
BEHL C. Breaking BAG: the Co-chaperone BAG3 in health and disease[J]. Trends Pharmacol Sci, 2016, 37(8): 672-688. DOI:10.1016/j.tips.2016.04.007 |
| [7] |
HISHIYA A, KITAZAWA T, TAKAYAMA S. BAG3 and Hsc70 interact with actin capping protein CapZ to maintain myofibrillar integrity under mechanical stress[J]. Circ Res, 2010, 107(10): 1220-1231. DOI:10.1161/CIRCRESAHA.110.225649 |
| [8] |
TAKAHASHI Y, MEYERKORD C L, WANG H G. Bif-1/endophilin B1:a candidate for crescent driving force in autophagy[J]. Cell Death Differ, 2009, 16(7): 947-955. DOI:10.1038/cdd.2009.19 |
| [9] |
OZSOYLEMEZ O D, OZTURK M, SUTLUPINAR N, et al. The effects of colchicum baytopiorum on regulatory genes of apoptotic and autophagic cell death in HeLa cells[J]. Curr Pharm Biotechnol, 2016, 17(15): 1369-1376. DOI:10.2174/1389201018666161109113543 |
| [10] |
ZHENG H J, ZHANG W B, ZHANG L, et al. The genome of the hydatid tapeworm Echinococcus granulosus[J]. Nat Genet, 2013, 45(10): 1168-1175. DOI:10.1038/ng.2757 |
| [11] |
TSAI I J, ZAROWIECKI M, HOLROYD N, et al. The genomes of four tapeworm species reveal adaptations to parasitism[J]. Nature, 2013, 496(7443): 57-63. DOI:10.1038/nature12031 |
| [12] |
WANG N, ZHONG X Q, SONG X J, et al. Molecular and biochemical characterization of calmodulin from Echinococcus granulosus[J]. Parasit Vectors, 2017, 10(1): 597. DOI:10.1186/s13071-017-2545-2 |
| [13] |
WANG D B, UO T, KINOSHITA C, et al. Bax interacting factor-1 promotes survival and mitochondrial elongation in neurons[J]. J Neurosci, 2014, 34(7): 2674-2683. DOI:10.1523/JNEUROSCI.4074-13.2014 |
| [14] |
KJAERULFF O, BRODIN L, JUNG A. The structure and function of Endophilin proteins[J]. Cell Biochem Biophys, 2011, 60(3): 137-154. DOI:10.1007/s12013-010-9137-5 |
| [15] |
ROSATI A, GRAZIANO V, DE LAURENZI V, et al. BAG3:a multifaceted protein that regulates major cell pathways[J]. Cell Death Dis, 2011, 2(4): e141. DOI:10.1038/cddis.2011.24 |
| [16] |
PECHSTEIN A, GERTH F, MILOSEVIC I, et al. Vesicle uncoating regulated by SH3-SH3 domain-mediated complex formation between endophilin and intersectin at synapses[J]. EMBO Rep, 2015, 16(2): 232-239. DOI:10.15252/embr.201439260 |
| [17] |
GORTAT A, SAN-ROMAN M J, VANNIER C, et al. Single point mutation in Bin/Amphiphysin/Rvs (BAR) sequence of endophilin impairs dimerization, membrane shaping, and Src homology 3 domain-mediated partnership[J]. J Biol Chem, 2012, 287(6): 4232-4247. DOI:10.1074/jbc.M111.325837 |
| [18] |
BOUBAKER G, GOTTSTEIN B, HEMPHILL A, et al. Echinococcus P29 antigen: molecular characterization and implication on post-surgery follow-up of CE patients infected with different species of the Echinococcus granulosus complex[J]. PLoS One, 2014, 9(5): e98357. DOI:10.1371/journal.pone.0098357 |
| [19] |
GONZÁLEZ G, SPINELLI P, LORENZO C, et al. Molecular characterization of P-29, a metacestode-specific component of Echinococcus granulosus which is immunologically related to, but distinct from, antigen 5[J]. Mol Biochem Parasitol, 2000, 105(2): 177-185. DOI:10.1016/S0166-6851(99)00166-8 |
| [20] |
HU H H, KANG J F, CHEN R, et al. Drug-induced apoptosis of Echinococcus granulosus protoscoleces[J]. Parasitol Res, 2011, 109(2): 453-459. DOI:10.1007/s00436-011-2276-9 |
| [21] |
KONNO T, MELO E P, CHAMBERS J E, et al. Intracellular sources of ROS/H2O2 in health and neurodegeneration: spotlight on endoplasmic reticulum[J]. Cells, 2021, 10(2): 233. DOI:10.3390/cells10020233 |
| [22] |
CHENG Z, ZHU S, WANG L, et al. Identification and characterisation of Emp53, the homologue of human tumor suppressor p53, from Echinococcus multilocularis: its role in apoptosis and the oxidative stress response[J]. Int J Parasitol, 2015, 45(8): 517-526. DOI:10.1016/j.ijpara.2015.02.010 |
| [23] |
WANG N, ZHAN J F, GUO C, et al. Molecular characterisation and functions of Fis1 and PDCD6 genes from Echinococcus granulosus[J]. Int J Mol Sci, 2018, 19(9): 2669. DOI:10.3390/ijms19092669 |
| [24] |
CESARO E, MONTANO G, ROSATI A, et al. WT1 protein is a transcriptional activator of the antiapoptotic bag3 gene[J]. Leukemia, 2010, 24(6): 1204-1206. DOI:10.1038/leu.2010.68 |
| [25] |
AMMIRANTE M, ROSATI A, ARRA C, et al. IKKγ protein is a target of BAG3 regulatory activity in human tumor growth[J]. Proc Natl Acad Sci U S A, 2010, 107(16): 7497-7502. DOI:10.1073/pnas.0907696107 |
| [26] |
FESTA M, DEL VALLE L, KHALILI K, et al. BAG3 protein is overexpressed in human glioblastoma and is a potential target for therapy[J]. Am J Pathol, 2011, 178(6): 2504-2512. DOI:10.1016/j.ajpath.2011.02.002 |
| [27] |
ROSATI A, AMMIRANTE M, GENTILELLA A, et al. Apoptosis inhibition in cancer cells: a novel molecular pathway that involves BAG3 protein[J]. Int J Biochem Cell Biol, 2007, 39(7-8): 1337-1342. DOI:10.1016/j.biocel.2007.03.007 |
| [28] |
XU L, WANG Z, HE S Y, et al. Bax-interacting factor-1 inhibits cell proliferation and promotes apoptosis in prostate cancer cells[J]. Oncol Rep, 2016, 36(6): 3513-3521. DOI:10.3892/or.2016.5172 |
| [29] |
ADDY F, ALAKONYA A, WAMAE N, et al. Prevalence and diversity of cystic echinococcosis in livestock in Maasailand, Kenya[J]. Parasitol Res, 2012, 111(6): 2289-2294. DOI:10.1007/s00436-012-3082-8 |
| [30] |
TIGRE W, DERESA B, HAILE A, et al. Molecular characterization of Echinococcus granulosus s. l. cysts from cattle, camels, goats and pigs in Ethiopia[J]. Vet Parasitol, 2016, 215: 17-21. DOI:10.1016/j.vetpar.2015.10.022 |
| [31] |
CABRERA G, CABREJOS M E, MORASSUTTI A L, et al. DNA damage, RAD9 and fertility/infertility of Echinococcus granulosus hydatid cysts[J]. J Cell Physiol, 2008, 216(2): 498-506. DOI:10.1002/jcp.21418 |
| [32] |
SPOTIN A, MAJDI M M A, SANKIAN M, et al. The study of apoptotic bifunctional effects in relationship between host and parasite in cystic echinococcosis: a new approach to suppression and survival of hydatid cyst[J]. Parasitol Res, 2012, 110(5): 1979-1984. DOI:10.1007/s00436-011-2726-4 |
(编辑 白永平)



