2. 中山大学生命科学学院 有害生物控制与资源利用国家重点实验室,广州 510006
2. State Key Laboratory of Biocontrol, School of Life Sciences, Sun Yat-sen University, Guangzhou 510006, China
冠状病毒是影响人畜健康的一大类病毒,其宿主范围广泛,靶组织多样,同一种病毒不同分支具有迥异的致病特点[1],疫苗免疫作为预防病毒性疫病的有效措施也常用于冠状病毒防控。猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)属于冠状病毒科冠状病毒属成员[2],病毒感染猪只后仅在小肠内复制[3],导致细胞变性、肠绒毛脱落,致使体内水分外排,猪只电解质紊乱。PEDV依据不同基因或基因组可分为多个进化分支,但从血清学分型角度判断则当前仅有一个血清型。该病尚无有效的治疗药物,合适的疫苗及合理的免疫程序是预防PED的重要措施[4]。PEDV常用疫苗有弱毒疫苗和灭活疫苗两类,弱毒疫苗产生的免疫效力更全面,但其常存在两个方面的不足:首先,弱毒疫苗的致弱及安全评价过程较为漫长,如DR13强毒株连续传100代毒力才减弱,可能降低弱毒疫苗的保护效力;其次,致弱过程中S蛋白受到很强的选择压力,有研究证实DR13及日本83P-5 100代弱毒疫苗与母本毒株属于不同遗传进化分支[5-6],其中S基因的变异与其有很高相关性,这使得弱毒疫苗与流行毒株基因差异进一步加大[7]。
灭活疫苗具良好的安全性、可匹配实际流行毒株的优点,但同样存在使用效果不稳定等缺点[8]。其他冠状病毒防控面临同样的问题,以鸡传染性支气管炎病毒(infectious bronchitis virus, IBV)为例,现有灭活疫苗免疫效果不理想,对同血清型的毒株攻毒保护率不佳[9]。针对以上问题,有相关研究利用浓缩疫苗研究免疫效果,显示免疫剂量确与保护率相关,但未阐明具体剂量组成与评价标准[8]。
因此,本研究制备不同总病毒粒子、感染性病毒粒子含量的PEDV疫苗,研究其激发体液免疫和细胞免疫效果,探讨不同抗原含量疫苗及免疫方式与保护效果之间的关系,为PEDV的有效防控提供参考,同时也对其他冠状病毒或黏膜类疫病[10]的有效免疫防控提供线索。
1 材料与方法 1.1 毒株和试验动物猪流行性腹泻病毒变异毒株GDS01[11]由中山大学生命科学学院有害生物控制与资源利用实验室分离保存;小鼠免疫及测定试验使用6周龄SPF BALB/c小鼠24只,在中山大学实验动物中心饲养;18头PEDV抗原抗体阴性4~5周龄仔猪,品种为杜洛克×长白×大白三元杂交。
1.2 主要试剂及耗材细胞:Vero细胞,由本实验室传代保存。克隆载体:pMD18-T vector,购自宝生物工程有限公司(以下称宝生工)。DMEM低糖培养基购自GIBCO公司,胎牛血清购自GIBCO公司,无EDTA胰酶(Invitrogen)、TPB(SIGMA)、一次性滤器(Millipore)、反转录试剂盒(Fermentas),TRIzol(Invitrogen),低熔点琼脂糖(TaKaRa),琼脂糖(BIOWEST),DL2000(TaKaRa)。细胞生长培养基:含10%胎牛血清的低糖DMEM,使用NaHCO3及HEPES调整培养液pH。病毒生长培养基:含0.3%TPB的低糖DMEM。1×PBS(pH 7.4):8 g NaCl,3.58 g Na2HPO4, 0.27 g KH2PO4,0.2 g KCl,加入800 mL水充分搅拌溶解,调整pH后,定容至1 L,高压灭菌后室温保存。MSE缓冲液:10 mmol·L-1 MOPS,pH 6.8;150 mmol·L-1 NaCl;1 mmol·L-1 EDTA。30%(w/w)蔗糖溶液:30 g蔗糖溶于70 mL MSE缓冲液中,过0.22 μm滤膜除菌。
1.3 病毒培养及浓缩取致密单层Vero传代细胞,接毒前用已灭菌PBS清洗3次,用生长培养基900 μL(含无EDTA的胰酶,浓度为7.5 μg·mL-1)与100 μL病毒液混合后加至单层细胞上,置37 ℃感作60 min后,弃掉混合上清,用已灭菌PBS清洗3次,加入4 mL含一定浓度胰蛋白酶的病毒生长培养基,于37 ℃、5%CO2培养箱中继续培养,每天观察细胞病变。当细胞出现病变后,进行冻存以备后续研究。
将病毒原液按10倍倍比稀释,各梯度病毒液按病毒接种传代方法接种至长满单层细胞6孔板中,准备含1%低熔点琼脂糖,含胰酶的病毒生长培养基,将其覆于细胞上,待培养基凝固后倒置培养,36 h后用万分之三中性红染色进行噬斑计数,完成病毒滴度测定。
采用超速离心浓缩病毒,首先准备用于超速离心的病毒液,以MOI=0.05为接种浓度接种单层Vero细胞,当单层细胞布满细胞病变时收获细胞及上清,冻融3次后4 ℃,4 000×g离心30 min去除细胞碎片,澄清的上清冻存于-80 ℃冰箱。应用超速离心进行病毒浓缩,以5 mL 30%蔗糖作为缓冲垫子防止PEDV纤突蛋白脱落,4 ℃,10 500×g离心2 h,离心沉淀用1%原始体积MSE悬浮混匀制备100×浓缩病毒液,1×浓缩组~50×浓缩组使用100×病毒液进行倍比稀释,200×浓缩病毒液制备方法为用0.5%MSE悬浮混匀离心沉淀。使用噬斑计数测定病毒感染性粒子数,应用病毒计数仪测定全病毒粒子数[12]。
1.4 疫苗的制备及免疫采用二乙烯亚胺(Binary ethylenimine,BEI)灭活,具体方法为:将0.1 mol·L-1 BEI加至疫苗中使其终浓度至5%,37 ℃孵育24 h灭活后用硫代硫酸钠中和残余BEI,病毒灭活是否彻底则是将灭活液体在细胞上进行连续传代3次观察细胞病变产生情况来验证。免疫小鼠疫苗制备:按1∶1比例将抗原与弗氏佐剂混合乳化,以液滴完全不散开判为乳化完全;免疫猪疫苗制备:所有抗原均使用SEPPIC 201佐剂进行抗原液乳化,根据产品说明书1∶1混合抗原液及佐剂,250 r·min-1混匀制备成疫苗。上述样品存放于4 ℃保存备用。
小鼠的免疫程序为6周龄进行一免,一免后14 d进行二免;仔猪免疫程序为4~5周龄仔猪进行一免,一免后21 d进行二免,每次免后1 h观察有无应激及过敏症状。
1.5 小鼠抗体检测及细胞因子测定小鼠血液采集时间点为:一免前;一免后14 d;一免后28 d。
抗体检测:本研究采用ELISA[13]和中和试验两种方法检测试验动物抗体水平。
小鼠细胞因子测定:通过ELISPOT试验检测IL-4及IFN-γ细胞因子水平,其方法如下:第一天完成分离脾淋巴细胞及加入刺激物培养试验,按3×105cell·well-1的细胞浓度将淋巴细胞加至活化的ELISPOT板中,每孔100 μL,试验组加入刺激物GDS01病毒液5×103 pfu·well-1,设置正对照孔(加入PMA 2.5 μg·mL-1)、负对照(只加细胞及培养基)及背景对照孔(不含细胞只加培养基和检测试剂)。所有样品加完后,将ELISPOT板放入37 ℃,5% CO2培养箱中培养20 h。
细胞裂解及斑点检测在第2天进行,具体步骤为:倾倒板内细胞及培养基,4 ℃放置10 min裂解板内细胞,洗涤5~7次后拍干。将稀释好的生物素标记抗体加入各孔,每孔加入100 μL后置于37 ℃孵育1 h,洗涤5次。将稀释好的酶标亲和素工作液100 μL·well-1加入后37 ℃孵育1 h,以上述洗涤方法洗涤5次后各孔加入AEC显色工作液,100 μL·well-1,37 ℃避光静置15 min后倾倒孔内液体,打开ELISPOT板底座,用去离子水反复冲洗正反面终止显色,将其放置在室温阴凉处晾干后用ELISPOT读板仪进行斑点计数。
1.6 仔猪中和抗体测定及攻毒试验疫苗免疫及对照仔猪在一免前、一免后21 d,二免后14、18、21 d采集血液并测定血清中和抗体效价,待不同免疫组抗体水平趋于稳定后开始攻毒,攻毒毒株为GDS01,圈舍温度为20 ℃,剂量为3×106 pfu·头-1。攻毒前3 d注射林可霉素、大观霉素混悬剂以防细菌性疫病干扰。
仔猪发病通过逐日观察排便进行判定,利用荧光定量RT-PCR方法研究仔猪排毒情况,荧光定量RT-PCR所用引物及探针序列如下:
上游引物:5′-GGGTATTGGAGAAAATCCTGATAG-3′;
下游引物:5′-AACTGGCGATCTGAGCATAG -3′。
探针:5′-AAGCAACAACAGAAGCCTAAGCAG-3′。
1.7 数据的统计分析采用Graphpad 5.0软件对数据进行统计分析,小鼠试验数据采用单因素方差分析,P < 0.05表示差异显著,P < 0.01表示差异极显著;仔猪中和抗体与病毒含量相关性分析采用Pearson相关性分析,仔猪攻毒评分与中和抗体相关性分析采用Spearman相关性分析。
2 结果 2.1 不同抗原含量疫苗的制备病毒液浓缩后,使用噬斑计数测定病毒感染性粒子数,应用病毒计数仪测定全病毒粒子数,结果见表 1。
|
|
表 1 应用噬斑计数及病毒计数仪测定PEDV感染性粒子及全病毒粒子 Table 1 Titration of PEDV infective particles and total particles based on PFU and Virus Counter |
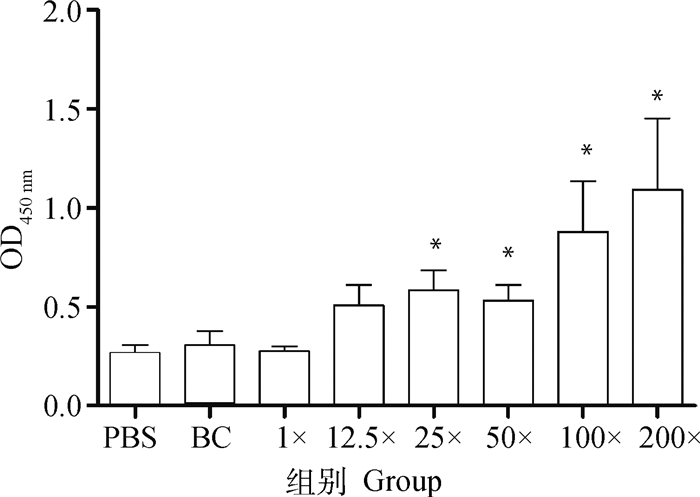
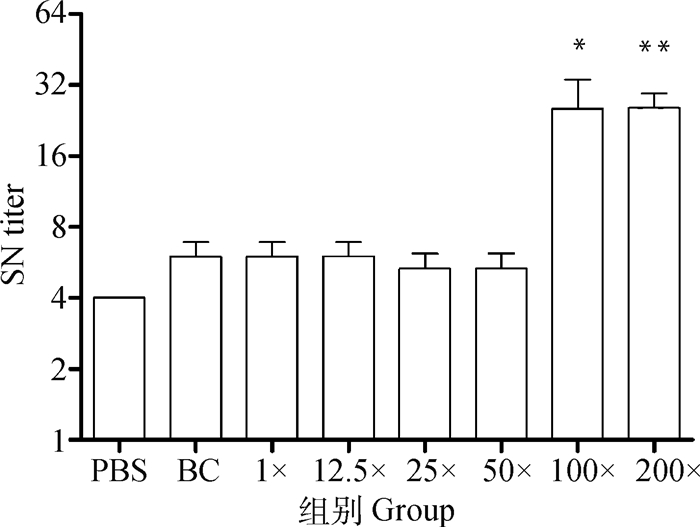
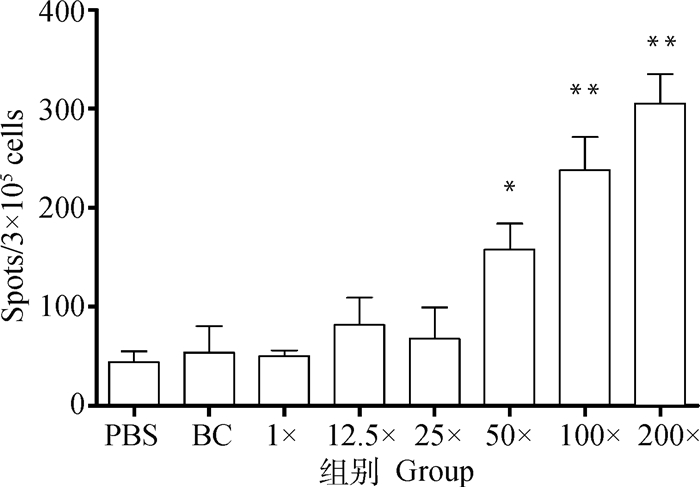
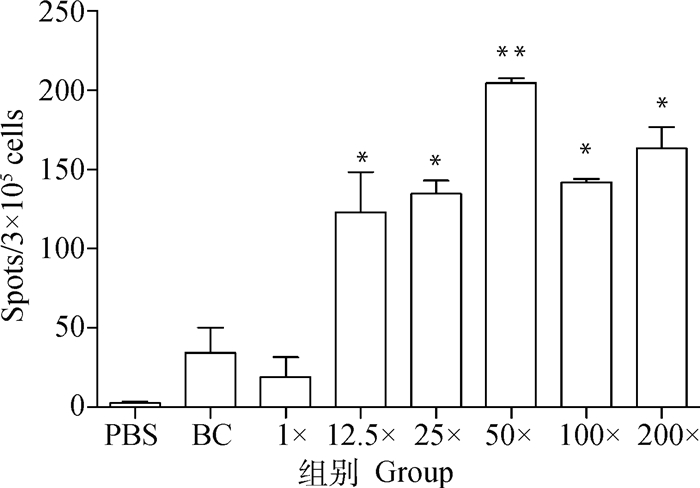
应用ELISA测定小鼠二免14 d抗体,如图 1所示,25×~200×浓缩疫苗抗体水平与PBS相比有显著性差异。另取血清灭活后进行血清中和试验,结果显示,12.5×~50×浓缩免疫组抗体水平与PBS免疫组相似,但当抗原含量达到8×106 pfu·mL-1 (即100×浓缩组)时,结果相比PBS组具有显著性差异,而2.2×107 pfu·mL-1(即200×浓缩组)则极显著高于PBS (图 2)。细胞免疫试验结果显示,50×~200×浓缩疫苗免疫小鼠刺激产生的IFN-γ滴度显著高于PBS组(图 3),同时IL-4检测结果则表明12.5×~200×浓缩疫苗均有助于刺激IL-4的产生(图 4)。由小鼠试验可知25×~200×浓缩疫苗在ELISA抗体水平及刺激IL-4的产生方面显著优于PBS组,50×浓缩疫苗在体液免疫与细胞免疫测定试验中有3个指标显著优于PBS对照组,而100×和200×浓缩疫苗则在上述试验中均显著或极显著优于PBS组,但100×浓缩疫苗免疫结果与200×浓缩疫苗结果之间没有显著差异。因此,综合考虑小鼠试验结果,选择25×~100×浓缩疫苗结合未浓缩疫苗及PBS作为仔猪免疫分组(表 2)。
|
*代表结果显著高于PBS组,下同 *represent the results are significantly higher than PBS group, the same as below 图 1 不同免疫组小鼠血清抗体ELISA检测结果 Fig. 1 The ELISA results of serum antibody for different mice immunity groups |
|
**代表结果极显著高于PBS组,下同 **represent the results are extremely significant higher than PBS group, the same as below 图 2 不同免疫组小鼠血清中和抗体检测结果 Fig. 2 Serum neutralization antibody titer of different mice immunity groups |
|
图 3 不同免疫组小鼠IFN-γ ELISPOT测定结果 Fig. 3 The IFN-γ ELISPOT results of different mice immunity groups |
|
图 4 不同免疫组小鼠IL-4 ELISPOT测定结果 Fig. 4 The IL-4 ELISPOT results of different mice immunity groups |
|
|
表 2 仔猪免疫分组 Table 2 The immunization groups of piglets |
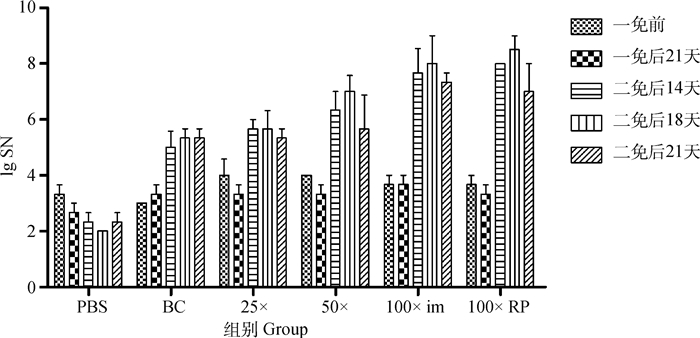
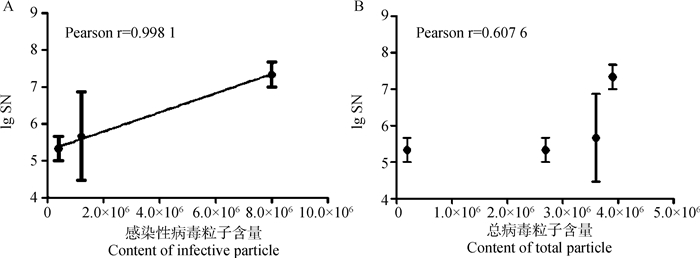
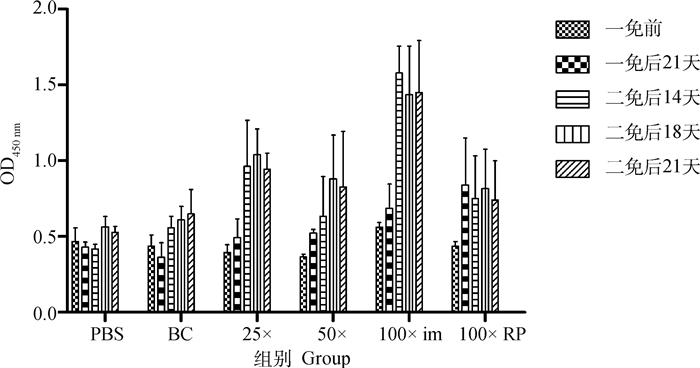
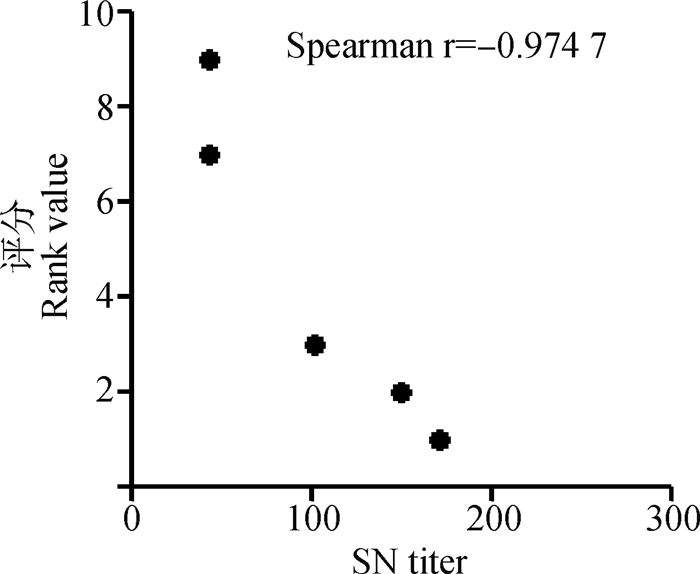
不同组仔猪免疫后于5个时间点测定中和抗体并利用ELISA测定血清抗体水平,图 5显示不同免疫组仔猪二免后14~21 d可形成稳定差异,于二免后21 d作为攻毒时间。同时以二免后21 d测定的中和抗体效价与不同浓度疫苗PFU结果及总病毒粒子数进行相关性分析,结果显示中和效价与PFU显著相关(r=0.998 1)且高于总病毒粒子数相关性(r=0.607 6,图 6)。ELISA结果与中和试验结果相似(图 7)。表 3以评分方式将攻毒试验结果定性资料进行赋值,显示不同疫苗组仔猪攻毒后发病及排毒情况,所有免疫组攻毒前检测均为PEDV阴性,攻毒试验中,PBS免疫组3头仔猪均有连续排毒的情况,其中1头于攻毒后2~6 d表现出水样稀便;未浓缩病毒疫苗免疫组中,1头仔猪可检出连续排毒同时伴有稀便,另外两头仔猪经检测表明其也可连续排毒,但未见明显水样稀便;25×浓缩组(3.8×105 pfu·mL-1) 与未浓缩免疫组情况相似,但未见水样稀便症状;50×浓缩组(1.2×106 pfu·mL-1) 1头仔猪可见连续排毒,但未见症状。而100×浓缩组(8×106 pfu·mL-1)中,肌肉注射方式与后海穴免疫方式结果相近均未见连续排毒情况。统计各组评分,利用Spearman非参数等级检验,分析免疫组评分和中和效价的相关性。结果显示,疾病评分与中和抗体具显著相关性,Spearman相关系数 r值为0.974 7(图 8)。攻毒评分为0时,代表疫苗可100%阻止排毒和发病,但其仅为理论值。本试验以点排毒为阈值,即3分为阈值判断不同免疫组对攻毒的保护效力,结果发现,8×106 pfu·mL-1免疫组低于阈值,可为猪只提供很好的保护力。
|
图 5 不同免疫组仔猪中和抗体测定结果 Fig. 5 Neutralization antibody of different piglets immunity groups |
|
图 6 感染性病毒粒子含量(A)及总病毒粒子含量(B)与中和抗体相关性分析结果 Fig. 6 The correlation analysis of infective particles (A) and total particles (B) with neutralization antibody |
|
图 7 不同免疫组仔猪血清抗体ELISA检测结果 Fig. 7 The ELISA results of serum antibody for different piglets immunity groups |
|
图 8 中和效价与攻毒评分相关性分析 Fig. 8 The correlation analysis of rank values and SN titer |
|
|
表 3 不同免疫组攻毒评分结果 Table 3 The rank values of different immunity groups after challenge |
病毒性疫病最主要的防控措施为疫苗免疫,例如猪瘟疫苗对中国乃至全球猪瘟的预防起到极其重要的作用[14],而伪狂犬病、猪圆环病毒病等多种流行疫病也主要依靠疫苗和免疫程序的更新而得以控制[15]。PEDV变异毒株自2010年暴发流行以来,已持续对全球养猪产业造成重大影响[16],其有效防控也有赖于疫苗的深入研究。目前,针对PEDV疫苗的研制方向存在以下几方面共识:1)免疫评价指标应与疫苗保护效果有很好的相关性;2)PEDV疫苗遗传进化特点须与流行毒株一致;3)PEDV疫苗需具备降低猪只排毒的能力[17-19]。
由于PEDV弱毒疫苗在效力及安全性等方面存在隐患。因此,灭活疫苗是当前防控PEDV的首选,但自2010年起不论是经典疫苗或是变异毒株灭活疫苗免疫后均不能提供显著且稳定的保护[17],影响灭活疫苗免疫稳定性的因素主要有以下几方面:1)常规灭活剂破坏主要抗原蛋白活性;2)疫苗毒株与流行毒株分属不同遗传分支;3) 疫苗剂量不稳定影响免疫效果。针对上述问题,本研究深入探讨疫苗剂量差异对免疫效果影响。首先,以BEI为灭活剂灭活病毒核酸,尽量减少对病毒抗原的影响[20]。其次,以变异毒株制备疫苗同时以该毒株作为攻毒毒株,即可为PEDV的防控提供新的参考,又可避免毒株差异带来的影响。不同免疫组疫苗抗原含量用两种方法测定,便于筛选确定影响免疫效果的关键因素。本试验以育肥初期猪只作为攻毒对象兼顾免疫系统的完善和较易发病排毒两方面因素,这使得本研究的结论具有代表性;其次,攻毒之前测定抗体情况主要的目的是研究体液免疫的差异性是否能在一定范围内与疫病发生相关,可为PEDV监测提供相应依据。
利用小鼠研究不同抗原含量体液免疫和细胞免疫差异,结果发现25×~100×浓缩疫苗免疫组可不同程度地刺激体液免疫和细胞免疫,值得注意的是,小鼠产生抗体与免疫剂量并不是直线相关,只有当病毒含量达8×106 pfu·mL-1时小鼠中和抗体与PBS组有显著差异,推测动物免疫存在最低剂量阈值,而8×106 pfu·mL-1对于小鼠来说即为其最低阈值。近一步利用仔猪进行免疫验证,结果表明猪只产生中和抗体的滴度与疫苗有效抗原含量有关。不同毒株均具有这一特点,Collin等[8]于2015年利用美国分离毒株进行两个滴度量效关系研究,发现免疫剂量大的一组刺激产生中和抗体滴度高于低剂量组,其结论表明感染粒子数与中和抗体的产生具一定相关性,扩展了本文结果的适用性。不同免疫方式在本试验中结果相似,因此为当前研究PEDV免疫方式提供新的参考[21-23]。
试验猪只均为未免疫PEDV疫苗母猪所产仔猪,为了进一步验证不同疫苗免疫效果,本研究也选择生产中免疫PEDV疫苗的母猪所产仔猪,重复验证未浓缩疫苗及8×106 pfu·mL-1的免疫效果。结果显示,未浓缩疫苗免疫组抗体水平参差不齐,免疫效果易受母源抗体干扰,其中1头试验猪一免后中和抗体为阴性,易为野毒感染提供空窗期,而8×106 pfu·mL-1免疫组则整齐度较高(图 9)。
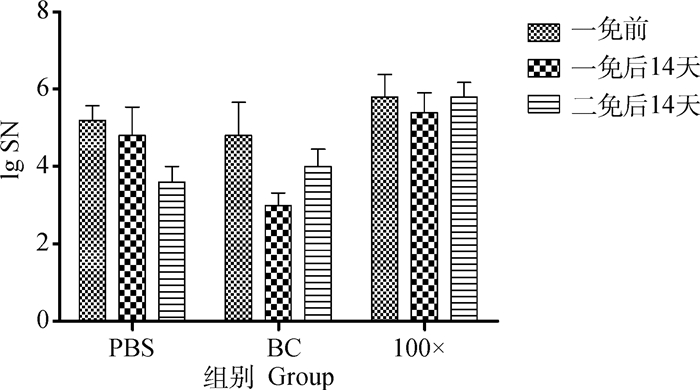
|
图 9 不同疫苗免疫有母源抗体仔猪中和抗体检测结果 Fig. 9 Neutralizing antibody of different piglets immunity groups with maternal antibody background |
研究中疫苗剂量是以感染性粒子和总病毒粒子两种方法作为定量依据,其中,25×浓缩疫苗与未浓缩疫苗感染性粒子数目相似,总病毒粒子数量相差10倍,但仔猪试验中,中和抗体水平及保护效果差异并不明显。由于两组猪只均未见明显腹泻,因此进一步分析两组仔猪增重变化情况,结果表明两组平均增重相近(BC:2 066 g;12.5×:1 917 g)。因此,总病毒粒子提升免疫保护的效果要弱于感染性粒子数,推测其主要原因是浓缩疫苗制备时病毒纤突由于机械性损伤非特异脱落,总病毒粒子仅有部分为完整病毒粒子。另一方面,体液免疫中和抗体水平与病毒保护效果呈显著相关,可避免猪只连续排毒及发病。
4 结论感染性病毒粒子数与免疫动物中和抗体水平呈显著相关,以2 mL 8×106 pfu·mL-1PEDV制备灭活疫苗免疫仔猪后可抵抗PEDV攻毒引起的腹泻及连续排毒。本研究为PEDV疫苗研究提供量效相关数据,试验表明PEDV灭活疫苗中完整病毒粒子数目是影响PEDV有效免疫的重要因素。
| [1] |
MASTERS P S, PERLMAN S. Coronaviridae[M]//KNIPE D M, HOWLEY P M. Fields Virology. Philadelphia: Wolters Kluwer, 2013: 825.
|
| [2] |
WOOD E N. An apparently new syndrome of porcine epidemic diarrhoea[J]. Vet Rec, 1977, 100(12): 243-244. DOI:10.1136/vr.100.12.243 |
| [3] |
SONG D, PARK B. Porcine epidemic diarrhoea virus: a comprehensive review of molecular epidemiology, diagnosis, and vaccines[J]. Virus Genes, 2012, 44(2): 167-175. DOI:10.1007/s11262-012-0713-1 |
| [4] |
WON H, LIM J, NOH Y H, et al. Efficacy of porcine epidemic diarrhea vaccines: a systematic review and meta-analysis[J]. Vaccines, 2020, 8(4): 642. DOI:10.3390/vaccines8040642 |
| [5] |
SONG D, MOON H, KANG B. Porcine epidemic diarrhea: a review of current epidemiology and available vaccines[J]. Clin Exp Vaccine Res, 2015, 4(2): 166-176. DOI:10.7774/cevr.2015.4.2.166 |
| [6] |
SATO T, TAKEYAMA N, KATSUMATA A, et al. Mutations in the spike gene of porcine epidemic diarrhea virus associated with growth adaptation in vitro and attenuation of virulence in vivo[J]. Virus Genes, 2011, 43(1): 72-78. DOI:10.1007/s11262-011-0617-5 |
| [7] |
THAN V T, CHOE S E, VU T T H, et al. Genetic characterization of the spike gene of porcine epidemic diarrhea viruses (PEDVs) circulating in Vietnam from 2015 to 2016[J]. Vet Med Sci, 2020, 6(3): 535-542. DOI:10.1002/vms3.256 |
| [8] |
COLLIN E A, ANBALAGAN S, OKDA F, et al. An inactivated vaccine made from a U.S. field isolate of porcine epidemic disease virus is immunogenic in pigs as demonstrated by a dose-titration[J]. BMC Vet Res, 2015, 11(1): 62. DOI:10.1186/s12917-015-0357-1 |
| [9] |
CAVANAGH D. Severe acute respiratory syndrome vaccine development: experiences of vaccination against avian infectious bronchitis coronavirus[J]. Avian Pathol, 2003, 32(6): 567-582. DOI:10.1080/03079450310001621198 |
| [10] |
FLECK R. 疫苗诱导对猪肺炎支原体的免疫防卫[J]. 汪秉刚, 译. 国外畜牧学(猪与禽), 2002(5): 44-46. FLECK R. Vaccination-induced immune defense against M. Hyo[J]. WANG B G, trans. Animal Sci Abroad-Pigs Poultry, 2002(5): 44-46. (in Chinese) |
| [11] |
HAO J W, XUE C Y, HE L L, et al. Bioinformatics insight into the spike glycoprotein gene of field porcine epidemic diarrhea strains during 2011-2013 in Guangdong, China[J]. Virus Genes, 2014, 49(1): 58-67. DOI:10.1007/s11262-014-1055-y |
| [12] |
ZHANG X B, HAO J W, ZHEN J, et al. Rapid quantitation of porcine epidemic diarrhea virus (PEDV) by Virus Counter[J]. J Virol Methods, 2015, 223: 1-4. DOI:10.1016/j.jviromet.2015.07.003 |
| [13] |
HAO J W, ZHANG Y, FANG S K, et al. Evaluation of purified recombinant spike fragments for assessment of the presence of serum neutralizing antibodies against a variant strain of porcine epidemic diarrhea virus[J]. Virol Sin, 2017, 32(4): 307-316. DOI:10.1007/s12250-017-3969-8 |
| [14] |
GANGES L, CROOKE H R, BOHóRQUEZ J A, et al. Classical swine fever virus: the past, present and future[J]. Virus Res, 2020, 289: 198151. DOI:10.1016/j.virusres.2020.198151 |
| [15] |
WANG J, CUI X, WANG X B, et al. Efficacy of the Bartha-K61 vaccine and a gE-/gI-/TK- prototype vaccine against variant porcine pseudorabies virus (vPRV) in piglets with sublethal challenge of vPRV[J]. Res Vet Sci, 2020, 128: 16-23. DOI:10.1016/j.rvsc.2019.10.005 |
| [16] |
WANG D, FANG L R, XIAO S B. Porcine epidemic diarrhea in China[J]. Virus Res, 2016, 226: 7-13. DOI:10.1016/j.virusres.2016.05.026 |
| [17] |
GERDTS V, ZAKHARTCHOUK A. Vaccines for porcine epidemic diarrhea virus and other swine coronaviruses[J]. Vet Microbiol, 2017, 206: 45-51. DOI:10.1016/j.vetmic.2016.11.029 |
| [18] |
MOGLER M A, GANDER J, HARRIS D L. Development of an alphavirus RNA particle vaccine against porcine epidemic diarrhea virus[J]. Ann Proc Amer Assn Swine Vets, 2014, 63-64. |
| [19] |
GOEDE D, MURTAUGH M P, NEREM J, et al. Previous infection of sows with a "mild" strain of porcine epidemic diarrhea virus confers protection against infection with a "severe" strain[J]. Vet Microbiol, 2015, 176(1-2): 161-164. DOI:10.1016/j.vetmic.2014.12.019 |
| [20] |
WU P, RODRIGUEZ Y Y, HERSHEY B J, et al. Validation of a binary ethylenimine (BEI) inactivation procedure for biosafety treatment of foot-and-mouth disease viruses (FMDV), vesicular stomatitis viruses (VSV), and swine vesicular disease virus (SVDV)[J]. Vet Microbiol, 2021, 252: 108928. DOI:10.1016/j.vetmic.2020.108928 |
| [21] |
SONG D S, OH J S, KANG B K, et al. Oral efficacy of Vero cell attenuated porcine epidemic diarrhea virus DR13 strain[J]. Res Vet Sci, 2007, 82(1): 134-140. DOI:10.1016/j.rvsc.2006.03.007 |
| [22] |
BANDRICK M, ARIZA-NIETO C, BAIDOO S K, et al. Colostral antibody-mediated and cell-mediated immunity contributes to innate and antigen-specific immunity in piglets[J]. Dev Comp Immunol, 2014, 43(1): 114-120. DOI:10.1016/j.dci.2013.11.005 |
| [23] |
JUNG K, SAIF L J, WANG Q H. Porcine epidemic diarrhea virus (PEDV): an update on etiology, transmission, pathogenesis, and prevention and control[J]. Virus Res, 2020, 286: 198045. DOI:10.1016/j.virusres.2020.198045 |
(编辑 范子娟)



