2. 南京农业大学 动物传染病实验室,南京 210095
2. Animal Infectious Disease Laboratory, Nanjing Agricultural University, Nanjing 210095, China
非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)引起的一种急性、高度致死性的烈性传染病[1-2]。世界动物卫生组织(OIE)将其列为法定报告动物疫病,同时也是我国重点防范的一类动物疫病。该病于2018年8月在我国首次报道,对我国养殖业造成了巨大经济损失[3]。ASFV为二十面体对称的双链DNA病毒,是非洲猪瘟病毒科(Asfarviridae)、非洲猪瘟病毒属(Asfivirus)的唯一成员,该病毒基因组长度为170~190 kb,有150~167个开放阅读框[4]。ASFV的p72、p54和p30等结构蛋白均具有良好的抗原性和免疫原性[5-8],是ELISA等血清学诊断的重要靶点。目前,我国对该病的防控主要依赖于早期诊断、严格的运输控制及其他生物安全措施[9]。
ASF病原学诊断技术主要包括病毒分离[10]、红细胞吸附试验[11]、PCR[12]、real-time PCR[13]、重组酶聚合酶扩增(RPA)[14]等;血清学诊断技术主要有荧光抗体技术[15]、ELISA[16-17]、胶体金快速免疫层析法(GICA)[18]等。OIE将ELISA作为诊断ASF的首选血清学方法。国外已研发出几种ASFV诊断试剂盒[9, 19-21],比如p72蛋白间接ELISA诊断试剂盒(Ingenasa, 西班牙)和p30阻断ELISA诊断试剂盒(IDvet, 法国)。我国已研制成功ASFV p30蛋白抗体检测试剂盒。本研究采用ASFV Pig/HLJ/2018毒株重组p72蛋白及其单克隆抗体6E5,成功建立了阻断ELISA方法,该方法具有较高的敏感性和良好的特异性,为我国ASFV感染诊断和流行病学调查提供了有效方法。
1 材料与方法 1.1 细胞、菌株及主要试剂宿主菌BL21(DE3)、pET-28a-p72(1-329 aa)重组质粒、ASFV p72蛋白单克隆抗体6E5由本实验室制备、鉴定及保存。ASFV阳性血清、阴性血清及ASFV Pig/HLJ/2018灭活病毒液由中国农业科学院哈尔滨兽医研究所提供,其中,临床ASFV阳性血清来自黑龙江省的农业农村部公布病例。猪伪狂犬病病毒(PRV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪圆环病毒2型(PCV2)、A型塞内卡病毒(SVA)、猪口蹄疫病毒(FMDV)、大肠杆菌(Escherichia coil,E. coli)、多杀性巴氏杆菌(Pasteurella multocida,PM)、副猪格拉瑟菌(Glaesserrella parasuis,GPs)和胸膜肺炎放线杆菌(Actinobacillus pleuropeumoniae,APP)参考阳性血清均由本实验室收集保存。羊抗鼠IgG(H+L)-HRP、TMB溶液购自上海碧云天生物技术有限公司。HRP-葡萄球菌A蛋白(SPA)(HRP-SPA)购自武汉博士德生物工程有限公司。经欧盟ASFV参考实验室认证的ID ScreenⓇ African Swine Fever Competition ELISA试剂盒购自法国IDvet公司[22]。
1.2 重组p72蛋白的表达与纯化将重组质粒pET-28a-p72(1—329 aa)转化至BL21(DE3)中,加入终浓度为1 mmol·L-1IPTG诱导表达6 h,超声破碎,4 ℃ 12 000 r·min-1离心10 min,将沉淀与上清分别进行SDS-PAGE鉴定。重组p72蛋白经尿素透析法纯化[23]。将纯化的蛋白进行Western blot鉴定。重组p72蛋白经BCA法测定蛋白浓度后,保存于-80 ℃备用。
1.3 单克隆抗体的制备、纯化及辣根过氧化物酶(HRP)标记6E5单克隆抗体杂交瘤细胞株,由本实验室制备,小鼠单抗的亚型属于IgG1型[24]。
利用6E5杂交瘤细胞制备腹水,采用Western blot鉴定其与灭活的AFSV病毒液反应特性。将腹水送至南京金斯瑞生物科技有限公司进行纯化和HRP标记。酶量0.905 mg·mL-1,IgG量1.923 mg·mL-1,克分子比值(E/P)1.882,标记率59.89%,ELISA抗体效价为1∶51 200。将纯化后的单抗进行SDS-PAGE鉴定,并置于-80 ℃长期保存。
1.4 阻断ELISA最佳反应条件的选择用pH 9.6碳酸盐抗原包被液将重组p72蛋白稀释至终浓度为1.0、0.5、0.1 μg·mL-1,包被ELISA酶标板,每孔100 μL,于37 ℃ 2 h,4 ℃ 12 h,然后用PBST洗涤5次,每次1 min。分别用含5%脱脂乳、2%明胶、1%BSA和0.1%BSA的PBST溶液进行封闭,每孔200 μL,于37 ℃ 2 h,洗涤同上。将ASFV阳性血清和阴性血清用PBST进行1∶2、1∶4、1∶8稀释,每孔100 μL,于37 ℃ 1 h。洗涤后将酶标单抗HRP-6E5用PBST进行1∶2 000、1∶3 000、1∶4 000、1∶5 000稀释,每孔100 μL,于37 ℃作用1 h。洗涤同上,加入TMB底物,于37 ℃避光显色10 min,显色完成后每孔加入50 μL 2 mol·L-1硫酸终止显色。用酶标仪在450 nm处读取吸光度(OD)值。根据血清OD450 nm值计算阻断率,确定最佳反应条件。计算公式:
阻断率= [(阴性对照OD450 nm值-待检血清OD450 nm值)/ 阴性对照OD450 nm值]×100%。
1.5 阻断ELISA临界值的确定用本研究建立的阻断ELISA方法对119份ASFV阴性血清样品(经IDvet公司生产的ASFV抗体检测试剂盒检测验证)进行检测,计算阻断率,根据统计学方法,计算平均阻断率(x)和标准差(s),以判定该方法的临界值。
1.6 敏感性试验用本研究建立的阻断ELISA方法检测50份ASFV阳性血清(经IDvet公司生产的ASFV抗体检测试剂盒检测验证),以判定该方法的敏感性。
1.7 分析特异性试验用本研究建立的阻断ELISA方法检测已知的ASFV、PRV、PRRSV、CSFV、PCV2、SVA、FMDV、E. coli、PM、GPs和APP抗体阳性血清,以确定该方法的特异性。
1.8 重复性试验1.8.1 批内重复性试验 用同一批次表达的重组p72蛋白包被酶标板检测20份阳性样品和10份阴性样品,每份样品设置3个重复,计算批内变异系数(coefficient of variation, CV)。
1.8.2 批间重复性试验 用3个不同批次表达的重组p72蛋白包被酶标板检测20份阳性样品和10份阴性样品,计算批间变异系数,评价该方法的重复性。
1.9 临床血清样品检测与符合率试验用本研究建立的阻断ELISA方法和IDvet公司生产的ASFV抗体检测试剂盒同时检测447份临床猪血清样品,计算相对敏感性、相对特异性和符合率。计算公式:
相对敏感性(%)=[阳性样品数/(阳性样品数+假阴性样品数)]×100;
相对特异性(%)=[阴性样品数/(阴性样品数+假阳性样品数)]×100;
符合率(%)=[(阳性样品数+阴性样品数)/检测总数]×100。
2 结果 2.1 目的基因的克隆、表达与纯化将重组质粒转化至大肠杆菌BL21(DE3)感受态细胞,经IPTG诱导后,进行超声裂解,分别将上清和沉淀进行SDS-PAGE鉴定。结果显示,只有诱导沉淀组在40 ku处出现明显条带,大小与预期相符(图 1A),说明重组p72蛋白主要以包涵体的形式表达。通过尿素透析法纯化重组p72蛋白。将纯化后的目的蛋白进行Western blot鉴定,ASFV阳性血清用PBST进行1∶100倍稀释作为一抗,HRP-SPA用PBST进行1∶10 000倍稀释作为二抗,结果显示在40 ku处出现特异性条带(图 1B),表明重组p72蛋白具有良好的反应原性。
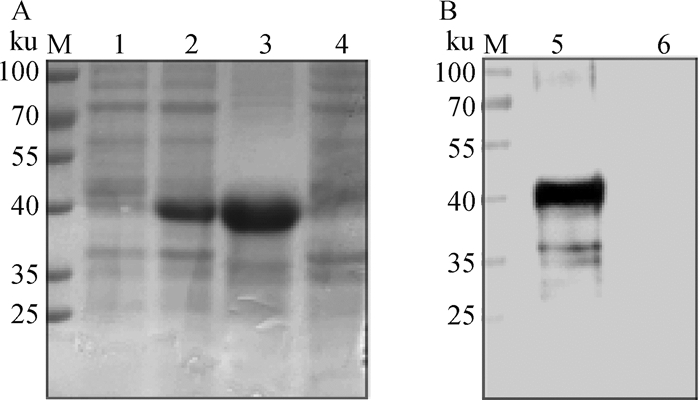
|
M.蛋白质相对分子质量标准;1.诱导上清;2.诱导沉淀;3.重组p72蛋白纯化后;4.BL21菌体裂解物对照;5.重组p72蛋白纯化后;6.BL21菌体裂解物对照 M. Protein marker; 1. Supernatant product with induction; 2. Precipitation product with induction; 3. Purified p72 recombinant protein; 4. BL21 bacteria lysis control; 5. Purified p72 recombinant protein; 6. BL21 bacteria lysis control 图 1 ASFV重组p72蛋白SDS-PAGE(A)和Western blot(B)鉴定结果 Fig. 1 SDS-PAGE (A) and Western blot (B) identification of ASFV p72 recombinant protein |
Western blot结果显示(图 2A), 6E5单克隆抗体能与灭活的ASFV发生特异性反应,在72 ku处有特异性的目的条带。纯化的6E5腹水SDS-PAGE鉴定结果(图 2B)显示,该抗体具有50 ku(重链)和25 ku(轻链)两个明显条带。HRP标记抗体(HRP-6E5)ELISA工作浓度为1∶4 000。
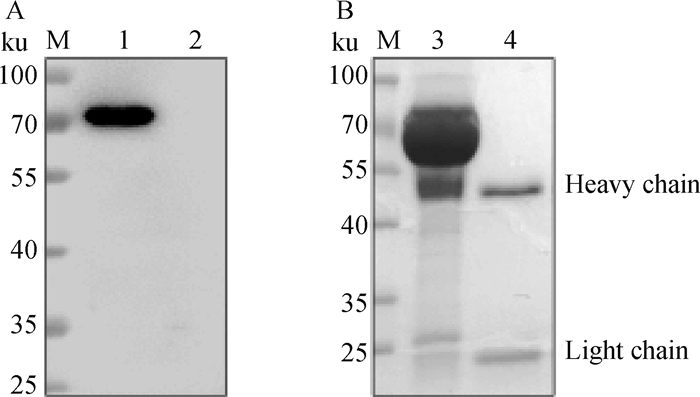
|
M.蛋白质相对分子质量标准;1.ASFV Pig/HLJ/2018灭活病毒液;2.猪肺泡巨噬细胞裂解物对照;3.小鼠腹水单抗6E5;4.纯化的小鼠腹水单抗6E5 M. Protein marker; 1. ASFV Pig/HLJ/2018 inactivated virus; 2. Porcine alveolar macrophages; 3.6E5 mAb ascites; 4. Purified 6E5 mAb 图 2 6E5单克隆抗体Western blot反应特性(A)及SDS-PAGE分析(B) Fig. 2 Identification of 6E5 monoclonal antibody with Western blot(A)and SDS-PAGE(B) |
通过对阻断ELISA方法的优化,最终确定:最佳抗原包被浓度为0.5 μg·mL-1;血清稀释度为1∶1(表 1),反应条件为37 ℃ 1 h;最佳封闭剂为1% BSA(表 2),反应条件为37 ℃ 2 h;酶标抗体稀释度为1∶4 000(表 3),反应条件为37 ℃ 1 h;TMB底物37 ℃ 10 min。
|
|
表 1 抗原包被浓度和血清稀释度的确定 Table 1 Determination of optimal concentration of antigen and dilution of serum |
|
|
表 2 最佳封闭液的确定 Table 2 Determination of optimal blocking buffer |
|
|
表 3 酶标单抗稀释度的确定 Table 3 Determination of optimal dilution of HRP-mAb |
利用本研究建立的阻断ELISA方法对119份猪阴性血清进行检测,ASFV阴性血清阻断率频率分布接近正态分布(图 3),经统计平均阻断率(x)为18.78%,标准差(s)为10.50%,x+2s=39.77%,x+3s=50.26%。按照临界值计算公式确定该方法的判定标准:当PI≥50%时判定为ASFV抗体阳性,当PI≤40%时判定为ASFV抗体阴性;当40%<PI<50%时判定为可疑,需重复检测1次,如果仍为可疑则判为阳性。
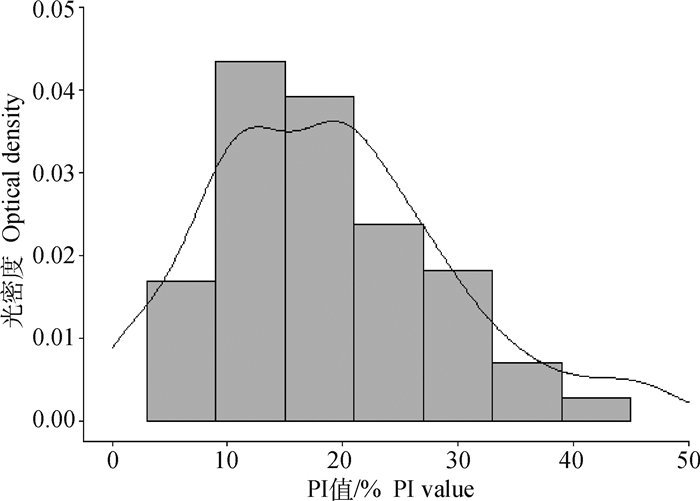
|
图 3 ASFV阴性血清阻断率频率分布分析 Fig. 3 Frequency distribution analysis of ASFV-negative serum percentage of inhibition |
选取50份ASFV阳性血清样品用本研究建立的阻断ELISA方法进行敏感性试验,结果显示,3份血清PI值为35.75%~37.49%,判为阴性,其余47份血清PI值58.01%~95.00%,判为阳性,表明该方法敏感性为94.0%。
2.6 特异性试验结果采用本研究建立的阻断ELISA方法检测ASFV、PRV、PRRSV、CSFV、PCV2、SVA、FMDV、E. coli、PM、GPs和APP抗体阳性血清,结果如表 4所示,除ASFV阳性血清检测结果为阳性外,其他均为阴性,证明该方法具有良好的特异性。
|
|
表 4 阻断ELISA特异性试验结果 Table 4 The specificity test results by the blocking ELISA |
选取20份ASFV阳性血清和10份ASFV阴性血清用本研究建立的阻断ELISA方法进行重复性试验。统计学分析结果显示:批内变异系数为0.78%~11.14%,批间变异系数为1.17%~11.56%,表明该方法具有良好的重复性。
2.8 符合率试验结果用本研究建立的阻断ELISA方法与IDvet公司生产的ASFV抗体检测试剂同时检测447份猪血清样品。结果如表 5所示,该方法与商品化试剂盒的相对敏感性为95.3%;相对特异性为94.5%;总符合率为94.9%。
|
|
表 5 阻断ELISA与商品化试剂盒符合率试验结果 Table 5 The coincidence tests results between the developed blocking ELISA and the commercial kit |
自2018年8月我国辽宁省沈阳市报告了首例ASF病例以来,该病迅速在全国范围内扩散,严重影响了我国的跨国贸易、食品安全及畜牧业的发展[3]。由于ASF的临床症状与经典猪瘟(CSF)、猪繁殖与呼吸综合征(PRRS)十分相似,无法通过临床症状和病理变化进行鉴别诊断[25]。因此,该病的确诊主要依靠实验室诊断。在病毒血清学检测技术中,ELISA抗体检测方法具有快速、敏感、便捷和批量化等优点,适用于大规模样品检测[17],故建立一种可靠的ELISA方法,对我国ASF疫情防控十分必要。
我国学者对ASFV抗体检测技术进行了一些研究,比如靳雯雯等[26]建立的ASFV VP73蛋白间接ELISA方法具有良好的特异性和敏感性,检测能力与进口试剂盒相当;曹琛福[27]构建的p54蛋白竞争ELISA抗体检测方法与西班牙Ingenasa试剂盒符合率为98.13%;张蕾等[28]根据p30、p54和p72蛋白设计了3条合成肽,建立了ASFV间接ELISA抗体检测方法,与进口商品化试剂盒的符合为92.9%。目前,针对ASFV p72蛋白的阻断ELISA抗体检测方法研究不多。ASFV检测抗原主要有p72、p30和p54蛋白等[29],其中,p72蛋白是ASFV中主要的结构蛋白,其氨基酸序列高度保守,在病毒复制周期中持续存在能够刺激机体产生较高滴度的抗体,是ASFV血清抗体阻断方法的理想靶标[30]。本实验室前期制备了12株抗p72蛋白的单克隆抗体,并通过阻断ELISA方法筛选鉴定出一株阻断效果良好的单克隆抗体6E5。本研究利用ASFV p72蛋白单克隆抗体6E5成功建立了ASF阻断ELISA抗体检测方法。该方法与PRV、PRRSV、CSFV、PCV2、SVA、FMDV、E. coli、PM、GPs和APP的参考阳性血清均不发生交叉反应,证明该方法具有较高的特异性。该方法的批内、批间试验变异系数均小于规定标准的15%,表明该方法的重复性良好。该方法与ID ScreenⓇ African Swine Fever Competition ELISA试剂盒同时检测447份猪临床血清样品,两者总符合率为94.9%。综上所述,本研究建立的ASF阻断ELISA抗体检测方法具有较好的敏感性和特异性,可用于临床血清学检测。
本研究采用的ASFV阳性血清和阴性血清来源于中国农业科学院哈尔滨兽医研究所,临床血清样品来源于规模化猪场。由于阳性血清样品的猪感染AFSV的时间等背景不够清晰,因此该方法能否用于病毒感染的早期诊断尚需进一步研究。
4 结论利用ASFV重组p72蛋白及其单克隆抗体6E5,成功建立了ASFV p72蛋白阻断ELISA检测方法,该方法具有良好的敏感性、特异性和重复性,为临床ASFV血清流行病学调查提供了技术手段。
| [1] |
GALINDO I, ALONSO C. African swine fever virus: a review[J]. Viruses, 2017, 9(5): 103. DOI:10.3390/v9050103 |
| [2] |
邓桦, 李慧, 杨鸿, 等. 急性非洲猪瘟的实验病理学研究[J]. 畜牧兽医学报, 2020, 51(11): 2836-2848. DENG H, LI H, YANG H, et al. Experimental pathological study of acute African swine fever[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(11): 2836-2848. (in Chinese) |
| [3] |
ZHOU X T, LI N, LUO Y Z, et al. Emergence of African swine fever in China, 2018[J]. Transbound Emerg Dis, 2018, 65(6): 1482-1484. DOI:10.1111/tbed.12989 |
| [4] |
WANG N, ZHAO D M, WANG J L, et al. Architecture of African swine fever virus and implications for viral assembly[J]. Science, 2019, 366(6465): 640-644. DOI:10.1126/science.aaz1439 |
| [5] |
NEILAN J G, ZSAK L, LU Z, et al. Neutralizing antibodies to African swine fever virus proteins p30, p54, and p72 are not sufficient for antibody-mediated protection[J]. Virology, 2004, 319(2): 337-342. DOI:10.1016/j.virol.2003.11.011 |
| [6] |
WU P, LOWE A D, RODRÍGUEZ Y, et al. Antigenic regions of African swine fever virus phosphoprotein P30[J]. Transbound Emerg Dis, 2020, 67(5): 1942-1953. |
| [7] |
LIU Q, MA B T, QIAN N C, et al. Structure of the African swine fever virus major capsid protein p72[J]. Cell Res, 2019, 29(11): 953-955. DOI:10.1038/s41422-019-0232-x |
| [8] |
PETROVAN V, MURGIA M V, WU P, et al. Epitope mapping of African swine fever virus (ASFV) structural protein, p54[J]. Virus Res, 2020, 279: 197871. DOI:10.1016/j.virusres.2020.197871 |
| [9] |
GIMÉNEZ-LIROLA L G, MUR L, RIVERA B, et al. Detection of African swine fever virus antibodies in serum and oral fluid specimens using a recombinant protein 30 (p30) dual matrix indirect ELISA[J]. PLoS One, 2016, 11(9): e0161230. DOI:10.1371/journal.pone.0161230 |
| [10] |
OURA C A L, EDWARDS L, BATTEN C A. Virological diagnosis of African swine fever—Comparative study of available tests[J]. Virus Res, 2013, 173(1): 150-158. DOI:10.1016/j.virusres.2012.10.022 |
| [11] |
GALLARDO C, FERNÁNDEZ-PINERO J, ARIAS M. African swine fever (ASF) diagnosis, an essential tool in the epidemiological investigation[J]. Virus Res, 2019, 271: 197676. DOI:10.1016/j.virusres.2019.197676 |
| [12] |
DE VILLIERS E P, GALLARDO C, ARIAS M, et al. Phylogenomic analysis of 11 complete African swine fever virus genome sequences[J]. Virology, 2010, 400(1): 128-136. DOI:10.1016/j.virol.2010.01.019 |
| [13] |
FERNÁNDEZ-PINERO J, GALLARDO C, ELIZALDE M, et al. Molecular diagnosis of African swine fever by a new real-time PCR using universal probe library[J]. Transbound Emerg Dis, 2013, 60(1): 48-58. DOI:10.1111/j.1865-1682.2012.01317.x |
| [14] |
王建昌, 王金凤, 刘立兵, 等. 非洲猪瘟病毒RPA等温检测方法的建立[J]. 中国动物检疫, 2016, 33(7): 78-81, 94. WANG J C, WANG J F, LIU L B, et al. Rapid and sensitive detection of African swine fever virus by recombinase polymerase Ampliifcation[J]. China Animal Health Inspection, 2016, 33(7): 78-81, 94. (in Chinese) |
| [15] |
BLOME S, GABRIEL C, BEER M. Pathogenesis of African swine fever in domestic pigs and European wild boar[J]. Virus Res, 2013, 173(1): 122-130. DOI:10.1016/j.virusres.2012.10.026 |
| [16] |
CUBILLOS C, GÓMEZ-SEBASTIAN S, MORENO N, et al. African swine fever virus serodiagnosis: A general review with a focus on the analyses of African serum samples[J]. Virus Res, 2013, 173(1): 159-167. DOI:10.1016/j.virusres.2012.10.021 |
| [17] |
BERGERON H C, GLAS P S, SCHUMANN K R. Diagnostic specificity of the African swine fever virus antibody detection enzyme-linked immunosorbent assay in feral and domestic pigs in the United States[J]. Transbound Emerg Dis, 2017, 64(6): 1665-1668. DOI:10.1111/tbed.12717 |
| [18] |
张鑫宇, 左伟勇, 朱善元, 等. 非洲猪瘟病毒p54抗体胶体金试纸检测方法的建立[J]. 中国预防兽医学报, 2014, 36(4): 281-285. ZHANG X Y, ZUO W Y, ZHU S Y, et al. Establishment of colloidal gold strip for detecting antibody against African swine fever virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(4): 281-285. (in Chinese) |
| [19] |
CARLSON J, ZANI L, SCHWAIGER T, et al. Simplifying sampling for African swine fever surveillance: assessment of antibody and pathogen detection from blood swabs[J]. Transbound Emerg Dis, 2018, 65(1): e165-e172. DOI:10.1111/tbed.12706 |
| [20] |
FREIJE J P, MUÑOZ M, VIÑUELA E, et al. High-level expression in Escherichia coli of the gene coding for the major structural protein (p72) of African swine fever virus[J]. Gene, 1993, 123(2): 259-262. DOI:10.1016/0378-1119(93)90134-O |
| [21] |
SASTRE P, GALLARDO C, MONEDERO A, et al. Development of a novel lateral flow assay for detection of African swine fever in blood[J]. BMC Vet Res, 2016, 12(1): 206. DOI:10.1186/s12917-016-0831-4 |
| [22] |
BLOME S, FRANZKE K, BEER M. African swine fever-a review of current knowledge[J]. Virus Res, 2020, 287: 198099. DOI:10.1016/j.virusres.2020.198099 |
| [23] |
孙海凤, 徐旋, 董静, 等. 猪源伪狂犬病病毒gB蛋白抗体阻断ELISA的建立与应用[J]. 中国兽医科学, 2018, 48(6): 712-716. SUN H F, XU X, DONG J, et al. Development of a blocking ELISA for the detection of gB protein antibodies against pseudorabies virus in swine[J]. Chinese Veterinary Science, 2018, 48(6): 712-716. (in Chinese) |
| [24] |
张路捷. 非洲猪瘟病毒p72和p30蛋白单克隆抗体研制及阻断ELISA抗体检测方法的建立[D]. 南京: 南京农业大学, 2021: 27-49. ZHANG L J. Preparation of monoclonal antibodies against p72 and p30 proteins of african swine fever virus and establishment of blocking ELISA[D]. Nanjing: Nanjing Agricultural University, 2021: 27-49. (in Chinese) |
| [25] |
LUNG O, FISHER M, ERICKSON A, et al. Fully automated and integrated multiplex detection of high consequence livestock viral genomes on a microfluidic platform[J]. Transbound Emerg Dis, 2019, 66(1): 144-155. DOI:10.1111/tbed.12994 |
| [26] |
靳雯雯, 杨俊兴, 花群俊, 等. 非洲猪瘟病毒抗体检测间接ELISA方法的建立[J]. 中国兽医学报, 2014, 34(7): 1043-1046. JIN W W, YANG J X, HUA Q J, et al. Development of an indirect enzyme-linked immunosorbent assay for detection antibody against African swine fever virus[J]. Chinese Journal of Veterinary Science, 2014, 34(7): 1043-1046. (in Chinese) |
| [27] |
曹琛福. 基于非洲猪瘟病毒P54蛋白抗原表位的ELISA检测方法建立及应用[D]. 广州: 华南农业大学, 2016: 49-61. CAO C F. Establishment and application of cELISA for detection of African swine fever based on p54 protein epitopes[D]. Guangzhou: South China Agricultural University, 2016: 49-61. (in Chinese) |
| [28] |
张蕾, 董春娜, 李静, 等. 非洲猪瘟病毒间接ELISA抗体检测方法的建立[J]. 病毒学报, 2020, 36(4): 670-674. ZHANG L, DONG C N, LI J, et al. Development of an ELISA based on synthetic peptides for detection of antibodies against the African swine fever virus[J]. Chinese Journal of Virology, 2020, 36(4): 670-674. (in Chinese) |
| [29] |
杨湛森, 蒋雅楠, 程楠, 等. 非洲猪瘟病毒检测方法的研究进展[J]. 分析测试学报, 2021, 40(5): 628-638. YANG Z S, JIANG Y N, CHENG N, et al. Research progress in detection methods for African swine fever[J]. Journal of Instrumental Analysis, 2021, 40(5): 628-638. (in Chinese) |
| [30] |
杨文兵, 邹亚文, 蒋一凡, 等. 非洲猪瘟血清学诊断靶点的研究进展[J]. 畜牧兽医学报, 2021, 52(5): 1208-1217. YANG W B, ZOU Y W, JIANG Y F, et al. Advances research on African swine fever serological diagnostic targets[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(5): 1208-1217. (in Chinese) |
(编辑 白永平)



