2. 公安部昆明警犬基地,昆明 650201;
3. 公安部警犬技术重点实验室,昆明 650201
2. Kunming Police Dog Base, Ministry of Public Security, Kunming 650201, China;
3. Key Laboratory of Police Dog Technology, Kunming 650201, China
昆明犬是我国自主培育的唯一的国产工作犬品种,由公安部昆明警犬基地培育,被国家畜禽品种认证为中国犬类的国家级畜禽新品种。昆明犬在治安防范、追踪、搜毒搜爆等多个警用领域发挥着巨大作用,是中国最优秀的工作犬品种之一[1]。昆明犬源自于20世纪50年代的云南本地狼犬(主体为本地犬和当时军警用德国牧羊犬的杂交后代)[2]。经过近70余年的群体继代选育及基础群建设,目前已经形成种群数量稳定及遗传多样性丰富的狼青、黑背、草黄3个品系的昆明犬群,现具有25个核心家系,遍布全国及东南亚、朝鲜、韩国、巴基斯坦等国家。我国广泛使用的工作犬品种还有源于欧洲的引进品种马里努阿犬和德国牧羊犬。马里努阿犬(简称马犬)是将进口马利诺斯犬(MALINOIS)的遗传特性进行改良,选育出符合中国气候环境、警用性能优越的中系马里努阿犬,其目前具有18个核心家系[3]。德国牧羊犬也是广泛使用的传统军警用犬,因其遗传和警用性能稳定而享誉世界。根据警用工作犬体型外貌、警用性能评定办法划分为普通家系和特异性家系。其中警用性能主要有胆量、兴奋性、占有性、跟随性等行为性状。由于近年来逐渐重视对国产工作犬品种的保种与遗传资源开发,因此利用基因组信息挖掘中国昆明犬与德国牧羊犬、马犬等引进品种的遗传关系及背景至关重要。
另外,由于家犬是人类亲密的伙伴之一,利用它们的认知和行为能力的差别[4-5],家犬被选择去完成各种各样的任务,如军警用、导盲、狩猎、放牧和陪伴犬,家犬的进化也经历了育种遗传多样性瓶颈效应[6-7],但目前大部分研究集中在控制体型[8]、身高[9]和被毛变化[10]的基因上,在警用工作犬品种人工选择中行为性状变化的遗传机制研究较少。基因芯片由于其价格实惠、高效便捷的特性而在动物遗传育种中广泛使用,Illumina CanineHD Beadchip芯片技术特有高度多态性SNPs,为品系内关联和拷贝数变异(CNV)研究提供了充足的SNP密度,具有均匀的基因组覆盖,可实现任何家犬品种遗传变异的检测。
本研究利用Illumina CanineHD Beadchip芯片对昆明犬、马里努阿犬、德国牧羊犬共计24头3个品种进行分析获得数据,并利用主成分(PCA)、STRUCTURE和邻接(NJ)树分析方法检测昆明犬的遗传群体结构,同时在基因组水平上充分挖掘昆明犬品种形成过程中可能受到选择的候选基因,为国内目前警犬品种的遗传资源保护和开发利用提供重要的参考依据。
1 材料与方法 1.1 试验材料试验共选取24头犬采集全血样本,对犬进行前肢静脉采血方法收集。选取样本为3个品种犬:其中采集昆明犬16头,采集马里努阿犬4头,采集德国牧羊犬4头,样本的遗传资源基本信息如表 1所示。血液样本用EDTA抗凝,-80 ℃保存,用于基因组DNA提取。
|
|
表 1 本试验采集犬的基本遗传信息 Table 1 The basic genetic information of dogs in this experiment |
血液基因组DNA提取试剂盒购自北京天根生化科技有限公司;EDTA、琼脂糖、DNA makerDL2000等均购自宝生物(大连)工程有限公司。
电泳仪购自北京六一仪器厂;凝胶成像系统购自Invitrogen公司;离心机购自Eppendorf公司;-80 ℃冰箱购自海尔公司;核酸质量检测仪购自Thermo公司
1.3 基因组DNA提取、纯化与分型利用血液基因组DNA提取试剂盒从血样中提取基因组DNA纯化后,采用Illumina CanineHD Beadchip芯片进行基因分型分析获得数据,用PLINK软件对芯片进行软件处理质控。
1.4 群体遗传结构分析采用PLINK[11]和Frappe软件进行群体结构分析,对24个犬个体进行K=2~5的分析(每个K 3个重复),用PLINK计算3个品种犬群体的杂合度和近交系数,马尔科夫蒙特卡洛(MCMC)计算的参数都将燃尽值设为20 000次,重复值设为30 000次。
1.5 聚类分析聚类分析之前,用PLINK软件的indep-pairwise选项进行SNP修剪(参数设为:25个SNPs为一个窗口,5个SNPs为一个步长,R2的阈值定为0.05)。PCA分析使用R语言包(http://www.r-project.org/)来进行主成分分析。
1.6 NJ进化树分析利用GENEPOP软件计算群体之间的两两距离,进行聚类分析,从而推断出种群间的亲缘关系远近。用Treebest[12]软件、邻接法(neighbor-joining methods)[13]构建个体NJ进化树。
1.7 滑动窗口位点筛选和基因注释通过在常染色体上设置500 kb的滑动窗口,选择每个窗口中具有最高最小等位基因频率(MAF)的SNPs位点,搜寻SNPs所在的基因区域。如果某个基因落在这个选择区段内,将这个基因定义为该行为性状差异的“候选基因”。若候选基因名称在两个数据库中有歧义,则按照Ensembl Genome Browser中所注释名称。基因注释通过R包完成,利用DAVID6.8(http://david.abcc.ncifcrf.gov/)[14]在线软件对选择出来的候选基因进行基因功能富集分析,分析的内容主要为基因功能聚类分析。
2 结果 2.1 SNP统计分析及质控结果基于芯片数据发现,最终有86 270个SNPs被筛选出来用于分析。SNP功能注释详见表 2,其中同义突变有782个,非同义突变有368个,非同义突变引起翻译提前终止5个,共有1 154个SNPs突变位于外显子区。
|
|
表 2 犬芯片SNP信息统计 Table 2 Statistics of Illumina CanineHD Beadchip SNP of dog |
基于贝叶斯模型的聚类算法来检测3个警犬品种基因组群体的分离程度(图 1),当假设有两个祖先群体(K=2)时,德国牧羊犬(DM)和其他品种犬完全区分开来;当K=3时马里努阿犬(ML)、昆明犬、德国牧羊犬可以区分开来,但昆明犬黑背品系(KH)中混有25.1%德国牧羊犬杂合。当K=4时,昆明犬品种中狼青品系(KL)、草黄品系(KC)从昆明犬中分离出来。昆明犬品种中黑背品系(KH)与其他群体间的亲缘关系很近,其中含有10.2%德国牧羊犬杂合,含有37.1%狼青品系杂合,含有35.2%的草黄品系杂合。当K=5时昆明犬品种中狼青品系的A1家系(KL01-04)和A2家系(KL05-08)可以分离出来,昆明犬黑背品系(KH)较难区分出来。
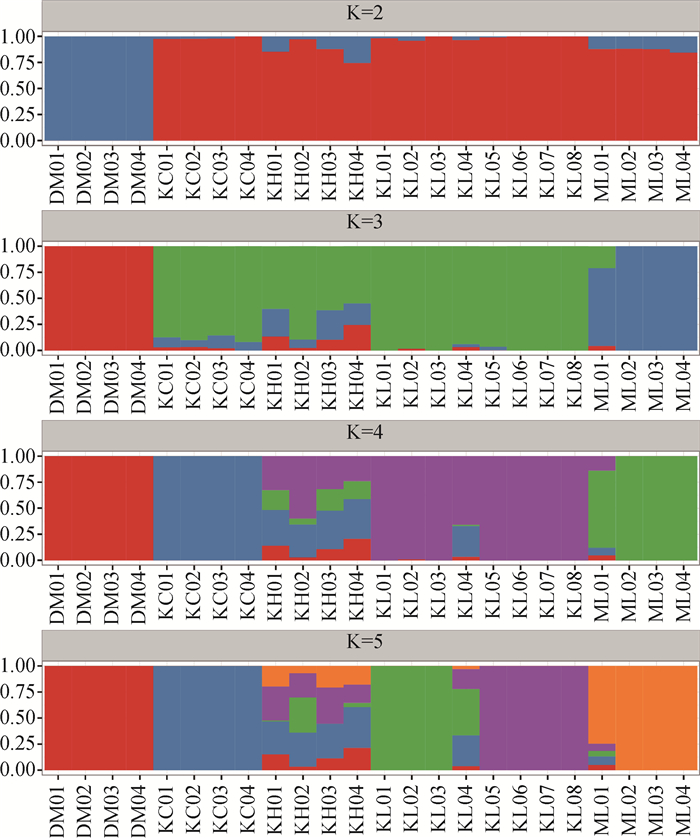
|
每种颜色代表一个群体,每个竖线块代表一个样本。横坐标为样本编号,纵坐标代表在祖先群体中所占的比例 Each color represents a population, and each vertical block represents a sample. The abscissa is the sample number, and the ordinate represents the proportion in the ancestral population 图 1 3个警犬品种K=2~5时STRCUTRUE群体结构 Fig. 1 Population structure of 3 police dog breeds of K=2-5 |
德国牧羊犬(DM)、昆明犬品种中黑背品系(KH)、草黄品系(KC)和狼青品系(KL)、马里努阿犬(ML)几个群体共24个个体进行杂合度和近交系数分析(表 3)。群体平均HO、HE均小于0.5,说明几个群体均受到一定程度的选择。其中德国牧羊犬(DM)的HO最小0.247 2,其近交系数(F)值最高0.036 47。其次是马犬(ML)的HO为0.264 4,其近交系数(F)值为0.034 16,与德国牧羊犬差异不大,但高于昆明犬3个品系群体的F值。昆明犬中黑背品系(KH)的平均HO值最高为0.382 1,近交系数(F)值为0.021 88,草黄品系(KC)和狼青品系(KL)的HO值略低于黑背品系(KH)。
|
|
表 3 3个品种犬群体的杂合度和近交系数 Table 3 Heterozygosity and inbreeding coefficient of 3 dog breeds |
通过主成分分析(principal components analysis,PCA)的方法估计了3个品种犬的群体结构(图 2)。与STRUCTURE结果相符,第一、二主成分能将德国牧羊犬(DM)、马里努阿犬(ML)、昆明犬清楚地分开(图 2A),PC1可以解释原所有变量(所有SNP)总体方差的16.93%,PC2、PC3分别占总变异的12.40%和9.25%。另外,与STRUCTURE分析K=4的结果相比,PCA的第一、第三成分已能很好地将昆明犬品种中狼青品系(KL)、草黄品系(KC)、黑背品系(KH)从昆明犬中明显分离出来,两个主成分(PC1和PC3)黑背品系与狼青品系存在一定程度的混合(图 2B)。
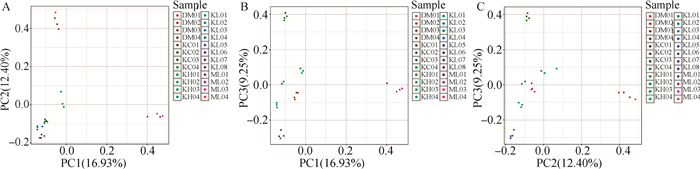
|
坐标轴标签括号中的数值代表主成分解释总体方差的百分比 The values in brackets on the axis label represent the percentage of the overall variance explained by the principal component 图 2 3个警犬品种群体PCA分析 Fig. 2 PCA analysis of 3 police dog breeds |
NJ树结果如图 3显示,主要由3大分支组成,分别为德国牧羊犬(DM)、昆明犬和马里努阿犬(ML)。昆明犬3个品系主要在一个主要分支中,其中昆明犬草黄品系(KC01-04)聚为一支,昆明犬品种中黑背品系(KH01、03、04)聚为一支,昆明犬品种中狼青品系的A1家系(KL01-04)和A2家系(KL05-08)各聚为一支。
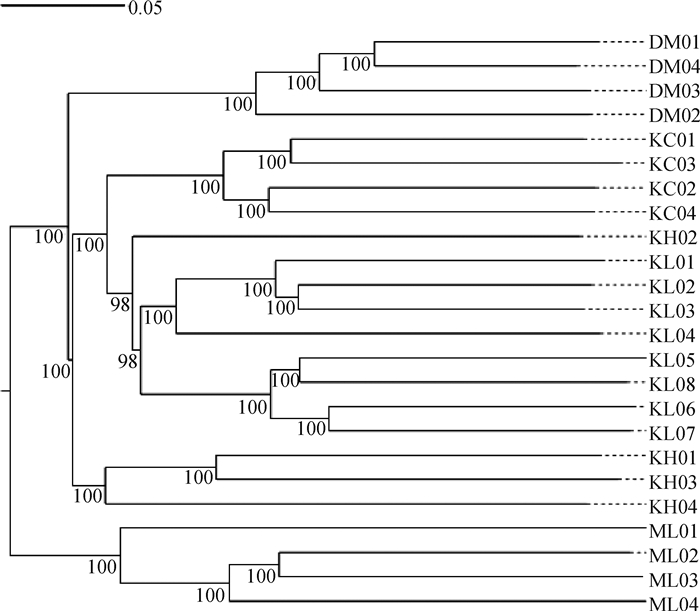
|
图 3 3个警犬品种群体系统发育进化树 Fig. 3 NJ-TREE of the 3 police dog breeds |
为了避免每条染色体的开始/结束端缺少侧翼标记信息,每条染色体开始和结束端的SNP标记必须选择。最后,选择了昆明犬554个具有高MAF的信息SNPs位点。将这些区域注释后,得到22个在昆明犬品种形成过程中可能受到选择的候选基因。用DAVID Bioinformatics Resource.(6.8)对可能受到选择的22个候选基因进行功能聚类分析发现(表 4),在昆明犬与其他品种分离后,其基因组中有两个类别的基因受到了正选择。第一类是与腺苷酸环化酶活化g蛋白偶联受体信号通路相关的基因及蛋白,包括腺苷酸环化酶2(ADCY2)、腺苷酸环化酶3(ADCY3)、腺苷酸环化酶8(ADCY8)。另一类是在神经元轴突的生长锥中具有聚合和稳定微管的功能,影响轴突和前导突起生长的相关基因。其中在脑发育过程中,候选基因FGF13调控神经元的迁移、大脑皮层和海马组织结构的形成,从而影响学习与记忆等脑功能[15]。
|
|
表 4 昆明犬中受正选择作用基因的功能聚类分析 Table 4 Functional cluster analysis of genes affected by positive selection in Kunming dogs |
本研究对3个中国主要警犬品种的共计24个个体(其中包含昆明犬狼青、黑背、草黄3种品系)用Illumina CanineHD Beadchip芯片进行基因分型,同时运用群体PCA主成分分析、STRUCTURE分析和NJ树进行了群体遗传分析。其中,昆明犬狼青品系(KL)、黑背品系(KH)、草黄品系(KC)3个品系有相似的体型和行为,不同的只是毛色。雄性成年个体体高在65~70 cm之间,而雌性成年个体体高在60~65 cm之间。狼青品系(KL)全都是黑色、黄色和灰色被毛,而黑背品系(KH)是黑色的背部和黄色的腹部和四肢,草黄品系(KC)主要是黄色被毛,少量黑色被毛。马里努阿犬(ML)被毛短,全身褐色,头面部黑色,体型外形匀称呈方形。德国牧羊犬(DM)被毛稍长,基本是黑背黄腹,雄性成年个体体高在60~65 cm之间,性情温良,服从命令,警惕性高,被广泛用于军警方面(图 4)。

|
A.昆明犬狼青品系(KL);B.昆明犬黑背品系(KH);C.昆明犬草黄品系(KC);D.马里努阿犬(ML);E.德国牧羊犬(DM) A. Kunming dog wolf-black strain (KL); B. Kunming dog back-black strain (KH); C.Kunming dog yellow train (KC); D. Belgian malinois (ML); E. German shepherd dog (DM) 图 4 3个工作犬品种的体形外貌特征 Fig. 4 Physical appearance of 3 police working dog breeds |
已有研究表明,家犬是一个由于人类驯化活动和迁徙运动产生的特殊物种[16],家犬起源学说也证明现代犬种历经了两个驯化阶段,既第一次由灰狼到家犬的驯化,以及第二次强力选择下的品系形成过程才形成了千差万别的400多个丰富的家犬品种[17]。本研究结果表明,当假设有两个祖先群体(K=2)时,德国牧羊犬(DM)和其他品种犬完全区分开来;当假设有3个群体(K=3)时,昆明犬(包含狼青品系、草黄品系、黑背品系)与马里努阿犬(ML)、德国牧羊犬(DM)可以分离开来。这也是由于欧洲随着工业革命的兴起,生产力逐渐剩余,人工选择开始倾向于由犬帮助人类进行警戒、守卫活动和以聪慧易于服从的大脑偏好为选种选育目标进而形成多品种的工作犬[18]。根据本研究结果,昆明犬存在部分与德国牧羊犬的杂合成分,表明昆明犬与德国牧羊犬群体间存在亲缘关系,这与前人对中国地方狼犬与德国牧羊犬毛色的遗传规律研究结果吻合[19]。尤其是昆明犬的黑背品系,是通过早期与德国牧羊犬黑背品系杂交选育得来的。由于昆明犬品种选育中引入了拥有优良性状的品种进行杂交,因此昆明犬黑背品系的杂合度高,近郊系数低,遗传多样性丰富。另外两个品系与马犬、德牧的遗传关系较远,可以明显分离出来。而马犬、德牧在长时间定向选育中,有效群体数量逐渐减少,群体遗传变异水平降低,杂合度降低,近交系数升高,遗传多样性降低。3个品种警犬平均HO和HE均小于0.5,说明3个群体均受到的强烈选择。草黄品系(KC)和狼青品系(KL)的HO值略低于黑背品系(KH),群体遗传分析能够区分群体的生理差异和地理起源,对应本研究中,昆明犬3个品系聚在一个分支中,但昆明犬草黄品系(KC)、黑背品系(KH)、狼青品系(KL)均存在一定程度的分化,本结果对3个中国主要警犬品种的遗传结构进行了说明。但本试验样本数量偏少,德国牧羊犬和马犬两个犬种分别选择4个有代表性的核心群样本,对群体遗传结构说明支撑力不足。
3.2 昆明犬品种中受选择的基因本试验筛选昆明犬基因组上的选择信号,利用基因功能富集分析发现了可能受到选择的重要候选基因。通过与基因组数据信息进行比对和基因注释共找到了22个选择信号候选基因。通过富集分析发现,第一类是与参与腺苷酸环化酶活化g蛋白偶联受体信号通路的基因及蛋白,包括腺苷酸环化酶2(ADCY2)、腺苷酸环化酶3(ADCY3)、腺苷酸环化酶8(ADCY8)基因。与犬ADCYs同源的基因在人的大脑组织中特异性高表达[20]。已有研究表明,跨膜腺苷酸环化酶(Adcy)参与脑中突触可塑性、多发性的形成,如学习和记忆的调节。它们合成由G蛋白偶联受体活化的细胞内环磷酸腺苷(cAMP)。Sanabra和Mengod[21]通过原位杂交检查大鼠和小鼠大脑9个ADCYs亚型的神经解剖分布证明了ADCYs在大鼠和小鼠脑的皮质、海马、丘脑核、嗅觉系统和小脑颗粒层中广泛分布。
本研究还明确揭示了在昆明犬受选择基因中的钙/钙调素依赖蛋白激酶2α(CAMK2A/II)、蛋白激酶(APRKX)和激腺苷酸环化酶(ADCY3),这3个基因均存在于嗅觉传导(olfactory transduction)通路中。研究表明,CaMKII能增强控钠通道的电活性和神经元兴奋性,ADCY3在大鼠增强突触可塑性中发挥重要作用,与恐惧相关的学习记忆和长期记忆巩固有关,在控制学习和记忆机制中起着重要作用[22-23],对昆明犬利用嗅觉进行鉴别的科学意义重大。已有研究表明,CaMKⅡ alpha亚型(CaMKⅡα)是在小鼠脑中特异并且大量表达,在缺乏CaMKIIα 3′UTR的小鼠中,CaMKIIα mRNA的树突状定位表达被破坏,嗅觉关联学习受到严重损害。因此揭示了CaMKIIα局部翻译是作为嗅觉可塑性的决定因素。Daroles等[24-25]通过比较中国土狗和比格猎犬在慢性应激刺激和不应激刺激两种条件下肾上腺皮质和垂体的转录组分析,证明了CaMKII2、GRM1等基因是通过控制下丘脑-垂体-肾上腺轴调节的关键基因,进而影响中国土狗和比格猎犬经受压力刺激时表现出不同应激反应耐受的差异。
另一类候选基因是在神经元轴突的生长锥中具有聚合和稳定微管的功能,影响轴突和前导突起的生长;在脑发育过程中,FGF13调控神经元的迁移、大脑皮层和海马组织结构的形成,从而影响学习与记忆等脑功能[26-27]。在小鼠上的试验证实,FGF13基因敲除小鼠由于神经元迁移迟滞造成大脑皮层和海马结构分层异常,学习记忆能力受到明显损害[15, 28]。结合本研究的结果,上述基因在犬上均未有明确的功能验证,以往的工作犬行为学研究普遍认为犬胆量本质上是适应和克服恐惧的能力,本研究结果表明,犬在受选择过程中与大脑功能偏好的基因在大脑的学习和记忆功能起到了重要作用。后续会继续开展警犬受选择基因的表达验证和功能研究,探究影响胆量、嗅觉学习等犬的警用行为性状的大脑遗传机制。
4 结论本研究分析了昆明犬的的群体遗传结构,探讨了3种警用工作犬品种的遗传关系。同时得到了22个在昆明犬品种形成过程中可能受到选择的候选基因。本试验挖掘的相关基因证明了昆明犬受到了强烈的人工选择进而产生了对影响应激反应、嗅觉学习记忆性能的调控。针对受选择基因,在后续应通过功能性验证来证明上述基因在昆明犬学习、记忆方面发挥的重要作用。本研究为国内警用工作犬的种质资源开发利用提供了重要理论依据。
| [1] |
黎立光, 强京宁, 宋兴国, 等. 昆明犬的研究综述[J]. 中国工作犬业, 2007(1): 13-15. LI L G, QIANG J N, SONG X G, et al. Research review of Kunming dogs[J]. China Working Dog, 2007(1): 13-15. DOI:10.3969/j.issn.1673-0135.2007.01.006 (in Chinese) |
| [2] |
WANG G D, CHENG L G, FAN R X, et al. Signature of balancing selection at the MC1R gene in Kunming Dog populations[J]. PLoS One, 2013, 8(2): e55469. DOI:10.1371/journal.pone.0055469 |
| [3] |
黄庆国, 李居东, 汪斌, 等. 中系马里努阿犬家系选育模式探索与实践[J]. 中国畜禽种业, 2019, 15(4): 71-73. HUANG Q G, LI J D, WANG B, et al. Exploration and practice of breeding model of malinua lineages[J]. The Chinese Livestock and Poultry Breeding, 2019, 15(4): 71-73. DOI:10.3969/j.issn.1673-4556.2019.04.057 (in Chinese) |
| [4] |
WANG G D, ZHAI W W, YANG H C, et al. Out of southern East Asia: the natural history of domestic dogs across the world[J]. Cell Res, 2016, 26(1): 21-33. DOI:10.1038/cr.2015.147 |
| [5] |
MACLEAN E L, SNYDER-MACKLER N, VONHOLD B M, et al. Highly heritable and functionally relevant breed differences in dog behaviour[J]. Proc Biol Sci, 2019, 286(1912): 20190716. |
| [6] |
WU C I, WANG G D, XU S H. Convergent adaptive evolution—how common, or how rare?[J]. Natl Sci Rev, 2020, 7(6): 945-946. DOI:10.1093/nsr/nwaa081 |
| [7] |
YANG Q Y, CHEN H, YE J H, et al. Genetic diversity and signatures of selection in 15 Chinese indigenous dog breeds revealed by genome-wide SNPs[J]. Front Genet, 2019, 10: 1174. DOI:10.3389/fgene.2019.01174 |
| [8] |
SLAVNEY A J, KAWAKAMI T, JENSEN M K, et al. Five genetic variants explain over 70% of hair coat pheomelanin intensity variation in purebred and mixed breed domestic dogs[J]. PLoS One, 2021, 16(5): e0250579. DOI:10.1371/journal.pone.0250579 |
| [9] |
SUTTER N B, BUSTAMANTE C D, CHASE K, et al. A single IGF1 allele is a major determinant of small size in dogs[J]. Science, 2007, 316(5821): 112-115. DOI:10.1126/science.1137045 |
| [10] |
QUIGNON P, SCHOENEBECK J J, CHASE K, et al. Fine mapping a locus controlling leg morphology in the domestic dog[J]. Cold Spring Harb Symp Quant Biol, 2009, 74: 327-333. DOI:10.1101/sqb.2009.74.009 |
| [11] |
PURCELL S, NEALE B, TODD-BROWN K, et al. PLINK: a tool set for whole-genome association and population-based linkage analyses[J]. Am J Hum Genet, 2007, 81(3): 559-575. DOI:10.1086/519795 |
| [12] |
VILELLA A J, SEVERIN J, URETA-VIDAL A, et al. EnsemblCompara GeneTrees: complete, duplication-aware phylogenetic trees in vertebrates[J]. Genome Res, 2009, 19(2): 327-335. DOI:10.1101/gr.073585.107 |
| [13] |
SAITOU N, NEI M. The neighbor-joining method: a new method for reconstructing phylogenetic trees[J]. Mol Biol Evol, 1987, 4(4): 406-425. |
| [14] |
SELZER P M, MARHOFER R J, ROHWER A. DAVID bioinformatics resource[Z]. 2008.
|
| [15] |
WU Q F, YANG L, LI S, et al. Fibroblast growth factor 13 is a microtubule-stabilizing protein regulating neuronal polarization and migration[J]. Cell, 2012, 149(7): 1549-1564. DOI:10.1016/j.cell.2012.04.046 |
| [16] |
ZHANG M, SUN G P, REN L L, et al. Ancient DNA evidence from china reveals the expansion of pacific dogs[J]. Mol Biol Evol, 2020, 37(5): 1462-1469. DOI:10.1093/molbev/msz311 |
| [17] |
ZHANG S J, WANG G D, MA P C, et al. Genomic regions under selection in the feralization of the dingoes[J]. Nat Commun, 2020, 11(1): 671. DOI:10.1038/s41467-020-14515-6 |
| [18] |
PARKER H G, DREGER D L, RIMBAULT M, et al. Genomic analyses reveal the influence of geographic origin, migration, and hybridization on modern dog breed development[J]. Cell Rep, 2017, 19(4): 697-708. DOI:10.1016/j.celrep.2017.03.079 |
| [19] |
潘寿文, 颜泽清. 中国地方狼犬与德国牧羊犬杂交育种毛色遗传规律的研究[J]. 中国畜牧兽医, 2009, 36(1): 80-82. PAN S W, YAN Z Q. The research on cross-breeding genetic laws of hair color between China local wolf-dog and German shepherd dog[J]. China Animal Husbandry & Veterinary Medicine, 2009, 36(1): 80-82. (in Chinese) |
| [20] |
BARROSO I. ADCY3, neuronal primary cilia and obesity[J]. Nat Genet, 2018, 50(1): 166-167. |
| [21] |
SANABRA C, MENGOD G. Neuroanatomical distribution and neurochemical characterization of cells expressing adenylyl cyclase isoforms in mouse and rat brain[J]. J Chem Neuroanat, 2011, 41(1): 43-54. DOI:10.1016/j.jchemneu.2010.11.001 |
| [22] |
STENGEL D, PARMA J, GANNAGÉ M H, et al. Different chromosomal localization of two adenylyl cyclase genes expressed in human brain[J]. Hum Genet, 1992, 90(1-2): 126-130. |
| [23] |
WOLF E J, RASMUSSON A M, MITCHELL K S, et al. A genome-wide association study of clinical symptoms of dissociation in a trauma-exposed sample[J]. Depress Anxiety, 2014, 31(4): 352-360. DOI:10.1002/da.22260 |
| [24] |
DAROLES L, GRIBAUDO S, DOULAZMI M, et al. FMRP and dendritic local translation of αCaMKⅡ mRNA are required for the structural plasticity underlying olfactory learning[J]. Biol Psychiatry, 2015, 80(2): 149-159. |
| [25] |
LUO W, FANG M X, XU H P, et al. Transcriptome comparison in the pituitary-adrenal axis between beagle and Chinese Field dogs after chronic stress exposure[J]. Anim Genet, 2015, 46(5): 522-534. DOI:10.1111/age.12325 |
| [26] |
PAN X Y, WU Q F, YANG L, et al. Roles of FGF13 in the regulation of neuronal spine development in mouse brain[C]// Proceedings of the 10th Biennial Conference of the Chinese Neuroscience Society. Beijing: Chinese Society of Neuroscience, 2013: 468.
|
| [27] |
FRY A E, MARRA C, DERRICK A V, et al. Missense variants in the N-terminal domain of the A isoform of FHF2/FGF13 cause an X-linked developmental and epileptic encephalopathy[J]. Am J Hum Genet, 2021, 108(1): 176-185. DOI:10.1016/j.ajhg.2020.10.017 |
| [28] |
YUNA B, CHENG T L, YANG K, et al. Autism-related protein MeCP2 regulates FGF13 expression and emotional behaviors[J]. J Genet Genomics, 2017, 44(1): 63-66. DOI:10.1016/j.jgg.2016.10.004 |
(编辑 郭云雁)



