2. 四川省草原科学研究院,成都 611731
2. Sichuan Academy of Grassland Sciences, Chengdu 611731, China
IGFBPs是IGFs的重要组成之一,通过与IGF配体、IGF受体之间的相互作用,共同调节机体的生长发育,参与脊椎动物生长、新陈代谢、生殖和免疫等调控过程[1-3]。IGFBP4作为构成动物GH/IGF生长轴的重要成员,能促进正常细胞增殖、分化、代谢等多种生理过程,同时能抑制癌细胞增殖和生存,诱导癌细胞凋亡[4-5]。IGFBP4主要在肝实质细胞合成,既可依赖于IGF又可独立于IGF发挥其生物学作用[6-7]。IGFBP4依赖作用表现在与IGF具有较强的亲和力,可与IGF结合调节生物活性[8-9]。在与非IGF系统蛋白相互作用下,IGFBP4可促进细胞增殖、代谢,体现其独立性,并可通过激活PI3K-Akt信号通路促进细胞分化[4, 10]。
牦牛(Bos grunniens)是我国青藏高原高山牧区特有的畜牧种质资源,常年生活在气候寒冷、高度缺氧、牧草缺少、强紫外线等极端生态环境中,是乳肉兼用高原型地方优良品种,也是我国动物遗传资源中珍稀的畜种资源和基因库[11-13]。肝是哺乳动物机体内最大的消化腺及代谢器官,利用内分泌因子不断调节新陈代谢平衡,在各种营养/有害物质代谢、蛋白质合成和消化液合成等过程中发挥重要功能[14-16]。动物生长发育过程中,外源性细胞色素P450等生物活性物质可对肝的成熟和代谢进行调节[17-18]。研究发现,IGFBP4参与了肝细胞的损伤再修复过程[19]。迄今为止,关于IGFBP4的研究多集中在mRNA水平的表达调控,尚未见IGFBP4在牦牛肝生长发育中作用的相关研究。
本研究以麦洼牦牛为试验对象,构建pET-28a-BgIGFBP4原核表达载体,对其进行诱导表达及鉴定,并探究IGFBP4蛋白对牦牛肝细胞及对小鼠生长的影响,为进一步研究IGFBP4在牦牛肝生长发育过程中的作用提供基础数据,为深入研究IGFBP4的生物学功能提供科学参考。
1 材料与方法 1.1 主要试剂及仪器Gel Extraction Kit购自美国Omega Bio-Tek公司;Nco Ⅰ、Xho Ⅰ限制性内切酶、T4连接酶购自日本TaKaRa公司;Protein Marker、大肠杆菌BL21(DE3)感受态细胞购自北京擎科公司;His标签蛋白纯化试剂盒、抗His标签鼠单克隆抗体购自北京康为世纪公司;BCA Protein Assay Kit购自北京天根公司;ECL发光试剂(C510043)、CCK8试剂盒(E606335)购自上海生工公司;小鼠生长激素(YX-E28736)、胰岛素(YX-E20353)、血管内皮生长因子(YX-E20260)ELISA检测试剂盒、牦牛生长激素(YX-E28725)、胰岛素(YX-E28749)、血管内皮生长因子(YX-E28788)ELISA检测试剂盒购自成都鹏世达公司。
稳压稳流电泳仪(型号为DYY-6B)购自北京市六一仪器厂;冷冻离心机(型号为5430R)购自德国Eppendorf公司;凝胶成像系统(型号为Universal Hood Ⅱ)、实时荧光定量PCR仪(型号为CFX96)、半干转膜仪(型号为Trans-Blot TurboTM System)、免染蛋白印迹转运系统(型号为ChemiDocTM Imaging System)、酶标仪(型号为iMarkTM)购自美国Bio-Rad公司;紫外可见分光光度计BioSpec-nano购自日本岛津生命科学公司;二氧化碳培养箱(型号为3131)、细胞计数仪(型号为CountessⅡ)购自美国Thermo公司。
1.2 原核表达载体的构建将本实验室已扩增得到的阳性PCR产物回收、纯化(引物序列为:F: GGGTACCATGCTGTCCCTCTGCCTC,R: CGGATCCTCACTCTCGGA-AGCTGTCAG),再用Nco Ⅰ、Xho Ⅰ限制性内切酶对回收产物和pET28a载体进行双酶切。酶切体系为:目的片段/pET28a载体12 μL,Nco Ⅰ、Xho Ⅰ各3 μL,1×K buffer 2 μL。混匀后37 ℃金属浴酶切6 h,再16 ℃金属浴连接12 h。连接体系为:目的片段15.5 μL,pET28a载体1.5 μL,T4连接酶1 μL,T4连接酶buffer 2 μL。将连接产物转化至大肠杆菌BL21感受态细胞,复苏后涂布于含0.1% Kana+(50 μg·mL-1)的LB培养基上37 ℃培养12 h,挑单菌落液体培养4 h。经菌液PCR鉴定后,将阳性克隆菌液送生工生物工程(上海)股份有限公司测序。
1.3 蛋白表达、纯化及鉴定将成功克隆的pET28a-BgIGFBP4菌株37 ℃培养至OD600 nm值在0.6~0.7时,分别加入0.25、0.5、1、1.5、2 mmol·L-1 IPTG诱导,取pET28a空载、未诱导和诱导12 h的菌液进行SDS-PAGE。将pET28a-BgIGFBP4菌株扩大诱导300 mL,加入PBS超声破碎菌体,离心后向沉淀中加入含8 mol·L-1尿素的Binding Buffer进行溶解,将离心得到的上清过滤后负载上柱,收集洗脱液进行SDS-PAGE,并按照BCA Protein Assay Kit进行浓度检测。取纯化得到的BgIGFBP4蛋白经SDS-PAGE分离后进行His标签鉴定,以25 V转膜30 min,5%脱脂奶粉封闭,先后孵育His标签一抗(4 ℃过夜,1:4 000) 和IgG-HRP二抗(室温1 h,1:10 000),利用化学发光液进行ECL显色并拍照。
1.4 BgIGFBP4蛋白对牦牛肝细胞增殖活性及集落形成能力的影响取对数生长期细胞,每组5个重复。试验组用“1.3”中获得的0.002、0.02、0.2、2、20 μg·mL-1 BgIGFBP4蛋白处理牦牛肝细胞,用不加目的蛋白的正常培养细胞作为对照组、不含细胞的培养液作为空白组,置于37 ℃培养24 h后,添加CCK8试剂检测其吸光度值。再选择增殖活性最佳的处理浓度2 μg·mL-1BgIGFBP4处理牦牛肝细胞24、48、72 h,同上设置对照组和空白组置于37 ℃培养,再检测吸光度值。
取对数生长期的牦牛肝细胞,每组3个重复。试验组用2 μg·mL-1 BgIGFBP4蛋白处理细胞,用不加目的蛋白的正常培养细胞作为对照组,置于37 ℃培养1周。当观察到肉眼可见的集落时,终止培养。结晶紫染色具体操作步骤同参考文献[20]。最后计算集落形成率(%):集落形成率=(集落数/接种细胞数)×100。
1.5 BgIGFBP4蛋白对牦牛肝细胞生长类激素含量的影响取对数生长期的牦牛肝细胞,每组3个重复。试验组用2 μg·mL-1 BgIGFBP4蛋白处理细胞,用不加目的蛋白的正常培养细胞作为对照组。置于37 ℃培养24、48、72 h后,收集对照组和试验组中细胞上清,按照ELISA试剂盒说明书测定牦牛肝细胞生长激素(growth hormone,GH)、血管内皮生长因子(vascular endothelial growth factor,VEGF)的含量变化。
1.6 BgIGFBP4蛋白对牦牛肝细胞PI3K-Akt信号通路相关生长因子表达的影响将“1.5”中培养的细胞去上清,收集对照组和试验组中细胞。每孔加入1 mL RNAiso Plus,用细胞刮板刮下细胞,提取细胞总RNA,合成cDNA保存备用。以β-actin作为内参基因,qRT-PCR引物详见表 1。扩增体系为:模板1 μL,上、下游引物各0.8 μL,ddH2O 2.2 μL,酶5.2 μL。扩增程序为:95 ℃ 3 min;95 ℃ 10 s,Tm 20 s,72 ℃ 20 s,共39次循环;熔解曲线65~95 ℃每5 s增加0.5 ℃。
|
|
表 1 牦牛基因引物序列 Table 1 Primer sequence for amplifying yak genes |
为探究BgIGFBP4蛋白对小鼠生长性能的影响,取30日龄((18±1)g)健康雄性KM小鼠。饲养环境符合试验动物环境设施要求:温度(23 ±3)℃,相对湿度(50±15)%。在饲养过程中,垫料、笼等器具均进行高压真空灭菌,垫料48 h更换一次,自由饮水。试验组每2 d灌喂100 μL 50 μg·mL-1 BgIGFBP4蛋白,对照组用等量的0.9%生理盐水进行灌喂,每组40只,共80只。试验前进行饥饿处理12 h,试验周期28 d。每天早晨记录小鼠采食量,试验28 d时空腹12 h后测定小鼠的体重,断头处死后剖取小鼠心、肝、脾、肺、肾和小肠称重。计算试验期间小鼠的平均日增重、平均日采食量、料重比及器官指数。
1.8 BgIGFBP4蛋白对小鼠血清生长类激素含量的影响为探究BgIGFBP4蛋白对小鼠血清生长类激素含量的影响,在试验28 d时随机取试验组和对照组小鼠3只,禁食禁水12 h后眼球采血,室温静置30 min后3 000 r·min-1离心10 min,测定小鼠血清GH、胰岛素(insulin,INS)、VEGF的含量变化。
1.9 BgIGFBP4蛋白对小鼠肝PI3K-Akt信号通路相关生长因子表达的影响为探究BgIGFBP4蛋白对小鼠肝PI3K-Akt信号通路相关生长因子表达的影响,在试验28 d时随机取试验组和对照组小鼠3只,提取肝总RNA并合成cDNA。以GAPDH作为内参基因,qRT-PCR引物详见表 2,扩增体系、扩增程序同上。
|
|
表 2 小鼠基因引物序列 Table 2 Primer sequence for amplifying mice genes |
qRT-PCR检测结果以最低表达量的Ct值作为不同组织间差异定量分析的参照,采用2-ΔΔCT法进行分析;以上各数据均通过SPSS 24.0统计软件对数据进行单因素ANOVA分析,结果用“平均值±标准差”表示,P < 0.01表示差异极显著,P < 0.05表示差异显著。
2 结果 2.1 BgIGFBP4蛋白表达、纯化及鉴定将诱导得到的菌液煮沸后进行SDS-PAGE,在0.25、0.5、1、1.5、2 mmol·L-1IPTG条件下诱导12 h表达出大小约28.86 ku的BgIGFBP4蛋白(27.86 ku目的蛋白+1 ku标签蛋白, 图 1A)。将诱导得到的BgIGFBP4蛋白通过Ni柱富集,Elution Buffer洗脱获得纯化的BgIGFBP4蛋白(图 1B)。蛋白定量结果显示,各管蛋白浓度分别为441.40、286.47、274.93 μg·mL-1。His标签鉴定结果显示有特异性条带出现(图 1C),进一步表明纯化得到的确为重组BgIGFBP4蛋白。
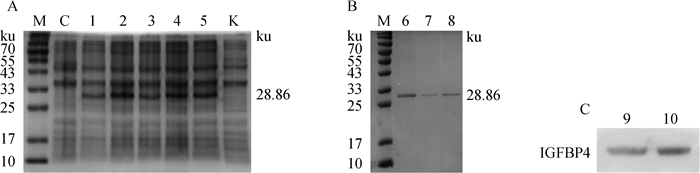
|
M. 蛋白相对分子质量标准;K. pET28a空载体;C. 未诱导;1~5.0.25、0.5、1、1.5、2 mmol·L-1 IPTG诱导;6~8. 蛋白纯化物;9~10. His鉴定 M. Protein marker; K. Empty pET28a vector; C. Uninduced pET28a-BgIGFBP4; 1-5.0.25、0.5、1、1.5、2 mmol·L-1 IPTG inducing; 6-8. Protein purification; 9-10. His identification 图 1 BgIGFBP4蛋白SDS-PAGE结果 Fig. 1 The SDS-PAGE results for the BgIGFBP4 protein |
添加不同浓度BgIGFBP4蛋白均能促进牦牛肝细胞的增殖,且在2 μg·mL-1时增殖活性最佳(图 2A)。用2 μg·mL-1 BgIGFBP4蛋白处理牦牛肝细胞不同时间,也能促进牦牛肝细胞的增殖,并随时间增加而增加(图 2B)。与对照组相比,试验组用2 μg·mL-1 BgIGFBP4蛋白处理牦牛肝细胞时,细胞集落形成率显著升高(P < 0.05,图 3)。
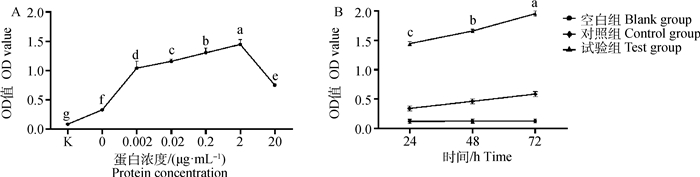
|
A.不同浓度处理24 h;B. 2 μg·mL-1 BgIGFBP4蛋白处理不同时间 A. 24 h with different concentrations; B. 2 μg·mL-1 BgIGFBP4 protein for different times 图 2 BgIGFBP4蛋白对牦牛肝细胞增殖活性的影响 Fig. 2 The effect of BgIGFBP4 protein on proliferation activity of yak hepatocytes |

|
a. 对照组;b. 试验组。*表示不同试验组之间差异显著(P < 0.05);下同 a. Control group; b. Test group. * indicate the statistically significant differences between different groups(P < 0.05); The same as below 图 3 BgIGFBP4蛋白对牦牛肝细胞集落形成能力的影响 Fig. 3 The effect of BgIGFBP4 protein on the colony forming ability of yak hepatocytes |
牦牛肝细胞生长类激素含量检测结果显示,2 μg·mL-1的BgIGFBP4蛋白处理牦牛肝细胞48、72 h时,均能使牦牛肝细胞上清GH、VEGF含量显著升高(P < 0.05,图 4)。
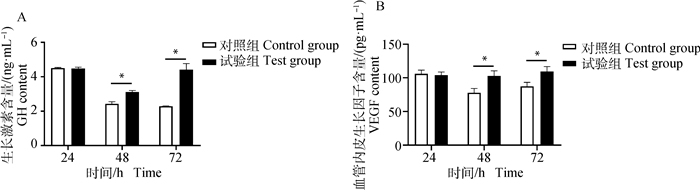
|
图 4 BgIGFBP4蛋白对牦牛肝细胞生长类激素指标的影响 Fig. 4 The effect of BgIGFBP4 protein on growth-like hormone indexes of yak hepatocytes |
PI3K-Akt信号通路相关生长因子转录水平检测结果显示,2 μg·mL-1 BgIGFBP4蛋白处理牦牛肝细胞24、48、72 h时,PI3K-Akt信号通路中细胞增殖相关基因ERBB2、IRS1、PIK3R1、AKT1、RAF1、MAPK3的转录水平均显著高于对照组(P < 0.05,图 5)。
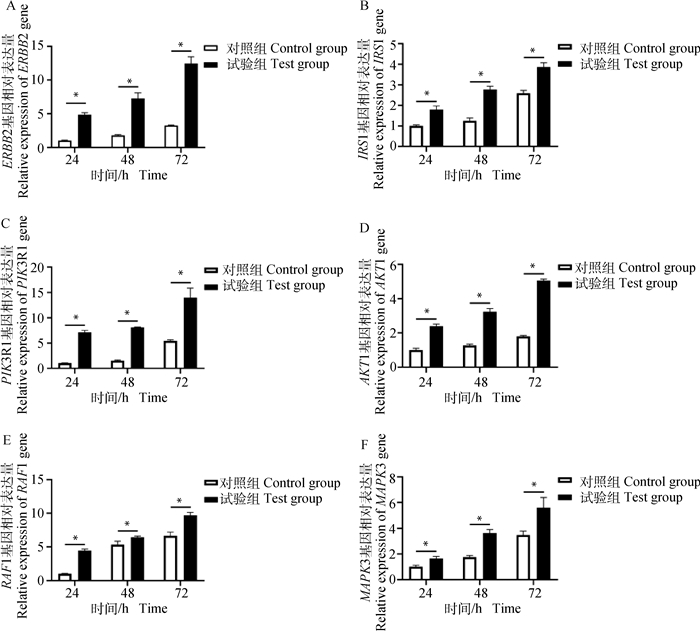
|
图 5 BgIGFBP4蛋白对牦牛肝细胞PI3K-Akt信号通路相关生长因子表达的影响 Fig. 5 The effect of BgIGFBP4 protein on related growth factors in PI3K-Akt signaling pathway of yak hepatocytes |
与对照组相比,试验28 d时试验组平均日增重显著增加(P < 0.05);试验组平均日采食量增加,但与对照组无显著差异;与对照组相比,试验28 d时试验组料重比显著降低(P < 0.05,图 6A)。与对照组相比,肝、脾、肺、肾、小肠等的器官指数显著增加(P < 0.05);试验组心脏指数增加,但与对照组无显著差异(图 6B)。
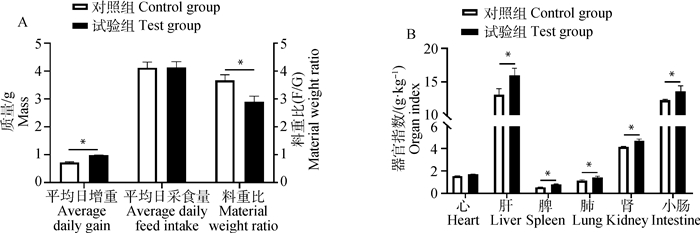
|
图 6 BgIGFBP4蛋白对小鼠生长性能的影响 Fig. 6 The effect of BgIGFBP4 protein on growth performance of mice |
小鼠血清生长类激素含量检测结果显示,每两天灌喂100 μL 50 μg·mL-1 BgIGFBP4蛋白,试验组中小鼠血清GH、INS、VEGF含量在28 d时均显著高于对照组(P < 0.05,图 7)。
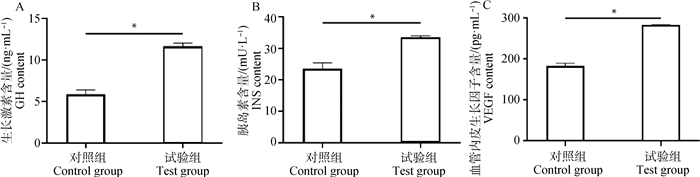
|
图 7 BgIGFBP4蛋白对小鼠血清生长类激素指标的影响 Fig. 7 The effect of BgIGFBP4 protein on serum growth-like hormone indexes of mice |
PI3K-Akt信号通路相关生长因子转录水平检测结果显示:每2 d灌喂100 μL 50 μg·mL-1 BgIGFBP4蛋白28 d时,PI3K-Akt信号通路中细胞增殖相关基因ERBB2、IRS1、PIK3R1、AKT1、RAF1、MAPK3基因转录水平均显著高于对照组(P < 0.05,图 8)。
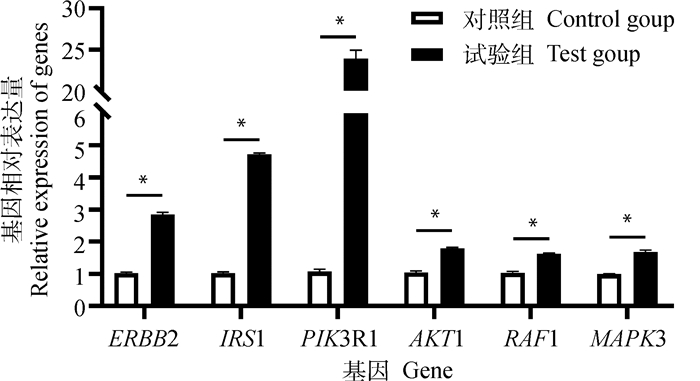
|
图 8 BgIGFBP4蛋白对小鼠肝PI3K-Akt信号通路相关生长因子表达的影响 Fig. 8 The effect of BgIGFBP4 protein on the expression of related growth factor in PI3K-Akt signaling pathway of mice liver |
IGFBP4是IGF系统的调节器,对IGF诱导的细胞生长产生刺激和抑制作用。IGFBP4可与同家族其他生长因子通过协同作用参与诸多生物过程如肝的生长发育等,在人类和动物的生长发育过程中发挥重要作用[8, 21]。IGFBP4的高表达能够延缓血管内皮细胞的衰老进程,其外源性蛋白也能促进骨髓间充质干细胞向神经祖细胞增殖分化、骨骼的形成、神经干细胞的增殖,并使神经干细胞向神经元方向分化[6, 22-23]。推测IGFBP4在mRNA及蛋白水平表达趋势一致,均能促进细胞增殖。本试验结果与上述研究结果一致,重组BgIGFBP4蛋白能促进牦牛肝细胞的增殖。
GH、INS和VEGF是调节动物生长的主要激素与生长因子,可促进细胞增殖、迁徙及激活,从而促进机体生长,并在胚胎发生发育、骨生成、创伤愈合中起着重要作用[24-25]。外源性添加GH能显著增加肝细胞IGFBP4的表达[26],且IGFBP4表达水平受GH活性改变的影响[27],推测IGFBP4与GH表达量呈正相关。并且IGFBP4可增强VEGF诱导的血管生成[28]。本试验结果表明,BgIGFBP4蛋白可通过刺激牦牛肝细胞生长相关激素GH、VEGF分泌,进一步促进细胞的增殖活性与机体的生长发育。
PI3K-Akt信号通路作为受体信号向细胞内传导的重要途径之一,能够促进细胞增殖分化,促进蛋白质的合成,是一种信号级联放大反应[29]。IGFBP4可通过激活PI3K-Akt信号通路促进细胞分化[4]。PI3K-Akt信号通路也是胰岛素效应信号传导的主要途径,与胰岛素相关因子的代谢效应高度相关[30]。IGFBPs信号系统激活酪氨酸激酶受体(ERBB2),导致胰岛素受体底物(IRS1)磷酸化,从而激活磷脂酰肌醇3激酶受体(PI3KR1),使蛋白激酶(AKT1)丝氨酸残基磷酸化,被激活的AKT1从质膜上释放出来,转移到细胞质、线粒体和细胞核内,磷酸化各种底物(RAF1、MAPK3),启动下游信号联级反应,从而调节糖原合成、糖异生和葡萄糖吸收,引发细胞增殖分化等生物效应[31]。PDGF、Gab1等外源蛋白可通过调节PI3K-Akt信号通路促进人晶状体上皮细胞增殖、诱导血管生成[32-33]。本试验结果与上述报道基因(ERBB2、IRS1、PIK3R1、AKT1、RAF1、MAPK3)一致,BgIGFBP4蛋白可促进PI3K-Akt信号通路中基因的表达,从而促进牦牛肝细胞增殖。
3.2 BgIGFBP4蛋白促进小鼠生长发育IGFBP4作为动物正常生长发育的重要生长因子,IGFBP4缺陷小鼠体质量比正常动物轻10%~15%[34]。敲除IGFBP4小鼠的成脂分化能力明显减弱,胚胎发育迟缓,个体体型明显缩小[35]。前人构建了IGFBP4过表达小鼠模型和东方红鳍豚IGFBP4转基因斑马鱼模型,初步证实IGFBP4可影响脑部、胚胎及成体发育[36-37]。本试验结果显示,重组BgIGFBP4蛋白处理小鼠后,平均日增重显著增加、料重比显著降低,肝等器官指数显著增加,血清GH等生长类激素含量显著升高,PI3K-Akt信号通路中生长相关因子转录水平显著升高(P < 0.05),提示BgIGFBP4蛋白可通过调节PI3K-Akt信号通路促进小鼠生长。
4 结论本研究成功构建了pET-28a-BgIGFBP4原核表达载体,并纯化获得了BgIGFBP4蛋白。根据体内外试验证实了重组BgIGFBP4蛋白可通过PI3K-Akt信号通路促进牦牛肝细胞增殖,并在动物水平验证了BgIGFBP4对小鼠生长的促进作用,为进一步深入研究IGFBP4的功能及其作用机理奠定了基础。
| [1] |
CLEMMONS D R. Role of IGF-binding proteins in regulating IGF responses to changes in metabolism[J]. J Mol Endocrinol, 2018, 61(1): T139-T169. DOI:10.1530/JME-18-0016 |
| [2] |
张云彤. 牙鲆IGFBPs基因的克隆以及表达分析[D]. 上海: 上海海洋大学, 2014. ZHANG Y T. Cloning and expression analysis of IGFBPs gene in Japanese Flounder[D]. Shanghai: Shanghai Ocean University, 2014. (in Chinese) |
| [3] |
王孟皓. 丝氨酸羟甲基转移酶2调控肝脏再生肝细胞增殖的机制研究[D]. 重庆: 重庆医科大学, 2019. WANG M H. Serine hydroxymethyltransferase 2 regulates hepatocytes proliferation in liver regeneration[D]. Chongqing: Chongqing Medical University, 2019. (in Chinese) |
| [4] |
王腾飞. IGFBP4在软骨细胞分化过程中的作用研究[D]. 北京: 北京协和医学院, 2018. WANG T F. Study of the role of IGFBP4 during chondrogenesis[D]. Beijing: Peking Union Medical College, 2018. (in Chinese) |
| [5] |
SU Y Y, NISHIMOTO T, HOFFMAN S, et al. Insulin-like growth factor binding protein-4 exerts antifibrotic activity by reducing levels of connective tissue growth factor and the C-X-C chemokine receptor 4[J]. FASEB BioAdv, 2019, 1(3): 167-179. DOI:10.1096/fba.2018-00015 |
| [6] |
LI H W, YU S K, HAO F, et al. Insulin-like growth factor binding protein 4 inhibits proliferation of bone marrow mesenchymal stem cells and enhances growth of neurospheres derived from the stem cells[J]. Cell Biochem Funct, 2018, 36(6): 331-341. DOI:10.1002/cbf.3353 |
| [7] |
李有朝, 来茂德. 胰岛素样生长因子结合蛋白的结构与功能研究概况[J]. 生物物理学报, 2010, 26(5): 347-357. LI Y Z, LAI M D. Summary of the study on structure and function of insulin-like growth factor-binding proteins[J]. Acta Biophysica Sinica, 2010, 26(5): 347-357. (in Chinese) |
| [8] |
HJORTEBJERG R. IGFBP-4 and PAPP-A in normal physiology and disease[J]. Growth Horm IGF Res, 2018, 41: 7-22. DOI:10.1016/j.ghir.2018.05.002 |
| [9] |
刘文韬. 血清类胰岛素生长因子IGF-1和肝组织IGF-1R在肝硬化病理过程中的表达[D]. 长春: 吉林大学, 2016. LIU W T. The expression of serum IGF-1 and hepatic IGF-1R in pathological process of liver cirrhosis[D]. Changchun: Jilin University, 2016. (in Chinese) |
| [10] |
CLEMMONS D R. IGF binding proteins and their functions[J]. Mol Reprod Dev, 1993, 35(4): 368-375. DOI:10.1002/mrd.1080350409 |
| [11] |
LUO J, HUANG Z Y, LIU H N, et al. Yak milk fat globules from the Qinghai-Tibetan plateau: membrane lipid composition and morphological properties[J]. Food Chem, 2018, 245: 731-737. DOI:10.1016/j.foodchem.2017.12.001 |
| [12] |
MIAO F H, GUO Z G, XUE R, et al. Effects of grazing and precipitation on herbage biomass, herbage nutritive value, and yak performance in an alpine meadow on the Qinghai-Tibetan Plateau[J]. PLoS One, 2015, 10(6): e0127275. DOI:10.1371/journal.pone.0127275 |
| [13] |
张天留, 高雪, 徐凌洋, 等. 高原家养动物环境适应性的研究进展[J]. 畜牧兽医学报, 2020, 51(7): 1475-1487. ZHANG T L, GAO X, XU L Y, et al. Research progress on environment adaptation of plateau domestic animals[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(7): 1475-1487. (in Chinese) |
| [14] |
JALALI M, MAHMOODI M, MOSALLANEZHAD Z, et al. The effects of curcumin supplementation on liver function, metabolic profile and body composition in patients with non-alcoholic fatty liver disease: a systematic review and meta-analysis of randomized controlled trials[J]. Complement Ther Med, 2020, 48: 102283. DOI:10.1016/j.ctim.2019.102283 |
| [15] |
SHAPPELL N W, DUKE S E, BARTHOLOMAY K A. In vitro subcellular characterization of flunixin liver metabolism in heifers, steers, and cows[J]. Res Vet Sci, 2019, 123: 118-123. DOI:10.1016/j.rvsc.2018.12.012 |
| [16] |
张崇志, 刘迎春, 高峰, 等. 妊娠后期营养限饲对蒙古绵羊胎儿肝脏生长发育及抗氧化能力的影响[J]. 畜牧兽医学报, 2013, 44(8): 1263-1268. ZHANG C Z, LIU Y C, GAO F, et al. Effects of maternal undernutrition during late pregnancy on growth, development and anti-oxidation capability of Mongolia ovine fetal liver[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(8): 1263-1268. (in Chinese) |
| [17] |
NAWAJI T, YAMASHITA N, UMEDA H, et al. Cytochrome P450 expression and chemical metabolic activity before full liver development in zebrafish[J]. Pharmaceuticals (Basel), 2020, 13(12): 456. DOI:10.3390/ph13120456 |
| [18] |
贾琳娜. Purβ调节肝脏葡萄糖代谢的分子机制研究[D]. 长春: 东北师范大学, 2020. JIA L N. The molecular mechanistic study of Purβ in the regulation of hepatic glucose metabolism[D]. Changchun: Northeast Normal University, 2020. (in Chinese) |
| [19] |
刘立新, 孙凌云, 郭晓红, 等. 胰岛素样生长因子结合蛋白2、4在实验性肝细胞损伤中的表达及意义[J]. 中国病理生理杂志, 2009, 25(1): 137-143. LIU L X, SUN L Y, GUO X H, et al. Expression of IGFBP2 and IGFBP4 in hepatocytes with experimental injury[J]. Chinese Journal of Pathophysiology, 2009, 25(1): 137-143. DOI:10.3321/j.issn:1000-4718.2009.01.028 (in Chinese) |
| [20] |
孔杨. WGCNA筛选癌基因RUVBL1及高良姜素抗胶质母细胞瘤的效应及机制研究[D]. 济南: 山东大学, 2020. KONG Y. The study of WGCNA screens out oncogene RUVBL1 and Galangin exerts anti-Glioblastoma effect and mechanism[D]. Ji'nan: Shandong University, 2020. (in Chinese) |
| [21] |
曾剑. 灯盏花素通过调节miRNA-7和IGFBP-4的表达抑制非小细胞肺癌生长的机制研究[D]. 杭州: 浙江大学, 2018. ZENG J. The mechanisms of breviscapine inhibiting the proliferation of non-small cell lung cancer via regulating expression of miRNA-7 and IGFBP-4[D]. Hangzhou: Zhejiang University, 2018. (in Chinese) |
| [22] |
陈春燕, 郭晋村, 黄卫斌. 胰岛素样生长因子结合蛋白4基因对内皮细胞衰老的调节作用[J]. 中国动脉硬化杂志, 2015, 23(5): 490-494. CHEN C Y, GUO J C, HUANG W B. Effects of insulin-like growth factor binding protein-4 on vascular endothelial cell senescence[J]. Chinese Journal of Arteriosclerosis, 2015, 23(5): 490-494. (in Chinese) |
| [23] |
王经纬. 胰岛素样生长因子结合蛋白-4对神经干细胞增殖分化的影响[D]. 唐山: 华北理工大学, 2015. WANG J W. The effects of IGF-binding protein-4 on proliferation and differentiation of neural stem cells[D]. Tangshan: North China University of Science and Technology, 2015. (in Chinese) |
| [24] |
田娟, 涂玮, 曾令兵, 等. 饥饿和再投喂期间尼罗罗非鱼生长、血清生化指标和肝胰脏生长激素、类胰岛素生长因子-Ⅰ和胰岛素mRNA表达丰度的变化[J]. 水产学报, 2012, 36(6): 900-907. TIAN J, TU W, ZENG L B, et al. The changes in growth, serum biochemical indices and GH/IGF-I/IN mRNA expression abundance of Oreochromis niloticus during fasting and re-feeding[J]. Journal of Fisheries of China, 2012, 36(6): 900-907. (in Chinese) |
| [25] |
仝晓阳, 李慧, 张苗, 等. VEGF和EGFL在骨血管生成中的作用[J]. 中国细胞生物学学报, 2017, 39(11): 1461-1466. TONG X Y, LI H, ZHANG M, et al. The role of VEGF and EGFL in bone angiogenesis[J]. Chinese Journal of Cell Biology, 2017, 39(11): 1461-1466. DOI:10.11844/cjcb.2017.11.0165 (in Chinese) |
| [26] |
王晶. 牙鲆(Paralichthys olivaceus)胰岛素样生长因子结合蛋白(IGFBPs)基因的克隆和表达调控分析[D]. 青岛: 中国海洋大学, 2014. WANG J. Molecular cloning, expression profiles and regulation analysis of insulin-like growth factor binding protein (IGFBPs) in Japanese flounder (Paralichthys olivaceus)[D]. Qingdao: Ocean University of China, 2014. (in Chinese) |
| [27] |
HJORTEBJERG R, BERRYMAN D E, COMISFORD R, et al. Depot-specific and GH-dependent regulation of IGF binding protein-4, pregnancy-associated plasma protein-A, and stanniocalcin-2 in murine adipose tissue[J]. Growth Horm IGF Res, 2018, 39: 54-61. DOI:10.1016/j.ghir.2018.01.001 |
| [28] |
WO D, CHEN J X, LI Q Y, et al. IGFBP-4 enhances VEGF-induced angiogenesis in a mouse model of myocardial infarction[J]. J Cell Mol Med, 2020, 24(16): 9466-9471. DOI:10.1111/jcmm.15516 |
| [29] |
ZHANG W, WANG L M, ZHOU P, et al. Identification and analysis of genetic variations in Pri-miRNAs expressed specifically or at a high level in sheep skeletal muscle[J]. PLoS One, 2015, 10(2): e0117327. DOI:10.1371/journal.pone.0117327 |
| [30] |
刘仕琦, 李冀, 王艳. 七味白术散对糖尿病小鼠肝脏组织PI3K/Akt信号通路的调节作用[J]. 中国实验方剂学杂志, 2020, 26(20): 153-160. LIU S Q, LI J, WANG Y. Regulatory effect of Qiwei Baizhusan on liver tissue insulin PI3K/Akt signal pathway in diabetic mice[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(20): 153-160. (in Chinese) |
| [31] |
KARA G, CIFCIBASI E, KARSIDAG K, et al. Short term effects of periodontal therapy on inflammatory markers in patients with type-2 diabetes[J]. Saudi Med J, 2015, 36(4): 469-476. DOI:10.15537/smj.2015.4.10380 |
| [32] |
邵陈沙. PI3K-AKT信号通路在PDGF促进人晶状体上皮细胞增殖中的作用[D]. 桂林: 桂林医学院, 2017. SHAO C S. The role of PI3K-AKT signaling pathway in the proliferation of human lens epithelial cell which promoted by platelet-derived growth factor[D]. Guilin: Guilin Medical College, 2017. (in Chinese) |
| [33] |
李文献. 接头蛋白Gab1通过PI3K-AKT信号通路调节bFGF诱导的血管生成[D]. 福州: 福建医科大学, 2015. LI W X. The scaffolding adapter protein Gab1 regulates bFGF-induced angiogenesis through the PI3K-AKT pathway[D]. Fuzhou: Fujian Medical University, 2015. (in Chinese) |
| [34] |
NING Y, SCHULLER A G P, CONOVER C A, et al. Insulin-like growth factor (IGF) binding protein-4 is both a positive and negative regulator of IGF activity in vivo[J]. Mol Endocrinol, 2008, 22(5): 1213-1225. DOI:10.1210/me.2007-0536 |
| [35] |
MARIDAS D E, DEMAMBRO V E, LE P T, et al. IGFBP4 is required for adipogenesis and influences the distribution of adipose depots[J]. Endocrinology, 2017, 158(10): 3488-3500. DOI:10.1210/en.2017-00248 |
| [36] |
张贺, 勾荣彬, 牛含虚, 等. 胰岛素样生长因子结合蛋白4转基因小鼠脑内细胞分化的研究[J]. 首都医科大学学报, 2018, 39(6): 910-916. ZHANG H, GOU R B, NIU H X, et al. Neural cell differentiation in the brain of insulin-like growth factor binding protein 4 transgenic mouse[J]. Journal of Capital Medical University, 2018, 39(6): 910-916. DOI:10.3969/j.issn.1006-7795.2018.06.021 (in Chinese) |
| [37] |
安琪儿. 五种IGF信号通路相关基因的转基因斑马鱼的构建[D]. 青岛: 中国海洋大学, 2014. AN Q E. Creation five transgenetic zebrafish strains related to IGF signaling pathway[D]. Qingdao: Ocean University of China, 2014. (in Chinese) |
(编辑 郭云雁)



