2. 宁夏农垦贺兰山奶业有限公司,银川 750000;
3. 宁夏畜牧工作站,银川 750001
2. Ningxia Agriculture Helanshan Dairy Corporation Ltd., Yinchuan 750000, China;
3. Animal Husbandry Extension Station, Yinchuan 750001, China
乳腺是哺乳动物特有的器官,其内部具有大量能够泌乳的腺泡。腺泡外围排列着单层乳腺上皮细胞(mammary epithelial cells, MECs),腺泡腔位于腺泡中央,主要负责将营养物质转化为乳汁[1-2]。乳汁中的成分包含蛋白质、脂质、糖类、维生素、矿物质和生物活性因子等,在生产上主要提供犊牛生长所需营养物质和抗体[3]。其中,乳脂肪是牛乳中能量的携带者,主要有两个来源:分别为脂肪酸的从头合成和血液中长链脂肪酸的摄取[4]。研究表明,牛乳中的各项成分受遗传、地理位置、生活环境、哺乳期和营养水平等诸多因素影响[5-6],其中乳脂的变化受营养水平调控影响最为显著。且牛乳对人类及动物都是非常重要的营养来源,人类对于牛乳的脂肪及蛋白具有特殊需求,因此,对乳脂合成的研究在奶牛育种改良过程中仍然是重中之重。
继1999年Nicholson等[7]提出“metabonomics”的概念后,代谢组学逐渐应用于人类、动物、植物的生理学、遗传学、药物研究以及疾病机理等多个相关领域的小分子代谢物测定[8-9]。代谢组学可以通过对代谢产物的分析来确定外源刺激因素对机体的影响,代谢物作为基因与物体表观之间的桥梁,可以更加直观地揭示所研究基因的功能[10]。Sundekilde等[11]通过对牛乳的代谢物和体细胞数(somatic cell count,SCC)进行研究,发现牛乳SCC升高时,代谢物乳酸、丁酸、异亮氨酸、乙酸和β-羟丁酸增加,马尿酸和富马酸减少,这些代谢物可作为牛乳质量鉴定的潜在标志物,也可进一步用于乳房炎的诊断。侯昆[12]在牛乳中添加青蒿素,研究牛乳代谢及调控机制,发现青蒿素可能通过抑制磷脂酰胆碱和溶血磷脂含量的增加,显著下调α-亚麻酸代谢、亚油酸代谢和甘油磷脂的代谢通路,进而影响奶牛乳腺中脂质代谢。付力立[13]对围产前期奶牛补饲酵母硒,发现有97种显著差异代谢物存在于初乳与常乳中,且从初乳过渡到牛乳时,代谢物的变化可以改变犊牛对氨基酸、促氮代谢物及能量的获取。
目前,我国荷斯坦牛乳中乳脂指标仍未达到人类机体需求的含量,且代谢组学对牛乳不同乳脂水平研究报道较少。因此本研究筛选出乳脂率具有极端差异的荷斯坦奶牛各13头,收集乳样进行代谢组学分析,筛选显著差异代谢物及高乳脂潜在标志性差异代谢物,为研究奶牛泌乳过程提供新的视角。
1 材料与方法 1.1 试验材料1.1.1 试验动物和样品采集 新鲜牛乳样品采自宁夏农垦贺兰山奶业茂盛牧场,试验牛饲喂相同的平衡全混合日粮(表 1)。选择体重与月龄相近,处于泌乳中后期(180~210 d)的第一胎次荷斯坦牛245头。采集每头奶牛早、中、晚(4∶3∶3混合)3个班次的乳样于50 mL专用集奶杯中(另外将所有奶样再分装一份至1.8 mL冻存管中,液氮速冷30 s,储存于-80 ℃冰箱用于代谢组测序),随即送往吴忠农牧局进行奶牛生产性能测定(dairy herd improvement,DHI),筛选体细胞数在20万个·mL-1以内,乳脂率在4.4%以上和3.0%以下的奶牛各13头。
|
|
表 1 日粮组成及营养水平(干物质基础) Table 1 The dietary composition and nutrient level(DM basis) |
1.1.2 主要仪器和试剂 仪器采用德国Thermo Fisher公司的Vanquish UHPLC系统与德国Thermo Fisher公司的Orbitrap Q ExactiveTM HF质谱联用仪。甲醇、甲酸、醋酸铵均为LC-MS Grade纯度(美国Thermo Fisher公司),水(德国Merck公司)。
1.1.3 牛乳样品处理 将牛乳样品从-80 ℃冰箱取出,置于室温条件下进行解冻,解冻后的样品取其100 μL置于极压管中,加入400 μL的80%甲醇水溶液0.1%甲酸预冷重悬; 涡旋震荡后,冰浴静置5 min,15 000×g、4 ℃离心20 min; 去除上层乳脂,取一定量的上清加质谱级水稀释至甲醇含量为53%;移至新的Eppendorf管中,15 000×g、4 ℃离心20 min,最后取上清液进行后续分析[14-15]。
1.2 方法1.2.1 UHPLC-MS条件确定、UPLC色谱条件与质谱条件 采用超高效液相色谱-质谱法(UHPLC-MS)对样品进行代谢组学分析,该方法具有更高效和超高的分离度、速度和灵敏度。同时也具有一定的高分辨率和高选择优势,能够得到精准的质谱图和相对分子量。本研究使用Vanquish UHPLC系统与Orbitrap Q ExactiveTM HF质谱联用仪对两组奶样进行代谢组学分析。UHPLC-MS分析:1 μL样品在Hypesil Goldcolumn(C18) 色谱柱上(100×2.1 mm, 1.9 μm)。正极性模式的洗脱液为洗脱液A (0.1% FA在水中)和洗脱液B(甲醇)。负极性模式洗脱液为洗脱液A (5 mol·L-1乙酸铵,pH 9.0)和洗脱液B(甲醇)。Q ExactiveTM HF质谱仪采用正/负极性模式,喷雾电压3.2 kV,毛细管温度320 ℃,鞘气流量40 arb, aux气流量10 arb。质谱条件:Orbitrap Q ExactiveTM HF质谱仪采用ESI扫描模式,质荷比扫描范围为:100~1 500 m·z-1; Spray Voltage: 3.2 kV; Sheath gas flow rate: 40 arb; Aux Gasflow rate: 10 arb; Capillary Temp: 320 ℃; Polarity: positive; negative; MS/MS二级扫描为data-dependent scans。乳样的色谱梯度洗脱程序见表 2。
|
|
表 2 乳样的色谱梯度洗脱程序 Table 2 Chromatographic gradient elution procedure for milk samples |
1.2.2 代谢组数据统计分析处理 UHPLC-MS生成的原始数据(.raw)文件导入Discoverer 3.1(CD3.1, Thermo Fisher)搜库软件进行处理,对每个代谢物进行峰校准、峰采集和定量。然后,将峰值强度归一化为总光谱强度。利用归一化后的数据,根据加性离子、分子离子峰和碎片离子对分子式进行预测。将峰值与mzCloud (https://www.mzcloud.org/)、mzVault和MassList数据库进行匹配比对,得到准确的定性和相对定量结果。使用统计软件R 3.4.3、Python 2.7.6和CentOS 6.6进行统计分析。
1.2.3 HF与LF组差异代谢物的筛选分析 使用代谢组学数据处理软件metaX进行主成分分析(PCA)和偏最小二乘判别分析(PLS-DA)。采用单因素分析(t-test)计算统计显著性(P-value)。根据(O)PLS-DA模型变量的变量权重值(variable importance for the projection,VIP)辅助筛选标志代谢物。选择VIP>1,P<0.05,FC≥2或FC≤0.5的代谢物作为差异代谢物。受试者工作特征(receiver operating characteristic,ROC)曲线能够进一步考察差异代谢物对高、低乳脂组样品的辨别能力,依据ROC曲线下的面积(area under curve,AUC)判断差异代谢物的识别能力。根据所获得的代谢物通过KEGG(https://www.genome.jp/kegg/pathway.html)、HMDB((https://hmdb.ca/metabolites)以及LIPID MAPS数据库(http://www.lipidmaps.org/)进行注释和代谢产物途径分析。
2 结果 2.1 乳样UHPLC-MS的代谢组学质谱图分析采用UHPLC-MS代谢组学技术检测HF和LF组荷斯坦奶牛的差异代谢物,将正、负离子检测模式下的QC样本质谱总离子流图(total ion chromatography,TIC)进行叠加,获得TIC重叠图(图 1),图谱可以观察到各谱峰的响应强度和保留时间基本重叠且基线稳定,说明试验过程中的数据可靠。
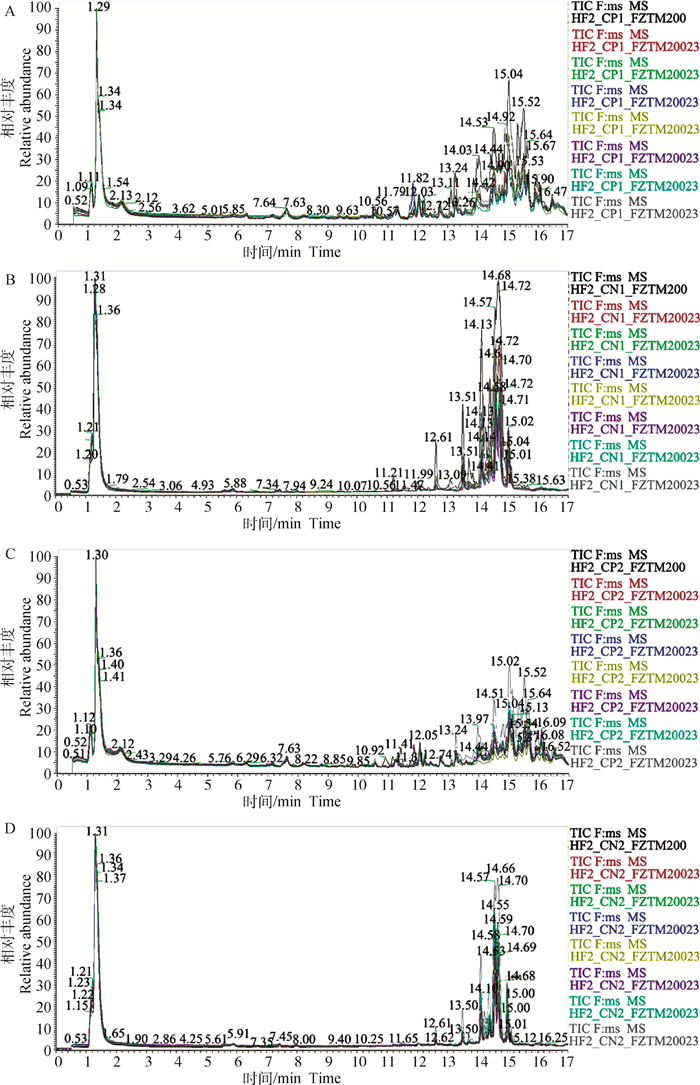
|
A、B.分别为HF组正、负离子模式下TIC重叠图谱; C、D.分别为LF组正、负离子模式下TIC重叠图谱 A, B. The TIC overlap spectra in the positive and negative ion modes of the HF group, respectively; C, D. The TIC overlap spectra in the positive and negative ion modes of the LF group, respectively 图 1 HF与LF两组QC样品在正、负离子模式下TIC重叠图谱 Fig. 1 TIC overlap spectra of QC samples in HF and LF groups in positive and negative ion modes |
使用监督的偏最小二乘判别分析(partial least squares discrimination analysis,PLS-DA),对数据进行分析来评估组间样本差异,在正离子模式下,PLS-DA得分图R2Y=0.88、Q2Y=0.46(图 2A); 在负离子模式下PLS-DA得分图R2Y=0.89、Q2Y=0.43(图 2B),此模型R2Y均高于0.5,Q2 Y值介于0.4~0.5,表明此模型的解释率高,预测能力可接受。进一步对正、负离子模式数据PLS-DA模型进行置换检验,可知,在正离子模式下Q2截距=-0.52(Q2 Intercept<0)(图 2C),负离子模式下Q2截距=-0.53(Q2 Intercept<0)(图 2D),表明PLS-DA模型未过度拟合,说明LF组与HF组奶样代谢物存在差异。
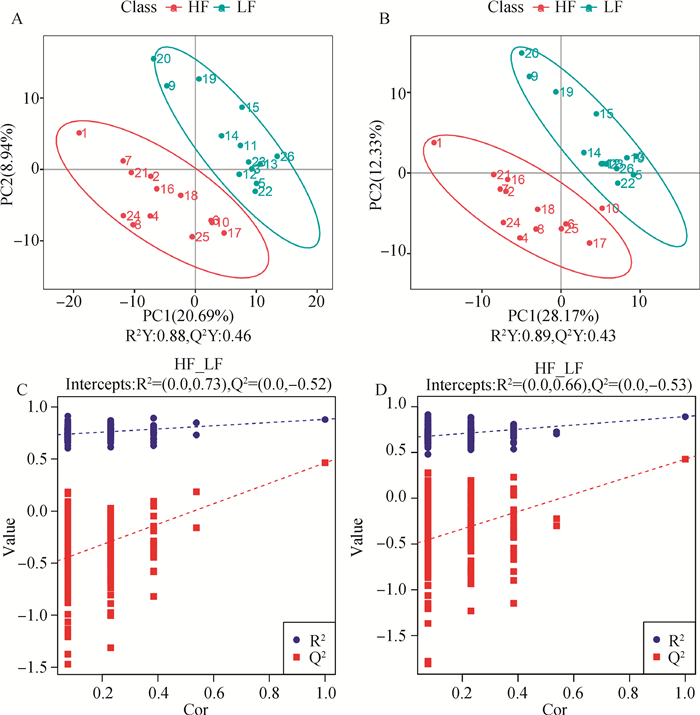
|
A、B.分别为正、负离子模式下PLS-DA得分图; C、D.分别为正、负离子模式下PLS-DA置换检验图 A, B. The PLS-DA score graphs in positive and negative ion modes, respectively; C, D. The PLS-DA displacement test graphs in positive and negative ion modes, respectively 图 2 HF与LF组代谢轮廓模式识别图 Fig. 2 The pattern recognition diagram of the metabolic profile of the HF and LF groups |
本研究共注释到343种代谢产物,其中正离子模式下228种,负离子模式下对115种。将PLS-DA的VIP值(VIP>1)和单变量统计分析(P<0.05)作为显著性差异代谢物的标准,共筛选出60种显著差异代谢物,其中正离子模式下有41种(表 3),负离子模式下有19种(表 4)。
|
|
表 3 LC-MS鉴定牛乳高、低水平乳脂显著差异代谢物(正离子模式) Table 3 LC-MS/MS identification of significantly differential metabolites in milk fat with high and low levels (positive ion mode) |
|
|
表 4 LC-MS/MS鉴定牛乳高、低水平乳脂潜在标志代谢物(负离子模式) Table 4 Identification of potential marker metabolites in milk fat with high and low levels by LC-MS/MS (negative ion mode) |
运用Python-3.5.0与R-3.4.3软件对正、负离子模式下60种显著差异代谢物进行聚类和富集分析,由聚类热图可知(图 3A、B),HF和LF组数据分别能够很好的聚集在一起,说明试验样本组内无明显差异,且相似代谢物聚集效果良好。KEGG富集分析图(图 3C、D)显示,代谢物主要富集在牛磺酸和亚牛磺酸代谢、类固醇激素生物合成、卵巢类固醇生成、氨基酰-tRNA生物合成、代谢途径和胆汁分泌途径。
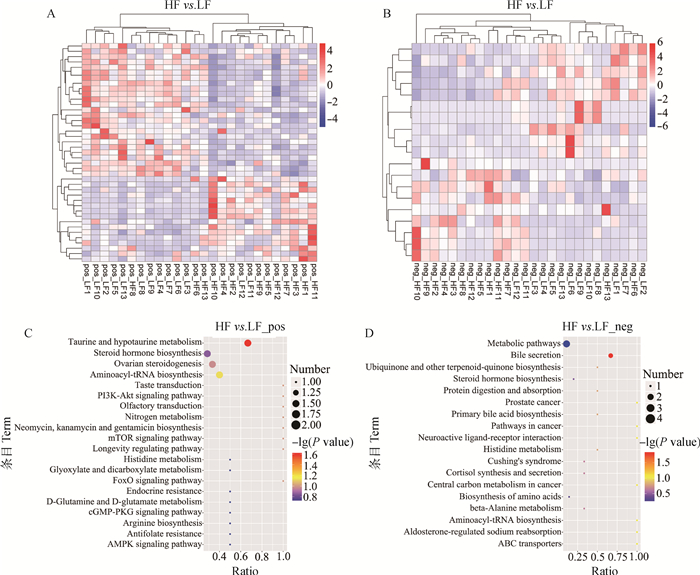
|
A、B.分别为正、负离子模式下聚类热图; C、D.分别为正、负离子模式下KEGG富集气泡图 A, B. The cluster heat maps in positive and negative ion modes; C, D. The bubble diagrams of KEGG enrichment in positive and negative ion modes 图 3 HF与LF两组奶样总显著性差异代谢物聚类、富集分析图 Fig. 3 The cluster, enrichment analysis diagrams of total significant difference metabolites in milk samples of HF and LF groups |
根据P<0.5且FC>2.0及P<0.5且FC<0.5可知,HF组奶样中有15种代谢物含量高于LF组,有6种代谢物含量低于LF组。为进一步筛选标志性差异代谢物,通过ROC曲线评判潜在的生物标记物,对60个显著差异代谢物进行分类识别能力考察。AUC为ROC曲线下方的面积,AUC值越接近于1,预测准确性越高。AUC值为0.5~0.8时,模型具有预测价值,但预测准确性较低; AUC值为0.8~0.9时,有一定预测准确性,此时代谢物是识别两组样品的主要指标; AUC值为0.9及以上时,有较高预测准确性,识别效果非常好。本试验筛选出AUC>0.8的差异代谢物共18种,其正离子模式下12种(图 4A):DL-2-(乙酰氨基)-3-苯基丙酸(DL-2-(acetylamino)-3-phenylpropanoic acid)、PC (14:0e/9:0)、1-甲基鸟嘌呤(1-methylguanine)、月桂酸甘油酯(Monolaurin)、乙基-1-(3-硝基-2-噻吩基)哌啶-4-羧酸乙酯(ethyl 1-(3-nitro-2-thienyl)piperidine-4-carboxylate)、N-苯乙酰谷氨酰胺(N-phenylacetylglutamine)、麦芽糖醇(Maltol)、5, 6-二羟基吲哚-2-羧酸(5, 6-dihydroxyindole-2-carboxylic acid)、5-甲基-DL-色氨酸(5-methyl-dl-tryptophan)、Lysopa 16:0、表睾酮(Epitestosterone)、5-羟基吲哚-3-乙酸(5-hydroxyindole-3-acetic acid)。负离子模式下6种(图 4B):PA (16:0/18:3)、δ-生育酚(delta-tocopherol)、胆酸(Cholic acid)、L-组氨酸(L-histidine)、皮质醇(Hydrocortisone)、N-油酰甘氨酸(N-oleoyl glycine)。其中AUC>0.85的差异代谢物有4种:N-油酰甘氨酸、皮质醇、δ-生育酚、PC (14:0e/9:0)。
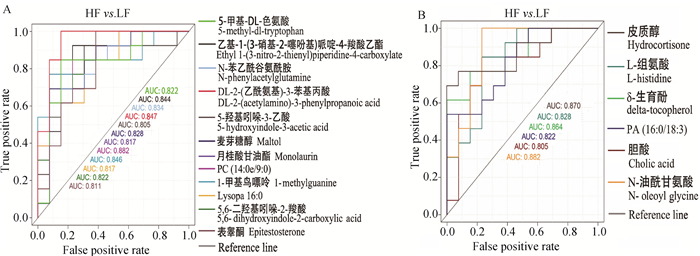
|
A、B.分别为正、负离子模式下ROC曲线图 A, B. The ROC curves in positive and negative ion modes 图 4 HF与LF两组奶样18个差异代谢物的ROC曲线图 Fig. 4 ROC curves of 18 differential metabolites in the milk samples of HF and LF groups |
荷斯坦牛乳是目前市场覆盖面积最广、种类最多的乳制品,乳脂作为其主要成分,是人类食物营养的重要来源。目前国内荷斯坦牛乳脂含量约为3.6%(低于娟姗牛5.2%[16]),因此对荷斯坦牛乳脂进行研究是非常有必要的。代谢组学作为近年来分子生物学领域代谢物分析的强有力工具,具有高度准确的预测和判断能力[17],目前应用于多个相关领域的小分子代谢物测定[8]。对于不同品种的乳汁而言,丹麦Sundekilde等[18]运用NMR技术对荷斯坦牛和娟姗牛的牛乳进行代谢组学分析,发现肉碱、胆碱和柠檬酸盐可作为区分荷斯坦牛与娟姗牛的标志代谢物。Yang等[19]进一步对中国荷斯坦奶牛、娟姗牛、牦牛、水牛、山羊、骆驼和马的乳代谢研究发现,差异代谢物胆碱和琥珀酸可区分荷斯坦牛和其它产乳动物的乳制品。
本研究通过代谢组揭示乳脂率具有极端差异的牛乳潜在标志性差异代谢物,结果发现,差异代谢物N-油酰甘氨酸、皮质醇、δ-生育酚、PC (14:0e/9:0)在HF中上调,PA (16:0/16:0)、LPS 21:0、PA (16:0/18:3)、N-甲酰基犬尿氨酸、HexCer-NS (d16:1/23:0) 在HF中下调。Chaturvedi等[20]研究表明,N-油酰甘氨酸具有独立转化为油酰胺的生物活性,且Arafat等[21]于1989年就发现油酰胺是正常人血清中存在的5种主要脂肪酸酰胺之一。目前,关于油酰胺生物合成途径存在两种假说,其中主要的一种假说认为肽基甘氨酸α-酰胺化单加氧酶(recombinant peptidylglycine alpha amidating monooxygenase, PAM)是油酰胺生物合成介质,而Merkler等[22]证明PAM能够催化初级脂肪酸的形成,脂肪酸和甘油进一步组成三酰甘油酯,本试验发现,N-油酰甘氨酸在高乳脂牛乳中含量更高,提示N-油酰甘氨酸能够促进乳脂的形成。在本试验中,HF组皮质醇显著高于LF组,皮质醇是一种由哺乳动物肾上腺中的肾上腺皮质产生的类固醇激素,属于糖皮质激素,又名氢化可的松,其作用主要促进碳水化合物、蛋白质和脂肪的新陈代谢,同时也起着抗炎作用,促进糖原、脂质和蛋白质的分解进而降低大多数身体细胞中的蛋白质水平[23-24]; 皮质醇通过促进草酰乙酸合成葡萄糖来刺激糖异生,再通过刺激肝内糖原合成来抵消血糖增加,调节整个血液中葡萄糖含量[25]; 在人乳中发现,皮质醇对母乳的中链和中间链脂肪酸有影响[26-27],这些脂肪酸可能来源于内源性从头合成,这表明母亲的饮食中碳水化合物与脂肪的比例很高[28-29]; Lee等[26]研究表明,糖皮质激素参与调节脂肪代谢; Linderborg等[30]研究表明,在富含三酰基甘油的脂质中,牛奶中的皮质醇水平比月桂酸含量高,以上研究表明皮质醇与脂肪代谢有关。Kiyose等[31]研究发现,δ-生育酚在到达肝之前被乳糜微粒结合到脂肪组织中,后在肝中进行代谢。δ-生育酚是维生素E的组成成分之一,维生素E作为一种脂溶性维生素,在动物生长发育过程中是不可或缺的,同时也是动物机体内主要的亲脂抗氧化剂,可清除脂质过氧自由基,破坏脂质过氧化的链增殖反应[32]。有研究表明,维生素E添加在日粮中可以有效减少肉鸡腹脂率、提升鹅胸肌粗脂肪率、影响猪肉大理石花纹、改善鼠脂肪含量和甘油三酯代谢、改善鱼的血脂代谢及调节脂肪代谢酶活性等[33-37]; Barzegar-Amini等[38]发现,维生素E可以通过抑制脂肪肝的产生和降低肝细胞的氧化应激来调节脂蛋白水平,预防血脂异常,维生素E缺乏则会增加脂质过氧化,导致磷脂周转增加[39],本试验发现,高乳脂率牛乳中δ-生育酚含量高于低乳脂,推测δ-生育酚对乳脂率具有一定的生理作用,但其具体机制有待进一步探究。
4 结论本试验运用UHPLC-MS技术对高、低不同乳脂率牛乳进行代谢组学分析,结果共检测到60种显著性差异代谢物,其中N-油酰甘氨酸、皮质醇、δ-生育酚、PC (14:0e/9:0)可作为高乳脂率牛乳潜在标志性差异代谢物。本研究结果可为奶牛乳脂代谢提供基础资料。
| [1] |
KASS L, ERLER J T, DEMBO M, et al. Mammary epithelial cell: influence of extracellular matrix composition and organization during development and tumorigenesis[J]. Int J Biochem Cell Biol, 2007, 39(11): 1987-1994. DOI:10.1016/j.biocel.2007.06.025 |
| [2] |
MORRONI M, GIORDANO A, ZINGARETTI M C, et al. Reversible transdifferentiation of secretory epithelial cells into adipocytes in the mammary gland[J]. Proc Natl Acad Sci U S A, 2004, 101(48): 16801-16806. DOI:10.1073/pnas.0407647101 |
| [3] |
李文清, 南雪梅, 卜登攀. 奶牛乳腺发育和泌乳相关的microRNA[J]. 动物营养学报, 2014, 26(1): 1-6. LI W Q, NAN X M, BU D P. MicroRNAs associated with bovine mammary development and lactation[J]. Chinese Journal of Animal Nutrition, 2014, 26(1): 1-6. (in Chinese) |
| [4] |
王小艳. 中国荷斯坦奶牛泌乳相关营养代谢组学研究[D]. 哈尔滨: 东北农业大学, 2013. WANG X Y. Study on the nutritional metabonomics related to the lactation in dairy cows[D]. Harbin: Northeast Agricultural University, 2013. (in Chinese) |
| [5] |
VERARDO V, GÓMEZ-CARAVACA A M, ARRÁEZ-ROMÁN D, et al. Recent advances in phospholipids from colostrum, milk and dairy by-products[J]. Int J Mol Sci, 2017, 18(1): 173. DOI:10.3390/ijms18010173 |
| [6] |
SENDA A, FUKUDA K, ISHⅡ T, et al. Changes in the bovine whey proteome during the early lactation period[J]. Anim Sci J, 2011, 82(5): 698-706. DOI:10.1111/j.1740-0929.2011.00886.x |
| [7] |
NICHOLSON J K, LINDON J C, HOLMES E. 'Metabonomics': understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29(11): 1181-1189. DOI:10.1080/004982599238047 |
| [8] |
SUN H Z, WANG D M, WANG B, et al. Metabolomics of four biofluids from dairy cows: potential biomarkers for milk production and quality[J]. J Proteome Res, 2015, 14(2): 1287-1298. DOI:10.1021/pr501305g |
| [9] |
TRAN H, MCCONVILLE M, LOUKOPOULOS P. Metabolomics in the study of spontaneous animal diseases[J]. J Vet Diagn Invest, 2020, 32(5): 635-647. DOI:10.1177/1040638720948505 |
| [10] |
HENDRIKSEN P J M, FREIDIG A P, JONKER D, et al. Transcriptomics analysis of interactive effects of benzene, trichloroethylene and methyl mercury within binary and ternary mixtures on the liver and kidney following subchronic exposure in the rat[J]. Toxicol Appl Pharmacol, 2007, 225(2): 171-188. DOI:10.1016/j.taap.2007.08.017 |
| [11] |
SUNDEKILDE U K, POULSEN N A, LARSEN L B, et al. Nuclear magnetic resonance metabonomics reveals strong association between milk metabolites and somatic cell count in bovine milk[J]. J Dairy Sci, 2013, 96(1): 290-299. DOI:10.3168/jds.2012-5819 |
| [12] |
侯昆. 青蒿素对奶牛乳汁代谢物的影响及其调控机制的研究[D]. 北京: 北京农学院, 2020. HOU K. The effect and mechanism of artemisinin on milk metabolites in dairy cows[D]. Beijing: Beijing University of Agriculture, 2020. (in Chinese) |
| [13] |
付力立. 基于代谢组学研究奶牛初乳与常乳组分差异及补饲酵母硒的影响[D]. 成都: 四川农业大学, 2019. FU L L. Differential metabolome between colostrum and normal milk in dairy cows and effects of supplementary yeast selenium-based on metabonomics[D]. Chengdu: Sichuan Agricultural University, 2019. (in Chinese) |
| [14] |
WANT E J, O'MAILLE G, SMITH C A, et al. Solvent-dependent metabolite distribution, clustering, and protein extraction for serum profiling with mass spectrometry[J]. Anal Chem, 2006, 78(3): 743-752. DOI:10.1021/ac051312t |
| [15] |
BARRI T, DRAGSTED L O. UPLC-ESI-QTOF/MS and multivariate data analysis for blood plasma and serum metabolomics: effect of experimental artefacts and anticoagulant[J]. Anal Chim Acta, 2013, 768: 118-128. DOI:10.1016/j.aca.2013.01.015 |
| [16] |
伊学彬. 影响奶牛乳脂率的因素及提高途径[J]. 现代畜牧科技, 2020(11): 46. YI X B. Factors affecting milk fat percentage of dairy cows and ways to improve[J]. Modern Animal Husbandry Science and Technology, 2020(11): 46. (in Chinese) |
| [17] |
ZHANG G S, TOBOLSKI D, ZWIERZCHOWSKI G, et al. A Targeted serum metabolomics GC-MS approach identifies predictive blood biomarkers for retained placenta in Holstein dairy cows[J]. Metabolites, 2021, 11(9): 633. DOI:10.3390/metabo11090633 |
| [18] |
SUNDEKILDE U K, FREDERIKSEN P D, CLAUSEN M R, et al. Relationship between the metabolite profile and technological properties of bovine milk from two dairy breeds elucidated by NMR-based metabolomics[J]. J Agric Food Chem, 2011, 59(13): 7360-7367. DOI:10.1021/jf202057x |
| [19] |
YANG Y X, ZHENG N, ZHAO X W, et al. Metabolomic biomarkers identify differences in milk produced by Holstein cows and other minor dairy animals[J]. J Proteomics, 2016, 136: 174-182. DOI:10.1016/j.jprot.2015.12.031 |
| [20] |
CHATURVEDI S, DRISCOLL W J, ELLIOT B M, et al. In vivo evidence that N-oleoylglycine acts independently of its conversion to oleamide[J]. Prostaglandins Other Lipid Mediat, 2006, 81(3-4): 136-149. DOI:10.1016/j.prostaglandins.2006.09.001 |
| [21] |
ARAFAT E S, TRIMBLE J W, ANDERSEN R N, et al. Identification of fatty acid amides in human plasma[J]. Life Sci, 1989, 45(18): 1679-1687. DOI:10.1016/0024-3205(89)90278-6 |
| [22] |
MERKLER D J, MERKLER K A, STERN W, et al. Fatty acid amide biosynthesis: a possible new role for peptidylglycine α-amidating enzyme and acyl-coenzyme A: glycineN-acyltransferase[J]. Arch Biochem Biophys, 1996, 330(2): 430-434. DOI:10.1006/abbi.1996.0272 |
| [23] |
DANDONA P, GHANIM H, BATRA M, et al. 274-LB: the anti-inflammatory effects of insulin and hydrocortisone combination in obese subjects[J]. Diabetes, 2019, 68(S1): 274. |
| [24] |
CLINTON K. Cushing's syndrome.Nutritional perspectives[J]. J Council Nutr, 2017, 40(4): 40-44. |
| [25] |
KELLER K, BALDWIN S, BRABETZ B. A review of cortisol: the "stress hormone"[J]. 2018, http://hdl.handle.net/1951/70287; 2018-05-31T17: 37: 59Z.
|
| [26] |
LEE M J, PRAMYOTHIN P, KARASTERGIOU K, et al. Deconstructing the roles of glucocorticoids in adipose tissue biology and the development of central obesity[J]. Biochim Biophys Acta, 2014, 1842(3): 473-481. DOI:10.1016/j.bbadis.2013.05.029 |
| [27] |
DJURHUUS C B, GRAVHOLT C H, NIELSEN S, et al. Additive effects of cortisol and growth hormone on regional and systemic lipolysis in humans[J]. Am J Physiol Endocrinol Metab, 2004, 286(3): E488-E494. DOI:10.1152/ajpendo.00199.2003 |
| [28] |
HASCOET J M, CHAUVIN M, PIERRET C, et al. Impact of maternal nutrition and perinatal factors on breast milk composition after premature delivery[J]. Nutrients, 2019, 11(2): 366. DOI:10.3390/nu11020366 |
| [29] |
DEMMELMAIR H, KOLETZKO B. Lipids in human milk[J]. Best Pract Res Clin Endocrinol Metab, 2018, 32(1): 57-68. DOI:10.1016/j.beem.2017.11.002 |
| [30] |
LINDERBORG K M, KORTESNIEMI M, AATSINKI A K, et al. Interactions between cortisol and lipids in human milk[J]. Int Breastfeed J, 2020, 15(1): 66. DOI:10.1186/s13006-020-00307-7 |
| [31] |
KIYOSE C, NISHIKAWA H, NAGASE M, et al. δ-Tocopherol slightly accumulates in the adipose tissue of mice[J]. J Oleo Sci, 2021, 70(2): 247-252. DOI:10.5650/jos.ess20254 |
| [32] |
ATKINSON J, MARQUARDT D, DIPASQUALE M, et al. From fat to bilayers: understanding where and how vitamin E works[J]. Free Radic Biol Med, 2021, 176: 73-79. DOI:10.1016/j.freeradbiomed.2021.09.015 |
| [33] |
李文娟. 鸡肉品质相关脂肪代谢功能基因的筛选及营养调控研究[D]. 北京: 中国农业科学院, 2008. LI W J. Filtration of functional genes related to lipid metabolism of meat quality and nutritional regulation in chickens[D]. Beijing: Chinese Academy of Agricultural Sciences, 2008. (in Chinese) |
| [34] |
周小乔, 王宝维, 葛文华, 等. 饲粮不同维生素E水平对鹅生产性能、胴体品质、血清生化指标和生殖激素含量的影响[J]. 动物营养学报, 2012, 24(3): 462-471. ZHOU X Q, WANG B W, GE W H, et al. Dietary vitamin E level affects performance, carcass quality, serum biochemical parameters and reproductive hormone contents of geese[J]. Chinese Journal of Animal Nutrition, 2012, 24(3): 462-471. (in Chinese) |
| [35] |
CALVO L, SEGURA J, TOLDRÁ F, et al. Meat quality, free fatty acid concentration, and oxidative stability of pork from animals fed diets containing different sources of selenium[J]. Food Sci Technol Int, 2017, 23(8): 716-728. DOI:10.1177/1082013217718964 |
| [36] |
常文露, 马爱国, 孙永叶, 等. 维生素E与镁对肥胖大鼠糖脂代谢影响的研究[J]. 卫生研究, 2014, 43(5): 713-718. CHANG W L, MA A G, SUN Y Y, et al. Effects of vitamin E and magnesium on glycolipid metabolism in obese rats[J]. Journal of Health Research, 2014, 43(5): 713-718. (in Chinese) |
| [37] |
BAISHNIKOVA I, SERGINA S, ILYINA T. Effect of vitamin E supplementation on α-tocopherol status and tissue antioxidants in American minks (Neovison vison)[J]. Turk J Vet Anim Sci, 2018, 42(6): 642-648. DOI:10.3906/vet-1803-82 |
| [38] |
BARZEGAR-AMINI M, GHAZIZADEH H, SEYEDI S M R, et al. Serum vitamin E as a significant prognostic factor in patients with dyslipidemia disorders[J]. Diabetes Metab Syndr, 2019, 13(1): 666-671. DOI:10.1016/j.dsx.2018.11.034 |
| [39] |
WATT A T, HEAD B, LEONARD S W, et al. Gene expression of CRAL_TRIO family proteins modulated by vitamin E deficiency in zebrafish (Danio rerio)[J]. J Nutr Biochem, 2021, 97: 108801. DOI:10.1016/j.jnutbio.2021.108801 |
(编辑 郭云雁)



