2. 人兽共患传染性疾病防治协同创新中心,石河子 832000;
3. 新疆农垦科学院省部共建绵羊遗传改良与健康养殖国家重点实验室,石河子 832000;
4. 动物疫病防控兵团重点实验室,石河子 832000
2. Collaborative Innovation Center for the Prevention and Control of Infectious Diseases, Shihezi 832000, China;
3. Institute of Animal Husbandry and Veterinary of Xinjiang Agricultural Reclamation Science Academy, Shihezi 832000, China;
4. Key Laboratory of Animal Disease Prevention and Control of Corps, Shihezi 832000, China
布鲁氏菌病(brucellosis)是一种由布鲁氏菌(Brucella)感染引起的人兽共患病,是我国重大的公共卫生问题之一[1]。布鲁氏菌致病机制的关键是它与宿主细胞的相互作用,巨噬细胞作为机体重要的免疫细胞,常常是布鲁氏菌入侵的首选对象[2],布鲁氏菌可利用自身的多种机制逃避宿主细胞的识别及杀伤,适应胞内环境并进行生存及复制[3]。布鲁氏菌的T4SS是一组由virB启动子(virB1~virB12)调控表达的多蛋白复合物,也是布鲁氏菌主要的毒力因子,主要通过分泌效应蛋白发挥毒力作用,协助布鲁氏菌顺利到达内质网,完成胞内的入侵及繁殖[4-5]。布鲁氏菌侵入宿主细胞后能通过调控细胞凋亡来影响自身的存活,因此研究布鲁氏菌调控细胞凋亡的具体机制成为越来越多学者关注的方向。研究表明,羊种布鲁氏菌能够诱导宿主细胞发生凋亡[6],最新研究发现,布鲁氏菌的一种核效应蛋白BspJ能够发挥抑制细胞凋亡的作用[7]。细胞凋亡发生途径通常有三条,近年来,经由内质网应激诱导的细胞凋亡途径愈发走进学者们的视野[8-9]。内质网是蛋白质加工、折叠及运输的主要场所,也是细胞重要的钙库,对于细胞稳态的维持至关重要[10-11],同时也是布鲁氏菌赖以生存的复制基地,然而,大量研究证实,正是因为布鲁氏菌在内质网中的大量复制,常常会导致内质网的稳态失衡,发生内质网应激[12-13],若内质网应激强度过强或持续时间过长,内质网稳态无法及时恢复,细胞就会走向凋亡。研究已经证实,T4SS效应蛋白VceC以及VceA的缺失能够影响布鲁氏菌调控的细胞凋亡[14],且VceC能够直接参与布鲁氏菌对内质网应激的调控[15]。但这些研究只是对布鲁氏菌T4SS效应蛋白所调控的内质网应激和细胞凋亡作了阐述,而对于整个T4SS在布鲁氏菌诱导的内质网应激和细胞凋亡过程中发挥的作用还不清除。
因此,本研究用牛种布鲁氏菌T4SS启动子缺失株A19ΔVirB侵染小鼠RAW264.7细胞,探究T4SS对牛种布鲁氏菌感染引起的内质网应激及细胞凋亡的影响,深入了解T4SS在布鲁氏菌胞内寄生过程中的作用,为进一步解析布鲁氏菌的致病机制及T4SS的功能研究提供理论依据。
1 材料与方法 1.1 材料1.1.1 菌株和细胞 小鼠巨噬细胞系RAW264.7和牛种布鲁氏菌A19疫苗株及其T4SS启动子缺失株A19ΔVirB[16]为兵团动物疫病防控重点实验室保存。细胞的培养和侵染方法按文献[17]进行。
1.1.2 主要试剂及仪器 RNA提取试剂盒和cDNA第一链合成试剂盒购自北京康为世纪生物科技有限公司;兔抗GRP78单克隆抗体、兔抗CHOP单克隆抗体、兔抗BCL-2单克隆抗体和兔抗BAX单克隆抗体均购自美国CST公司;细胞凋亡检测试剂盒购自上海爱必信生物科技有限公司;高通量实时荧光定量PCR仪购自赛默飞世尔科技公司;流式细胞仪购自美国BD公司。
1.2 方法1.2.1 引物设计与合成 参照GenBank中公布的GRP78、CHOP、BAX和BCL-2基因的mRNA序列,利用Primer 5.0软件设计对应的qRT-PCR引物(引物序列见表 1),引物由上海生工生物工程股份有限公司合成。
|
|
表 1 qRT-PCR引物序列 Table 1 Primer sequence of qRT-PCR |
1.2.2 qRT-PCR检测内质网应激、凋亡相关基因的转录水平 布鲁氏菌A19和A19ΔVirB以100:1的感染复数侵染RAW264.7细胞[16],在侵染的6、12和24 h用Trizol裂解细胞,收集的细胞裂解液置于无RNAase的EP管中,按照康为世纪RNA提取试剂盒说明书进行细胞总RNA的提取,取1 μL样品进行RNA浓度和纯度的测定;而后继续按照康为世纪cDNA第一链合成试剂盒的说明书将提取的RNA反转录成cDNA;最后以cDNA为模板,GAPDH为内参基因,用实时荧光定量PCR仪进行检测,qRT-PCR反应条件:95 ℃ 5 min;95 ℃ 15 s,59 ℃ 30 s,72 ℃ 30 s,共40个循环;试验完成后,用2-ΔΔCt法来计算各基因的相对转录量。
1.2.3 Western blot检测内质网应激、凋亡相关基因的蛋白表达水平 布鲁氏菌A19和A19ΔVirB以100:1的感染复数侵染RAW264.7细胞,在侵染的6、12和24 h收集细胞,在收集细胞前5 min先在冰上按照比例配制好RIPA和蛋白酶抑制剂混合物,用配制好的混合物在冰上裂解细胞约10 min,而后用细胞刮轻轻将细胞刮下,收集裂解液于无菌EP管中;按照凯基BCA蛋白含量检测试剂盒说明书进行蛋白浓度的测定,并进行蛋白浓度的调齐;最后进行SDS-PAGE凝胶电泳,对比蛋白Marker的大小切下目的条带后转膜,分别孵育GRP78、CHOP、BCL-2和BAX抗体,按照Western blot常规步骤进行检测。
1.2.4 流式细胞术检测细胞凋亡情况 布鲁氏菌A19和A19ΔVirB以100:1的感染复数侵染RAW264.7细胞, 在侵染的6、12和24 h用不含EDTA的胰酶消化细胞,消化下来的细胞收集到无菌EP管中,800 r·min-1离心5 min,弃上清,用无菌PBS漂洗细胞,离心后弃上清,用Binding buffer将细胞重悬,按照细胞凋亡检测试剂盒说明书进行相应抗体的孵育,立即上机进行检测。
1.2.5 数据统计 所有数据使用SPSS 26.0软件进行差异显著性分析,并用GraphPad Prism 8.0软件作图。
2 结果 2.1 牛种布鲁氏菌T4SS对内质网应激标志性分子GRP78和CHOP转录水平的影响通过收集感染不同时间点的RAW264.7细胞,提取细胞总RNA,检测内质网应激标志性分子GRP78和CHOP的转录水平,结果显示,在侵染的6、12和24 h,缺失株A19ΔVirB组GRP78的转录水平均显著低于亲本株A19组(P < 0.05)(图 1A);在侵染后的6 h,缺失株组CHOP的转录水平也显著低于亲本株(P < 0.05),12 h时升高(P>0.05), 而到了24 h,缺失株组CHOP的转录水平发生了显著高于亲本株(P < 0.01)的现象(图 1B)。本试验结果初步表明T4SS的缺失能够降低牛种布鲁氏菌诱导内质网应激的能力。
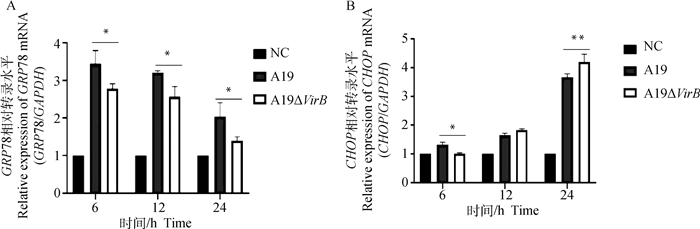
|
A. GRP78;B. CHOP。NC.正常对照组;A19.A19感染组;A19ΔVirB. A19ΔVirB感染组;与A19组相比,*.差异显著(P<0.05), **.差异极显著(P<0.01);下同 A. GRP78; B. CHOP. NC. Normal control; A19. A19 infected group; A19ΔVirB. A19ΔVirB infected group; Compared with A19 group, *. Significant difference (P < 0.05), **. Extremely significant difference (P < 0.01); The same as below 图 1 qRT-PCR检测Brucella感染后RAW264.7细胞GRP78、CHOP的转录水平 Fig. 1 qRT-PCR was used to detect the transcription level of GRP78 and CHOP in RAW264.7 after Brucella infection |
通过收集感染不同时间点的RAW264.7细胞,提取细胞总蛋白,检测内质网应激标志性分子GRP78和CHOP的蛋白表达变化,结果显示,在侵染的6、12和24 h,缺失株组GRP78的蛋白表达水平均显著低于亲本株(P < 0.05或P < 0.01)(图 2A、B);在侵染后的6 h,缺失株组CHOP的蛋白表达水平也显著低于亲本株(P < 0.05),而到了24 h,变成了显著高于亲本株(P < 0.05)(图 2C、D)。本试验结果与qRT-PCR结果相符,更进一步表明T4SS的缺失能够降低牛种布鲁氏菌诱导内质网应激的能力。
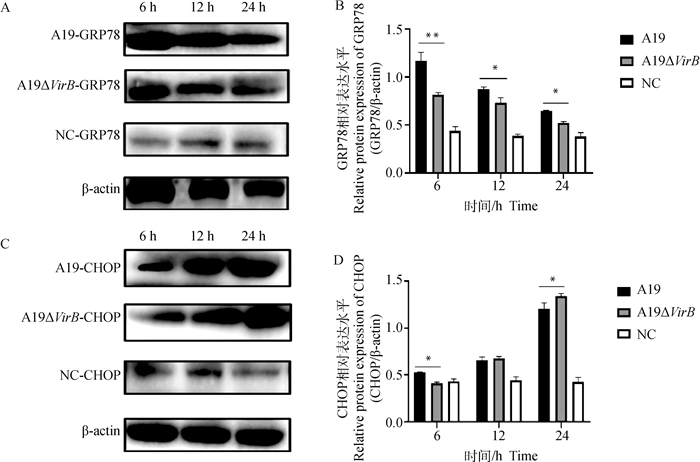
|
A. GRP78的蛋白表达水平;B. A图的灰度值分析;C. CHOP的蛋白表达水平;D. C图的灰度值分析 A. GRP78 expression level; B. Gray value analysis of figure A; C. CHOP expression level; D. Gray value analysis of figure C 图 2 Western blot检测Brucella感染后RAW264.7细胞GRP78、CHOP的蛋白表达水平 Fig. 2 Western blot was used to detect the protein expression level of GRP78 and CHOP in RAW264.7 after Brucella infection |
通过收集感染不同时间点的RAW264.7细胞,提取细胞总RNA,检测凋亡相关分子BAX和BCL-2的转录水平,结果显示,在侵染的24 h,缺失株A19ΔVirB组BAX的转录水平显著高于亲本株(P < 0.05)(图 3A),而缺失株组抗BCL-2的转录水平显著低于亲本株(P < 0.01)(图 3B),本试验结果初步表明T4SS的缺失能够促进牛种布鲁氏菌诱导细胞凋亡的能力。
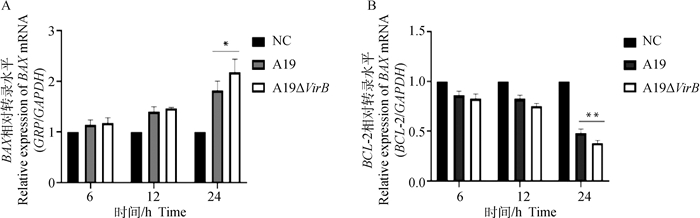
|
A. BAX; B. BCL-2 图 3 qRT-PCR检测Brucella感染后RAW264.7细胞BAX、BCL-2的转录水平 Fig. 3 qRT-PCR was used to detect the transcription level of BAX and BCL-2 in RAW264.7 after Brucella infection |
通过收集感染不同时间点的RAW264.7细胞,提取细胞总蛋白,检测凋亡相关分子BAX和BCL-2的蛋白表达变化,结果显示,在侵染的24 h,缺失株A19ΔVirB组BAX的蛋白表达水平显著高于亲本株(P < 0.05)(图 4A、B),而BCL-2的蛋白表达水平显著低于亲本株(P < 0.05)(图 4C、D),本试验结果与qRT-PCR结果相符,更进一步表明T4SS的缺失能够促进牛种布鲁氏菌诱导细胞凋亡的能力。
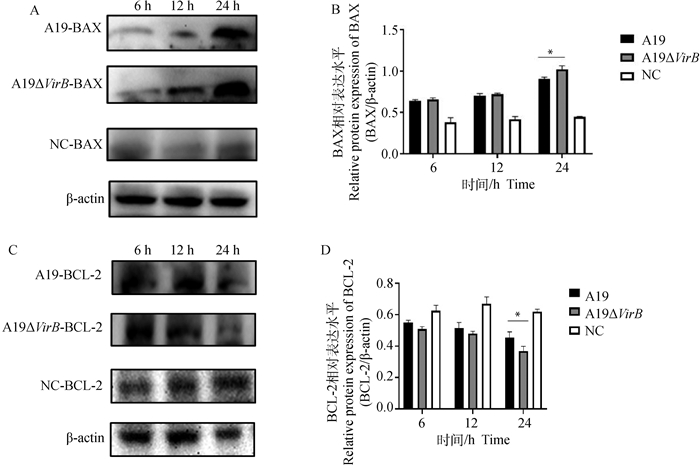
|
A. BAX的蛋白表达水平;B. A图的灰度值分析;C. BCL-2的蛋白表达水平;D. C图的灰度值分析 A. BAX expression level; B. Gray value analysis of figure A; C. BCL-2 expression level; D. Gray value analysis of figure C 图 4 Western blot检测Brucella感染后RAW264.7细胞BAX、BCL-2的蛋白表达水平 Fig. 4 Western blot was used to detect the protein expression level of BAX and BCL-2 in RAW264.7 after Brucella infection |
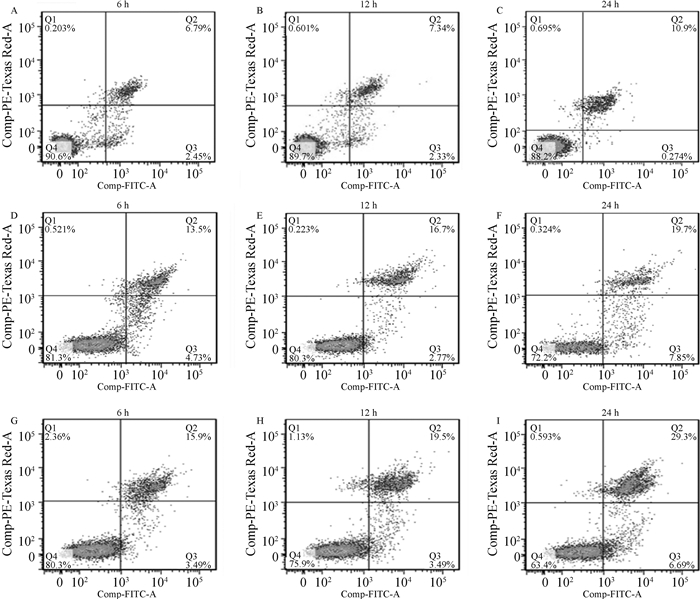
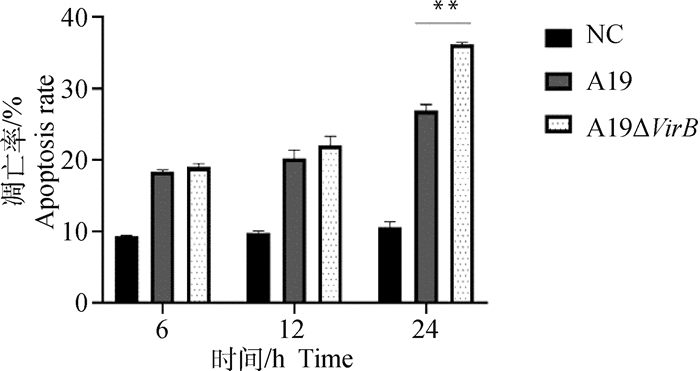
通过收集感染不同时间点的RAW264.7细胞,按照凋亡试剂盒说明书进行抗体的孵育,用流式细胞仪进行检测,结果显示,在侵染的24 h,缺失株A19ΔVirB引起的细胞凋亡率显著高于亲本株(P < 0.05)(图 5、6),与qRT-PCR和Western blot结果相符,证实T4SS的缺失确实增强了布鲁氏菌诱导细胞凋亡的能力。
|
A~C. 对照组6、12和24 h;D~F. 布鲁氏菌A19侵染组6、12和24 h;G~I. 布鲁氏菌A19ΔVirB侵染组6、12和24 h A-C. Control group at 6, 12 and 24 h; D-F. Brucella A19 infection group at 6, 12 and 24 h; G-I. Brucella A19ΔVirB infection group at 6, 12 and 24 h 图 5 流式细胞术检测细胞凋亡率 Fig. 5 Flow cytometry was used to detect the apoptosis rate |
|
图 6 细胞凋亡率分析 Fig. 6 Analysis of apoptosis rate |
布鲁氏菌是一种胞内寄生菌,利用其特有的胞内寄生机制在机体内建立起慢性感染。内质网是细胞维持稳态的重要细胞器,同时也是布鲁氏菌肆虐繁殖的场所[18]。virB编码的T4SS是布鲁氏菌主要的毒力因子之一,在它的帮助下,布鲁氏菌逃避了被溶酶体降解的命运,顺利到达内质网开始大量的增殖[19]。然而,也正因为布鲁氏菌在内质网中的肆虐繁殖,导致内质网丧失其原本平衡的环境,内质网应激便应然而生。有报道称,粗糙型布鲁氏菌能通过促进T4SS分泌的方式诱导内质网应激[20],也有报道发现,布鲁氏菌T4SS分泌的效应蛋白VceC能够诱导内质网应激,甚至能够操控内质网应激从而保证布鲁氏菌的胞内存活[15]。GRP78通常在内质网应激发生时大量表达,是参与维持内质网稳态的重要蛋白[21],CHOP在内质网应激诱导的细胞凋亡途径中扮演着重要角色[22],二者是衡量内质网应激发生与否的重要指示性分子。本研究结果显示,亲本株A19及其T4SS启动子缺失株A19ΔVirB均能引起GRP78的表达水平升高,且变化趋势一致,前期升高明显,后期则出现下降,这可能是细胞的一种防御机制,通过GRP78表达的升高来帮助恢复内质网稳态,延长细胞在失衡环境下的存活时间;缺失株A19ΔVirB的GRP78的表达水平始终低于亲本株,提示缺失株引起内质网应激的能力较亲本株弱,这可能是因为virB的缺失使T4SS无法正常表达,限制了其帮助布鲁氏菌顺利到达内质网的能力,从而降低了布鲁氏菌诱导内质网应激的能力;此外,两株菌中CHOP的表达水平也始终高于对照组,但趋势则与GRP78相反,呈现逐渐上升的趋势,此结果与支飞杰[23]在山羊肺泡巨噬细胞中的研究结果相似,其中的机制可能是因为随着GRP78的表达下降,细胞挽回内质网应激的能力减弱,无法及时恢复稳态,最终启动了CHOP介导的细胞凋亡途径;缺失株组CHOP的表达水平在感染前期显著低于亲本株,与GRP78的表达变化相呼应,更进一步地证实缺失株引起内质网应激的能力较亲本株弱,但到了感染的24 h,出现了显著高于亲本株的现象,提示CHOP介导的凋亡途径可能被激活,而这可能是因为virB的缺失使T4SS无法正常表达,因而无法正常分泌一些对细胞凋亡具有抑制作用的蛋白,从而更容易启动CHOP主导的细胞凋亡途径,诱发凋亡。
当内质网应激程度过强或者持续时间太久,就会发生细胞凋亡[24]。细胞凋亡是细胞“自我牺牲”的体现,也是宿主对抗病原菌感染的重要途径[25]。布鲁氏菌常常通过抑制被感染细胞凋亡的方式促进自身的存活,而被感染细胞则通过凋亡来限制布鲁氏菌生存。史静雪[14]发现,布鲁氏菌T4SS分泌的效应蛋白VceC和VceA均具有促进人滋养层细胞凋亡的作用;而最新的一项研究表明,布鲁氏菌T4SS分泌的效应蛋白VceC能够抑制CHOP介导的山羊胚胎滋养层细胞凋亡从而有利于布鲁氏菌的胞内复制[12]。本研究通过qRT-PCR和Western blot检测了细胞凋亡关键分子BAX和BCL-2的转录及蛋白表达水平,结果表明,缺失株引起促凋亡基因BAX表达水平升高的能力较亲本株强,且缺失株抑制抗凋亡基因BCL-2的能力也较亲本株强,表明缺失株引起细胞凋亡的能力强于亲本株;为了进一步证实细胞凋亡确实发生,又使用流式细胞术检测了两株菌感染后细胞凋亡的情况,发现缺失株引起细胞凋亡的能力比亲本株强,与BAX和BCL-2的表达水平变化结果相符,而出现这种现象的原因可能是因为virB缺失后T4SS丧失了毒力功能,使布鲁氏菌的毒力减弱,从而更容易被宿主细胞识别并启动细胞凋亡将其清除。本研究整体表明,牛种布鲁氏菌T4SS的缺失降低了布鲁氏菌诱导内质网应激的能力,反而增强了其诱导凋亡的能力,出现这种结果的原因可能是因为布鲁氏菌诱导的凋亡是多种因素相互作用的结果,而其中的具体机制还需进一步探索。
4 结论使用牛种布鲁氏菌T4SS启动子缺失株A19ΔVirB侵染RAW264.7细胞后发现,牛种布鲁氏菌T4SS的缺失能够降低布鲁氏菌诱导内质网应激的能力,却增强布鲁氏菌诱导细胞凋亡的能力,这对于布鲁氏菌致病机制的阐明具有一定的意义,为今后T4SS功能的研究奠定了基础,也为布鲁氏菌有效疫苗的研发提供了科学依据。
| [1] |
GELETU U S, USMAEL M A, MUMMED Y Y. Seroprevalence and risk factors of small ruminant brucellosis in West Hararghe zone of oromia regional state, Eastern Ethiopia[J]. Vet Med Int, 2021, 2021: 6671554. |
| [2] |
耿慧娟. 布鲁氏杆菌在巨噬细胞内可以长期存在的原因[J]. 中西医结合心血管病电子杂志, 2020, 8(28): 58-59. GENG H J. Reasons why Brucella can long-term persist within macrophages[J]. Cardiovascular Disease Journal of Integrated Traditional Chinese and Western Medicine (Electronic), 2020, 8(28): 58-59. (in Chinese) |
| [3] |
JIAO H W, ZHOU Z X, LI B W, et al. The mechanism of facultative intracellular parasitism of Brucella[J]. Int J Mol Sci, 2021, 22(7): 3673. DOI:10.3390/ijms22073673 |
| [4] |
KE Y H, WANG Y F, LI W F, et al. Type IV secretion system of Brucella spp. and its effectors[J]. Front Cell Infect Microbiol, 2015, 5: 72. |
| [5] |
CELLI J. The intracellular life cycle of Brucella spp.[J]. Microbiol Spectr, 2019, 7(2): 10. |
| [6] |
MA Z C, LI R R, HU R R, et al. Brucella abortus BspJ is a nucleomodulin that inhibits macrophage apoptosis and promotes intracellular survival of Brucella[J]. Front Microbiol, 2020, 11: 599205. DOI:10.3389/fmicb.2020.599205 |
| [7] |
何作萍. 羊种布鲁氏菌外膜蛋白诱导的细胞凋亡分子机制[D]. 广州: 南方医科大学, 2016. HE Z P. Molecular mechanism of apoptosis induced by outer membrane proteins of Brucella melitensis[D]. Guangzhou: Southern Medical University, 2016. (in Chinese) |
| [8] |
岳瑞超. MAP诱导内质网应激介导的巨噬细胞凋亡及其对小鼠感染M. bovis的影响[D]. 北京: 中国农业大学, 2018. YUE R C. MAP induces macrophage apoptosis mediated by ERs and its effect on M. bovis-infected mice[D]. Beijing: China Agriculture University, 2018. (in Chinese) |
| [9] |
孟鹭, 赵冬冬, 吴雨桐, 等. 内质网应激介导的胰岛β细胞凋亡研究进展[J]. 动物医学进展, 2019, 40(8): 98-102. MENG L, ZHAO D D, WU Y T, et al. Progress on islet β cells apoptosis mediated by endoplasmic reticulum stress[J]. Progress in Veterinary Medicine, 2019, 40(8): 98-102. (in Chinese) |
| [10] |
刘宇婷, 李国新, 王斌. 疱疹病毒与内质网应激[J]. 生物工程学报, 2021, 37(1): 67-77. LIU Y T, LI G X, WANG B. Herpesvirus and endoplasmic reticulum stress[J]. Chinese Journal of Biotechnology, 2021, 37(1): 67-77. (in Chinese) |
| [11] |
李铭, 邹颖, 郭寒, 等. 钙离子在内质网应激中的作用[J]. 动物医学进展, 2018, 39(9): 112-116. LI M, ZOU Y, GUO H, et al. Effect of calcium ion on endoplasmic reticulum stress[J]. Progress in Veterinary Medicine, 2018, 39(9): 112-116. DOI:10.3969/j.issn.1007-5038.2018.09.023 (in Chinese) |
| [12] |
ZHI F J, ZHOU D, BAI F R, et al. VceC Mediated IRE1 pathway and inhibited CHOP-induced apoptosis to support Brucella replication in goat trophoblast cells[J]. Int J Mol Sci, 2019, 20(17): 4104. DOI:10.3390/ijms20174104 |
| [13] |
尹彦龙, 李杨, 白芙蓉, 等. 布鲁氏菌对RAW264.7细胞内质网应激与细胞因子分泌的影响[J]. 微生物学通报, 2017, 44(12): 2896-2904. YIN Y L, LI Y, BAI F Y, et al. Effect of Brucella suis S2 on endoplasmic reticulum stress and cytokines in RAW264.7 cells[J]. Microbiology China, 2017, 44(12): 2896-2904. (in Chinese) |
| [14] |
史静雪. 布鲁氏菌分泌蛋白VceA和VceC对细胞自噬和凋亡的影响[D]. 石河子: 石河子大学, 2017. SHI J X. Secretion proteins VceA and VceC of Brucella effects on autophagy and apoptosis[D]. Shihezi: Shihezi University, 2017. (in Chinese) |
| [15] |
相彩霞. 布鲁氏菌VceC蛋白对山羊滋养层细胞内质网应激反应和性腺激素分泌的影响[D]. 杨凌: 西北农林科技大学, 2017. XIANG C X. The endoplasmic reticulum stress and gonadal hormone secretory influence of Brucella VceC on goat trophoblast cells[D]. Yangling: Northwest A & Forestry University, 2017. (in Chinese) |
| [16] |
邓肖玉, 何金科, 杨琴, 等. 牛种布鲁氏菌A19 VirB启动子缺失株的构建及其生物学特性研究[J]. 中国畜牧兽医, 2020, 47(3): 864-872. DENG X Y, HE J K, YANG Q, et al. Construction of Brucella abortus A19 VirB promoter deletion strain and study on its biological characteristics[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(3): 864-872. (in Chinese) |
| [17] |
席静, 王月丽, 邓肖玉, 等. STA6介导的巨噬细胞极化对布鲁氏菌胞内存活的影响[J]. 畜牧兽医学报, 2022, 53(1): 263-271. XI J, WANG Y L, DENG X Y, et al. STA6 mediated macrophage polarization on intracellular survival of Brucella[J]. Acta Veternaria et Zootechnica Sinica, 2022, 53(1): 263-271. (in Chinese) |
| [18] |
WANG X G, LIN P F, LI Y, et al. Brucella suis vaccine strain 2 induces endoplasmic reticulum stress that affects intracellular replication in goat trophoblast cells in vitro[J]. Front Cell Infect Microbiol, 2016, 6: 19. |
| [19] |
吴同垒, 单晓枫, 康元环, 等. 布鲁菌Ⅳ型分泌系统效应蛋白的研究进展[J]. 中国兽医学报, 2018, 38(3): 602-608. WU T L, SHAN X F, KANG Y H, et al. Research advances on type Ⅳ secretion system effectors of Bruella[J]. Chinese Journal of Veterinary Science, 2018, 38(3): 602-608. (in Chinese) |
| [20] |
LI P, TIAN M X, BAO Y Q, et al. Brucella rough mutant induce macrophage death via activating IRE1α pathway of endoplasmic reticulum stress by enhanced T4SS secretion[J]. Front Cell Infect Microbiol, 2017, 7: 422. |
| [21] |
刘同君, 赵盼, 赵敏孟, 等. 内质网应激标记基因Grp78参与鹅肥肝免疫/炎症状态的调控[J]. 畜牧兽医学报, 2019, 50(4): 727-737. LIU T J, ZHAO P, ZHAO M M, et al. Endoplasmic reticulum stress marker gene Grp78 is involved in regulation of immune/inflammatory state of goose fatty liver[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(4): 727-737. (in Chinese) |
| [22] |
胡海, 田明星, 丁婵. CHOP调控内质网应激介导细胞凋亡的机制[J]. 中国预防兽医学报, 2019, 41(2): 219. HU H, TIAN M X, DING C. Mechanisms by which CHOP regulates ER stress-mediated apoptosis[J]. Chinese Journal of Preventive Veterinary Medicine, 2019, 41(2): 219. (in Chinese) |
| [23] |
支飞杰. 布鲁氏菌GntR缺失菌株构建及其对山羊肺泡巨噬细胞内质网应激的影响[D]. 杨凌: 西北农林科技大学, 2018. ZHI F J. Construction of Brucella GntR gene mutant strain and its effect on endoplasmic reticulum stress in goat alveolar macrophages[D]. Yangling: Northwest A & F University, 2018. (in Chinese) |
| [24] |
弓晶, 解新科. 内质网应激和细胞自噬对肝细胞凋亡的影响[J]. 临床肝胆病杂志, 2019, 35(12): 2828-2832. GONG J, XIE X K. Effect of endoplasmic reticulum stress and autophagy on hepatocyte apoptosis[J]. Journal of Clinical Hepatology, 2019, 35(12): 2828-2832. (in Chinese) |
| [25] |
高文暄. 微生物感染与细胞凋亡相互作用研究进展[J]. 生物学教学, 2018, 43(11): 4-6. GAO W X. Progress in the interaction between microbial infection and apoptosis[J]. Biology Teaching, 2018, 43(11): 4-6. (in Chinese) |
(编辑 白永平)



