2. 新疆畜牧科学院生物技术研究所,乌鲁木齐 830011;
3. 石河子大学动物科技学院,石河子 832000
2. Biotechnology Institute of Xinjiang Academy of Animal Science, Urumqi 830011, China;
3. College of Animal Science and Technology, Shihezi University, Shihezi 832000, China
Oct4是迄今人们发现最早也是最重要的维持胚胎干细胞多潜能性和自我更新的关键基因,这种功能遗传于早期脊椎动物Oct4基因的同系物,并在不同种系之间高度保守[1]。Oct4最初在卵母细胞、早期胚胎和胚胎癌细胞中被发现。由于胚胎癌细胞与来自胚胎内细胞团(inner cell mass,ICM)的胚胎干细胞具有相似的生物学特性,被广泛用作研究胚胎发育的模型[2]。Oct4主要在受精卵、桑椹胚、卵裂球、囊胚内细胞团以及着床后胚胎的上胚层和原始生殖细胞等多能性细胞中表达[3]。例如在小鼠中,将Oct4基因敲除,该胚囊正常植入后不能形成多能性的内细胞团,因此,不能正常着床而停滞发育,在着床前期囊胚阶段(胚胎发育3.5~4.5 d)死亡。表明Oct4基因在早期胚胎发育过程中形成多能性细胞是必要的[4]。在多个动物物种上关于Oct4基因的文章已报道过多篇,而在绵羊上的报道很少。在牛胚胎滋养层细胞(trophectoderm,TE)中检测到Oct4 mRNA[5-6],而在小鼠上,Oct4仅在内细胞团上表达[7]。与小鼠的高繁殖力相比,反刍动物如牛羊的繁殖力一直比较低,在牛羊中,大约45%的囊胚会在胚胎附植和妊娠识别过程中丢失[8]。在牛羊胚胎进入子宫后,会经历囊胚扩张、孵化、迁移、伸长、附植,侵润和胎盘形成等几个主要过程。牛羊等反刍动物的囊胚在附植前需要在子宫充分的伸长[9], 这与小鼠有明显的不同。在小鼠上,对囊胚发育的多能基因调控一直是研究热点。其中,多能转录因子Oct4(Pou5f1)的表达逐渐完全限定在囊胚ICM中随后限定在上胚层细胞(epiblast)中表达[10-11]。内细胞在胚胎植入过程中分化为上胚层(epiblast,EPI)和下胚层(hypoblas,也称原始内胚层,即primitive endoderm,PrE)[12]。Cdx2基因(caudal related homeobox 2 transcription factor,Cdx2)则完全在囊胚分化的滋养层细胞上表达[13],Oct4和Cdx2相互负调控,Oct4基因抑制Cdx2的表达,Berg等[6]研究表明,在牛TE上存在Oct4和Cdx2的共表达,牛受精卵第6天左右开始发育为囊胚,并进入子宫角,牛囊胚TE细胞中检测到Oct4 mRNA,并可以维持到第12~13天,直到孕体开始延长的时候才在TE中逐渐消失[14-15],而在小鼠上,Oct4仅在内细胞团上表达[7]。与小鼠胚胎相比,Oct4下调对牛胚胎发育的影响更为严重。不同于小鼠胚胎,Oct4在牛TE中的表达不会消失,即使在完全扩张的囊胚阶段也是如此[16]。
1 材料与方法 1.1 试验动物从乌鲁木齐市屠宰场采集阿勒泰绵羊卵巢。将采集的新鲜卵巢在37 ℃恒温条件下3 h内运回实验室。
1.2 试验材料荧光倒置显微镜(Olympus),固定针(Origio),CO2培养箱(Thermo),体视镜(Olympus),NUNC四孔板培养皿(Becton Dickinson),35、60 mm培养皿(Becton Dickinson),玻璃管(BJ-40细玻管, 中国),15 mL离心管(Corning,USA),一次性注射器(康福莱医疗器械有限公司,郑州,中国),矿物油(Sigma),卵母细胞体外成熟培养液, 体外受精液, 胚胎培养液。
溶液配方如下:
卵母细胞体外成熟培养液:M199+10% FBS(Gibco)+0.05 IU·mL -1FSH+0.05 IU·mL-1 LH+1 μg·mL-1雌二醇+24.2 μg·mL-1丙酮酸钠+10 ng·mL-1 EGF(Gibco)。
体外受精液配方:SOF液+1% NEAA+2% BAA+20% FBS+6 IU·mL-1肝素钠+100 IU·mL-1庆大霉素。
胚胎培养液配方:SOF液+1% NEAA+2% BAA+100 IU·mL-1双抗+5 mg·mL-1 BSA。
本试验中未注明试剂均购自Sigma Aidrich(Saint Louis, USA)公司。
1.3 试验方法1.3.1 卵母细胞成熟 屠宰场取阿勒泰羊卵巢,用灭菌的生理盐水洗涤卵巢2~3次后,再抽取直径为2~8 mm卵泡,用PBS缓冲液稀释后,在体视显微镜下收集形态正常和结构完整的A、B级卵母细胞,将卵母细胞用PBS缓冲液洗3次后,再用卵母细胞成熟液洗2次,放入预先平衡好的成熟培养液中成熟培养24 h[4]。培养条件为:38.5 ℃,5% CO2和饱和湿度。
在体视显微镜下观察卵丘细胞扩展状态,用0.1%的透明质酸酶对成熟后的卵母细胞进行处理, 除去大部分卵丘细胞, 并用受精液洗涤3次后置于装有0.5 mL受精液的四孔板内备用。
1.3.2 卵母细胞的体外受精 从液氮罐中取萨福克羊的冻精液,40 ℃水浴解冻,将解冻后的精液移入3 mL平衡好的获能液底部,在培养箱中使精子孵育上游30 min,使精子获能,然后取上清1.5 mL,1 500 r·min1离心5 min,去上清液,底部即为获能精子,将获能后的精子用受精液重悬,按照1×105个·ml-1轻轻加入含有成熟卵母细胞的四孔板中,放入CO2培养箱中受精24 h[17]。
1.3.3 胚胎培养 体外受精胚胎用胚胎培养液洗3次,然后放入胚胎培养液中,置38.5 ℃,5% CO2,饱和湿度下培养,受精48 h后统计卵裂率,培养168 h后统计囊胚率。
1.3.4 胚胎免疫荧光染色 胚胎样品在4%多聚甲醛固定过夜,PBS洗5 min(3次),吸去PBS;用5%山羊血清封闭;用含0.2% Triton-100的PBS通透30 min,加入PBS洗5 min(3次),吸去PBS;加入anti-OCT4一抗(Abcom-19857)或者anti-CDX2(Abcom-227201)一抗,4 ℃孵育过夜,吸去一抗,加入PBS洗5 min(3次),吸去PBS;加入用Alexa Fluor 488或546(red)标记的二抗(Abcom),室温孵育60 min,PBS洗3 min(3次),胚胎细胞核用DAPI(1 mg·mL-1)染核5 min,加入PBS洗5 min(3次),吸去PBS,将胚胎用封片剂固定于载玻片上,用荧光显微镜观察[18]。
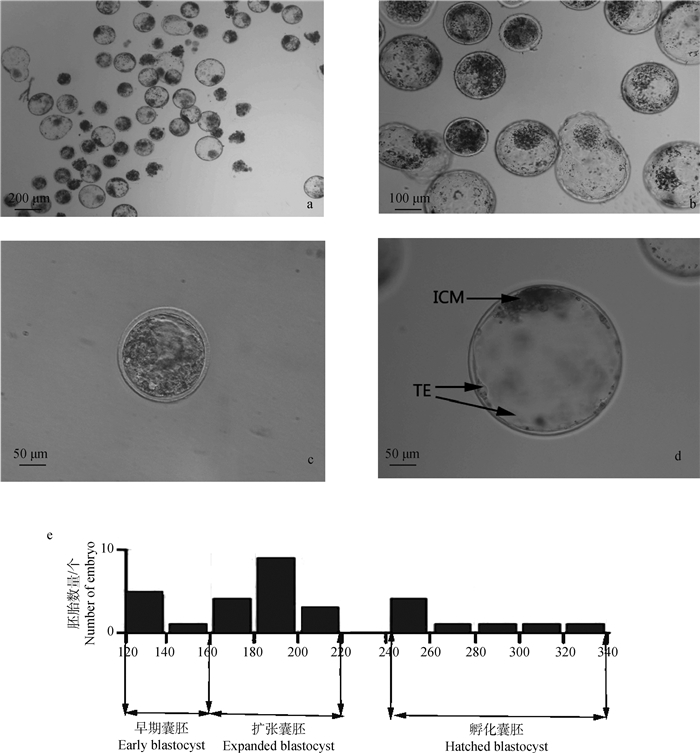
2 结果 2.1 绵羊体外囊胚的直径和细胞数对体外培养的胚胎进行了卵裂率和囊胚率的统计,结果如表 1所示,经过体外成熟、体外受精和体外培养的阿勒泰羊胚胎卵裂率为79%,卵裂后的胚胎体外培养168 h后,可获得大量的囊胚,结果如图 1a和图 1b所示。阿勒泰羊体外胚胎囊胚率为62%。此时的囊胚包括不同直径的早期囊胚、扩张囊胚和孵化囊胚(图 1b)。
|
|
表 1 绵羊卵母细胞体外受精后卵裂率和囊胚率 Table 1 Ovine oocyte cleavage rate and blastocyst rate after in vitro fertilization |
|
a. 发育至168 h的绵羊胚胎(40×);b. 发育至168 h的绵羊胚胎(100×);c. 早期囊胚(200×);d. 扩张囊胚(200×);e.发育至囊胚阶段的胚胎直径分布图 a. Sheep embryos (40×) developed to 168 h; b. Sheep embryos at 168 h of development (100×); c. Early blastocyst (200×); d. The expanded blastocyst(200×); e. Diameter and distribution of embryos at the blastocyst stage 图 1 羊体外囊胚形态与囊胚直径分布 Fig. 1 Sheep blastocyst morphology and blastocyst diameter distribution in vitro |
胚胎发育至囊胚期后,出现了细胞形态学上第一次明显的分化:即分化为外周扁平的TE细胞和内侧团状ICM细胞(图 1c、1d),TE细胞在囊胚外层形成单层球状结构, 内部包裹ICM和囊胚液,ICM为致密的团块状[19]。
如图 1a所示,发育阻滞的胚胎未形成囊胚,其透明带没有扩张,胚胎直径在160 μm以下(结果未显示)。对早期囊胚、扩张囊胚和孵化囊胚的直径分别进行测量,结果如图 1e所示:绵羊早期囊胚直径在160 μm以下,此时透明带还没有明显的扩张;扩张囊胚直径范围在160 μm~240 μm之间,此时透明带明显变薄,但是胚胎还未从透明带中孵出。由于囊胚从透明带孵化后直径迅速增加,孵化囊胚直径一般在240~340 μm之间。根据试验结果,推测体外获得的绵羊囊胚开始孵化的直径临界区间在200~220 μm。
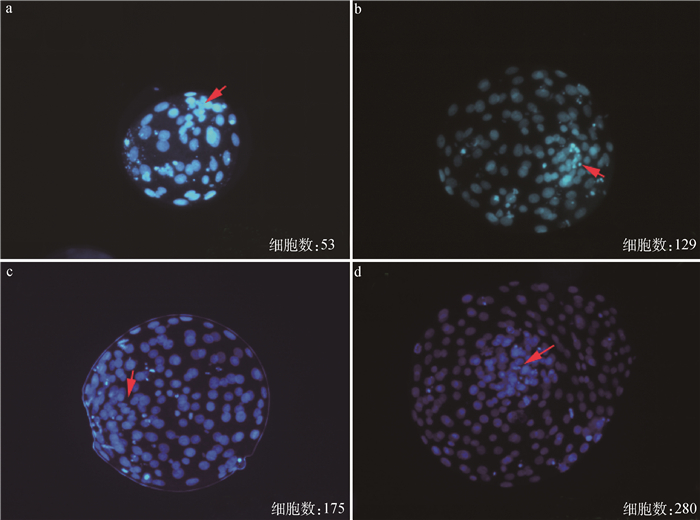
为进一步分析不同发育时期囊胚的细胞数,并确定ICM和TE细胞的形态和位置,本试验收集了体外培养168 h后的囊胚,对不同发育阶段的囊胚进行DAPI染色,统计各阶段囊胚的总细胞数。DAPI是细胞核荧光染料,表示细胞核所在位置,结果如图 2所示:同一时间发育至囊胚阶段的胚胎不仅在细胞直径上有所差异,且在细胞总数上有明显的不同。早期囊胚细胞数较少,细胞数在100以下(图 2a);扩张囊胚一般细胞数为200个以下(图 2b、2c);同一时期孵化囊胚细胞数可以达到280个,结果表明在同一培养条件下,胚胎分裂增殖速度差异明显。
|
a. 早期囊胚,总细胞数53;b. 扩张囊胚,总细胞数129;c. 扩张囊胚,总细胞数175;d. 孵化囊胚,总细胞数280,红色箭头所示为ICM区域 a. Early blastocyst, total cell number 53; b. Expanded blastocyst, total cell number 129; c. Expanded blastocyst, total cell number 175; d. Hatched blastocyst, total cell number 280. The ICM area is shown by the red arrows 图 2 体外培养168 h绵羊囊胚DAPI染色 Fig. 2 DAPI staining of sheep blastocysts cultured for 168 h in vitro |
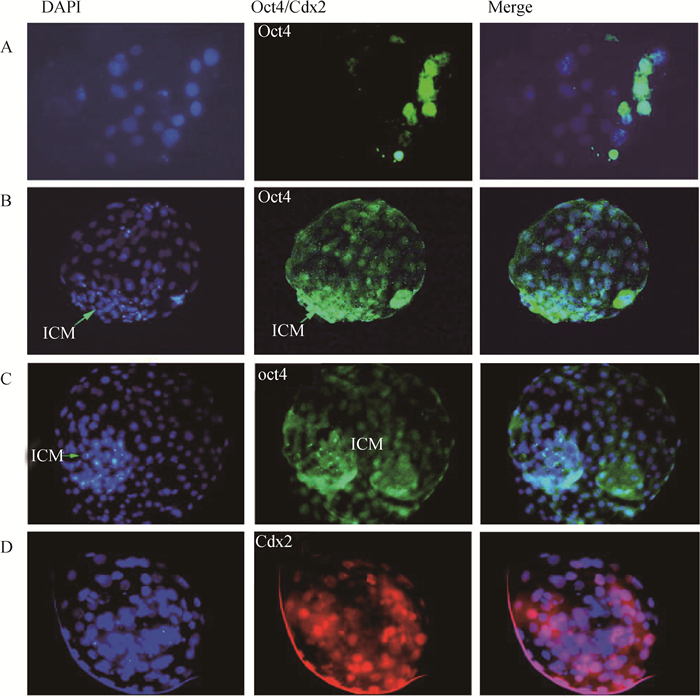
2.2.1 不同发育时期绵羊胚胎Oct4基因的免疫荧光染色 为分析阿勒泰羊早期胚胎不同发育阶段Oct4基因在表达,分别对2~8细胞期,16~32细胞期和囊胚期胚胎进行了Oct4基因的免疫荧光染色,染色结果表明,阿勒泰羊早期胚胎在2~8细胞期胚胎内均未检测到Oct4基因的表达(结果未显示);在阿勒泰羊16~32细胞期中Oct4基因出现表达(图 3A),由于Oct4基因是转录因子,主要在细胞核表达,因此和DAPI的细胞核定位染色相互重叠(图 3A),染色结果提示:在阿勒泰羊胚胎16~32细胞期并不是所有的细胞都检测到Oct4基因的表达,只有部分细胞表达Oct4基因(图 3A)。胚胎发育至囊胚期后,细胞分化为外围扁平的TE细胞和内部团块状的ICM,从免疫荧光染色结果看,在扩张期和孵化期囊胚,Oct4基因不仅在内细胞团中表达(图 3B、3C),也在大部分TE细胞中表达,这与小鼠的Oct4基因表达模式不同。Oct4基因是多能基因,但是在绵羊上,不仅观察到Oct4基因在内细胞团中表达,而且在扩张囊胚分化的TE细胞上也有表达(图 3B)。
|
A.16~32细胞期胚胎(200×)开始表达Oct4基因;B.扩张囊胚(200×)表达Oct4基因;C.孵化囊胚(200×)表达Oct4基因;D.Cdx2基因在囊胚期胚胎的TE上表达 A. Oct4 gene was expressed in 16~32 cell stage embryo(200×); B. Oct4 gene was expressed in the expanded blastocyst (200×): C. Oct4 gene was expressed in hatched blastocyst(200×); D. Expression of Cdx2 gene on TE in blastocyst embryos 图 3 Oct4基因在绵羊胚胎不同发育时期的表达及Cdx2基因在囊胚期胚胎的TE表达 Fig. 3 Expression of Oct4 gene in different developmental stages of sheep embryos and TE expression of Cdx2 gene in blastocyst embryos |
2.2.2 囊胚期TE细胞Cdx2免疫荧光染色 对囊胚期胚胎Cdx2基因进行免疫荧光染色,结果如图 3D所示:作为TE的标记基因,Cdx2基因在囊胚期分化的TE细胞上表达。由于囊胚期胚胎为多层球状体,TE细胞在外侧包裹着内部的内细胞团细胞,本试验免疫荧光染色显示:在内细胞团所在区域未见明亮的团块状荧光区域,Cdx2基因在绵羊内细胞团上不表达(图 3D)。本试验结果证实:绵羊囊胚期TE细胞上存在Oct4和Cdx2的共表达。由于体外培养条件的限制,绵羊胚胎只能培养到囊胚阶段,Oct4在绵羊附植前胚胎TE中何时消失,还需要进一步的研究证实。
3 讨论在过去20年当中,利用体外胚胎生产技术已经成功得到了大多数的家养动物的后代[20-24]。然而,当前无论从胚胎形态还是物质代谢方面,体外生产的胚胎在质量上都还达不到体内胚胎的水平[25]。体外受精效率的提高不仅要求卵母细胞成熟和精子获能的能力,同时体外培养环境,包括培养液对促进体外胚胎的生产都具有重要作用[26]。当前在绵羊体外受精胚胎生产过程中,国内外研究者大多参考和借鉴牛体外受精胚胎生产的体系和方法,并在此基础上加以完善[27]。
本研究应用免疫荧光染色对体外培养的受精卵、卵裂胚、桑葚胚和囊胚进行了Oct4蛋白的检测。结果表明:受精卵和早期卵裂胚未检测到Oct4蛋白;16~32细胞期桑葚胚部分细胞表达Oct4蛋白表达。根据研究结果推测:虽然此时胚胎还未出现真正意义上第一次细胞分化(分化为外侧的TE和内部的ICM),胚胎细胞间已经出现了明显的表达差异性。小鼠上的研究也证实:在4细胞期胚胎的不同卵裂球之间,多能基因Oct4和Cdx2的表达已经出现了明显差异[6],本研究提示:Oct4在第一次细胞分化过程中可能起到了重要调控作用。本研究还表明:在阿勒泰绵羊囊胚细胞中TE和ICM均表达Oct4。而早表达Oct4基因的细胞将发育为TE还是ICM, 还需要进一步验证。
本研究通过免疫荧光染色表明囊胚TE的细胞核上Oct4持续表达,Oct4在TE上与Cdx2存在共表达。Oct4基因和Cdx2基因互相抑制,Oct4可以负调控Cdx2基因的表达,Cdx2也可以通过抑制Oct4基因增强子的表达,而降低Oct4表达水平[28]。卵裂球中Cdx2分布的高低水平是影响小鼠胚胎进行不对称分裂次数和ICM细胞数的关键影响因子[6],升高Cdx2的表达,可以促进TE细胞分化和增殖,相反,降低胚胎中Cdx2的表达则促进了ICM的数量。因此,Cdx2和Oct4基因的协调表达决定了胎盘和胎儿的发育。
在牛上,TE细胞中Oct4基因表达下调非常缓慢,导致TE中出现Oct4和Cdx2基因的共表达[29]。在胚胎附植前,干扰素(interferon-tau,IFNT)是母体妊娠识别过程最主要的功能蛋白[6],IFNT由反刍动物TE的单核细胞产生,自发现至今已经有三十多年的历史,但是目前还没有好的方法可以调控IFNT的分泌。Cdx2是IFNT转录必需的转录因子[8, 16]。此外,Cdx2还可维持IFNT基因处于松散的常染色质状态,从而有利于IFNT的转录[30],促进胚胎的附植。IFNT的转录还需要转录因子激活蛋白CREBBP(cAMP-response element binding protein),AP1和ETS2形成复合物[31], AP1-CREBBP-ETS2复合物必须结合到IFNT基因的上游的启动子区和增强子区域,才能启动IFNT的转录。Oct4基因的POU结合域可以与ETS2的中央结合域直接结合,从而抑制AP1-CREBBP-ETS2复合物的产生[32],进而不利于TE细胞转录IFNT。因此,Oct4可以通过抑制Cdx2的表达,间接影响IFNT的转录,也可以通过抑制AP1-CREBBP-ETS2复合物而直接抑制IFNT的转录,因此,Oct4在胚胎TE中的持续表达,可能对胎盘发育及胚胎在子宫附植产生不利的影响。
4 结论本研究通过体外成熟、体外受精和体外培养获得了不同发育时期的绵羊胚胎,应用免疫荧光染色探讨了Oct4在早期胚胎的表达规律,结果表明:受精卵,早期卵裂胚未检测到Oct4蛋白;16~32细胞期桑葚胚部分细胞表达Oct4蛋白;Oct4与Cdx2基因在绵羊囊胚TE中存在共表达。这一现象在反刍动物如牛上也有报道,证实了牛早期囊胚TE上存在大量Oct4基因的mRNA,但作者并未通过荧光染色证实Oct4蛋白的表达[6]。作为重要的多能转录因子,Oct4在TE细胞中表达的生物学意义目前还不清楚。应当关注的问题是:Oct4基因表达在牛羊胚胎TE细胞中如何调控?能否像小鼠一样,Oct4是否可以在牛羊TE中迅速消失?Oct4在牛羊TE细胞迅速消失后,IFNT表达能否升高,从而提高妊娠率?鉴于牛羊大动物胚胎在子宫中伸长,识别和附植失败是导致妊娠率低的主要原因,因此,有必要对早期胚胎Oct4基因表达规律和调控机制进行深入分析,以及找到提高妊娠率的关键靶点。
| [1] |
MORRISON G M, BRICKMAN J M. Conserved roles for Oct4 homologues in maintaining multipotency during early vertebrate development[J]. Development, 2006, 133(10): 2011-2022. DOI:10.1242/dev.02362 |
| [2] |
刘晓鹏. 小鼠Oct4基因剪接体的鉴定和功能分析[D]. 杨凌: 西北农林科技大学, 2018. LIU X P. Identification and functional analysis of mouse Oct4 gene splicing[D]. Yangling: Northwest A&F University, 2018. (in Chinese) |
| [3] |
任婧. 旁分泌因子促进绵羊卵母细胞体外成熟和早期胚胎发育的作用研究[D]. 呼和浩特: 内蒙古大学, 2017. REN J. Paracrine factors promote in vitro maturation and early embryo development of ovine oocytes[D]. Hohhot: Inner Mongolia University, 2017. (in Chinese) |
| [4] |
NIWA H. Molecular mechanism to maintain stem cell renewal of ES cells[J]. Cell Struct Funct, 2001, 26(3): 137-148. DOI:10.1247/csf.26.137 |
| [5] |
田丽, 时邵辉, 胡虹宇, 等. 绵羊Oct4基因的克隆及序列分析[J]. 草食家畜, 2019(3): 19-24. TIAN L, SHAO S H, HU H Y, et al. Sequence analysis and cloning of Oct4 gene in sheep[J]. Grass-Feeding Livestock, 2019(3): 19-24. (in Chinese) |
| [6] |
BERG D K, SMITH C S, PEARTON D J, et al. Trophectoderm lineage determination in cattle[J]. Dev Cell, 2011, 20(2): 244-255. DOI:10.1016/j.devcel.2011.01.003 |
| [7] |
SAADELDIN I M, CHOI W, DA TORRE B R, et al. Embryonic development and implantation related gene expression of oocyte reconstructed with bovine trophoblast cells[J]. J Reprod Dev, 2012, 58(4): 425-431. DOI:10.1262/jrd.11-112H |
| [8] |
NIWA H, TOYOOKA Y, SHIMOSATO D, et al. Interaction between Oct3/4 and Cdx2 determines trophectoderm differentiation[J]. Cell, 2005, 123(5): 917-929. DOI:10.1016/j.cell.2005.08.040 |
| [9] |
ROBERTS R M, CROSS J C, LEAMAN D W. Interferons as hormones of pregnancy[J]. Endocr Rev, 1992, 13(3): 432-452. |
| [10] |
NAGAOKA K, NOJIMA H, WATANABE F, et al. Regulation of blastocyst migration, apposition, and initial adhesion by a chemokine, interferon γ-inducible protein 10 kDa (IP-10), during early gestation[J]. J Biol Chem, 2003, 278(31): 29048-29056. DOI:10.1074/jbc.M300470200 |
| [11] |
NICHOLS J, ZEVNIK B, ANASTASSIADIS K, et al. Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4[J]. Cell, 1998, 95(3): 379-391. DOI:10.1016/S0092-8674(00)81769-9 |
| [12] |
王红梅. 哺乳动物早期胚胎发育研究进展和伦理[J]. 生物医学转化, 2020, 1(1): 35-42. WANG H M. Advances and ethics in research of early mammalian embryonic development[J]. Biomedical Transformation, 2020, 1(1): 35-42. (in Chinese) |
| [13] |
RALSTON A, ROSSANT J. Genetic regulation of stem cell origins in the mouse embryo[J]. Clin Genet, 2005, 68(2): 106-112. DOI:10.1111/j.1399-0004.2005.00478.x |
| [14] |
CHAWENGSAKSOPHAK K, JAMES R, HAMMOND V E, et al. Homeosis and intestinal tumours in Cdx2 mutant mice[J]. Nature, 1997, 386(6620): 84-87. DOI:10.1038/386084a0 |
| [15] |
DEGRELLE S A, CAMPION E, CABAU C, et al. Molecular evidence for a critical period in mural trophoblast development in bovine blastocysts[J]. Dev Biol, 2005, 288(2): 448-460. DOI:10.1016/j.ydbio.2005.09.043 |
| [16] |
刘瑞琪, 王玮玮, 屈鹏祥, 等. FGF4在牛早期胚胎发育过程中的表达[J]. 动物医学进展, 2018, 39(1): 56-60. LIU R Q, WANG W W, QU P X, et al. Expression of FGF4 in bovine embryos at early developmental stage[J]. Progress in Veterinary Medicine, 2018, 39(1): 56-60. DOI:10.3969/j.issn.1007-5038.2018.01.010 (in Chinese) |
| [17] |
赵天, 李谷月, 潘阳阳, 等. Oct4在牦牛卵母细胞及早期胚胎发育过程中的表达[J]. 畜牧兽医学报, 2017, 48(3): 577-584. ZHAO T, LI G Y, PAN Y Y, et al. The Expression of octamer-binding transcription factor 4 gene (Oct 4) in Yak (Bos grunneins) oocytes and preimplantation embryos produced by in vitro fertilization[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(3): 577-584. (in Chinese) |
| [18] |
赵楠楠, 王艳, 郭艳娟, 等. Oct4和Cdx2对牛胚胎内细胞团和滋养外胚层分化的影响[J]. 中国实验动物学报, 2020, 28(6): 818-823. ZHAO N N, WANG Y, GUO Y J, et al. Effects of Oct4 and Cdx2 on differentiation of bovine embryonic inner cell mass and trophectoderm[J]. Acta Laboratorium Animalis Scientia Sinica, 2020, 28(6): 818-823. DOI:10.3969/j.issn.1005-4847.2020.06.012 (in Chinese) |
| [19] |
郭延华. EGF对不同直径卵泡绵羊卵母细胞体外成熟、受精及胚胎发育的影响[D]. 石河子: 石河子大学, 2010. GUO Y H. The effect of EGF on ovine oocytes with different size follicle maturation, fertilization and the early development competence of embryo in vitro[D]. Shihezi: Shihezi University, 2010. (in Chinese) |
| [20] |
BRACKETT B G, BOUSQUET D, BOICE M L, et al. Normal development following in vitro fertilization in the cow[J]. Biol Reprod, 1982, 27(1): 147-158. DOI:10.1095/biolreprod27.1.147 |
| [21] |
CHENG W T K, MOOR R M, POLGE C. In vitro fertilization of pig and sheep oocytes matured in vivo and in vitro[J]. Theriogenology, 1986, 25(1): 146. DOI:10.1016/0093-691X(86)90200-1 |
| [22] |
HANADA A. In vitro fertilization in goats[J]. Jpn J Anim Reprod, 1985, 31: 21-26. |
| [23] |
CROZET N, HUNEAU D, DE DESMEDT V, et al. In vitro fertilization with normal development in the sheep[J]. Gamete Res, 1987, 16(2): 159-170. DOI:10.1002/mrd.1120160207 |
| [24] |
PALMER E, BÉZARD J, MAGISTRINI M, et al. In vitro fertilization in the horse.A retrospective study[J]. J Reprod Fertil Suppl, 1991, 44: 375-384. |
| [25] |
KHURANA N K, NIEMANN H. Energy metabolism in preimplantation bovine embryos derived in vitro or in vivo[J]. Biol Reprod, 2000, 62(4): 847-856. DOI:10.1095/biolreprod62.4.847 |
| [26] |
万鹏程, 石文艳, 周平, 等. 绵羊体外受精胚胎培养系统优化与囊胚差异染色[J]. 新疆农业科学, 2010, 47(12): 2469-2476. WAN P C, SHI W Y, ZHOU P, et al. Optimization of culture system and bastaca differential cell staining of in vitro fertilization embryos of sheep[J]. Xinjiang Agricultural Sciences, 2010, 47(12): 2469-2476. (in Chinese) |
| [27] |
GOOLAM M, SCIALDONE A, GRAHAM S J L, et al. Heterogeneity in Oct4 and Sox2 targets biases cell fate in 4-cell mouse embryos[J]. Cell, 2016, 165(1): 61-74. DOI:10.1016/j.cell.2016.01.047 |
| [28] |
IMAKAWA K, KIM M S, MATSUDA-MINEHATA F, et al. Regulation of the ovine interferon-tau gene by a blastocyst-specific transcription factor, Cdx2[J]. Mol Reprod Dev, 2006, 73(5): 559-567. DOI:10.1002/mrd.20457 |
| [29] |
SAKURAI T, SAKAMOTO A, MUROI Y, et al. Induction of endogenous interferon tau gene transcription by CDX2 and high acetylation in bovine nontrophoblast cells[J]. Biol Reprod, 2009, 80(6): 1223-1231. DOI:10.1095/biolreprod.108.073916 |
| [30] |
SAKURAI T, BAI H, KONNO T, et al. Function of a transcription factor CDX2 beyond its trophectoderm lineage specification[J]. Endocrinology, 2010, 151(12): 5873-5881. DOI:10.1210/en.2010-0458 |
| [31] |
XU N C, TAKAHASHI Y, MATSUDA F, et al. Coactivator CBP in the regulation of conceptus IFNτ gene transcription[J]. Mol Reprod Dev, 2003, 65(1): 23-29. DOI:10.1002/mrd.10293 |
(编辑 范子娟)



