2. 湘南学院基础医学院,郴州 423000
2. Department of Basic Medicine, Xiangnan University, Chenzhou 423000, China
钩吻(Gelsemium elegans)是马钱科植物葫蔓藤的全草,根据其分布分为两大类:一类是生长在北美洲的美洲钩吻,包括Gelsemium sempervirens和Gelsemium rankinii两种,另一类为生长在亚洲东南亚地段的亚洲钩吻(Gelsemium elegans Benth)[1]。在中国,钩吻又名大茶药、断肠草、野葛等,主要分布于我国华南一带[2]。药理学研究显示,钩吻具有镇痛、镇静、抗焦虑、抗炎、抗肿瘤等作用[3-7],药理活性成分主要为吲哚生物碱,如钩吻素子、钩吻素甲、钩吻素己、钩吻绿碱等[8-12]。钩吻又名“猪人参”,《唐本草》云“人或畜食其叶皆死,羊食则大肥,猪食之能治热性病”。中国兽药典2015记载,将钩吻粉碎过筛后喂食猪,具有健胃、杀虫之功效,可促进猪的生长[13],同时也可作为水产养殖添加剂,提高鱼类免疫力和生长性能[14-15]。因此钩吻具有作为药物及饲料添加剂开发的潜力,但钩吻安全作用范围窄,不遵循钩吻使用原则易导致中毒的发生。中毒典型症状包括头晕、呕吐、视力模糊、肌肉无力、四肢麻痹、瞳孔扩大、呼吸困难、昏迷和抽搐[16-17],呼吸衰竭和呼吸肌麻痹是诱发死亡的主要原因[18-20]。高含量的吲哚类生物碱既是钩吻的药理活性成分同时也是毒性成分。在北美钩吻分离出的各种单体中以钩吻素乙的毒性最强,而亚洲钩吻中以钩吻素己毒性最强,腹腔注射大鼠时LD50分别为0.2、0.165 mg·kg-1。此两种生物碱同属剧毒物质,其中毒症状与钩吻全草或者提取物中毒症状相似,是诱发钩吻毒性的主要物质[3]。毒性发生迅速且易诱发死亡,影响钩吻在兽医临床的安全应用[17]。目前,对钩吻毒性机制研究进展缓慢,尚无特效解毒剂。探寻钩吻中毒的有效解救药物,有利于防控钩吻不合理使用引起的中毒。本试验将氟马西尼与肾上腺素列为候选药物,研究联合用药能否缓解钩吻毒性的发生与发展,以期寻找特效的解救药物,完善钩吻的毒理数据,促进钩吻的安全开发。
1 材料与方法 1.1 实验动物SD大鼠120只,体重200 g±20 g,购自湖南斯莱克景达实验动物有限公司,在SPF级动物房饲养,适应一周后开始试验。
1.2 试剂与仪器钩吻全草灌服液由湖南省兽药工程技术研究中心制备,浓度为0.1 g·mL-1,即1 mL灌服液含有生药0.1 g。盐酸肾上腺素注射液(哈药三精制药有限公司,批号19071231,规格1 mL:1 mg),氟马西尼注射液(湖南正清制药有限公司,批号1910406,规格2 mL:0.2 mg)。XR900型大鼠无创血压测定仪(欣软科技有限公司,上海),EPC-10膜片钳放大器(Heka electronics,德国),微电极拉制仪(Sutter instruments, 美国),毛细玻璃管(Sutter instruments, 美国),倒置显微镜(麦克奥迪,福建)。
1.3 试验设计1.3.1 大鼠灌胃钩吻的急性毒性 60只大鼠禁食不禁水12 h后,按体重随机分为6组(n=10),雌雄各半。试验设1个空白对照组(灌胃生理盐水)和5个给药组(灌胃剂量分别为0.10、0.15、0.22、0.34、0.50 g·kg-1)。灌胃体积为10 mL·kg-1,按体重计算各组给药量。灌胃后记录各组大鼠的毒性反应和死亡情况,用Bliss法软件计算半数致死量(LD50),并对死亡大鼠进行大体尸检。
1.3.2 解救药物对钩吻中毒大鼠的解救效果 将48只大鼠按体重随机分为4组(n=12),雌雄各半,试验设对照组、氟马西尼解救组、肾上腺素解救组、联合用药解救组(氟马西尼+肾上腺素)。根据钩吻急性毒性结果选择大于LD50的剂量0.34 g·kg-1为对照组的灌胃剂量,构建钩吻中毒模型。解救组在中毒模型基础上给予解救药物,解救药物使用剂量参考人医临床推荐用量,根据动物体表面积折算法在大鼠和人之间做等效剂量换算[21],计算公式:大鼠剂量=X mg×0.018/0.2 kg,其中X为推荐用量。人医临床氟马西尼推荐用量0.6 mg,肾上腺素推荐用量0.5 mg。换算到大鼠后氟马西尼给药剂量为0.06 mg·kg-1,肾上腺素给药剂量为0.05 mg·kg-1。解救组在大鼠灌胃钩吻后腹腔注射解救药物。记录各组大鼠中毒症状出现、死亡时间。采用生存曲线进行数据分析,比较解救药物是否可以缓解中毒症状、延缓死亡时间及减少死亡数量。
1.3.3 解救药物对中毒大鼠的血压、心率、呼吸频率的影响 使用大鼠无创血压测定仪,对1.3.2各组大鼠进行监测。在恒温加热仓中检测大鼠尾动脉脉搏。将压脉套至大鼠尾部近心端,高敏脉搏换能器对准尾巴腹侧,调整放大器灵敏度至脉搏振幅足够大,在设定的时间使用充气球充气和放气,测量收缩压、舒张压、平均压和心率。
1.3.4 分子对接预测药物作用靶点 采用分子对接方法验证钩吻素己和氟马西尼分别与GABAA受体的结合情况。在Protein Data Bank(PDB)数据库中获取GABAA受体蛋白(PDB ID: 6 dw1)三维结构。使用Schrödinger软件包中的Protein and Ligand Preparation模块,基于OPLS-2005力场对蛋白加氢、加电荷和质子化处理,并进行能量优化。以Glide对接方法预测小分子与蛋白的结合模式,生成小分子与蛋白结合得分最高的结合位点构象作为最终对接构象。
1.3.5 全细胞膜片钳检测钩吻素己对GABAA受体电流的影响 将原代大鼠海马神经元细胞接种至带有细胞爬片且包被多聚L-赖氨酸的培养皿中培养。用微电极拉制仪将毛细玻璃管拉制成记录电极,在倒置显微镜下操纵微电极操纵仪将记录电极接触到细胞上。手动膜片钳技术检测细胞GABAA受体电流,在形成全细胞封接后细胞膜电压钳制于-70 mV,在Gap-free模式下进行给药记录,给药顺序依次为喷射GABA 6 μmol·L-1、钩吻素己10 μmol·L-1、GABA 6 μmol·L-1+钩吻素己10 μmol·L-1,GABA 6 μmol·L-1 +钩吻素己10 μmol·L-1 +氟马西尼10 μmol·L-1。试验数据由膜片钳放大器进行采集,并储存于PatchMaster(Heka electronics, 德国)软件。
1.4 数据统计与分析大鼠解救效果使用Graphpad prism8进行生存曲线分析,并经Logrank检验显著性,组间比较采用学生t-test进行分析,计算各组P值。结果P < 0.05为有统计学意义(*.P < 0.05, **.P < 0.01)。
2 结果 2.1 钩吻全草对大鼠的急性毒性钩吻全草灌胃大鼠后,大鼠出现明显的中毒症状。主要表现为自发活动水平明显减少,精神沉郁,呼吸短而急促,弓背,前肢无力匍匐不动,抬头时出现明显的震颤,眼球凸出,严重者出现明显腹式呼吸,伴有张嘴辅助呼吸动作,全身皮肤呈淡蓝色的紫绀缺氧状态,最后因呼吸衰竭,抽搐跳跃挣扎而亡。大鼠在灌胃给药后中毒症状出现的时间在10~40 min,死亡时间基本上在1 h之内。症状出现时间和死亡时间随着剂量的增大加快,对中毒死亡的大鼠进行剖检,心、肺、肝有明显淤血,颜色暗红,其他脏器未见异常。空白对照组没有发生大鼠死亡现象。通过bliss软件测算钩吻灌胃大鼠的LD50为0.25 g · kg-1 (表 1), 测定的LD50 95%置信限为0.20~0.31 g·kg-1。未死亡的大鼠在症状出现1 h后均可自行恢复,且在观察期14 d未见死亡。钩吻急性毒性具有潜伏期短和抑制呼吸的特点。
|
|
表 1 钩吻全草对大鼠的急性毒性 Table 1 Acute toxicity of Gelsemium elegans in rats |
为使解救效果的评价更直观,以大鼠头部震颤、眼球凸出症状都出现作为中毒症状出现时间,即中毒时间。由结果可知,氟马西尼和肾上腺素单独解救组都可以一定程度上提高大鼠存活率,存活率从25%分别提高到了42%和50%(P < 0.05),且单独使用肾上腺素显著性降低中毒比率并延缓大鼠平均死亡时间(P < 0.05),单独使用氟马西尼没有此效果(表 2,图 1)。氟马西尼和肾上腺素联合解救时,解救效率大大提高,大鼠存活率升高至92%(P < 0.01),且中毒率由100%降至67%,平均症状出现时间以及平均死亡时间都显著性延缓,分别由16.56 min延缓至25.98 min(P < 0.01),40.13 min延缓至58.05 min(P < 0.01)。由此可知,联合用药显著提高了中毒大鼠的存活率,同时缓解了中毒症状并延缓了死亡时间。
|
|
表 2 候选药物对钩吻中毒大鼠的解救效果(x±sx) Table 2 The detoxification of candidate antidotes to Gelsemium elegans poisoning rats (x±sx) |

|
FLM. 氟马西尼;EPI. 肾上腺素;与对照组比较,*. P < 0.05; **.P < 0.01。下同 FLM. Flumazenil; EPI. Epinephrine; compared with control group, *.P < 0.05; **.P < 0.01. The same as below 图 1 候选药物对钩吻中毒大鼠的解救生存曲线 Fig. 1 The survival curves of Gelsemium elegans poisoning rats treated with antidotes |
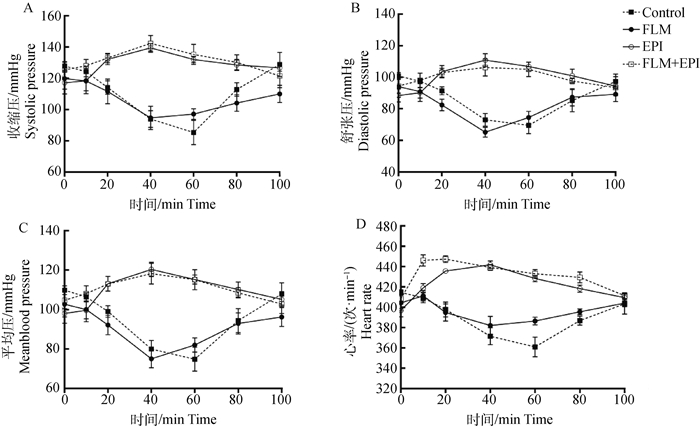
由结果可知(图 2),对照组的大鼠在灌胃钩吻后,收缩压、舒张压、平均压、心率都显著降低,在40~60 min收缩压、舒张压、平均压、心率降到最低值,这与钩吻中毒大鼠的平均死亡时间接近。氟马西尼单独解救组收缩压、舒张压、平均压、心率与对照组的趋势一致,无明显缓解效果。而肾上腺素单独解救组和联合用药组的大鼠收缩压、舒张压、平均压和心率有明显升高现象,40 min后逐渐恢复。中毒大鼠100 min时血压与心率基本恢复至正常范围,后续观察无死亡现象。
|
图 2 候选药物对钩吻中毒大鼠的收缩压、舒张压、平均压及心率的影响 Fig. 2 The effects of antidotes on systolic, diastolic, mean blood pressure and heart rate of Gelsemium elegans poisoning rats |
采用钩吻神经毒性最大生物碱钩吻素己,与解救药物氟马西尼的中枢作用靶点GABAA受体进行分子对接,计算机分子对接分析钩吻素己与GABAA受体的相互作用关系,并与氟马西尼的作用位点进行比较。对接结果显示,钩吻素己与氟马西尼均可与GABAA受体膜外结构域α1 γ2亚基间隙空腔较好地结合,结合的空腔位置相近,深入疏水空腔,紧贴蛋白质表面,结合效果较好(图 3)。钩吻素己与氟马西尼与氨基酸Lys 102,分别形成3.2和3.1 Å的氢键。通过药物与蛋白结合互作能量分解分析,氟马西尼与蛋白质结合的总结合自由能比钩吻素己更高(-85.47 vs -77.15 kJ·mol-1)。钩吻素己和氟马西尼都可以有效地靶向作用于GABAA蛋白,但氟马西尼结合能力优于钩吻素己,可逆转钩吻素己的毒性效果。

|
A. GABAA蛋白3D结构及配体结合部位;B. 钩吻素己与GABAA对接区域结构;C. 氟马西尼与GABAA对接区域结构 A. GABAA 3D structure and ligand binding site; B. Docking region structure of Gelsenicine and GABAA; C. Docking region structure of flumazenil and GABAA 图 3 GABAA受体和配体对接区域的结构3D图 Fig. 3 3D view of the structure of GABAAreceptor and ligand docking region |
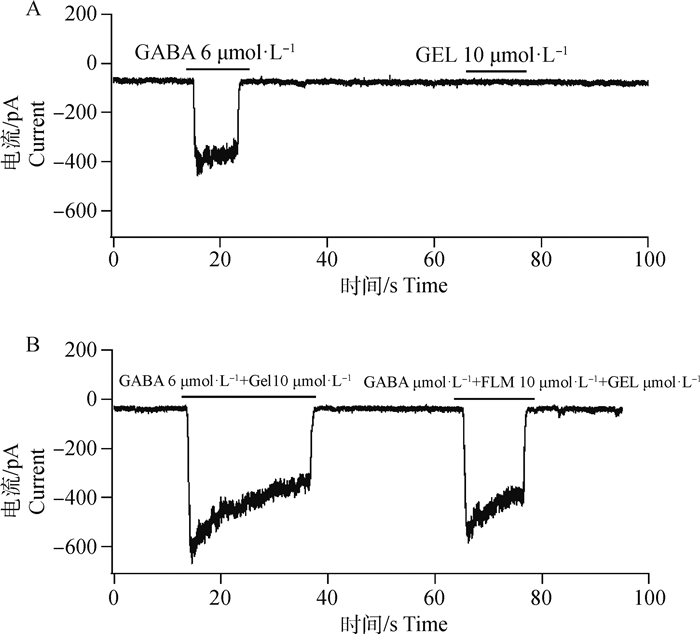
采用全细胞膜片方法探讨钩吻素己对GABAA受体的影响(图 4),数据显示,单独添加6 μmol·L-1 GABA时,Cl-通道打开使Cl-内流形成显著的GABAA受体电流峰。单独添加钩吻素己10 μmol·L-1未产生任何电流峰,这说明钩吻素己对GABAA受体没有直接激动作用。但同时加入GABA和钩吻素己时,钩吻素己可延长GABA与GABAA受体的作用时间,使Cl-通道开放时间明显延长。GABA与氟马西尼、钩吻素己同时加入时,Cl-通道开放时间恢复正常,说明氟马西尼可逆转钩吻素己产生的通道开放延长效应。
|
A.钩吻素己对GABAA受体无直接激动作用;B.钩吻素己延长GABAA受体通道开放时间及氟马西尼的拮抗作用;FLM. 氟马西尼;GEL. 钩吻素己 A. No direct agonistic effect of gelsenicine on GABAAreceptor; B. Gelsenicine prolong the GABAAreceptor channel opening time and the antagonistic effect of flumazenil; FLM. Flumazenil; GEL. Gelsenicine 图 4 钩吻素己对GABAA受体电流的影响 Fig. 4 Effects of gelsenicine on GABAA receptor current |
钩吻中毒病例多由于误采、误食或不遵循药物使用原则所致[20, 22-23]。迄今未找到钩吻中毒特效解毒药,临床中毒病例以对症治疗为主,洗胃、导泻、血液净化、维持气道通畅为主要的治疗手段,严重呼吸抑制患者则采用侵入性治疗予以呼吸辅助。但钩吻中毒具有潜伏期短、病情发生凶险的特点,临床抢救疗效并不显著。找寻有效的解救药物及毒性作用的靶点也成为人们亟待解决的难题。
CYP3A4/5是钩吻生物碱的主要代谢酶,抑制其活性可以显著提高钩吻毒性的发生,但未报道激活其活性是否可以减毒[24]。钩吻生物碱可抑制乙酰胆碱酯酶活性[25],但使用胆碱受体阻断药阿托品解救时没有解救效果[19]。提前15 min注射氟马西尼可以明显提高中毒小鼠的存活率[19]。而提前注射戊巴比妥或地西泮30 min可明显延长钩吻生物碱诱发大鼠惊厥的时间,但是没有提高大鼠存活率[16]。尽管此类报道都建立在预注射的基础上,但从药物作用靶点的规律分析,钩吻的毒性作用与GABAA受体密切相关。GABAA受体是临床治疗焦虑、癫痫及诱导镇静、睡眠、麻醉药物的作用靶点[26],其包含苯二氮卓类药物地西泮[27]和巴比妥类药物戊巴比妥的作用靶点[28-29]。氟马西尼是GABAA受体苯二氮卓类药物结合位点的竞争性拮抗剂,可作为解毒剂逆转苯二氮卓类药物的过度麻醉[27, 30]。本研究结果显示,钩吻灌胃后再给予氟马西尼,解毒的效果只升高了17%,解救效果不及文献报道的防预效果,因此仅使用氟马西尼仍不能作为钩吻中毒的特效解救药物。但本研究发现氟马西尼与肾上腺素联合解救时,解救效果显著。血压下降是死亡的重要危险信号之一,此前有报道钩吻总碱注射液会导致麻醉大鼠的血压下降,心率减慢[31]。神经毒性所致的呼吸抑制一旦出现,容易导致血压降低,呼吸衰竭等危及生命的指征。血压和心率的稳定对钩吻中毒的解救发挥至关重要的作用。肾上腺素是一种强大的血管增压药物,可增加心肌的收缩力,并松弛支气管平滑肌,扩张支气管有利于呼吸的恢复[32-33]。联合肾上腺素使用,可缓解钩吻的中毒症状,呼吸抑制引发的血压下降、心率减慢、呼吸频率紊乱现象都得到一定缓解,起到标本兼治的效果,具有较大的临床应用价值。
GABAA受体是GABA能系统介导快速抑制性神经传递的主要执行者,可抑制神经兴奋信号传递[33-34]。GABAA受体主要功能与Cl-通道有关,激活后Cl-内流,膜电位发生超极化,产生突触后抑制作用。GABAA受体由5个亚基聚对称排列组合形成蛋白质复合物,多由2α1、2β2和γ2 5个亚单位组成[35-37]。近年来,利用分子模拟技术预测外源化学物质的毒性及解释其作用机制已经得到了很好的发展。郑杰等[38]通过分子对接和分子动力学模拟,研究雪卡毒素及其毒性作用靶点钠通道的结合方式,预测雪卡毒素的毒作用模式。不同药物对GABAA受体的变构作用不同,氟马西尼作为逆转苯二氮卓类药物的变构调节剂,可以拮抗苯二氮卓类药物的效果[29]。由于GABAA受体与钩吻素己神经毒性作用的靶点密切相关,本研究通过PDB数据库提供的GABAA受体三维结构,利用分子对接比较发现氟马西尼、钩吻素己与GABAA受体α1 γ2亚基间隙空腔具有较好的结合效果,但氟马西尼的结合自由能要优于钩吻素己,这与氟马西尼提前预注射对钩吻毒性有较好的预防效果相匹配。氟马西尼与GABAA受体对接位点与文献报道的结合位点相近[35, 39]。已有研究表明,4-羟基钩吻素己可延长GABA受体的动作电位[19],本文利用全细胞膜片钳技术测试了钩吻素己与氟马西尼对GABAA受体离子通道电流的影响,氟马西尼作为GABAA受体的竞争性拮抗剂可以拮抗钩吻素己所致的离子通道开放时间延长的现象。但钩吻素己作用于GABAA受体后对受体结构的影响及引发的毒性反应仍需从结构生物学角度深入研究。
此次解救试验,仅对钩吻毒性敏感的大鼠进行了研究和临床观察评估,大鼠中毒及药物解救方案推行到临床仍需要从实际发生的病例中进行完善和总结。
4 结论氟马西尼联合肾上腺素使用是钩吻中毒的有效解救药物组合,可有效缓解中毒症状,显著提高大鼠的存活率,且钩吻神经毒性靶点与GABAA受体密切相关。
| [1] |
LIU Y S, TANG Q, CHENG P, et al. Whole-genome sequencing and analysis of the Chinese herbal plant Gelsemium elegans[J]. Acta Pharm Sin B, 2020, 10(2): 374-382. DOI:10.1016/j.apsb.2019.08.004 |
| [2] |
易金娥, 袁慧. 钩吻毒素的研究进展[J]. 湖南环境生物职业技术学院学报, 2003, 9(1): 26-30. YI J E, YUAN H. Research and development on enterotoxin of gelsemium elegans benth[J]. Journal of Hunan Environment-Biological Polytechnic, 2003, 9(1): 26-30. DOI:10.3969/j.issn.1671-6361.2003.01.004 (in Chinese) |
| [3] |
JIN G L, SU Y P, LIU M, et al. Medicinal plants of the genus Gelsemium (Gelsemiaceae, Gentianales)-a review of their phytochemistry, pharmacology, toxicology and traditional use[J]. J Ethnopharmacol, 2014, 152(1): 33-52. DOI:10.1016/j.jep.2014.01.003 |
| [4] |
JIN G L, YUE R C, HE S D, et al. Koumine decreases astrocyte-mediated neuroinflammation and enhances autophagy, contributing to neuropathic pain from chronic constriction injury in rats[J]. Front Pharmacol, 2018, 9: 989. DOI:10.3389/fphar.2018.00989 |
| [5] |
DUTT V, DHAR V J, SHARMA A. Antianxiety activity of Gelsemium sempervirens[J]. Pharm Biol, 2010, 48(10): 1091-1096. DOI:10.3109/13880200903490521 |
| [6] |
WU Y E, LI Y D, LUO Y J, et al. Gelsemine alleviates both neuropathic pain and sleep disturbance in partial sciatic nerve ligation mice[J]. Acta Pharmacol Sin, 2015, 36(11): 1308-1317. DOI:10.1038/aps.2015.86 |
| [7] |
YUAN Z, LIANG Z, YI J, et al. Protective effect of koumine, an alkaloid from Gelsemium sempervirens, on injury induced by H2O2 in IPEC-J2 cells[J]. Int J Mol Sci, 2019, 20(3): 754. DOI:10.3390/ijms20030754 |
| [8] |
SU Y P, SHEN J, XU Y, et al. Preparative separation of alkaloids from Gelsemium elegans Benth. using pH-zone-refining counter-current chromatography[J]. J Chromatogr A, 2011, 1218(23): 3695-3698. DOI:10.1016/j.chroma.2011.04.025 |
| [9] |
LIU M, HUANG H H, YANG J, et al. The active alkaloids of Gelsemium elegans Benth. are potent anxiolytics[J]. Psychopharmacology (Berl), 2013, 225(4): 839-851. DOI:10.1007/s00213-012-2867-x |
| [10] |
WU J, YANG C L, SHA Y K, et al. Koumine alleviates lipopolysaccharide-induced intestinal barrier dysfunction in IPEC-J2 cells by regulating Nrf2/NF-κB pathway[J]. Am J Chin Med, 2020, 48(1): 127-142. DOI:10.1142/S0192415X2050007X |
| [11] |
CHEN L P, PAN H B, BAI Y J, et al. Gelsemine, a natural alkaloid extracted from Gelsemium elegans Benth. alleviates neuroinflammation and cognitive impairments in Aβ oligomer-treated mice[J]. Psychopharmacology (Berl), 2020, 237(7): 2111-2124. DOI:10.1007/s00213-020-05522-y |
| [12] |
LIU M, SHEN J, LIU H, et al. Gelsenicine from Gelsemium elegans attenuates neuropathic and inflammatory pain in mice[J]. Biol Pharm Bull, 2011, 34(12): 1877-1880. DOI:10.1248/bpb.34.1877 |
| [13] |
CAO J J, YANG K, YU H, et al. Comparative toxicokinetic profiles of multiple-components of Gelsemium elegans in pigs and rats after a single oral administration[J]. Toxicon, 2020, 181: 28-35. DOI:10.1016/j.toxicon.2020.04.093 |
| [14] |
YE Q, FENG Y Y, WANG Z L, et al. Effects of dietary Gelsemium elegans alkaloids on intestinal morphology, antioxidant status, immune responses and microbiota of Megalobrama amblycephala[J]. Fish Shellfish Immunol, 2019, 94: 464-478. DOI:10.1016/j.fsi.2019.09.048 |
| [15] |
YE Q, FENG Y Y, WANG Z L, et al. Effects of dietary Gelsemium elegans alkaloids on growth performance, immune responses and disease resistance of Megalobrama amblycephala[J]. Fish Shellfish Immunol, 2019, 91: 29-39. DOI:10.1016/j.fsi.2019.05.026 |
| [16] |
RUJJANAWATE C, KANJANAPOTHI D, PANTHONG A. Pharmacological effect and toxicity of alkaloids from Gelsemium elegans Benth[J]. J Ethnopharmacol, 2003, 89(1): 91-95. DOI:10.1016/S0378-8741(03)00267-8 |
| [17] |
DUTT V, THAKUR S, DHAR V J, et al. The genus Gelsemium: an update[J]. Pharmacogn Rev, 2010, 4(8): 185-194. DOI:10.4103/0973-7847.70916 |
| [18] |
谢立璟, 韩雪峰. 钩吻中毒的机制、临床特点及处理[J]. 药物不良反应杂志, 2006, 8(3): 202-204. XIE L J, HAN X F. Mechanism, clinical characteristics and management of Gelsemium elegans poisoning[J]. Adverse Drug Reactions Journal, 2006, 8(3): 202-204. DOI:10.3969/j.issn.1008-5734.2006.03.011 (in Chinese) |
| [19] |
YANG S P, LIU Y, SUN F F, et al. Gelsedine-type alkaloids: discovery of natural neurotoxins presented in toxic honey[J]. J Hazard Mater, 2020, 381: 120999. DOI:10.1016/j.jhazmat.2019.120999 |
| [20] |
ZHOU Z, WU L, ZHONG Y H, et al. Gelsemium elegans poisoning: a case with 8 months of follow-up and review of the literature[J]. Front Neurol, 2017, 8: 204. DOI:10.3389/fneur.2017.00204 |
| [21] |
徐叔云, 卞如濂, 陈修. 药理实验方法学[M]. 3版. 北京: 人民卫生出版社, 2002: 1937. XU S Y, BIAN R L, CHEN X. Experimental methodology of pharmacology[M]. 3rd ed. Beijing: People's Medical Publishing House, 2002: 1937. (in Chinese) |
| [22] |
QU D, QIAO D F, CHEN X C, et al. Fatal poisoning by accidental ingestion of the "heartbreak grass" (Gelsemium elegans) verified by toxicological and medico-legal analyses[J]. Forensic Sci Int, 2021, 321: 110745. DOI:10.1016/j.forsciint.2021.110745 |
| [23] |
NG W Y, HUNG L Y, LAM Y H, et al. Poisoning by toxic plants in Hong Kong: a 15-year review[J]. Hong Kong Med J, 2019, 25(2): 102-112. |
| [24] |
SUN R J, CHEN M H, HU Y X, et al. CYP3A4/5 mediates the metabolic detoxification of humantenmine, a highly toxic alkaloid from Gelsemium elegans Benth[J]. J Appl Toxicol, 2019, 39(9): 1283-1292. DOI:10.1002/jat.3813 |
| [25] |
VINCENT D, LAGREU R. Effect of alkaloids of Gelsemium sempervirens Aiton on cholinesterases[J]. C R Seances Soc Biol Fil, 1951, 145(5-6): 348-350. |
| [26] |
BRAAT S, KOOY R F. The GABAA receptor as a therapeutic target for neurodevelopmental disorders[J]. Neuron, 2015, 86(5): 1119-1130. DOI:10.1016/j.neuron.2015.03.042 |
| [27] |
ZHU S T, NOVIELLO C M, TENG J F, et al. Structure of a human synaptic GABAA receptor[J]. Nature, 2018, 559(7712): 67-72. DOI:10.1038/s41586-018-0255-3 |
| [28] |
ERNST B J, CLARK G F, GRUNDMANN O. The physicochemical and pharmacokinetic relationships of barbiturates - from the past to the future[J]. Curr Pharm Des, 2015, 21(25): 3681-3691. DOI:10.2174/1381612821666150331131009 |
| [29] |
KIM J J, GHARPURE A, TENG J F, et al. Shared structural mechanisms of general anaesthetics and benzodiazepines[J]. Nature, 2020, 585(7824): 303-308. DOI:10.1038/s41586-020-2654-5 |
| [30] |
VOTEY S R, BOSSE G M, BAYER M J, et al. Flumazenil: a new benzodiazepine antagonist[J]. Ann Emerg Med, 1991, 20(2): 181-188. DOI:10.1016/S0196-0644(05)81219-3 |
| [31] |
周名璐, 杨兴业, 熊志刚, 等. 钩吻总碱注射液对麻醉大鼠呼吸、血压、心电及脑电的影响[J]. 中成药, 1996(6): 24-26, 52. ZHOU M L, YANG X Y, XIONG Z G, et al. Effect of gelsemine total alkaloid injection on breathing, blood-pressure, electrocardiogram and electroencephalogram of anesthesia rat[J]. Chinese Traditional Patent Medicine, 1996(6): 24-26, 52. (in Chinese) |
| [32] |
SALEHEEN A, CAMPBELL B M, PROSSER R A, et al. Estimation of available epinephrine dose in expired and discolored autoinjectors via quantitative smartphone imaging[J]. Anal Bioanal Chem, 2020, 412(12): 2785-2793. DOI:10.1007/s00216-020-02505-y |
| [33] |
SICHERER S H, SIMONS F E R. Epinephrine for first-aid management of anaphylaxis[J]. Pediatrics, 2017, 139(3): e20164006. DOI:10.1542/peds.2016-4006 |
| [34] |
PHULERA S, ZHU H T, YU J, et al. Cryo-EM structure of the benzodiazepine-sensitive α1β1γ2S tri-heteromeric GABAA receptor in complex with GABA[J]. Elife, 2018, 7: e39383. DOI:10.7554/eLife.39383 |
| [35] |
MIDDENDORP S J, HURNI E, SCHÖNBERGER M, et al. Relative positioning of classical benzodiazepines to the γ2-subunit of GABAA receptors[J]. ACS Chem Biol, 2014, 9(8): 1846-1853. DOI:10.1021/cb500186a |
| [36] |
UUSI-OUKARI M, KORPI E R. Regulation of GABAA receptor subunit expression by pharmacological agents[J]. Pharmacol Rev, 2010, 62(1): 97-135. DOI:10.1124/pr.109.002063 |
| [37] |
SIGEL E, STEINMANN M E. Structure, function, and modulation of GABAA receptors[J]. J Biol Chem, 2012, 287(48): 40224-40231. DOI:10.1074/jbc.R112.386664 |
| [38] |
郑杰, 赵斌, 闫鸿鹏, 等. 雪卡毒素毒性机理的分子对接及分子动力学研究[J]. 化学学报, 2011, 69(17): 2026-2030. ZHENG J, ZHAO B, YAN H P, et al. Molecular docking and molecular dynamics simulation studies of toxicity mechanism of ciguatoxin[J]. Acta Chimica Sinica, 2011, 69(17): 2026-2030. (in Chinese) |
| [39] |
SIGEL E, BUHR A. The benzodiazepine binding site of GABAA receptors[J]. Trends Pharmacol Sci, 1997, 18(11): 425-429. DOI:10.1016/S0165-6147(97)01118-8 |
(编辑 白永平)



