2. 福建农林大学动物科学学院(蜂学学院),福州 350002;
3. 预防兽医学与生物技术福建省高校重点实验室,龙岩 364012
2. College of Animal Sciences (College of Bee Science), Fujian Agriculture and Forestry University, Fuzhou 350002, China;
3. Fujian Key Laboratory of Preventive Veterinary Medicine and Biotechnology, Longyan 364012, China
肝脂质沉积症又称脂肪肝是宠物临床中最常见的肝胆疾病之一,包括肝脂肪变性、炎症和纤维化等病理改变[1]。其近些年来日趋普遍的发病趋势严重威胁到宠物的生命健康以及生活质量。犬猫肝脂沉积症的病理学机制非常复杂,肝细胞内甘油三酯积累的主要代谢异常原因尚不完全清楚,但可能包括脂肪酸摄取、合成、分解和分泌途径的改变[1-3]。风柜斗草(Sarcopyramis napalensis Wall)作为一种保肝护肝、治疗肝炎的单验方被民间广为使用[4]。Guo等[5]研究发现,风柜斗草醇提物能有效改善经CCl4或D-GalN处理后的小鼠血清中谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)的活力水平,及肝组织中丙二醛(malondialdehyde,MDA)含量,同时显著提高了组织中超氧化物歧化酶(superoxide dismutase, SOD)的活性和谷胱甘肽(glutathione,GSH)的活性,与水飞蓟素或双苯二甲酸酯处理结果相似;组织病理学检查发现,与CCl4组和D-GalN组相比,风柜斗草醇提物组小鼠肝病理变化有明显改善。郑晓艳和陈育青[6]应用高脂饮食诱导大鼠建立的非酒精性脂肪肝病模型,观察风柜斗草黄酮干预非酒精性脂肪肝病的作用,发现风柜斗草黄酮可显著降低非酒精性脂肪肝病大鼠血清中TC、TG、ALT、AST的含量,改善其肝组织病理学改变,表明风柜斗草黄酮可有效预防和治疗非酒精性脂肪肝病。因此,风柜斗草在治疗宠物肝脂质沉积症上具有很大的潜力,本课题组前期研究证明风柜斗草水提物显著改善猫肝脂质沉积症,但目前对其作用机制尚未深入研究。
本研究通过分析风柜斗草提取物对蛋氨酸胆碱缺乏(methionine-choline-deficient, MCD)饮食诱导肝脂沉积症小鼠肝脂质代谢相关基因表达情况,结合肝脂质代谢组学分析结果,进一步探究脂质代谢在该药物治疗肝脂沉积症中的作用,为该药在宠物临床中的开发与应用提供理论基础。
1 材料与方法 1.1 材料C57BL/6小鼠购于北京华阜康生物科技股份有限公司。试验严格按照龙岩学院实验动物伦理委员会批准的试验方案和指南进行。MCD、MCS鼠粮购自睿迪生物科技(深圳)有限公司。
碱性磷酸酶(AKP)检测试剂盒、谷丙转氨酶(ALT/GPT)检测试剂盒、谷草转氨酶(AST/GOT)检测试剂盒、谷胱甘肽过氧化物酶(GSH-PX)检测试剂盒、丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒购自南京建成生物科技有限公司;组织固定液购自武汉赛维尔生物科技有限公司;总RNA提取试剂盒、逆转录试剂盒、qPCR试剂盒、蛋白浓度测定试剂盒购自南京诺唯赞生物技术有限公司;细胞裂解液、蛋白酶、磷酸酶抑制剂、封闭液、一抗稀释液、二抗稀释液购自碧云天生物技术有限公司;GADPH抗体、AMPK抗体、p-AMPK抗体、羊抗兔二抗均购自Cell Signaling Technology。
1.2 方法1.2.1 风柜斗草提取物制备 风柜斗草粉碎过50目筛,取风柜斗草粉100 g,用20倍蒸馏水浸泡升温至70 ℃后60赫兹频率超声萃取2 h,抽滤泵抽滤收集滤液,滤渣用20倍水重复操作1次,全部滤液负压旋转蒸发浓缩至10~15 mL,冷却至室温,加入无水乙醇至70%醇含量,抽滤得上清,负压旋转蒸发浓缩,冷冻干燥制得风柜斗草提取物(Sarcopyramis napalensis Wall extract, SNE),-80 ℃保存。
1.2.2 试验小鼠分组、造模、给药 60只雄性C57BL/6小鼠随机分为6组,每组10只,对照组饲喂蛋氨酸胆碱充足(methionine-choline-sufficient, MCS)鼠粮,灌喂生理盐水;MCS+SNE组灌喂400 mg·(kg·bw)-1剂量的风柜斗草提取物;模型组饲喂MCD鼠粮,灌喂生理盐水;MCD+SNE低、中、高剂量组饲喂MCD鼠粮,分别灌喂100、200、400 mg·(kg·bw)-1剂量的风柜斗草提取物,造模及药物干预6周。
1.2.3 肝组织病理学评估 取5 mm×5 mm×2 mm的小鼠肝组织,将其浸泡在福尔马林中,一系列的脱水处理,二甲苯透明,将烧的蜡放在烘箱中使其融化,取肝组织进行浸蜡,随后进行石蜡包埋,用切片机切取厚度为5 μm的组织石蜡,进行后续的HE和天狼猩红染色以及封片观察,评估肝脂肪沉积以及纤维化程度。
1.2.4 血清AKP、ALT、AST及肝组织GSH-Px、SOD、MDA检测 按照试剂盒说明书进行血清AKP、ALT、AST活力水平以及肝组织GSH-Px、SOD活力水平的检测,以及肝组织MDA含量的检测。
1.2.5 肝组织AMPK蛋白的Western blot分析 取肝组织匀浆,提取总蛋白,用BCA蛋白浓度检测试剂盒进行蛋白定量,变性,电泳,转膜,孵育抗体过夜(一抗为兔源AMPK、p-AMPK、GAPDH抗体,均按1∶1 000稀释,二抗为羊抗兔抗体,按1∶2 000稀释),显影,用Image J软件进行灰度分析。
1.2.6 肝组织脂质代谢和纤维化相关基因mRNA表达水平检测 取肝组织按照试剂盒说明书提取总RNA并且分析RNA的浓度和纯度;依据逆转录说明书,在42 ℃ 2 min、37 ℃ 15 min以及85 ℃ 5 sec进行逆转录,随后建立RT-PCR体系,扩增并检测肝型-脂肪酸结合蛋白(liver-fatty acid binding protein, L-FABP)、基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)、金属蛋白酶组织抑制剂-2(tissue inhibitor of metalloproteinase-2, TIMP-2)、脂肪酸合成酶(fatty acid synthase, FAS)、固醇调节元件结合蛋白-1c(sterol regulatory element binding protein 1c, SREBP-1c)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)、脂肪酸转运蛋白-3(fatty acid transport protein-3, FATP-3)、脂肪酸转运蛋白-4(fatty acid transport protein-4, FATP-4)、细胞间黏附分子-1(intercellular cell adhesion molecule-1, ICAM-1)、血管细胞黏附分子-1(vascular cell adhesion molecule-1, VCAM-1)的表达,引物序列见表 1。
|
|
表 1 实时荧光定量PCR引物序列 Table 1 Primer sequence of real-time fluorescence quantitative PCR |
反应条件设置为95 ℃ 10 min,95 ℃ 15 s,53~60 ℃ 30 s,72 ℃ 30 s(40个循环周期)和72 ℃ 10 min。脂质代谢相关基因的表达量以GAPDH为内参基因进行归一化,计算出目的基因以及内参基因的Ct平均值,利用公式(2-ΔΔCt)计算结果。
1.2.7 肝组织非靶向脂质组学分析 采用LC-MS/MS技术进行非靶向脂质组学分析,利用高分辨率质谱仪Q Exactive (Thermo Fisher Scientific, USA),分别采集正离子和负离子两种模式的数据来增加脂质检测覆盖度。使用LipidSearch 4.1软件进行LC-MS/MS数据处理,包括智能峰提取、脂质鉴定、峰对齐等的一系列分析。使用代谢组学R软件包metaX进行统计分析。通过PCA模型观察样本的组间差异情况,使用PLS-DA模型前两个主成分的VIP值,结合差异变化倍数分析和T检验筛选差异脂质分子。
1.2.8 统计分析 采用Graphpad prism 5统计软件进行单因素方差分析Turkey多重比较,P < 0.05(差异显著),P < 0.01(差异极显著)作为差异显著性判断标准。
2 结果 2.1 肝组织病理学评估2.1.1 肝脂肪变性和炎症评估 肝石蜡切片HE染色结果显示,对照MCS组的小鼠肝切片,MCD组肝细胞中出现大量脂质积聚,脂质聚集导致细胞核向一侧偏移,肝静脉索周围细胞结构参差不齐,可见炎性细胞浸润及炎症簇;MCS+400 mg·(kg·bw)-1 SNE组中肝静脉索周围细胞结构排列整齐,细胞内无明显脂质出现,这说明MCS+400 mg·(kg·bw)-1 SNE组不会对小鼠的肝造成影响;MCD+200 mg·(kg·bw)-1 SNE、MCD+400 mg·(kg·bw)-1 SNE组对比MCD组,肝细胞中脂质积聚显著减少,较少见炎症簇,肝细胞结构整齐边界清楚(图 1)。
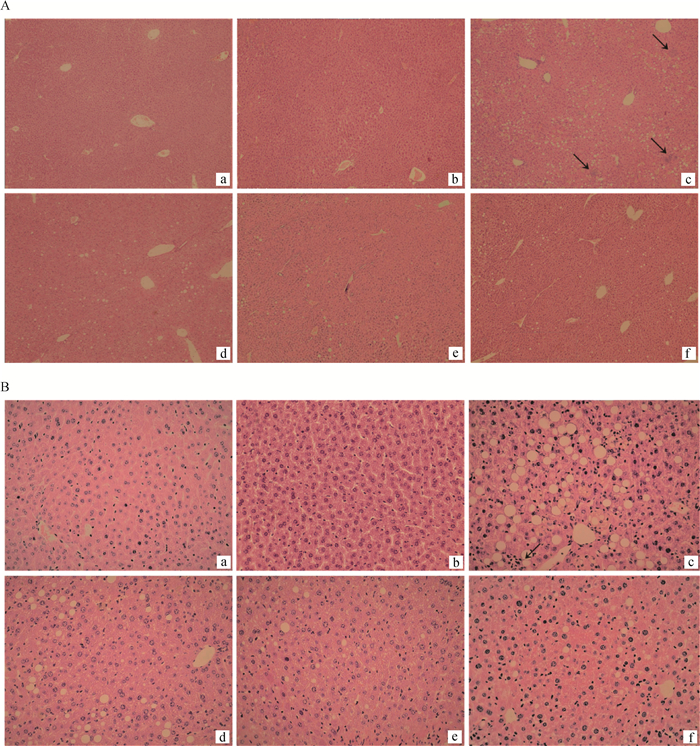
|
A.100×;B. 400×。↑指向炎症簇。a. MCS; b. MCS+400 mg·(kg·bw)-1 SNE; c. MCD; d. MCD+100 mg·(kg·bw)-1 SNE; e. MCD+200 mg·(kg·bw)-1; f. MCD+400 mg·(kg·bw)-1 SNE A.100×; B. 400×. ↑ points to clusters of inflammation. a. MCS; b. MCS+400 mg·(kg·bw)-1 SNE; c. MCD; d. MCD+100 mg·(kg·bw)-1 SNE; e. MCD+200 mg·(kg·bw)-1; f. MCD+400 mg·(kg·bw)-1 SNE 图 1 风柜斗草提取物对MCD模型小鼠肝脂肪沉积以及炎症簇的影响 Fig. 1 Effect of Sarcopyramis napalensis Wall extract on the lipid deposition and inflammation clusters in the livers of MCD diet-fed mice |
2.1.2 肝纤维化情况评估 肝石蜡切片天狼猩红染色结果显示,对照MCS组的小鼠肝切片,MCD组小鼠肝纤维化明显;MCS+400 mg·(kg·bw)-1 SNE组中肝细胞排列紧密整齐,未见异常情况;MCD+ 100 mg·(kg·bw)-1 SNE组、MCD+200 mg·(kg·bw)-1 SNE组、MCD+400 mg·(kg·bw)-1 SNE组小鼠肝切片中纤维化较MCD组都有明显改善,且随剂量的增加纤维化改善越明显,在MCD+400 mg·(kg·bw)-1 SNE组中已未见明显的纤维化(图 2)。
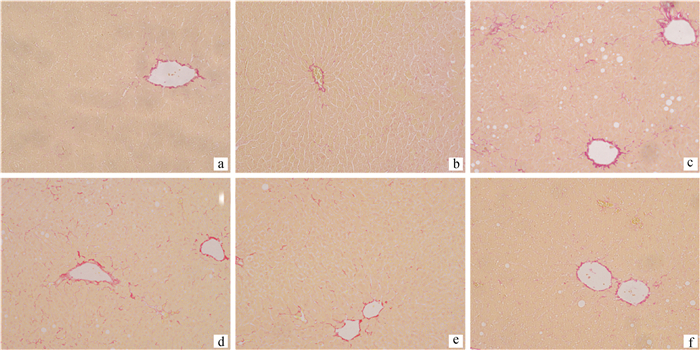
|
a. MCS; b. MCS+400 mg·(kg·bw)-1 SNE; c. MCD; d. MCD+100 mg·(kg·bw)-1 SNE; e. MCD+200 mg·(kg·bw)-1; f. MCD+400 mg·(kg·bw)-1 SNE 图 2 风柜斗草提取物对MCD模型小鼠肝纤维化的影响(200×) Fig. 2 Effect of Sarcopyramis napalensis Wall extract on liver fibrosis of MCD diet-fed mice(200×) |
如表 2血清学检测结果显示,给予风柜斗草提取物100、200、400 mg·(kg·bw)-1时均可显著降低MCD饲料饲喂的小鼠血清中谷丙转氨酶和碱性磷酸酶的活力(P < 0.05),同样说明风柜斗草提取物可以显著改善MCD饮食诱导的脂肪肝炎;给予风柜斗草提取物均可显著降低MCD饲料饲喂的小鼠肝组织中丙二醛的含量(P < 0.05),显著提高小鼠肝中谷胱甘肽过氧化物酶的活力(P < 0.05,表 2)。
|
|
表 2 风柜斗草提取物对MCD模型小鼠血清AKP、ALT、AST活力水平,肝组织GSH-Px和SOD活力水平及MDA含量的影响 Table 2 Effect of Sarcopyramis napalensis Wall extract on the levels of AKP, ALT and AST in serum, and the levels of GSH-Px, SOD and the content of MDA in liver tissue of MCD diet-fed mice |
上述结果显示,400 mg·(kg·bw)-1剂量的风柜斗草提取物改善脂肪肝炎和纤维化效果最好,后续药理机制研究采用400 mg·(kg·bw)-1剂量开展。Western blot检测肝组织AMPK磷酸化结果显示,与MCS组相比,MCD饲料饲喂小鼠肝中AMPK蛋白的活性(P < 0.05)被显著抑制;MCS+400 mg·(kg·bw)-1 SNE组与MCS组中AMPK的激活情况没有显著差异;对比MCD组,MCD+400 mg·(kg·bw)-1 SNE组小鼠肝AMPK被显著激活了(图 3)。
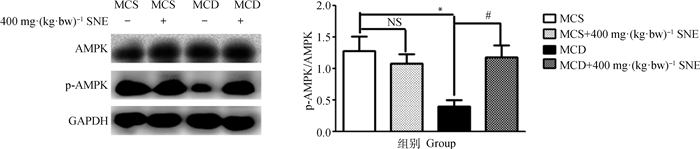
|
与MCS组相比,*. P < 0.05;与MCD组相比,#. P < 0.05 Compared with MCS group, *. P < 0.05; Compared with MCD group, #. P < 0.05 图 3 风柜斗草提取物对MCD模型小鼠肝中AMPK激活水平的影响 Fig. 3 Effect of Sarcopyramis napalensis Wall extract on AMPK activation levels in the liver of MCD diet-fed mice |
检测肝中脂肪酸合成相关基因SREBP-1c和FAS的mRNA表达水平可得(表 3):与MCS组相比,MCD组的SREBP-1c的mRNA表达水平升高49.0%(P>0.05);对比MCD组,MCD+ 400 mg·(kg·bw)-1 SNE组的SREBP-1c mRNA水平被极显著地抑制,使其表达量降低了59.7%(P < 0.001),这与小鼠肝中AMPK蛋白磷酸化结果形成印证。而MCD组相比MCS组,FAS的mRNA表达水平显著下降52.0%(P < 0.05);对比MCD组,MCD + 400 mg·(kg·bw)-1 SNE组中FAS的mRNA表达水平升高91.7%(P < 0.05)。结合AMPK激活情况分析,风柜斗草提取物可抑制MCD饲料饲喂小鼠肝脂肪酸的合成。
|
|
表 3 风柜斗草提取物对MCD模型小鼠肝中SREBP-1c、FAS、L-FABP、FATP-3、FATP-4 mRNA表达水平的影响 Table 3 Effect of Sarcopyramis napalensis Wall extract on the mRNA expression levels of SREBP-1c, FAS, L-FABP, FATP-3, and FATP-4 in the liver of MCD diet-fed mice |
检测肝中脂肪酸转运相关基因L-FABP、FATP-3和FATP-4的mRNA表达水平可得(表 3):与MCS组相比,MCD组的L-FABP的mRNA表达水平极显著升高147.0%(P < 0.001);对比MCD组,MCD+400 mg·(kg·bw)-1 SNE组L-FABP的mRNA表达水平下降了68.8%(P < 0.001)。分析FATP-3的mRNA表达水平,MCD组相比MCS组升高了43.0%,但没有显著差异(P>0.05);对比MCD组,MCD+400 mg·(kg·bw)-1 SNE组FATP-3的mRNA表达水平显著的下降了57.3%(P < 0.05)。分析FATP-4的mRNA表达水平,与MCS组相比,MCD组的FATP-4 mRNA表达水平极显著升高了93.0%(P < 0.001);对比MCD组,MCD+400 mg·(kg·bw)-1 SNE组的FATP-4 mRNA表达水平极显著地下降了59.0%(P < 0.001)。由此可见,风柜斗草提取物可改善MCD饲料饲喂小鼠肝中与脂肪酸转运相关的基因表达,通过抑制L-FABP、FATP-3和FATP-4的基因表达来减少肝对脂肪酸的摄取。
检测肝中炎症相关基因ICAM-1、VCAM-1以及纤维化相关因子MMP-2、TIMP-2的mRNA表达水平可得(表 4):与MCS组相比,MCD组的ICAM-1的mRNA表达水平极显著升高了51.0%(P < 0.01);对比MCD组,MCD+400 mg·(kg·bw)-1 SNE组ICAM-1的mRNA表达水平下降了37.1%(P < 0.01)。分析VCAM-1的mRNA表达水平,MCD组相比MCS组升高了346%(P < 0.001);对比MCD组,MCD +400 mg·(kg·bw)-1 SNE组VCAM-1的mRNA表达水平下降了38.8%(P < 0.001)。分析MMP-2的mRNA表达水平,MCD组相比MCS组升高了347%(P < 0.001);对比MCD组,MCD+400 mg·(kg·bw)-1 SNE组MMP-2的mRNA表达水平下降了61.7%(P < 0.001)。TIMP-2的mRNA表达水平分析结果则显示,MCD组相比MCS组升高了151%(P < 0.01);对比MCD组,MCD+400 mg·(kg·bw)-1 SNE组TIMP-2的mRNA表达水平下降了43.8%(P < 0.01)。
|
|
表 4 风柜斗草提取物对MCD模型小鼠肝中ICAM-1、VCAM-1、MMP-2、TIMP-2 mRNA表达水平的影响 Table 4 Effect of Sarcopyramis napalensis Wall extract on the mRNA expression levels of ICAM-1, VCAM-1, MMP-2, TIMP-2 in the liver of MCD diet-fed mice |
2.5.1 差异脂质分子分析 差异脂质分子的聚类分析,首先对数据进行了log2转换,采用层次聚类方法(hierarchical cluster)对差异脂质分子进行聚类分析。距离计算使用欧氏距离(Euclidean distance),数据标准化方法选择Z-score(zero-mean normalization)。结果如图 4,图中的每一列代表一个差异离子,每一行代表一个样本,不同颜色表示不同的强度。从绿色到红色,表示强度从低到高(图 4A-B)。
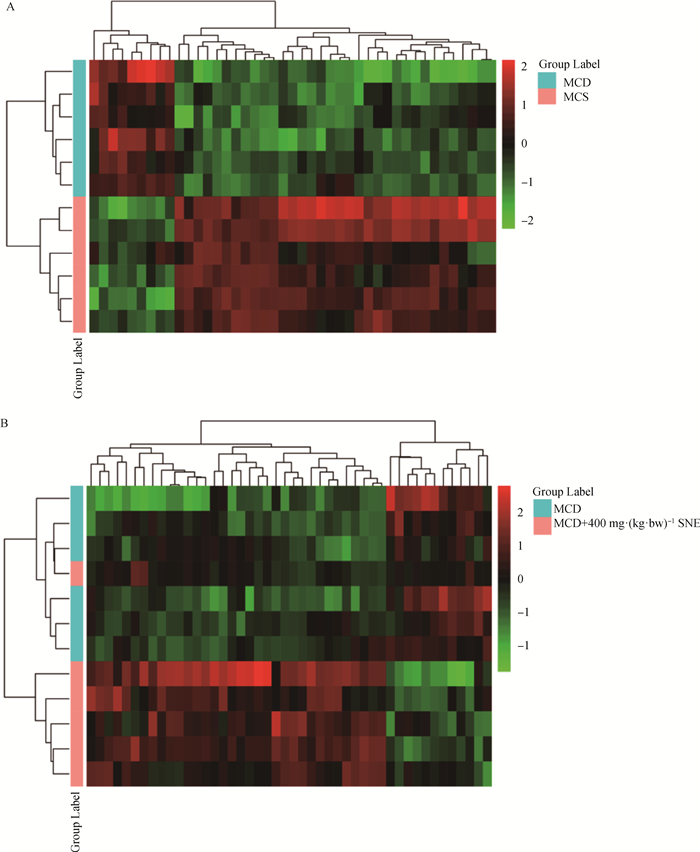
|
图 4 MCD_MCS (A)和MCD_MCD+400 mg·(kg·bw)-1 SNE (B)差异脂质分子的聚类分析热图 Fig. 4 Heat map of cluster analysis of MCD_MCS(A) and MCD_MCD+400 mg·(kg·bw)-1 SNE(B) differential lipid molecules |
2.5.2 脂质亚类的定量分析 检测到的不同脂质亚类在各组样本中的相对含量结果如图 5所示,与MCS组相比,MCD组小鼠肝中甘油三酯(triglyceride, TG)、磷脂酰胆碱(phosphatidyl cholinelecithin, PC)、神经酰胺(ceramide, Cer)、磷脂酰甘油(phosphatidyl glycerol, PG)的相对含量显著升高(P < 0.05),同时鞘磷脂(sphingomyelin, SM)、辅酶Co(Q9)、磷脂酰乙醇胺(phosphatidyl ethanolamine, PE)、二甲基磷脂酰乙醇胺(phosphatidyldimethyl ethanolamine, dMEPE)、单半乳糖二酰甘油脂(monogalactosyl diglyceride, MGDG)、溶血磷脂酰胆碱(lysophosphatidylcholine, LPC)、磷脂酰丝氨酸(phosphatidylserine, PS)的相对含量显著下降(P < 0.05),MCS+400 mg·(kg·bw)-1 SNE组与MCS组中各物质的相对含量没有显著差异(P>0.05);对比MCD组,MCD+400 mg·(kg·bw)-1 SNE组肝中TG、PC、Cer、PG的相对含量显著降低(P < 0.05),鞘磷脂SM、辅酶Q9、PE、dMEPE、MGDG、LPC、PS的相对含量显著上升(P<0.05)。
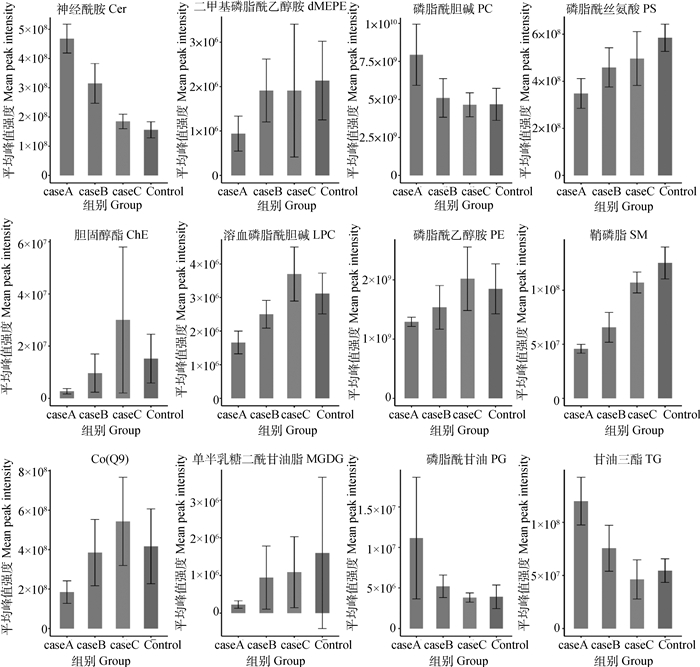
|
caseA. MCD; caseB. MCD+400 mg·(kg·bw)-1 SNE; caseC. MCD+400 mg·(kg·bw)-1 SNE; Control. MCS 图 5 不同脂质亚类在各组样本中的相对含量 Fig. 5 The relative content of different lipid subtypes in samples of each group |
郑晓艳和陈育青[6]以高脂饲料饲喂SD大鼠建立脂肪肝动物模型,应用乙醇萃取的风柜斗草粗黄酮干预后改善了肝脂肪沉积以及血清ALT水平,证明风柜斗草黄酮具有抑制脂肪肝形成以及脂质过氧化的作用,但并未进一步探究其改善肝脂肪变性的机制。本研究则证明了风柜斗草水煮醇沉提取物具有改善MCD饮食诱导的小鼠肝脂质沉积、炎症和纤维化的作用,同时进一步研究了其作用机制。本研究使用的风柜斗草水煮醇沉提取物中,总多糖占比22.03%,总黄酮占比2.11%,总皂苷占比2.87%,其改善肝脂沉积症的有效成分仍有待进一步研究。
AMPK信号通路对维持有机体糖脂代谢稳态具有特别重要的作用,激活AMPK可以有效改善包括脂肪性肝病在内的一些代谢性疾病[7-9]。有研究报道,在肝组织中特异表达激活AMPK可以显著改善高脂饮食诱导的小鼠肥胖和非酒精性脂肪肝[10]。同时也有研究表明,激活肝AMPK可抑制脂肪酸合成[11],且其中一种机制是通过抑制SREBP-1c[12-13]。SREBPs是控制胆固醇、脂肪酸、甘油三酯和磷脂生物合成所需基因表达的转录因子家族,SREBP-1c优先控制参与TG合成和积累的基因的表达[14-15]。AMPK/SREBP通路已被证明是许多天然产物改善脂肪肝病的作用靶点[16-17]。虽然本研究结果中MCD饮食下调了而不是上调肝组织FAS的基因表达水平,推测可能是代偿性上调的原因,但发现风柜斗草提取物激活MCD饮食饲喂小鼠肝AMPK,抑制SREBP-1c基因表达,证明了风柜斗草提取物仍然可通过调控AMPK/SREBP-1c通路改善肝脂肪蓄积。
本研究发现,风柜斗草提取物主要改善MCD饮食诱导小鼠肝TG和PG合成。肝是通过甘油磷酸途径利用甘油以及脂肪酸合成甘油三酯的。肝中L-FABP与FATP水平升高会增加肝脏对脂肪酸的摄取[18-19],从而促进TG和PG合成。L-FABP在肝细胞大量表达,可结合多种配体,如饱和脂肪酸和胆固醇[20]。敲除L-FABP导致肝细胞脂肪酸摄取减少,抑制脂肪酸β氧化,改善高脂饮食诱导肝脂肪变性[21-22]。FATP在脂肪酸的跨膜转运中发挥重要作用,FATP-2、FATP-4与FATP-5与肝摄取脂肪酸能力密切相关[23-24]。在高脂饮食诱导的脂肪肝大鼠中发现随着非酒精性肝病程度的加重,FATP-4表达明显增高[25]。本研究发现,风柜斗草提取物显著抑制MCD饮食饲喂小鼠肝L-FABP和FATP-4的基因表达,说明风柜斗草提取物也可通过抑制FATP-4与L-FABP表达来减少肝对脂肪酸的摄取,从而减少肝中TG、PG水平,进而改善肝脂肪蓄积。
MMPs、TIMPs是调节细胞外基质合成和降解的两种重要因子,它们已被证明,在肝纤维化形成中发挥的重要作用[26-27]。有学者研究发现MMP-2和TIMP-2表达水平在MCD饮食、高脂饮食以及四氯化碳诱导肝纤维化过程中都显著升高,MMP-2/TIMP-2平衡也被打破[28-30]。本研究证明风柜斗草提取物能显著抑制MCD饮食诱导的MMP-2和TIMP-2表达,并改善MMP2/TIMP2的动态平衡,进而改善MCD饮食诱导的小鼠肝的纤维化。为探讨脂质亚类在肝炎症和纤维化中的作用,本研究进一步利用脂质组学分析了MCD饮食诱导的肝脂沉积症小鼠肝组织多种脂质分子的变化情况以及风柜斗草提取物的干预影响,研究结果表明,风柜斗草提取物显著提高肝脂沉积症小鼠肝组织中SM和辅酶Q9相对含量以及降低Cer相对含量。近年来有许多研究表明,SM以及其代谢产物Cer参与了包括非酒精性肝病在内的一些肝疾病的发生发展[31-33]。SM和Cer参与了应激及死亡配体诱导的肝细胞凋亡[34];Cer也被证明参与了诱导肝细胞氧化应激损伤[35-36],以及抑制胰岛素信号传导、促进细胞凋亡、损害线粒体功能和调节炎症反应[37];辅酶Q代谢在非酒精性脂肪肝小鼠中发生紊乱[38-39],有研究发现,高果糖和中链反式脂肪酸诱导的脂肪肝炎小鼠的血清辅酶Q9水平也同时升高[40]。本研究有关GSH-Px和MDA等抗氧化检测结果证明了风柜斗草提取物显著提高了MCD饮食诱导的小鼠肝组织抗氧化水平,改善了肝氧化应激状态,因此本研究有关SM、Cer和辅酶Q9的研究结果提示,风柜斗草提取物可通过提高MCD饮食诱导的小鼠肝组织中SM和辅酶Q9相对含量以及降低Cer相对含量来改善肝细胞氧化损伤情况,进而改善炎症反应和纤维化,但其具体作用机制未得到深入探讨,同时SM和Cer的具体种类改变情况也没有阐明,有待进一步研究。
4 结论风柜斗草提取物可显著改善MCD饲料饲喂的小鼠肝脂质沉积、炎症以及纤维化。其改善肝脂沉积症的作用机制可能为通过激活肝脂沉积症小鼠肝组织AMPK来抑制SERBP-1C调控的TG合成,以及通过抑制FATP与L-FABP表达减少肝对脂肪酸的摄取,从而减少肝中TG、PG以及其合成所需的相关物质在肝中的含量,进而改善肝脂肪变性。更进一步地,风柜斗草提取物通过提高肝脂沉积症小鼠肝组织中SM和辅酶Q9相对含量以及降低Cer相对含量,改善肝细胞氧化应激损伤情况而改善肝炎症反应和纤维化。
| [1] |
WEBB C B. Hepatic lipidosis: clinical review drawn from collective effort[J]. J Feline Med Surg, 2018, 20(3): 217-227. DOI:10.1177/1098612X18758591 |
| [2] |
CENTER S A. Feline hepatic lipidosis[J]. Vet Clin North Am Small Anim Pract, 2005, 35(1): 225-269. DOI:10.1016/j.cvsm.2004.10.002 |
| [3] |
VALTOLINA C, FAVIER R P. Feline hepatic lipidosis[J]. Vet Clin North Am Small Anim Pract, 2017, 47(3): 683-702. DOI:10.1016/j.cvsm.2016.11.014 |
| [4] |
林晓兰, 郑涛, 何雪娇, 等. 习用风柜斗草研究进展[J]. 福建热作科技, 2020, 45(4): 63-66. LIN X L, ZHENG T, HE X J, et al. Study progress of sarcopyramis nepalensis wall, snepalensis wall[J]. Fujian Science & Technology of Tropical Crops, 2020, 45(4): 63-66. DOI:10.3969/j.issn.1006-2327.2020.04.021 (in Chinese) |
| [5] |
GUO J R, ZHANG J W, YAO G M, et al. Hepatoprotective activity of the ethanol extract of Sarcopyramis nepalensis[J]. J Huazhong Univ Sci Technol Med Sci, 2012, 32(6): 844-848. DOI:10.1007/s11596-012-1045-z |
| [6] |
郑晓艳, 陈育青. 风柜斗草黄酮治疗大鼠非酒精性脂肪肝的研究[J]. 江西中医药大学学报, 2016, 28(2): 84-87. ZHENG X Y, CHEN Y Q. Study of flavonoids from sarcopyramis nepalensis wall for treating non-alcoholic fatty liver disease[J]. Journal of Jiangxi University of Traditional Chinese Medicine, 2016, 28(2): 84-87. (in Chinese) |
| [7] |
朱文俊, 陈兴勇, 刘乐, 等. 番鸭产蛋各期肝脂肪酸组成及AMPK信号通路基因表达研究[J]. 畜牧兽医学报, 2021, 52(9): 2429-2438. ZHU W J, CHEN X Y, LIU L, et al. Fatty acid composition and gene expression of AMPK signaling pathway in liver of muscovy duck at different egg-laying stages[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(9): 2429-2438. (in Chinese) |
| [8] |
BOUDABA N, MARION A, HUET C, et al. AMPK re-activation suppresses hepatic steatosis but its downregulation does not promote fatty liver development[J]. EBioMedicine, 2018, 28: 194-209. DOI:10.1016/j.ebiom.2018.01.008 |
| [9] |
HUANG H, LEE S H, SOUSA-LIMA I, et al. Rho-kinase/AMPK axis regulates hepatic lipogenesis during overnutrition[J]. J Clin Invest, 2018, 128(12): 5335-5350. DOI:10.1172/JCI63562 |
| [10] |
GARCIA D, HELLBERG K, CHAIX A, et al. Genetic liver-specific AMPK activation protects against diet-induced obesity and NAFLD[J]. Cell Rep, 2019, 26(1): 192-208. DOI:10.1016/j.celrep.2018.12.036 |
| [11] |
LI C Z, DONG X, DU W J, et al. LKB1-AMPK axis negatively regulates ferroptosis by inhibiting fatty acid synthesis[J]. Signal Transduct Target Ther, 2020, 5(1): 187. DOI:10.1038/s41392-020-00297-2 |
| [12] |
KOHJIMA M, HIGUCHI N, KATO M, et al. SREBP-1c, regulated by the insulin and AMPK signaling pathways, plays a role in nonalcoholic fatty liver disease[J]. Int J Mol Med, 2008, 21(4): 507-511. |
| [13] |
段素素, 雷娜, 吴海妹, 等. 脂质代谢调控机制及相应药物研究进展[J]. 山东医药, 2021, 61(20): 93-96. DUAN S S, LEI N, WU H M, et al. Research progress on regulation mechanism of lipid metabolism and related drugs[J]. Shandong Medical Journal, 2021, 61(20): 93-96. DOI:10.3969/j.issn.1002-266X.2021.20.024 (in Chinese) |
| [14] |
FANG D L, WAN Y, SHEN W, et al. Endoplasmic reticulum stress leads to lipid accumulation through upregulation of SREBP-1c in normal hepatic and hepatoma cells[J]. Mol Cell Biochem, 2013, 381(1-2): 127-137. DOI:10.1007/s11010-013-1694-7 |
| [15] |
MOSLEHI A, HAMIDI-ZAD Z. Role of SREBPs in liver diseases: a mini-review[J]. J Clin Transl Hepatol, 2018, 6(3): 332-338. |
| [16] |
CHEN Q, WANG T T, LI J, et al. Effects of natural products on fructose-induced nonalcoholic fatty liver disease (NAFLD)[J]. Nutrients, 2017, 9(2): 96. DOI:10.3390/nu9020096 |
| [17] |
IPSEN D H, LYKKESFELDT J, TVEDEN-NYBORG P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease[J]. Cell Mol Life Sci, 2018, 75(18): 3313-3327. DOI:10.1007/s00018-018-2860-6 |
| [18] |
魏苏宁, 苏雪莹, 徐国恒. 肝细胞甘油三酯代谢途径异常与脂肪肝[J]. 中国生物化学与分子生物学报, 2016, 32(2): 123-132. WEI S N, SU X Y, XU G H. Anomaly of triglyceride metabolism in liver lead to NAFLD[J]. Chinese Journal of Biochemistry and Molecular Biology, 2016, 32(2): 123-132. (in Chinese) |
| [19] |
RUI L Y. Energy metabolism in the liver[J]. Compr Physiol, 2014, 4: 177-197. |
| [20] |
张震, 富文俊, 邢宇锋, 等. L-FABP/PPARα信号通路与非酒精性脂肪性肝炎关系的研究进展[J]. 山东医药, 2016, 56(8): 98-100. ZHANG Z, FU W J, XING Y F, et al. Research progress in the relationship between L-FABP/PPARα signaling pathway and nonalcoholic steatohepatitis[J]. Shandong Medical Journal, 2016, 56(8): 98-100. DOI:10.3969/j.issn.1002-266X.2016.08.041 (in Chinese) |
| [21] |
NEWBERRY E P, XIE Y, KENNEDY S, et al. Decreased hepatic triglyceride accumulation and altered fatty acid uptake in mice with deletion of the liver fatty acid-binding protein gene[J]. J Biol Chem, 2003, 278(51): 51664-51672. DOI:10.1074/jbc.M309377200 |
| [22] |
NEWBERRY E P, XIE Y, KENNEDY S M, et al. Protection against Western diet-induced obesity and hepatic steatosis in liver fatty acid-binding protein knockout mice[J]. Hepatology, 2006, 44(5): 1191-1205. DOI:10.1002/hep.21369 |
| [23] |
PEREZ V M, GABELL J, BEHRENS M, et al. Deletion of fatty acid transport protein 2 (FATP2) in the mouse liver changes the metabolic landscape by increasing the expression of PPARα-regulated genes[J]. J Biol Chem, 2020, 295(17): 5737-5750. DOI:10.1074/jbc.RA120.012730 |
| [24] |
KAZANTZIS M, STAHL A. Fatty acid transport proteins, implications in physiology and disease[J]. Biochim Biophys Acta, 2012, 1821(5): 852-857. DOI:10.1016/j.bbalip.2011.09.010 |
| [25] |
冯爱娟, 陈东风, 樊丽琳, 等. FATP4在大鼠非酒精性脂肪肝中的表达及相关性[J]. 重庆医学, 2007, 36(8): 707-708, 711. FENG A J, CHEN D F, FAN L L, et al. Effect of fatty acid transport protein 4 on rat non-alcoholic fatty liver[J]. Chongqing Medicine, 2007, 36(8): 707-708, 711. DOI:10.3969/j.issn.1671-8348.2007.08.011 (in Chinese) |
| [26] |
MASUZAKI R, KANDA T, SASAKI R, et al. Noninvasive assessment of liver fibrosis: current and future clinical and molecular perspectives[J]. Int J Mol Sci, 2020, 21(14): 4906. DOI:10.3390/ijms21144906 |
| [27] |
REN J J, HUANG T J, ZHANG Q Q, et al. Insulin-like growth factor binding protein related protein 1 knockdown attenuates hepatic fibrosis via the regulation of MMPs/TIMPs in mice[J]. Hepatobiliary Pancreat Dis Int, 2019, 18(1): 38-47. DOI:10.1016/j.hbpd.2018.08.008 |
| [28] |
ASOKAN S M, HUNG T H, LI Z Y, et al. Protein hydrolysate from potato confers hepatic-protection in hamsters against high fat diet induced apoptosis and fibrosis by suppressing Caspase-3 and MMP2/9 and by enhancing Akt-survival pathway[J]. BMC Complement Altern Med, 2019, 19(1): 283. DOI:10.1186/s12906-019-2700-8 |
| [29] |
HEMMANN S, GRAF J, RODERFELD M, et al. Expression of MMPs and TIMPs in liver fibrosis–a systematic review with special emphasis on anti-fibrotic strategies[J]. J Hepatol, 2007, 46(5): 955-975. DOI:10.1016/j.jhep.2007.02.003 |
| [30] |
WANG X J, LI L, WANG H W, et al. Epoxyeicosatrienoic acids alleviate methionine-choline-deficient diet-induced non-alcoholic steatohepatitis in mice[J]. Scand J Immunol, 2019, 90(3): e12791. |
| [31] |
张敏, 沈彤. 神经酰胺与肥胖相关疾病防治的研究进展[J]. 安徽医科大学学报, 2020, 55(1): 146-149. ZHANG M, SHEN T. Research progress of ceramides in the prevention and treatment of obesity-related diseases[J]. Acta Universitatis Medicinalis Anhui, 2020, 55(1): 146-149. (in Chinese) |
| [32] |
韩海静, 齐雪, 牛春燕. 神经酰胺在非酒精性脂肪性肝病发生发展中的作用[J]. 临床肝胆病杂志, 2017, 33(8): 1584-1588. HAN H J, QI X, NIU C Y. Role of ceramide in development and progression of nonalcoholic fatty liver disease[J]. Journal of Clinical Hepatology, 2017, 33(8): 1584-1588. DOI:10.3969/j.issn.1001-5256.2017.08.038 (in Chinese) |
| [33] |
孙明谦, 苗兰, 张颖, 等. 基于液质联用技术对早期高脂血症金黄地鼠肝脏鞘脂的靶向代谢组学研究[J]. 实验动物科学, 2021, 38(2): 30-34, 40. SUN M Q, MIAO L, ZHANG Y, et al. Targeted metabonomics of sphingolipids in liver tissue from early stage hyperlipidemia hamsters using liquid chromatography-tandem mass spectrometry[J]. Laboratory Animal Science, 2021, 38(2): 30-34, 40. DOI:10.3969/j.issn.1006-6179.2021.02.005 (in Chinese) |
| [34] |
LIN M L, LIAO W J, DONG M J, et al. Exosomal neutral sphingomyelinase 1 suppresses hepatocellular carcinoma via decreasing the ratio of sphingomyelin/ceramide[J]. FEBS J, 2018, 285(20): 3835-3848. DOI:10.1111/febs.14635 |
| [35] |
孟星星. 酸性鞘磷脂酶/神经酰胺通路介导噪声刺激所致小鼠肝细胞损伤[D]. 西安: 第四军医大学, 2017. MENG X X. Acid sphingomyelinase/ceramide mediates hepatocytic injury of mice induced by noise exposure[D]. Xi'an: Air Force Medical University, 2017. (in Chinese) |
| [36] |
RÉGNIER M, POLIZZI A, GUILLOU H, et al. Sphingolipid metabolism in non-alcoholic fatty liver diseases[J]. Biochimie, 2019, 159: 9-22. DOI:10.1016/j.biochi.2018.07.021 |
| [37] |
PREUSS C, JELENIK T, BODIS K, et al. A new targeted lipidomics approach reveals lipid droplets in liver, muscle and heart as a repository for diacylglycerol and ceramide species in non-alcoholic fatty liver[J]. Cells, 2019, 8(3): 277. DOI:10.3390/cells8030277 |
| [38] |
CHEN K, CHEN X, XUE H L, et al. Coenzyme Q10 attenuates high-fat diet-induced non-alcoholic fatty liver disease through activation of the AMPK pathway[J]. Food Funct, 2019, 10(2): 814-823. DOI:10.1039/C8FO01236A |
| [39] |
DURAND M, COUÉ M, CROYAL M, et al. Changes in key mitochondrial lipids accompany mitochondrial dysfunction and oxidative stress in NAFLD[J]. Oxid Med Cell Longev, 2021, 2021: 9986299. |
| [40] |
KOHLI R, KIRBY M, XANTHAKOS S A, et al. High-fructose, medium chain trans fat diet induces liver fibrosis and elevates plasma coenzyme Q9 in a novel murine model of obesity and nonalcoholic steatohepatitis[J]. Hepatology, 2010, 52(3): 934-944. DOI:10.1002/hep.23797 |
(编辑 郭云雁)



