2. 福建师范大学南方生物医学研究中心,福州 350015
2. Southern Biomedical Research Center, Fujian Normal University, Fuzhou 350015, China
猪伪狂犬病病毒(pseudorabies virus, PRV)是疱疹病毒科(Herpesviridae) 疱疹病毒属的一个重要成员[1],宿主范围较广,可感染不同年龄的猪、牛、绵羊、犬、猫、水貂、雪貂、小鼠、大鼠、豚鼠等。猪伪狂犬病在我国生猪养殖中发病率较高。此外,不同日龄段猪感染后所表现的临床症状不一样,幼龄猪感染后死亡率接近70%,成年母猪主要表现为流产、死胎或产木乃伊胎儿等,公猪则主要表现为精子的活力低,或精子数量少等。该病无季节性,各个季节均会发生。目前,虽然我国成熟商品化疫苗多,但因病毒变异快,因此疫苗的预防效果总体不甚理想,生猪的野毒阳性率仍然较高,损失较为严重[2-4]。
PRV病毒粒子呈正二十面体,直径为150~180 nm[5]。它的基因组较大,约为143 kb,编码约80个蛋白。PRV毒性蛋白主要是糖蛋白gE、gD、gI以及胸苷激酶(TK)的基因协同控制,其中TK基因对PRV的增殖、复制、潜伏感染及激活有重要的作用,因此TK基因是PRV的主要毒性基因,常作为治疗及开发疫苗的首选靶基因。而gE基因和gI结合在一起,促进病毒入侵宿主细胞,因此,控制入侵的源头也非常关键。由L48基因编码的被膜蛋白VP16,通过与宿主的细胞因子Oct-1和HCF-1结合从而激活立即早期基因IE180的转录和表达,进而调控一系列下游基因的表达和病毒的增殖,它在病毒复制及装配中执行着非常重要的生物学功能[6-7]。因而,VP16也是基因靶向治疗的关键所在。
CRISPR/Cas9系统是一个高效的基因编辑系统,能精确靶向编辑目的基因,已被广泛应用于生命科学领域的研究[8]。它不仅对动物细胞、细菌和病毒能进行实时靶向编辑,而且能够用于动物和部分人的胚胎基因编辑[9-10]。此外,CRISPR/Cas9系统对于遗传性疾病的治疗也有很好的应用前景,之前的研究证实该系统可用来治疗亨廷顿氏病(huntingtin基因突变引起的疾病)的小鼠,矫正了严重联合免疫缺陷病(severe combined immunodeficiency disease, SCID)的致病突变等[11-12]。
腺联病毒(adeno-associated virus,AAV)是单链复制缺陷型DNA病毒,它的宿主范围广,能感染分化成熟的细胞和分化未成熟的细胞,也能转导不同分裂期的细胞,被广泛应用于疾病的基因治疗和转基因研究等[13]。目前,AAV转导系统对于多种疾病的临床试验正在进行中,它很有可能成为世界上第一个上市的基因治疗药物载体。目前的研究表明,AAV的安全性高,通过加工后可口服,因此它是较为合适的基因治疗载体[14-16]。
本研究利用重组腺联病毒载体携带CRISPR/Cas9系统,靶向体内感染的PRV关键毒力基因TK和gE,以及复制关键点的VP16基因,从而在源头削弱PRV的毒力,并通过破坏它的复制相关基因,从而达到抑制或减弱它复制能力,进而达到治疗的效果。
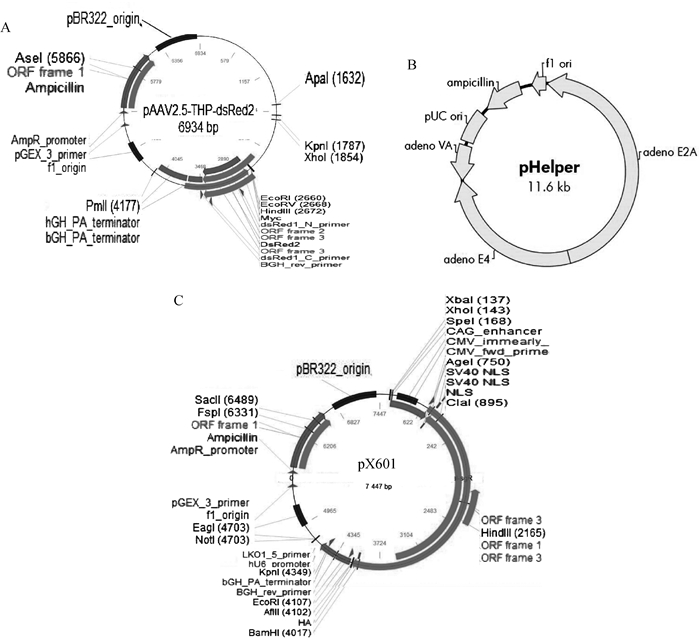
1 材料与方法 1.1 材料1.1.1 菌株、载体和细胞 大肠杆菌DH5α感受态细胞来源于TaKaRa公司。pX601质粒为Addgene产品; AAV2/5质粒为Biovector公司产品;pHelper质粒为广州华韵生物科技有限公司产品,相关图谱见图 1。pXTK、pXgE、pXVP16质粒为本实验室制备。293A细胞来源于上海纪宁生物科技有限公司,ST细胞为本实验室保存,两种细胞都是贴壁细胞,使用含10%血清的DMEM培养基;PRV(Fa,闽A株)株来自福建农林大学。
|
A. AAV2/5质粒;B. pHelper质粒;C. pX601质粒 A. AAV2/5 plasmid; B. pHelper plasmid; C. pX601 plasmid 图 1 腺联病毒携带CRISPR/Cas9系统载体 Fig. 1 The plasmids of AAV and CRISPR/Cas9 |
1.1.2 实验动物 140只20 g左右的BALB/c小鼠,购自吴氏动物中心。所有的动物试验严格按照福建师范大学南方生物医学研究中心的动物伦理相关规定执行(动物实验伦理批准号:FJSU3568423)。
1.2 方法 1.2.1 CRISPR/Cas9-sgRNA敲除质粒的构建1.2.1.1 sgRNA的设计与合成 从NCBI下载PRV的目标基因TK、gE和VP16序列,输入sgRNA网站http://crispr.mit.edu/进行sgRNA的目标序列的设计,挑选合适的sgRNA由福州铂尚生物公司合成(表 1)。
|
|
表 1 sgRNA引物 Table 1 The primers of sgRNA |
sgRNA合成后,加入PBS进行混匀,置于梯度PCR仪中进行退火,退火体系:Primer R 1 μL,Primer F 1 μL,10× PCR Buffer 2 μL,无菌水16 μL。退火反应条件:95 ℃,10 min,然后按2 ℃·s-1的速度让退火温度下降至85 ℃,接着又以0.25 ℃·s-1的速度降至25 ℃,最后以25 ℃维持1 min完成退火。将退火完成的sgRNA置于-20 ℃冰箱备用。
1.2.1.2 pX601质粒转化 1 μL的pX601质粒(Amp抗性)加入100 μL DH5α感受态细胞,42 ℃恒温热刺激90 s,冰浴2~3 min;再加入800 μL LB液体培养基,置37 ℃ 250 r·min-1培养1 h;取出菌,按4 000 r·min-1离心5 min,弃801 μL上清,留100 μL进行重悬,均匀涂布在Amp平板上,37 ℃恒温培养箱中12 h;隔日挑选单一的菌落,进行扩增,然后再PCR检测,测序验证。
1.2.1.3 pX601质粒的提取、酶切、纯化及连接 按照康为世纪生物科技有限公司无内毒素质粒小提试剂盒说明书进行操作。用BbsⅠ限制性核酸内切酶切pX601质粒。酶切的反应条件:37 ℃ 10 min,65 ℃ 10 min。反应中各组分:Plasmid pX601 5 μg,10×Fast Digest buffer 5 μL,BbsⅠ 5 μL,去离子水40 μL。
用TaKaRa DNA frangment purification kit提取并纯化酶切后的pX601质粒。接着用T4连接酶连接纯化、酶切的pX601质粒和退火后的sgRNA,反应体系为25 μL,反应液中各组分:T4 DNA Ligase 1 μL,10×T4 DNA buffer 2.5 μL,Vector 50 ng,sgRNA 150 ng,去离子水21.5 μL。连接时将混合液轻轻混匀,置于PCR仪中16 ℃,3 h最后65 ℃ 10 min。
1.2.1.4 重组质粒的转化及验证 将重组质料转化至DH5α大肠杆菌中增殖,然后挑选单克隆进行增殖,然后应用PCR及测序验证(引物见表 2)。
|
|
表 2 选定基因的验证引物 Table 2 The PCR validation primers for selective genes |
1.2.2.1 重组腺联病毒载体的验证引物 根据pX601质粒序列设计引物RT-pX601,用于鉴定腺联病毒的组装,具体序列见表 2验证引物。
1.2.2.2 质粒转染293A细胞和病毒的收集 将5×106·mL-1的293A细胞均匀平铺于15 cm的细胞培养皿中,待细胞贴壁且汇合度达70%~90%时,弃除旧培养液,加入无血清DMEM培养基;取3个EP管,分别加入135 μL的1 g·mL-1的PEI试剂和15 μg AAV2/5质粒、10 μg pHelper质粒,再分别加入20 μg pXTK、pXgE和pXVP16质粒,PEI和质粒量的总量比为3∶1,混匀后室温静置15 min;将含有3种混合质粒的PEI混合液加入到细胞培养基中,并轻摇混匀;做好标记,放入37 ℃、5%CO2的细胞培养箱内培养12 h;12 h后更换含10%胎牛血清的DMEM培养基,放入37 ℃、5% CO2的细胞培养箱内培养;24 h后收集细胞上清(含重组腺联病毒),做好标记存贮于4 ℃冰箱备用,并在细胞培养皿中加入新鲜的含10%胎牛血清的DMEM培养基;24 h后,将培养皿中的细胞连同培养基收集到45 mL离心管中,反复冻融,剧烈震荡后3 000 r·min-1离心5 mim,取上清。
1.2.2.3 重组腺联病毒的滴度测定 取10 μL浓缩后的AAV病毒液提取全基因组;以AAV病毒基因组和pX601质粒作为模板,Q-Cas9为引物,进行Real-time PCR;然后计算病毒拷贝数:首先计算出作为模板的0.15 ng pX601质粒的摩尔数,计算公式“摩尔数=总质量/分子量”[pX601是碱基数为7 447 bp的dsDNA平均分子量(MW)=(碱基数)×(660道尔顿/碱基)=7 447×660道尔顿,即7 447×660 g·mol-1,pX601摩尔数=0.15×10-9/(7 447×660)mol;0.15 ng pX601质粒的拷贝数=6.02×1023×0.15×10-9/(7 447×660)=1.84× 107拷贝数];然后根据real-time PCR结果,计算出3种重组腺联病毒载体和pX601质粒表达Cas9的倍数比,将倍数乘以0.15 ng pX601质粒的拷贝数,得出AAV基因组的拷贝数;再根据模板AAV基因组占10 μL AAV的基因组的比值,计算出10 μL AAV的拷贝数。
1.2.2.4 重组腺联病毒载体及功能验证 重组腺联病毒感染5×105·mL-1的ST细胞,24 h后收集细胞,按照TRIzol中的操作方法提取细胞总RNA,再应用PrimeScript RT reagent Kit with gDNA Eraser进行反转录,接着应用RT-PCR检测重组腺联病毒中的Cas9、TK基因、gE和VP16的mRNA水平。
1.2.2.5 携带Cas9-TK-gE-VP16的编辑质粒转染ST细胞 5×105·mL-1 ST细胞均匀分布于6孔板中,细胞贴壁并长至汇合度80%时,弃去培养基,更换新鲜的无血清DMEM培养基;取1EP管,按PEI和质粒3∶1的质量比,分别加入2.5 μg质粒和1 g·mL-1的PEI 7.5 μL;将含有敲除质粒的PEI混合液加入到细胞培养基中,并轻轻摇晃混匀;做好标记,置37 ℃、5% CO2的细胞培养箱内培养12 h。
1.3 重组腺联病毒系统在细胞水平对感染PRV的治疗效果评估1.3.1 重组腺联病毒载体感染ST细胞 ST细胞以5×105·mL-1的浓度均匀铺于6孔板中,等细胞贴壁并长至汇合度达80%时,弃去旧培养基,更换新鲜的无血清DMEM培养基;将携带3个不同片段的3种AAV(AAV-TK、AAV-gE、AAV-VP16)的稀释,取部分AAV稀释到109拷贝·mL-1;每种AAV浓度设置4个时间梯度,分别为感染ST细胞8、16、24、32 h(从加入PRV后开始计时),每种AAV设置1个对照(只加AAV),取108拷贝分别加入6孔板中混匀,并做好标记,置37 ℃、5% CO2的细胞培养箱中培养12 h后换液加入PRV。
1.3.2 ST细胞形态变化观察和收集 每到一个时间梯度时,在显微镜下观察细胞状态并拍照,做好标记,再进行细胞样品收集和细胞总RNA的纯化。
1.3.3 ST细胞中的PRV核酸拷贝数的变化情况 按PrimeScript RT reagent Kit with gDNA Eraser说明书进行反转录。应用Real-time PCR测定ST细胞中的PRV核酸拷贝数的变化情况,在MicroAmpⓇFast 8-Tube Strip 0.1 mL快速反应8联管中配制反应混合液,反应条件为95 ℃ 20 s、95 ℃ 15 s、60 ℃ 30 s、72 ℃ 30 s、95 ℃ 15 s、60 ℃ 60 s、95 ℃ 15 s结束。其中, 95 ℃反应20 s为第一阶段(称为Hold Stage), 第二阶段为PCR Stage(即95 ℃ 15 s、60 ℃ 30 s、72 ℃ 30 s);最后一步为熔解曲线扩增阶段(即95 ℃ 15 s、60 ℃ 60 s、95 ℃ 15 s)。第二阶段进行40个循环,退火温度因不同基因而不同。每组做3个重复。根据Ct值进行数据处理。
反应体系设置为10 μL,各组分组成:前后引物各0.25 μL,模板120 ng,SYBRⓇ Premix Ex Taq II(Tli RNaseH Plus) ROX Plus 5 μL,DEPC水0.5 μL。
1.4 重组腺联病毒编辑系统对感染PRV小鼠的治疗效果评估 1.4.1 小鼠感染PRV半数致死量(LD50)的测定1.4.1.1 Karber法计算PRV滴度 取10 μL病毒液进行梯度稀释,每个梯度相差10倍体积,每个稀释梯度为8个复孔。每隔24 h观察细胞病变情况,连续观察直至没有新病变孔出现。然后统计阳性孔比例,根据公式lgTCID50=L-d(S-0.5) 计算出PRV的滴度,L为最高稀释度的对数,d为稀释度对数之间的差,S为阳性孔比例总和。lgLD50=Xk-d(∑p-0.5),Xk为最大剂量对数,∑p为各剂量组死亡率之和,d为稀释度对数之间的差。
1.4.1.2 试验分组设计 取30只BALB/c小鼠,分为6组, 分别为1×106.5 TCID50组、1×105.5 TCID50组、1×104.5TCID50组、1×103.5 TCID50组、1×102.5TCID50组及空白对照组。空白组注射DMEM,肌内注射,注射部位均为左后腿肌肉,注射体积为100 μL。每天记录小鼠的存活情况。
1.4.2 治疗试验分组 取110只20 g左右的BALB/c小鼠,随机平均分成两大组:观察组和试验组,观察组用于观察小鼠的生理状况和死亡统计,试验组用于小鼠组织的采取。具体分组:100 μL DMEM+10 μL生理盐水注射1次组,PRV注射1次组,AAV-TK注射治疗1次组,AAV-gE注射治疗1次组,AAV-VP16注射治疗1次组,AAV-TK注射治疗2次组,AAV-gE注射治疗2次组,AAV-VP16注射治疗2次组,AAV-TK注射治疗3次组,AAV-gE注射治疗3次组,AAV-VP16注射治疗3次组,每组5只小鼠,共11组。其中PRV用肌内注射法(注射小鼠后腿内侧),注射量为5×104 TCID50,只注射1次;AAV用尾静脉注射法, 每次注射109拷贝数,分注射1次、2次和3次组,多次注射组为隔天注射,表中PRV+AAV的注射次数指的是AAV的注射次数;DMEM和生理盐水分别用肌内注射、尾静脉注射。
1.4.3 小鼠生理状态观察 注射病毒后,每天记录观察组中各组小鼠的生理变化,包括小鼠的进食、精神状态、瘙痒症伤口面积、死亡数量和时间、观察是否有特殊病理行为,并进行统计分析。
1.4.4 小鼠组织采取 在小鼠的腹腔注射250 μL的5%水合氯醛,麻醉小鼠,用200 mL的注射器装满DEPC水,连接4号半的输液器针头,在注射泵上固定;麻醉后解剖小鼠,剪开小鼠胸腔露出心,剪破右心耳,将针头刺入心尖3~4 mm开始灌注,灌注约20 mL DEPC水时,灌注完成(直到小鼠耳部、趾部没有血色);取小鼠脑部及脾组织,并将其从小鼠身上剥离,将脾组织放入预备的做有相应标记EP管中,放入-80 ℃冰箱内冰冻(用于总RNA的纯化)。
1.4.5 小鼠脑部组织总RNA纯化 取小鼠脑组织5 g,放入1.5 mL EP管中,加入200 μL的TRIzol,研磨成组织浆液,再加入800 μL TRIzol,进行细胞总RNA的纯化。
1.4.6 cDNA的合成 按照PrimeScript RT reagent Kit with gDNA Eraser说明书进行反转录。
1.4.7 Real-time PCR 具体试验步骤参见cDNA的实时荧光定量PCR反应。
1.5 图像分析和数据统计试验中测序结果用Mega 5.0和Bioedit软件分析;RT-PCR结果用CorelDRAW软件处理分析。
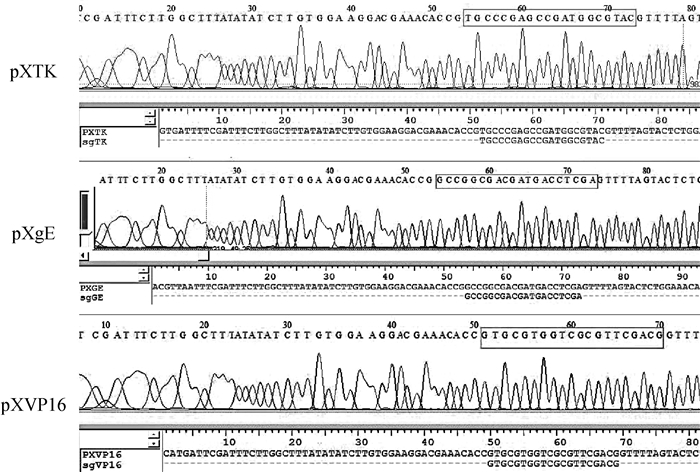
2 结果 2.1 编辑质粒的验证将sgRNA连接到pX601质粒,经测序和生物学软件Bioedit的比对证实, 目标序列的sgRNA成功构建针对PRV 3个关键基因的pX601编辑质粒(图 2)。
|
pXTK为pX601载体连接TK基因sgRNA的重组质粒; pXgE为pX601载体连接gE基因sgRNA的重组质粒; pXVP16为pPX601载体连接VP16基因sgRNA的重组质粒;线框内部分为sgRNA序列 pXTK is a recombinant plasmid of pX601 vector connecting TK gene sgRNA; pXgE is a recombinant plasmid of pX601 vector connecting gE gene sgRNA; pXVP16 is a recombinant plasmid connecting VP 16 gene sgRNA with pPX601 vector; The framed part is sgRNA sequence 图 2 3种编辑质粒的测序与序列比对 Fig. 2 Sequencing and sequence alignment of edited plasmids |
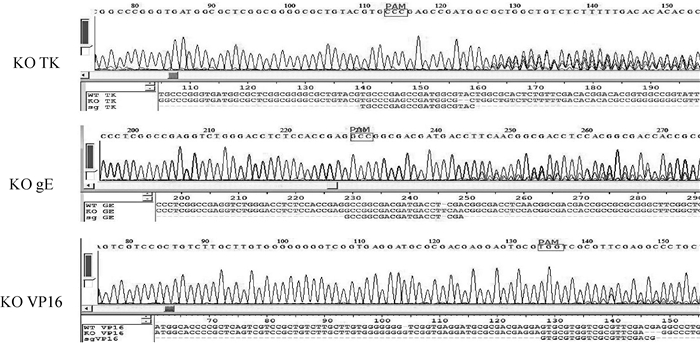
为进一步验证编辑质粒的靶基因序列,分别将pXTK、pXgE和pXVP16 3种编辑质粒转染ST细胞12 h,后加入1×105 TCID50的PRV,24 h后收集含PRV的细胞和上清,反复冻融3次,提PRV基因组DNA,进行PCR扩增并测序验证。测序结果证实,PRV的病毒基因在靶基因位置出现了套叠峰,证实编辑质粒在PRV的TK、gE和VP16位置发生了剪切编辑(详细的编辑效率之前文章已经验证)[17],具备剪切PRV的功能(图 3)。
|
图 3 3种剪切质粒对PRV剪切的测序验证 Fig. 3 Sequencing analysis of PRV gene editing by knockout plasmids |
2.3.1 pT-IE180载体的构建 pT-IE180载体是本研究构建的含PRV IE180基因部分片段的TA克隆载体。用ExTaq酶扩增出PRV IE180基因目的片段,连接到pMD19-T上,目的片段大小为101 bp,测序结果如图 4,可以看出质粒载体上有约100 bp的序列与PRV IE180基因片段相同,图中两个不同的碱基是所用的PRV基因组参照系列的点突变。

|
图 4 PRV IE180基因组和T-IE180序列比对 Fig. 4 Comparison of the PRV IE180 gene sequence with T-IE180 sequence |
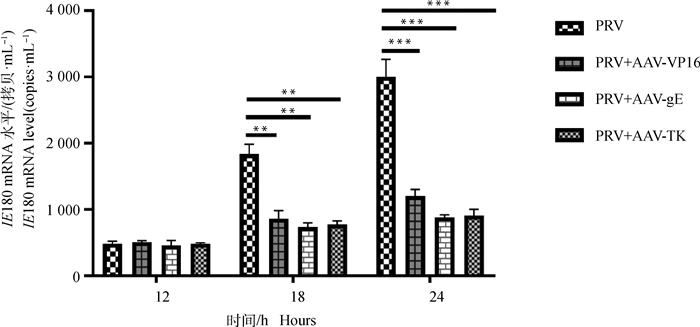
2.3.2 重组腺联病毒编辑系统对ST细胞中PRV拷贝数影响 ST细胞以5×105·mL-1的细胞浓度均匀铺于6孔板中,在铺板的同时分别加入1×108拷贝数的AAV-gE、AAV-TK和AAV-VP16,12 h后给细胞换液,并加入105 TCID50的PRV处理细胞,在12、18、24 h 3个时间段收集细胞,并提取细胞RNA反转录成cDNA作为模板,用IE180和猪源管家基因GAPDH基因引物进行Real-time PCR,检测不同时段细胞中病毒量的变化情况。如图 5所示,在12 h不同AAV处理过的细胞中PRV量相比于没有处理过的细胞并没明显的减少,而18 h时,AAV-gE和AAV-VP16处理组,PRV的IE180的拷贝数明显下降(P≤0.01),但AAV-TK、AAV-gE和AAV-VP16 3组间的变化却不明显。24 h时,AAV-TK、AAV-gE和AAV-VP16处理组的PRV IE180的拷贝数出现更为显著的下降(P≤0.001)。
|
**. P≤0.05; ***. P≤0.001 图 5 Real-time PCR检测3种AAV处理ST细胞后PRV的病毒量变化 Fig. 5 Real-time PCR testing the change of PRV virus amount after ST cells deal with three pX601 recombinant vectors carried by AAV |
2.3.3 重组腺联病毒编辑系统降低了PRV对ST细胞致病性 ST细胞以5×105·mL-1的细胞浓度均匀铺于6孔板中,在铺板的同时分别加入1×108拷贝数的AAV-gE、AAV-TK和AAV-VP16,12 h后给细胞换液,并加入105 TCID50的PRV处理细胞,每到一个时间梯度时,在显微镜下观察细胞状态并拍照,做好标记,记录细胞的形态变化,结果发现,与没有处理过的细胞相比,12 h时不同AAV相关治疗系统处理过的细胞的拉网、聚集及死亡现象明显较少,细胞的病变整体较为轻微。
如图 6所示,在24 h时可以观察到大部分对照细胞已经开始病变(变圆),且可以观察到漂在培养液中的死细胞,在40 h时,细胞培养液变浑浊,细胞全部死亡,AAV-gE、AAV-TK和AAV-VP16接种组相对较好。

|
图 6 重组腺联病毒编辑系统降低了PRV对ST细胞致病性 Fig. 6 Recombinant AAVs with CRISPR vector have down-regulated CPE of ST cells after the PRV infection |
2.4.1 小鼠感染PRV半数致死量的测定 观察并记录小鼠每天的存活情况,并进行了统计分析,如图 7,从图中可以看出PRV对小鼠的半数致死量为103.5 TCID50。
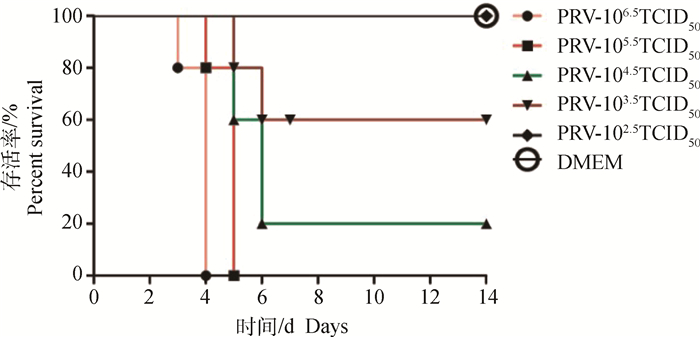
|
图 7 PRV对小鼠的半数致死量分析 Fig. 7 Testing LD50 of PRV infected mice |
2.4.2 重组腺联病毒编辑系统对感染PRV后小鼠“伪狂犬瘙痒症”影响 猪的PRV宿主范围较广,可感染不同年龄的猪、牛、绵羊、犬、猫、水貂、雪貂、小鼠、大鼠和豚鼠等。在不同种属间表现的临床症状往往不一样,哺乳小猪或断奶小猪感染该病毒后常表现为腹泻或部分有神经症状。但小鼠感染该病毒则表现为明显的瘙痒症,尤其通过肌内注射进行感染试验时,小鼠的瘙痒症明显。为了评估AAV携带的CRISPR系统对PRV的治疗效果,本研究中记录AAV携带的CRISPR系统对PRV的治疗中各组小鼠的瘙痒症状,结果发现攻毒后注射1次的AAV-gE治疗组小鼠有2只出现轻微的瘙痒症状(挠后腿)(表 3,图 8b),而注射2次的则出现1只,注射3次的小鼠并没有出现明显的搔痒症(表 3)。另外一组,AAV-VP16组,注射1、2、3次则分别出现3、2和1只(表 3,图 8d)。而AAV-TK治疗组,出现搔痒症小鼠较少,只在注射治疗1次组出现1只搔痒症小鼠(表 3),其他的小鼠则没有明显的搔痒症表现。而对照组(未进行治疗)的小鼠全部出现搔痒症(图 8a)。
|
|
表 3 重组腺联病毒治疗对小鼠“伪狂犬瘙痒症”发生的影响 Table 3 Influence of recombinant AAVs treatment on incidence of "Pseudo-rabies pruritus" in mice |

|
a.未注射AAV; b.注射AAV 1次;c.注射AAV 2次;d.注射AAV 3次 a. Non-injection of AAV; b. Once injection of AAV; c. Twice injection of AAV; d. Three times injection of AAV 图 8 3种不同AAV治疗的PRV攻毒小鼠伤口对比 Fig. 8 Compare the wound of PRV infected mice treated by three different AAVs |
2.4.3 重组腺联病毒编辑系统降低了PRV对小鼠致病性 经AAV-TK治疗1次的PRV感染小鼠(图 9a),100 h内,死亡5只,死亡时间推后约2 d(平均死亡时间46 h),且存活2只小鼠;经AAV-TK治疗2次的PRV感染小鼠则死亡4只,存活3只,且小鼠的死亡时间也是明显推后(平均死亡时间82.5 h);而治疗3次的小鼠,则全部存活,在100 h的观察时间内存活率最高,而且存活时间最长。AAV-VP16治疗组中注射1次AAV-VP16的仅有1只存活,注射2次AAV-VP16有2只存活,注射3次AAV-VP16则有5只存活(图 9b)。通过AAV-gE治疗发现,小鼠生存曲线如图 9c,从图 9c中可以看出AAV-gE注射2次的治疗小鼠有2只小鼠存活,3次的则有6只存活,从图 9c中可以看出AAV-gE治疗的小鼠存活状况比不治疗的小鼠情况略好些,在一定时间内存活率略大些,存活时间也更久。从图 9中可以看出AAV-TK、AAV-VP16和AAV-gE组注射3次的小鼠存活率均超过70%,其中AAV-TK组达到100%的存活(100 h),这个结果说明3次注射效果比1次和2次都好,且以AAV-TK组小鼠疗效最好。只进行AAV尾静脉注射和注射DMEM与生理盐水的小鼠全部存活,且很有活力,生理体征都正常。
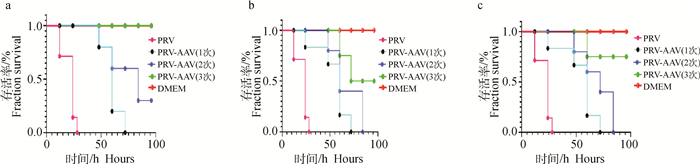
|
a. AAV-TK; b. AAV-VP16; c. AAV-gE 图 9 3种AAV治疗组PRV攻毒小鼠的生存曲线 Fig. 9 Survival of PRV infected mice treated by AAVs carrying three different CRISPR/Cas9-sgRNA systems |
2.4.4 重组腺联病毒编辑系统对PRV感染小鼠的免疫器官的影响 AAV本身是DNA病毒,作为外源核酸病原体常引起小鼠的免疫应答作用,从而导致小鼠免疫器官的变化。为了评估重组腺联病毒编辑系统是否对机体的免疫有上调作用,对注射不同次数腺病毒携带编辑质粒的小鼠进行麻醉,再用DEPC水对小鼠进行灌注,然后再取脾,拍照并测量比对,结果发现注射PRV的小鼠脾组织比只注射DMEM和生理盐水的正常小鼠小,而只注射AAV的小鼠脾组织有些肿大。图 10a~c为相同注射次数的3种AAV治疗小鼠脾组织的对比,可以看出用AAV-TK治疗3次小鼠的脾大小和形状最接近正常小鼠,而用AAV-gE和AAV-VP16治疗的小鼠脾都有一定程度的萎缩,但是比单纯注射PRV的小鼠好些,可见3种AAV对治疗感染PRV的小鼠都有一定的疗效,其中AAV-TK的治疗效果最佳。图 10a~c分别为相同AAV不同注射次数的小鼠脾进行对比,从图中可以看出,AAV-TK和AAV-gE注射2次时小鼠的脾大小和形状最接近正常小鼠,而AAV-VP16注射3次时小鼠脾最接近正常小鼠(图 10c)。
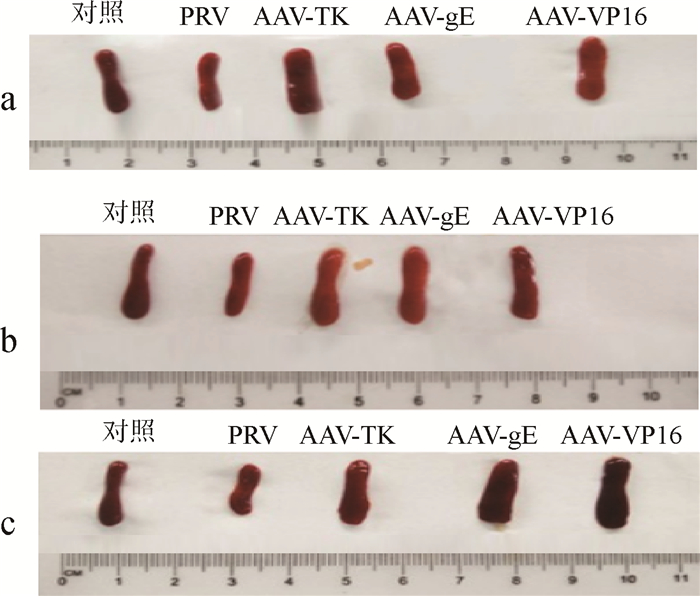
|
a.注射AAV 1次;b.注射AAV 2次;c.注射AAV 3次 a. Once injection of AAV; b. Twice injection of AAV; c. Three times injection of AAV 图 10 3种不同AAV治疗的小鼠脾组织对比 Fig. 10 Compare the splenic tissues of mice treated by three different AAV |
2.4.5 重组腺联病毒编辑系统部分抑制PRV在小鼠脑组织中的复制 PRV是一种嗜神经病毒,感染后在脑部组织的分布较高,可作为发病的指征。此外,小鼠感染PRV后,常表现为典型搔痒症,因而本研究通过检测小鼠的脑部组织病毒的载量,来初步评估重组腺联病毒编辑系统对PRV感染小鼠治疗效果。用IE180引物和小鼠脑组织cDNA进行Real-time PCR。结果如图 11,经过重组腺联病毒编辑系统治疗的小鼠,脑组织中病毒的拷贝数都比对照组低(P≤0.01)。经过重组腺联病毒编辑系统治疗的小鼠2次和3次的小鼠脑组织的病毒的拷贝数显著比对照组低(P≤0.001)。此外,AAV-TK注射3次的治疗组脑部组PRV量比AAV-gE组还低(P≤0.05)。这个结果表明重组腺联病毒编辑系统对小鼠脑部PRV的载量有下调作用,而AAV-TK组的降低效果最为明显。

|
*. P≤0.05; P≤0.01; ***. P≤0.001 Changes of PRV amount in the brain tissues of PRV-infected mice treated by AAV carrying the corresponding CRISP/Cas-sgRNA systems 图 11 AAV治疗PRV感染小鼠脑部组织中PRV量的变化 |
PRV感染在我国生猪养殖中较为普遍,且对生产影响较大。若要净化PRV阳性猪群,只能通过严格筛查并及时淘汰[18-21]。但该方法操作繁琐,代价高,并不适合当前生猪养殖。因而对于感染PRV的阳性猪及阳性猪场,采取有效的治疗手段是当前降低生猪养殖亏损,促进生猪产业发展的迫切需求。本试验中作者通过重组腺联病毒载体转运CRISPR/Cas9系统,进入PRV感染小鼠体内,剪切PRV的毒力基因TK和gE,以及复制相关基因VP16,以期减弱PRV的毒力和复制能力,乃至清除小鼠体内的病毒。据报道,CRISPR/Cas9系统不仅对动物细胞、细菌和病毒能进行实时靶向编辑,而且能够用于动物和部分人的胚胎基因编辑。此外,CRISPR/Cas9系统还成功地治疗亨廷顿氏病(huntingtin基因突变引起的疾病)的小鼠,矫正了严重联合免疫缺陷病[11-12]。本试验中作者利用重组腺联病毒载体来转运CRISPR/Cas9系统,明显地减少了细胞和小鼠组织中PRV IE180的mRNA,抑制了PRV的复制和进一步的繁殖。随着冶疗次数增加,细胞病变减少。小鼠典型“伪狂犬搔痒症”明显减轻,一定时间小鼠的存活时间和存活率都获得提高,这个结果与预期一致。
本研究应用伪狂犬病病毒IE180基因作为评估重组腺联病毒载体编辑系统的治疗效果,主要是因为之前有研究报道,伪狂犬病病毒只含一个立即早期基因,即IE180基因,该基因对病毒在动物体内的复制至关重要[22],只有IE180基因开放转录,并翻译成IE180蛋白, 其下游的基因才能在IE180蛋白的激活作用下得以完全开放转录, 否则病毒复制将不能完成。IE180基因的表达产物IE180蛋白是一个多功能蛋白,不仅能激活同源蛋白基因启动子,而且能激活某些异源蛋白基因启动子[23-26]。细胞试验表明,IE180拷贝数低的处理组,其细胞的病变也较轻;通过评价感染PRV小鼠和治疗组小鼠的存活率、存活时间以及体征,作者发现PRV的IE180较低组,其小鼠成活率较高,死亡率较低,小鼠出现搔痒症的现象也明显减少;防治效果和治疗的次数成正比。这进一步证实,该小鼠模型的结果对当前阳性PRV猪的治疗有一定的借鉴作用。
研究中还发现,虽然运载有三种重组CRISPR/Cas-sgRNA表达系统的AAV由于自身具有免疫原性,在一定程度上引起了小鼠机体内的免疫反应,但对小鼠并没有致病性伤害,且对PRV感染小鼠有一定的治疗效果。其中,AAV-TK和AAV-VP16治疗组小鼠注射2次时的治疗效果最好,AAV-gE治疗组小鼠的治疗效果较差。作者还对比了不同AAV注射不同次数治疗小鼠的脾组织,发现PRV感染小鼠的脾出现严重萎缩,而经过AAV治疗后的小鼠脾组织萎缩有明显改善。
应用重组腺联病毒载体运载CRISPR/Cas9系统治疗PRV感染是可行的。AAV-TK和AAV-gE减弱PRV毒性,而AAV-VP16抑制PRV的复制,3种AAV治疗PRV感染都有一定的效果。在3种AAV的治疗结果中,注射3次AAV的治疗比注射1和2次的效果好。由于小鼠试验重复次数有限,体内评估标准尚且不明确,有可能和猪体内的效果不完全一致,因此该方法在猪的治疗效果尚有待进一步研究。
4 结论重组腺联病毒载体编辑系统用于感染PRV的ST细胞,能明显减缓和减轻ST细胞病变;用于PRV感染小鼠,可降低感染小鼠的死亡率、延长存活时间,提高成活率,减轻搔痒症,治疗效果和治疗次数成正比。
| [1] |
彭金美, 安同庆, 赵鸿远, 等. 猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J]. 中国预防兽医学报, 2013, 35(1): 1-4. PENG J M, AN T Q, ZHAO H Y, et al. Identification and antigenic variation of new epidemiology of pseudorabies virus from swine[J]. Chinese Journal of Preventive Veterinary Medicine, 2013, 35(1): 1-4. (in Chinese) |
| [2] |
PICKARD G E, BRODERSEN B, SOLLARS P J, et al. The pseudorabies virus R2 non-neuroinvasive vaccine: a proof-of-concept study in pigs[J]. Vaccine, 2020, 38(29): 4524-4528. DOI:10.1016/j.vaccine.2020.05.002 |
| [3] |
ZHANG T, LIU Y C, CHEN Y M, et al. A single dose glycoprotein D-based subunit vaccine against pseudorabies virus infection[J]. Vaccine, 2020, 38(39): 6153-6161. DOI:10.1016/j.vaccine.2020.07.025 |
| [4] |
王进. Bartha-K61疫苗和vPRV-XJ5 gE/gI/TK三基因缺失株对猪伪狂犬病毒变异株亚致死性攻毒的保护作用[D]. 扬州: 扬州大学, 2019. WANG J. Efficacy of Bartha-K61 vaccine and A gE-/gI-/TK-prototype vaccine of variant porcine pseudorabies virus (vPRV) Strain XJ5 for piglets against A sublethal challenge with vPRV strain XJ5[D]. Yangzhou: Yangzhou University, 2019. (in Chinese) |
| [5] |
HÖLPER J E, REICHE S, FRANZKE K, et al. Generation and characterization of monoclonal antibodies specific for the Pseudorabies Virus nuclear egress complex[J]. Virus Res, 2020, 287: 198096. DOI:10.1016/j.virusres.2020.198096 |
| [6] |
古金元, 马梓承, 彭涛, 等. 山东省部分地区猪伪狂犬病病毒分离鉴定及其gE基因遗传变异分析[J]. 中国兽医学报, 2019, 39(1): 21-24, 30. GU J Y, MA Z C, PENG T, et al. Isolation, identification and phylogenetic analysis of gE gene of pseudorabies virus in parts of Shandong province[J]. Chinese Journal of Veterinary Science, 2019, 39(1): 21-24, 30. (in Chinese) |
| [7] |
ONO E, WATANABE S, NIKAMI H, et al. Pseudorabies virus (PRV) early protein 0 activates PRV gene transcription in combination with the immediate-early protein IE180 and enhances the infectivity of PRV genomic DNA[J]. Vet Microbiol, 1998, 63(2-4): 99-107. DOI:10.1016/S0378-1135(98)00236-3 |
| [8] |
CONG L, ZHANG F. Genome engineering using CRISPR-Cas9 system[M]//PRUETT-MILLER S M. Chromosomal Mutagenesis. New York: Humana Press, 2015: 197-217.
|
| [9] |
HORVATH P, BARRANGOU R. CRISPR/Cas, the immune system of bacteria and archaea[J]. Science, 2010, 327(5962): 167-170. DOI:10.1126/science.1179555 |
| [10] |
WESTRA E R, BUCKLING A, FINERAN P C. CRISPR-Cas systems: beyond adaptive immunity[J]. Nat Rev Microbiol, 2014, 12(5): 317-326. DOI:10.1038/nrmicro3241 |
| [11] |
WU J J, TANG Y, ZHANG C L. Targeting N-terminal Huntingtin with a dual-sgRNA strategy by CRISPR/Cas9[J]. BioMed Res Int, 2019, 2019: 1039623. |
| [12] |
DUNBAR G L, KONERU S, KOLLI N, et al. Silencing of the mutant Huntingtin gene through CRISPR-Cas9 improves the mitochondrial biomarkers in an in vitro model of Huntington's disease[J]. Cell Transplantat, 2019, 28(4): 460-463. DOI:10.1177/0963689719840662 |
| [13] |
SAMULSKI R J, ZHU X, XIAO X, et al. Targeted integration of adeno-associated virus (AAV) into human chromosome 19[J]. EMBO J, 1991, 10(12): 3941-3950. DOI:10.1002/j.1460-2075.1991.tb04964.x |
| [14] |
RABINOWITZ J E, ROLLING F, LI C W, et al. Cross-packaging of a single adeno-associated virus (AAV) type 2 vector genome into multiple AAV serotypes enables transduction with broad specificity[J]. J Virol, 2002, 76(2): 791-801. DOI:10.1128/JVI.76.2.791-801.2002 |
| [15] |
MCCOWN T J, XIAO X, LI J, et al. Differential and persistent expression patterns of CNS gene transfer by an adeno-associated virus (AAV) vector[J]. Brain Res, 1996, 713(1-2): 99-107. DOI:10.1016/0006-8993(95)01488-8 |
| [16] |
SHI X Q, FANG G G, SHI W F, et al. Insertional mutagenesis at positions 520 and 584 of adeno-associated virus type 2 (AAV2) capsid gene and generation of AAV2 vectors with eliminated heparin- binding ability and introduced novel tropism[J]. Human Gene Ther, 2006, 17(3): 353-361. DOI:10.1089/hum.2006.17.353 |
| [17] |
LIN J X, LI Z L, FENG Z H, et al. Pseudorabies virus (PRV) strain with defects in gE, gC, and TK genes protects piglets against an emerging PRV variant[J]. J Vet Med Sci, 2020, 82(6): 846-855. DOI:10.1292/jvms.20-0176 |
| [18] |
WEINBERG M S, SAMULSKI R J, MCCOWN T J. Adeno-associated virus (AAV) gene therapy for neurological disease[J]. Neuropharmacology, 2013, 69: 82-88. DOI:10.1016/j.neuropharm.2012.03.004 |
| [19] |
李海琴, 康昭风, 谭美芳, 等. 2016—2017年江西省部分地区规模化猪场猪伪狂犬病血清流行病学调查[J]. 江西农业大学学报, 2018, 40(5): 1037-1041. LI H Q, KANG Z F, TAN M F, et al. A seroepidemiological survey of porcine pseudorabies virus in some large scale pig farms from 2016—2017 in Jiangxi Province[J]. Acta Agriculturae Universitatis Jiangxiensis, 2018, 40(5): 1037-1041. (in Chinese) |
| [20] |
杨珊珊, 徐璇, 孙涛, 等. 2016年江苏省部分猪场猪伪狂犬病血清流行病学调查[J]. 中国动物检疫, 2017, 34(8): 17-19. YANG S S, XU X, SUN T, et al. Serum epidemiological investigation on porcine pseudorabies in some swine farms of Jiangsu Province in 2016[J]. China Animal Health Inspection, 2017, 34(8): 17-19. (in Chinese) |
| [21] |
孙颖, 王雪莹, 梁婉, 等. 2018年伪狂犬病病毒的流行特征及其遗传变异分析[J]. 畜牧兽医学报, 2020, 51(3): 584-593. SUN Y, WANG X Y, LIANG W, et al. Epidemiological and evolutionary characteristics of pseudorabies virus in China in 2018[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(3): 584-593. (in Chinese) |
| [22] |
周绪斌, 雷健良, 周克钢, 等. 2008年中国11省市规模化猪场伪狂犬病野毒血清流行病学系统监测与分析[C]//中国畜牧兽医学会家畜传染病学分会第七届全国会员代表大会暨第十三次学术研讨会论文集. 南宁: 中国畜牧兽医学会, 2009. ZHOU X B, LEI J L, ZHOU K G, et al. 2008 Surveillance and Analysis of large-scale pig farms in 11 provinces and cities[C]//13th Academic Seminar of Animal Infectious Diseases Branch of Chinese Society of Animal Husbandry and Veterinary Medicine, 2009. (in Chinese) |
| [23] |
OU C J, WONG M L, HUANG C J, et al. Suppression of promoter activity of the LAT gene by IE180 of pseudorabies virus[J]. Virus Genes, 2002, 25(3): 227-239. DOI:10.1023/A:1020959521745 |
| [24] |
GUO H, ZHOU R, XI Y, et al. Transcriptional suppression of IE180 and TK promoters by the EP0 of pseudorabies virus strains Ea and Fa[J]. Virus Genes, 2009, 38(2): 269-275. DOI:10.1007/s11262-008-0320-3 |
| [25] |
ONO E, TAHARAGUCHI S, WATANABE S, et al. Suppression of pseudorabies virus replication by a mutant form of immediate-early protein IE180 repressing the viral gene transcription[J]. Vet Microbiol, 1998, 60(2-4): 107-117. DOI:10.1016/S0378-1135(97)00153-3 |
| [26] |
WU B W, ENGEL E A, ENQUIST L W. Characterization of a replication-incompetent pseudorabies virus mutant lacking the sole immediate early gene IE180[J]. mBio, 2014, 5(6): e01850. |
(编辑 白永平)



