奶牛围产期包括围产前期(产前21 d)和围产后期(产后21 d)。围产期奶牛由于采食量下降,胎儿急速发育等因素,能量摄入无法满足机体需求[1-2],导致能量和其他营养素的负平衡,进而易患各种代谢疾病,如脂肪肝、酮病等。有研究表明,产后奶牛脂肪肝患病率高达50% [3]。
烟酸(niacin, NA),又名尼克酸,与其衍生物烟酰胺是VB3的两种形式,是人体和动物不可缺少的营养成分。VB3是辅酶I和辅酶II前体物,还可通过烟酸的G蛋白偶联受体(GPR109A)发挥抗脂解作用[4],在能量代谢和细胞保护途径都起着至关重要的作用[5]。NA在临床上被广泛用于治疗血脂代谢异常。Ganji等[6-8]在体内外研究发现,NA可显著改善肝中脂肪积累以及脂肪变性、炎症和纤维化;Li等[9]的研究结果表明,NA可通过增加肝的脂质氧化并减少脂肪酸的从头合成来缓解大鼠慢性酒精脂肪肝。NA在奶牛饲料中作为添加剂也被广泛使用。Morey等[10]报道在围产期奶牛基础日粮中添加24 g·d-1过瘤胃保护烟酸(rumen-protected niacin, RPN),可降低产后血浆中非酯化脂肪酸(nonesterifiedfatty acid, NEFA)的浓度。从源头上减少机体体脂动员,使进入肝的NEFA减少是缓解脂肪肝途径之一,加速甘油三酯(triglycerides, TG)转运出肝是缓解脂肪肝的另一条途径。胆碱(choline, CH)是一种水溶性维生素类营养物质,参与3个主要的生理过程:1)作为细胞结构物质,维持细胞膜的结构和功能;2)参与乙酰胆碱合成,维持信息传递;3)作为甲基供体,参与机体甲基和蛋氨酸循环,调控基因表达[11]。此外,CH可促进极低密度脂蛋白(very low density lipoprotein,VLDL)的合成,使TG及时转运出肝组织,还可作为肉毒碱的甲基供体加快肝中脂肪酸的β氧化,减少TG的沉积[12-13]。CH在人类和鼠的肝组织能量代谢中发挥重要作用,并可用于预防和治疗脂肪肝[14-16]。由于反刍动物瘤胃的特殊性,添加的CH需经过瘤胃包被技术加工,孙菲菲[17]在围产期奶牛基础日粮中添加60 g·d-1过瘤胃保护胆碱(rumen-protected choline, RPC),发现RPC能显著降低血浆NEFA的含量,提高VLDL的含量,从而改善肝和机体健康。综上,烟酸可从源头上减少进入肝的NEFA,胆碱可增加肝中TG的运输,二者分别从不同的途径缓解奶牛脂肪肝,但二者同时添加是否有协同作用并未报道。因此,本试验旨在前期研究基础上,研究日粮中添加RPN和RPC对围产期奶牛泌乳性能和脂质代谢的影响,以期为缓解奶牛脂肪肝提供理论依据。
1 材料与方法 1.1 试验设计与分组本试验选用24头健康、胎次相近的中国荷斯坦围产期奶牛(山东省淄博市某规模化奶牛场)。根据2×2试验设计法,将奶牛分为4组,每组6头。日粮处理组分别为:对照组(CON,基础日粮)、烟酸组(RPN,基础日粮+18.4 g·d-1 RPN(有效成分9.6 g·d-1))、胆碱组(RPC,基础日粮+60 g·d-1 RPC(氯化胆碱15 g·d-1))、混合组(RPN×RPC,基础日粮+18.4 g·d-1 RPN+60 g·d-1 RPC)。RPN剂量参考Morey等[10, 18]的方法;RPC剂量参考孙菲菲[17]的方法。试验期为产前14 d到产后21 d,共35 d。试验用RPN(纯度65%,过瘤胃率80.3%)和RPC(氯化胆碱25%,过瘤胃率85%)均购自杭州康德权饲料有限公司。
1.2 饲养管理试验牛饲养管理均依照牧场管理制度。试验期配制2种日粮,分别是围产前期日粮和围产后期日粮,原料组成及营养水平见表 1;基础日粮以全混合日粮(total mixed ratio,TMR)的形式饲喂,分别于07:00和16:00饲喂,自由采食和饮水。
|
|
表 1 围产前期和围产后期日粮组成(干物质基础) Table 1 Ingredient composition of diets fed during the prepartum and postpartum periods(DM basis) |
1.3.1 血液样品的采集 于产前14、7 d,产后1、7、14和21 d 18:00在颈静脉采集约10 mL血液样品,分装于EDTA-K2抗凝管中,3 000×g离心15 min,取上清液(即血浆),分装于1.5 mL离心管中,-20 ℃冷冻保存,待测。
1.3.2 肝组织样品的采集 于产后21 d进行肝组织活检(每次在13:00时采集),用活检针穿刺采集肝组织样本。将第10和11根肋骨和髋关节到右前肢肘关节的连线交叉处区域剃光,酒精消毒,2 mL盐酸利多卡因皮下麻醉,5 min后通过皮肤反应评估麻醉效果,用刀片在体壁切口,活检针向肝插入,收集约100 mg组织在液氮中快速冷冻,-80 ℃下保存,待测。
1.4 测定指标及方法1.4.1 母牛体重和犊牛初生重 产犊后1、7、14和21 d测定母牛体重(body weight, BW)和犊牛初生重。
1.4.2 产奶量测定与乳成分分析 产犊后,试验奶牛采用鱼骨式挤奶台进行挤奶,挤奶厅配套利拉伐奶厅管理系统软件,记录产后1~21 d的产奶量,产后14 d和产后21 d上午和下午均采集乳样各约50 mL,均匀混合为全天奶样,混合奶样中添加1~2滴饱和重铬酸钾溶液作为防腐剂,混匀保存。乳成分使用全自动乳成分分析仪(FOSS, 丹麦)测定,检测指标包括乳脂肪、乳蛋白、乳糖、固形物和乳尿素氮。
1.4.3 血浆生化指标测定 血浆生化指标均使用生化试剂盒测定:葡萄糖(GLU,上海优选生物科技有限公司),甘油三酯(TG,E-BC-K261-M,武汉伊莱瑞特生物科技股份有限公司),NEFA(A042-1-1,南京建成生物工程研究所)、β-羟丁酸(β-hydroxybutyric acid,BHBA,E030-1-1,南京建成生物工程研究所,中国南京)。VLDL含量采用酶联免疫吸附法测定,试剂盒购于上海优选生物科技有限公司。
1.4.4 肝TG的测定 肝TG使用商业试剂盒(E-BC-K261-M,武汉伊莱瑞特生物科技股份有限公司)测定,总蛋白浓度使用BCA法。
1.4.5 肝脂质合成和氧化相关基因表达量的测定 采用常规TRIzol法,提取奶牛肝组织总RNA。称取50~80 mg冷冻肝组织,加入1 mL TRIzol(TaKaRa,中国大连),充分匀浆,取上清液,加入氯仿和异丙醇,获得RNA沉淀。然后用75%的乙醇洗涤RNA沉淀,将其溶解于无RNAse水中。使用超微量核酸蛋白测定仪检测RNA浓度。随后将RNA反转录为cDNA(UEIris RT mix with DNase,R2020,US EVERBRIGHT INC)。反应条件是:42 ℃持续30 min、95 ℃持续5 min、5 ℃持续5 min,-20 ℃保存备用。使用SYBR(US EVERBRIGHT INC,S2014))进行实时荧光定量(RT-qPCR)。扩增体系为10 μL:SYBR Green Master Mix (2×)5 μL,正向和反向引物各0.5 μL,cDNA 4 μL。使用两步快速扩增法:95 ℃预变性30 s,95 ℃变性10 s,重复40个循环,60 ℃退火30 s,重复40个循环(LightCycler® 96,Roche)。基因表达量用经典的2-ΔΔCT方法计算[19],引物序列见表 2。
|
|
表 2 引物列表 Table 2 Primer list |
试验数据使用SAS 9.2的混合线性模型进行单因素和双因素重复测定分析(Repeated Measurement Model),对于单个时间点的组间差异显著性,采用单因素方差分析(One-way ANOVA),P≤0.05表示差异显著,0.05 < P≤0.10表示具有差异趋势,P>0.05表示无显著性差异。
2 结果 2.1 添加RPN和RPC对围产期奶牛生产性能的影响如表 3和表 4所示,奶牛的BW和犊牛的初生重并未受到添加RPN和RPC的影响,产后3周内,奶牛的BW呈现下降状态。日粮添加RPN和RPC对围产后期奶牛产奶量(图 1)、乳脂、乳蛋白、乳糖、非脂固形物和乳尿素氮(表 5)均无显著影响(主效应P>0.05)。
|
|
表 3 围产期奶牛添加RPN和RPC对围产期奶牛体重的影响 Table 3 Effects of RPN and RPC supplementation on body weight of perinatal dairy cows |
|
|
表 4 围产期奶牛添加RPN和RPC对围产期犊牛初生重的影响 Table 4 Effects of RPN and RPC supplementation on body weight of calves |

|
图 1 围产期奶牛添加RPN和RPC对产奶量的影响 Fig. 1 Effects of RPN and RPC supplementation on milk production of perinatal dairy cows |
|
|
表 5 围产期奶牛添加RPN和RPC对乳成分的影响 Table 5 Effects of RPN and RPC supplementation on milk composition of perinatal dairy cows |
如图 2所示,围产期奶牛基础日粮中添加RPN和RPC可分别提高血浆中NA和CH的含量(主效应P < 0.001)。在整个试验期,血浆NA和CH含量随时间变化而变化(Time P < 0.001),NA和CH含量都是在产后1 d达到最高。

|
图 2 RPN和RPC对围产期奶牛血浆中NA和CH含量的影响 Fig. 2 Effects of RPN and RPC on plasma NA and CH concentrations of perinatal dairy cows |
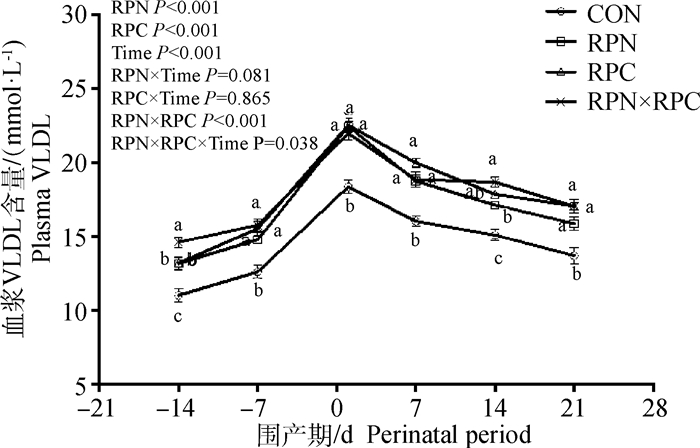
如图 3所示,添加RPN和RPC对血浆中NEFA、BHBA和GLU无显著影响(主效应P>0.05),RPN与RPC间不存在交互作用(RPN×RPC P>0.05),但血浆NEFA、BHBA浓度均受时间影响(Time P < 0.05)。单独添加RPN和RPC对血浆中TG无显著性影响(主效应P>0.05),但RPN和RPC存在交互作用(RPN×RPC P < 0.05),且与时间存在交互作用(RPN×RPC×Time P < 0.05)。动态监测产前14 d到产后21 d血浆中VLDL的含量,结果显示(图 4),日粮中添加RPN、RPC显著增加了血浆中VLDL的含量(主效应RPN P < 0.001, RPC P < 0.001),且二者存在交互作用(RPN×RPC P < 0.001)。RPN×RPC与时间也存在交互效应(RPN×RPC×Time P=0.038),组间比较,RPN、RPC和RPN×RPC的VLDL含量均显著高于CON组(P < 0.05)。

|
图 3 RPN和RPC对围产期奶牛血浆中生化指标含量的影响 Fig. 3 Effects of RPN and RPC on the contents of biochemical indexes of perinatal dairy cows plasma |
|
图 4 RPN和RPC对围产期奶牛血浆中VLDL含量的影响 Fig. 4 Effects of RPN and RPC on plasma VLDL concentrations of perinatal dairy cows |
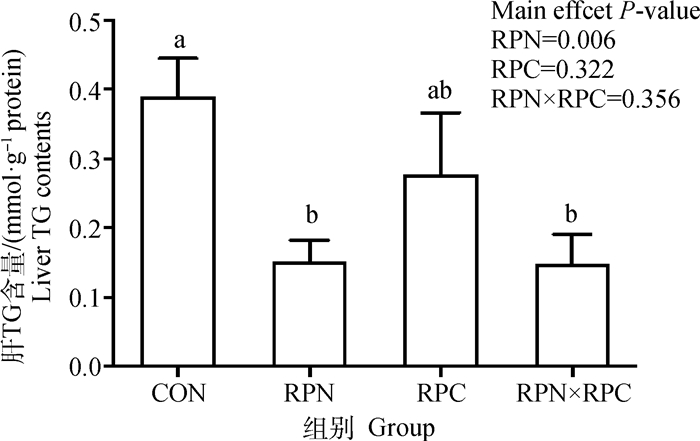
如图 5所示,日粮添加RPN显著降低了肝中TG的含量(主效应P=0.006)。组间比较发现,RPN和RPN×RPC组肝中TG含量显著低于CON组(P < 0.05), RPC组与CON组相比差异不显著(P>0.05)。
|
图 5 RPN和RPC对围产期奶牛肝中TG含量的影响 Fig. 5 Effects of RPN and RPC on liver TG concentrations of perinatal dairy cows |
由表 6可知,日粮中添加RPN和RPC对PPAR-α mRNA相对表达量无显著影响(主效应P>0.05),但RPN和RPC存在互作效应(RPN×RPC P=0.043)。RPC有降低DGAT1的趋势(主效应RPC P < 0.10),添加RPN和RPC对脂质合成和氧化的其他基因相对表达量均无显著影响(主效应P>0.05);组间对比差异不显著(P> 0.05)。
|
|
表 6 RPN和RPC对围产期奶牛肝脂代谢相关基因的影响 Table 6 Effects of RPN and RPC on liver lipid metabolism related genes of perinatal dairy cows |
在过去几十年,关于奶牛日粮中补饲RPN和RPC的研究有很多,大多数结果表明二者的补充不影响泌乳早期的采食量(dry matter intake, DMI)和产奶量。Morey等[10]在围产期奶牛基础日粮中添加24 g·d-1 RPN,对体况评分(body condition score, BCS)、BW、能量平衡、产奶量及乳成分无显著影响。Yuan等[20]研究结果显示,围产期奶牛日粮中补饲12 g·d-1 RPN对奶牛生产性能也无显著影响。Bollatti等[21]报道,奶牛日粮添加12.9 g·d-1 RPC不会影响其DMI、BCS和BW。本试验研究结果与之一致,日粮添加RPN和RPC对围产期奶牛、犊牛体重产奶量以及乳成分无显著影响。但也有研究结果显示,补饲RPN和RPC可以提高奶牛产奶量[22-23]。Potts等[23]发现,在试验中添加60 g·d-1 RPC(氯化胆碱含量为28.8%),可显著增加奶牛的产奶量。本试验RPC添加量与Potts等[23]的试验相似,但氯化胆碱含量较低,为25%。因此,本试验生产性能无显著变化可能是由于添加量较低或生物学效价不同,后续应加大添加量,探索RPN和RPC的最佳剂量。
3.2 添加RPN和RPC对围产期奶牛血液生化指标的影响为增加小肠中对NA和CH的生物利用度,本试验从产前14 d到产后21 d持续添加RPN和RPC,显著提高了血浆中NA和CH的含量。值得注意的是,二者混合添加后血浆中CH的含量并未显著提高,且与CON组中的CH含量接近,原因可能是部分CH在肝中转化为甜菜碱,进一步提供甲基,而NA代谢过程中会消耗甲基[24],导致RPN × RPC组CH含量未显著提高,其具体原因还需进一步探究。
泌乳早期,奶牛为补偿能量不足而动用体脂[25],导致血浆中NEFA、BHBA和肝中TG显著增加[26]。由于其抗脂解作用,烟酸被认为是一种降脂化合物[27]。因此,烟酸有望抑制泌乳早期的脂肪分解以改善奶牛健康。NEFA是反映奶牛脂肪动员和代谢健康的重要指标[28]。研究表明,围产期补饲RPN可降低血浆NEFA浓度[20, 29],但也有研究表明添加RPN对血液NEFA浓度无显著影响。Zeitz等[30]试验中补饲79 mg·kg-1 BW RPN,奶牛血浆TG含量和NEFA浓度无显著差异,本试验研究结果与之一致。Aragona等[31]发现,添加16、32、48 g·d-1 RPN对围产期奶牛能量代谢和生产性能无显著影响。Pires等[32-34]发现,每小时持续真胃灌注3 mg·kg-1 BW RPN可显著降低奶牛血浆NEFA浓度,但在灌注停止后2~4 h观察到NEFA浓度显著反弹,且持续4~9 h。表明一定水平的RPN可以抑制脂肪分解,但血浆NEFA浓度的反弹可能会干扰对奶牛烟酸抗脂解作用的评估。血浆中NEFA部分氧化形成BHBA或酯化后作为TG储存在肝中。有人提出,血浆NEFA浓度可能不是决定血浆BHBA浓度的唯一因素,但本试验结果中添加RPN和RPC对血浆中NEFA和BHBA的浓度均无显著影响。如同NEFA一样,也存在持续灌注RPN可显著降低BHBA浓度,但停止灌注后反弹的现象[33-34]。采血时间可能是导致各研究之间血浆NEFA和BHBA浓度差异的一个原因,因为血浆NEFA和BHBA浓度可能会因进食和采血之间的时间间隔而产生差异[4]。因胆碱可促进VLDL的合成,是被广泛用于缓解奶牛脂肪肝的添加剂。围产期奶牛补饲RPC对血浆NEFA和BHBA的影响也不一致,这可能是因为开始补充的时期、持续时间、补充水平或过瘤胃保护率不同导致的[35]。一些研究中,RPC降低了血液NEFA和BHBA浓度[36-38],而在其他研究中无显著影响[39-41]。本试验添加RPC对血浆NEFA和BHBA浓度无显著影响,二者混合添加对NEFA和BHBA也无显著影响。
3.3 添加RPN和RPC对围产期奶牛肝中TG及脂质代谢相关基因表达的影响奶牛的肝脂肪变性主要是由体脂动员、脂肪酸氧化、TG合成和输出的不平衡引起的。在非反刍动物中,肝中TG累积与SREBP-1c的转录活性和丰度密切相关,部分原因是该蛋白质参与调节脂肪酸和TG合成的基因,包括ACC1、FAS和DGAT1[42-43]。Jia等[44]的研究表明,中度脂肪肝奶牛的肝中过度诱导SREBP-1c及其靶分子ACC1、FAS和DGAT1表达。此外,用高浓度脂肪酸处理犊牛原代肝细胞可上调脂肪生成分子(ACA、FAS和DGAT1)的表达,部分是通过增加SREBP-1c的表达和活性。这表明脂肪生成是奶牛中度脂肪肝发育的一个组成部分[45],而PPAR-α和CPT1A可促进脂肪酸的氧化,CPT1A是PPAR-α的靶分子。本试验发现,RPC有降低DGAT1的趋势,表明添加RPN和RPC有降低肝中脂肪合成的可能。另一方面,本试验添加RPC奶牛肝中TG含量显著降低,可能是RPC促进了VLDL的合成,有利于肝中TG的输出。
4 结论围产期奶牛日粮中添加RPN和RPC可显著提高血浆中VLDL的含量,降低肝中TG的含量,从而有效缓解围产期奶牛脂肪过度沉积,但二者混合添加的效果并未显著优于单独添加,具体机制还需进一步探究。
| [1] |
LOPREIATO V, MEZZETTI M, CATTANEO L, et al. Role of nutraceuticals during the transition period of dairy cows: a review[J]. J Anim Sci Biotechnol, 2020, 11: 96. DOI:10.1186/s40104-020-00501-x |
| [2] |
CHEN M, LOOR J J, ZHAI Q, et al. Short communication: enhanced autophagy activity in liver tissue of dairy cows with mild fatty liver[J]. J Dairy Sci, 2020, 103(4): 3628-3635. DOI:10.3168/jds.2019-17457 |
| [3] |
JORRITSMA R, JORRITSMA H, SCHUKKEN Y H, et al. Prevalence and indicators of post partum fatty infiltration of the liver in nine commercial dairy herds in The Netherlands[J]. Livest Prod Sci, 2001, 68(1): 53-60. DOI:10.1016/S0301-6226(00)00208-6 |
| [4] |
CHEN J C, YANG Z G, DONG G Z. Niacin nutrition and rumen-protected niacin supplementation in dairy cows: an updated review[J]. Br J Nutr, 2019, 122(10): 1103-1112. DOI:10.1017/S0007114519002216 |
| [5] |
GODIN A M, FERREIRA W C, ROCHA L T S, et al. Nicotinic acid induces antinociceptive and anti-inflammatory effects in different experimental models[J]. Pharmacol Biochem Behav, 2012, 101(3): 493-498. DOI:10.1016/j.pbb.2012.02.012 |
| [6] |
GANJI S H, KASHYAP M L, KAMANNA V S. Niacin inhibits fat accumulation, oxidative stress, and inflammatory cytokine IL-8 in cultured hepatocytes: impact on non-alcoholic fatty liver disease[J]. Metabolism, 2015, 64(9): 982-990. DOI:10.1016/j.metabol.2015.05.002 |
| [7] |
GANJI S H, KUKES G D, LAMBRECHT N, et al. Therapeutic role of niacin in the prevention and regression of hepatic steatosis in rat model of nonalcoholic fatty liver disease[J]. Am J Physiol Gastrointest Liver Physiol, 2014, 306(4): G320-G327. DOI:10.1152/ajpgi.00181.2013 |
| [8] |
KASHYAP M L, KAMANNA S, HOA N, et al. New use of niacin for the potential treatment of nonalcoholic fatty liver disease (NAFLD): efficacy on fibrosis[C]//Abstract Presented at the 2018 AASLD Industry Colloquium: Novel Targets and Therapies in Liver Disease. Washington DC: AASLD, 2018.
|
| [9] |
LI Q, XIE G X, ZHANG W L, et al. Dietary nicotinic acid supplementation ameliorates chronic alcohol-induced fatty liver in rats[J]. Alcohol Clin Exp Res, 2014, 38(7): 1982-1992. DOI:10.1111/acer.12396 |
| [10] |
MOREY S D, MAMEDOVA L K, ANDERSON D E, et al. Effects of encapsulated niacin on metabolism and production of periparturient dairy cows[J]. J Dairy Sci, 2011, 94(10): 5090-5104. DOI:10.3168/jds.2011-4304 |
| [11] |
WORTMANN S B, MAYR J A. Choline-related-inherited metabolic diseases-a mini review[J]. J Inherit Metab Dis, 2019, 42(2): 237-242. DOI:10.1002/jimd.12011 |
| [12] |
GOSELINK R M A, VAN BAAL J, WIDJAJA H C A, et al. Effect of rumen-protected choline supplementation on liver and adipose gene expression during the transition period in dairy cattle[J]. J Dairy Scie, 2013, 96(2): 1102-1116. DOI:10.3168/jds.2012-5396 |
| [13] |
ZOM R L G, VAN BAAL J, GOSELINK R M A, et al. Effect of rumen-protected choline on performance, blood metabolites, and hepatic triacylglycerols of periparturient dairy cattle[J]. J Dairy Sci, 2011, 94(8): 4016-4027. DOI:10.3168/jds.2011-4233 |
| [14] |
PAUL ANGULO M D. Nonalcoholic fatty liver disease[J]. N Engl J Med, 2002, 346(16): 1221-1231. DOI:10.1056/NEJMra011775 |
| [15] |
OLIVEIRA C P M S, DA COSTA GAYOTTO L C, TATAI C, et al. Oxidative stress in the pathogenesis of nonalcoholic fatty liver disease, in rats fed with a choline-deficient diet[J]. J Cell Mol Med, 2002, 6(3): 399-406. DOI:10.1111/j.1582-4934.2002.tb00518.x |
| [16] |
SPENCER M D, HAMP T J, REID R W, et al. Association between composition of the human gastrointestinal microbiome and development of fatty liver with choline deficiency[J]. Gastroenterology, 2011, 140(3): 976-986. DOI:10.1053/j.gastro.2010.11.049 |
| [17] |
孙菲菲. 胆碱和蛋氨酸对奶牛围产期营养平衡和机体健康的影响及机制[D]. 杨凌: 西北农林科技大学, 2017. SUN F F. Choline and methionine regulate nutrient balance and health of transition dairy cows: responses and potential mechnisms[D]. Yangling: Northwest A&F University, 2017. (in Chinese) |
| [18] |
CARLSON L A. Nicotinic acid and other therapies for raising high-density lipoprotein[J]. Curr Opin Cardiol, 2006, 21(4): 336-344. DOI:10.1097/01.hco.0000231404.76930.e9 |
| [19] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [20] |
YUAN K, SHAVER R D, BERTICS S J, et al. Effect of rumen-protected niacin on lipid metabolism, oxidative stress, and performance of transition dairy cows[J]. J Dairy Sci, 2012, 95(5): 2673-2679. DOI:10.3168/jds.2011-5096 |
| [21] |
BOLLATTI J M, ZENOBI M G, ARTUSSO N A, et al. Effects of rumen-protected choline on the inflammatory and metabolic status and health of dairy cows during the transition period[J]. J Dairy Sci, 2020, 103(5): 4192-4205. DOI:10.3168/jds.2019-17294 |
| [22] |
赵术帆, 张晓明, 咸玉龙, 等. 过瘤胃保护烟酸对奶牛生产性能的影响及经济效益分析[J]. 中国奶牛, 2012(11): 10-15. ZHAO S F, ZHANG X M, XIAN Y L, et al. Effect of supplementing rumen protected niacin on milk performance of dairy cow and economic benefits analysis[J]. China Dairy Cattle, 2012(11): 10-15. DOI:10.3969/j.issn.1004-4264.2012.11.006 (in Chinese) |
| [23] |
POTTS S B, SCHOLTE C M, MOYES K M, et al. Production responses to rumen-protected choline and methionine supplemented during the periparturient period differ for primi- and multiparous cows[J]. J Dairy Sci, 2020, 103(7): 6070-6086. DOI:10.3168/jds.2019-17591 |
| [24] |
SUN W P, ZHAI M Z, LI D, et al. Comparison of the effects of nicotinic acid and nicotinamide degradation on plasma betaine and choline levels[J]. Clin Nutr, 2017, 36(4): 1136-1142. DOI:10.1016/j.clnu.2016.07.016 |
| [25] |
CARDOSO F C, KALSCHEUR K F, DRACKLEY J K. Symposium review: nutrition strategies for improved health, production, and fertility during the transition period[J]. J Dairy Sci, 2020, 103(6): 5684-5693. DOI:10.3168/jds.2019-17271 |
| [26] |
ÇOLAKOǦLU H E, YAZLIK M O, PEKCAN M, et al. Impact of prepartum body condition score loss on metabolic status during the transition period and subsequent fertility in brown Swiss dairy cows[J]. J Vet Res, 2019, 63(3): 375-382. DOI:10.2478/jvetres-2019-0039 |
| [27] |
ROMANI M, HOFER D C, KATSYUBA E, et al. Niacin: an old lipid drug in a new NAD+ dress[J]. J Lipid Res, 2019, 60(4): 741-746. DOI:10.1194/jlr.S092007 |
| [28] |
OSPINA P A, NYDAM D V, STOKOL T, et al. Associations of elevated nonesterified fatty acids and β-hydroxybutyrate concentrations with early lactation reproductive performance and milk production in transition dairy cattle in the northeastern United States[J]. J Dairy Sci, 2010, 93(4): 1596-1603. DOI:10.3168/jds.2009-2852 |
| [29] |
HRISTOVSKA T, CINCOVIĆ M, STOJANOVIĆ D, et al. Influence of niacin supplementation on the metabolic parameters and lipolysis in dairy cows during early lactation[J]. Kafkas Univ Vet Fak Derg, 2017, 23(5): 773-778. |
| [30] |
ZEITZ J O, WEBER A, MOST E, et al. Effects of supplementing rumen-protected niacin on fiber composition and metabolism of skeletal muscle in dairy cows during early lactation[J]. J Dairy Sci, 2018, 101(9): 8004-8020. DOI:10.3168/jds.2018-14490 |
| [31] |
ARAGONA K M, RICE E M, ENGSTROM M, et al. Supplementation of nicotinic acid to prepartum Holstein cows increases colostral immunoglobulin G, excretion of urinary purine derivatives, and feed efficiency in calves[J]. J Dairy Sci, 2020, 103(3): 2287-2302. DOI:10.3168/jds.2019-17058 |
| [32] |
PIRES J A A, PESCARA J B, GRUMMER R R. Reduction of plasma NEFA concentration by nicotinic acid enhances the response to insulin in feed-restricted Holstein cows[J]. J Dairy Sci, 2007, 90(10): 4635-4642. DOI:10.3168/jds.2007-0146 |
| [33] |
PESCARA J B, PIRES J A A, GRUMMER R R. Antilipolytic and lipolytic effects of administering free or ruminally protected nicotinic acid to feed-restricted Holstein cows[J]. J Dairy Sci, 2010, 93(11): 5385-5396. DOI:10.3168/jds.2010-3402 |
| [34] |
PIRES J A A, STUMPF L F, SOUTULLO I D, et al. Effects of abomasal infusion of nicotinic acid on responses to glucose and β-agonist challenges in underfed lactating cows[J]. J Dairy Sci, 2016, 99(3): 2297-2307. DOI:10.3168/jds.2015-10308 |
| [35] |
SHAHSAVARI A, D'OCCHIO M J, AL JASSIM R. The role of rumen-protected choline in hepatic function and performance of transition dairy cows[J]. Br J Nutr, 2016, 116(1): 35-44. DOI:10.1017/S0007114516001641 |
| [36] |
ARSHAD U, ZENOBI M G, STAPLES C R, et al. Meta-analysis of the effects of supplemental rumen-protected choline during the transition period on performance and health of parous dairy cows[J]. J Dairy Sci, 2020, 103(1): 282-300. DOI:10.3168/jds.2019-16842 |
| [37] |
ESPOSITO G, IRONS P C, WEBB E C, et al. Interactions between negative energy balance, metabolic diseases, uterine health and immune response in transition dairy cows[J]. Anim Reprod Sci, 2014, 144(3-4): 60-71. DOI:10.1016/j.anireprosci.2013.11.007 |
| [38] |
COOKE R F, SILVA DEL RíO N, CARAVIELLO D Z, et al. Supplemental choline for prevention and alleviation of fatty liver in dairy cattle[J]. J Dairy Sci, 2007, 90(5): 2413-2418. DOI:10.3168/jds.2006-028 |
| [39] |
HUMER E, BRUGGEMAN G, ZEBELI Q. A meta-analysis on the impact of the supplementation of rumen-protected choline on the metabolic health and performance of dairy cattle[J]. Animals (Basel), 2019, 9(8): 566. |
| [40] |
LEIVA T, COOKE R F, BRAND?O A P, et al. Effects of rumen-protected choline supplementation on metabolic and performance responses of transition dairy cows[J]. J Anim Sci, 2015, 93(4): 1896-1904. DOI:10.2527/jas.2014-8606 |
| [41] |
FURKEN C, HOEDEMAKER M. Influence of feeding rumen-protected choline to transition dairy cows.part 2:health and reproduction[J]. Tierarztl Prax Ausg G Grosstiere Nutztiere, 2014, 42(2): 79-87. DOI:10.1055/s-0038-1623213 |
| [42] |
VILLANUEVA C J, MONETTI M, SHIH M, et al. Specific role for acyl CoA: diacylglycerol acyltransferase 1 (Dgat1) in hepatic steatosis due to exogenous fatty acids[J]. Hepatology, 2009, 50(2): 434-442. DOI:10.1002/hep.22980 |
| [43] |
ZHANG L, LI H X, PAN W S, et al. Novel hepatoprotective role of Leonurine hydrochloride against experimental non-alcoholic steatohepatitis mediated via AMPK/SREBP1 signaling pathway[J]. Biomed Pharmacother, 2019, 110: 571-581. DOI:10.1016/j.biopha.2018.12.003 |
| [44] |
JIA H D, LI X B, LIU G W, et al. Perilipin 5 promotes hepatic steatosis in dairy cows through increasing lipid synthesis and decreasing very low density lipoprotein assembly[J]. J Dairy Sci, 2019, 102(1): 833-845. DOI:10.3168/jds.2018-15208 |
| [45] |
DONG J H, LOOR J J, ZUO R K, et al. Low abundance of mitofusin 2 in dairy cows with moderate fatty liver is associated with alterations in hepatic lipid metabolism[J]. J Dairy Sci, 2019, 102(8): 7536-7547. DOI:10.3168/jds.2019-16544 |
(编辑 范子娟)



