2. 美国华盛顿州立大学动物科学系,普尔曼 99164-6310
2. Department of Animal Sciences, Washington State University, Pullman WA 99164-6310, United States of America
驴肉是常见的肉类食品之一,不仅肉质鲜嫩,还富含许多优质的蛋白质。广灵驴是早期劳动人民多年精心培育的优质小型驴种,也是中国五大优良驴种之一[1-2]。近年来,广灵驴因肉质鲜嫩以及营养价值丰富逐渐受到人们的追捧。嫩度是衡量肉品质的感官指标之一,是肉食质量的决定性感官属性[3]。许多研究发现,消费者有意愿选购嫩度更好的肉食产品[4]。肉质的嫩度主要受到肌纤维特性、肌内结缔组织特性、肌原纤维蛋白水解酶特性以及肌内脂肪含量等相关因素的影响[5-6]。目前,评价肉质嫩度的方法主要是华纳-布拉茨勒剪切力(WBSF)和肌原纤维断裂指数(MFI)[7-8],此外,高光谱成像技术可能是进行肉质嫩度分类和可视化的潜在方法[9-10]。
转录组学是一种通过对基因表达情况和调控规律进行全面研究从而揭示复杂的生物学通路以及性状调控网络分子机制的学科。Fernandez-Barroso等[11]对不同嫩度伊比利亚猪进行RNA-Seq研究,鉴定出了200个差异表达基因和245个新异构体。Muniz等[12]利用RNA测序数据鉴定与肉牛嫩度相关的新mRNA亚型。代谢组学不仅提供了发现用于监测和评估食品质量的生物标志物的线索,而且还揭示了酶促反应产生关键代谢物的分子途径,已被广泛应用于肌肉和肉类科学的研究[13-14]。Muroya等[15]基于CE-TOF MS的代谢组学研究揭示了死后猪快慢型肌肉特有的代谢途径。Wang等[16]通过核磁共振氢谱(1HNMR)和多元数据分析研究了肉鸡胸肌木质化对代谢产物谱的影响,结果发现,组氨酸、β-丙氨酸、肌酸、肌酐等代谢物的水平显著低于正常组。目前,对畜禽动物肉质进行组学研究的报道多见于猪[17]、牛[18-19]、羊[20]和鸡[21]等动物,而尚未见以驴肉为材料进行肉质嫩度的研究。
由于单一的转录组分析获得的差异表达基因在代谢通路中作用于多种物质,不能直接判断引起代谢物质累积的强度,而代谢组学可以发现相关通路中代谢物种类和离子丰度的差异,对全面解析肉质嫩度相关代谢产物生物合成的调控机制具有非常重要的意义。因此,可以借助转录组与代谢组联合分析充分挖掘调控驴肉嫩度的基因与代谢物,从分子水平上解析驴肉嫩度的调控机制。本试验利用转录组以及代谢组测序技术研究不同肉质嫩度的广灵驴背最长肌组织并筛选出差异表达基因和差异代谢物,然后通过联合分析来揭示不同肉质嫩度的广灵驴个体的生物遗传机制,旨在为广灵驴肉质嫩度的分子改良和分子育种提供理论依据。
1 材料与方法 1.1 试验材料从山西省忻州市繁峙县田源毛驴养殖科技发展有限公司选择30头生长环境和饲养条件相同、33~36月龄的雌性广灵驴。于屠宰30 min内采集第12~13肋骨间的背最长肌组织,之后于液氮中冷藏备用。
1.2 主要仪器与试剂石油醚、TRIzol、甲醇、丙醇、甲酸和乙腈均为Merck级标准品。MAQC-12肌肉嫩度仪(南京铭奥仪器设备有限公司);索氏抽提器SXT-02(上海洪纪仪器设备有限公司);超高效液相色谱串联傅里叶变换质谱仪(Thermo公司);Illumina Novaseq 6000测序仪(Illumina公司)。
1.3 样品测定及筛选利用嫩度仪和索氏抽提仪检测广灵驴背最长肌的剪切力和肌内脂肪含量。对30头广灵驴剪切力和肌内脂肪含量进行综合分析,以“剪切力×0.7-肌内脂肪含量×100×0.3”为参考,筛选出剪切力和肌内脂肪含量存在显著差异的8头广灵驴,并将其分成高嫩度组(HT,n=4)和低嫩度组(LT,n=4)。
1.4 广灵驴背最长肌总RNA提取以及转录组测序使用TRIzol试剂从背最长肌组织中提取总RNA,然后利用Nanodrop 2000和Agilent 2100生物分析仪对总RNA的浓度、纯度以及RIN(RNA integrity number)值进行检测。取检验合格的总RNA样品构建cDNA文库并在Illumina Novaseq 6000平台上进行双端测序,测序工作由上海美吉生物医药科技有限公司完成。将原始数据过滤后得到高质量的质控数据,并与从NCBI数据库中下载的驴的基因组数据(GCF_001305755.1)进行比对,利用Trinity 2.8.4软件对reads序列进行组装拼接,利用定量指标TPM方法来计算基因表达水平。
1.5 代谢组样品处理及LC-MS检测取50 mg背最长肌组织样本于2 mL离心管中,加入400 μL提取液(甲醇∶水=4∶1(v∶v))进行代谢产物提取。样本经研磨、低温超声提取、静置、离心后移取上清液至进样瓶中上机分析。所有样品均采用LC-MS进行分析,每组样品有6个生物学重复。色谱条件:HSS T3色谱柱(100 mm×2.1 mm i.d., 1.8 μm);流动相(A为95%水+5%乙腈,B为47.5%乙腈+47.5%异丙醇+5%水,A、B相均含0.1%甲酸);柱温为40 ℃,进样量为2 μL。质谱条件:采用正、负离子两种模式采集质谱信号,电压为3 500 V和-2 800 V;鞘气40 psi,辅助加热气10 psi,离子源加热温度400 ℃,20~40~60 V循环碰撞能。
1.6 转录组、代谢组的数据分析及联合分析使用DESeq2[22]进行组间基因的差异分析,计算每个基因的差异表达倍数(Fold Change,FC),并以|log2Fold-Change|≥1且矫正后的P值(P-adjust) < 0.05为标准筛选差异表达基因。对差异表达基因进行KEGG富集分析[23],并以P-adjust < 0.05为判断标准。利用主成分分析(PCA)和正交最小偏二乘判别分析(OPLS-DA)来判定各样本间的差异大小。差异代谢物的选择基于变量权重值(VIP)和Student’s-t检验P值来确定,VIP≥1且P-adjust < 0.05的代谢物为显著差异代谢物。通过KEGG数据库进行的代谢通路注释,以P-adjust < 0.05为条件判断KEGG通路存在显著富集情况。利用KEGG数据库对差异表达基因与代谢物进行通路富集分析,利用R语言cor函数算出两者的斯皮尔曼(Spearman)系数,以相关系数大于0.8为筛选标准,之后用Cytoscape构建基因-代谢物网络图。
2 结果 2.1 广灵驴背最长肌剪切力和肌内脂肪含量的测定高嫩度组(HT,n=4)和低嫩度组(LT,n=4)的广灵驴肌内脂肪含量和剪切力值如表 1所示,LT组与HT组差异极显著(P < 0.000 1)。
|
|
表 1 广灵驴背最长肌剪切力和肌内脂肪含量的描述性统计 Table 1 Descriptive statistics of shear force and intramuscular fat content of Guangling donkey longissimus dorsi muscle |
与对照组(LT组)相比较,在HT组中共鉴定出1 253个差异表达基因,其中表达量发生上调(up)的基因共有832个,占差异基因总数的66.40%,表达量发生下调(down)的基因共有421个,占差异基因总数的33.60%(图 1)。对HT和LT两组中的差异表达基因进行了聚类分析,从图 2中可以看出,8个样本聚为两个类别,HT组中的样本HT1、HT3、HT2、HT4聚为一类,LT组的样本LT2、LT4、LT1、LT3聚为一类,这说明这些聚集基因可能具有相似的功能注释或者处于同一条代谢通路,且不同组间样本具有明显的表达差异。
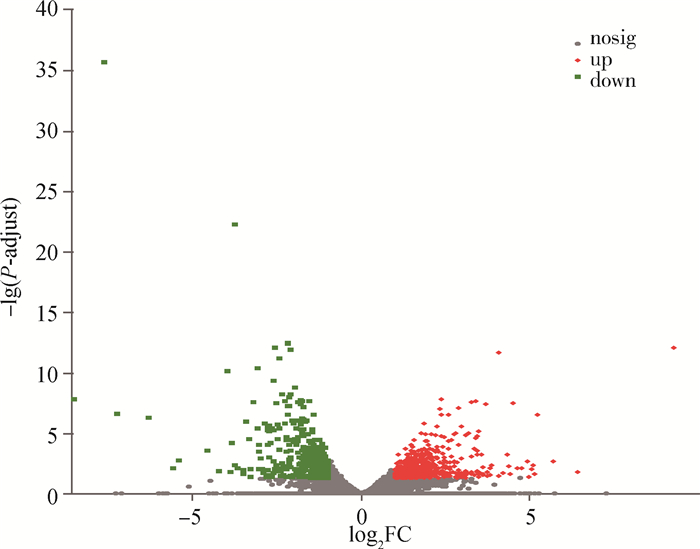
|
图 1 HT组和LT组的组间差异表达基因火山图 Fig. 1 Volcanic plots of differentially expressed genes between HT and LT groups |
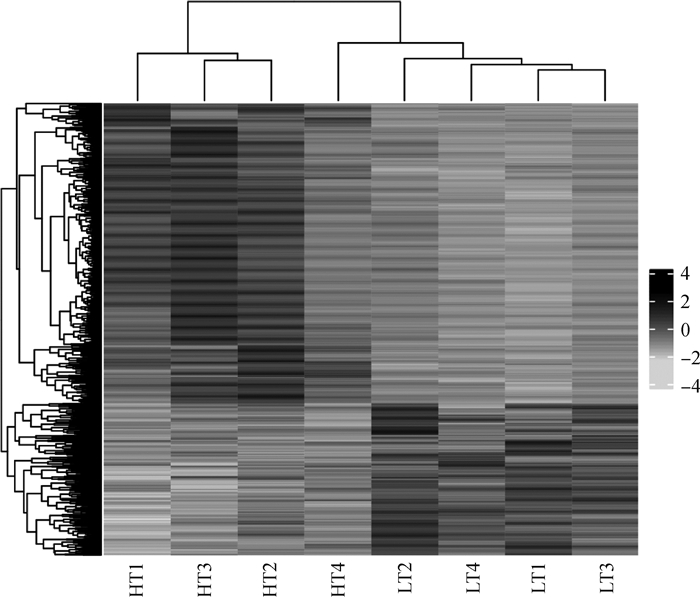
|
横坐标为样本,纵坐标为基因聚类 Abscissa is samples, ordinate is gene clustering 图 2 HT组和LT组的组间差异表达基因聚类热图 Fig. 2 Clustering heatmap of DEGs between HT and LT groups |
将1 253个差异基因进行KEGG富集分析,结果显示共富集到310个代谢途径,其中29个代谢途径显著富集(P < 0.05),选取显著富集的前25条KEGG代谢通路进行展示(图 3),其中AMPK信号通路、糖酵解/糖异生、胰高血糖素信号通路、黏附斑激酶信号通路、磷酸戊糖途径、果糖和甘露糖代谢、胰岛素抵抗、甘油酯代谢、甘油磷脂代谢、HIF-1信号通路以及胰岛素信号通路等多种通路可能影响广灵驴的肉质嫩度。

|
图 3 KEGG富集分析散点图 Fig. 3 KEGG pathway enrichment analysis scatter plot |
PCA分析结果发现(图 4),正、负离子模式中的组间样本被区分开,QC样本均能聚集在中心点附近,表明两组之间的代谢物存在差异,分析方法重复性较好。OPLS-DA分析表明(图 5),HT组和LT组在正、负离子模式下均有效地分成两类,表明各组间代谢物表型存在显著差异。为了避免过度拟合,本研究还进行了OPLS-DA模型验证(置换检验n=200),正、负两种离子模式下的R2与Q2截距分别达到0.928 7、-0.009 3和0.936、-0.117 7,说明两个模型具有较好稳定性且不存在过拟合现象。这些结果表明,材料具有足够的重现性,使其适合于以下分析验证。
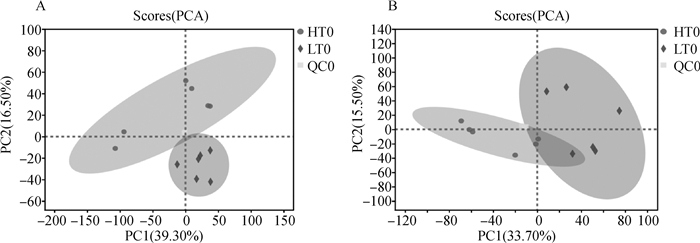
|
A. 正离子模式下样品PCA分析;B. 负离子模式下样品PCA分析 A. PCA analysis of samples in positive ion mode; B. PCA analysis of samples in negative ion mode 图 4 正、负离子模式下两组样品及质控的PCA结果 Fig. 4 PCA results of two groups of samples and quality control in positive and negative ion modes |
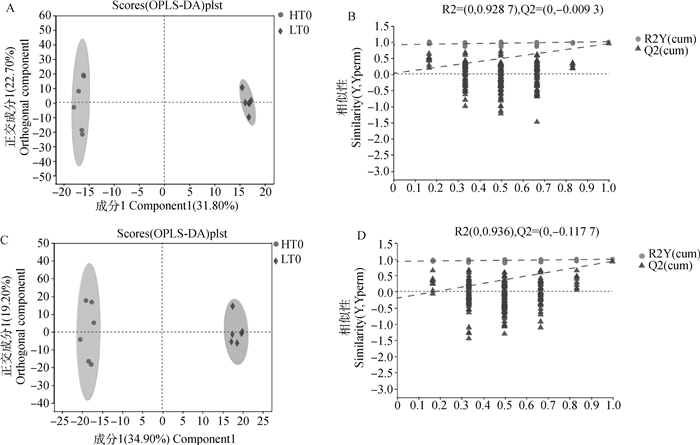
|
A. 正离子模式下样品的OPLS-DA模型得分图;B. 正离子模式下模型验证图;C. 负离子模式下样品的OPLS-DA模型得分图;D. 负离子模式下模型验证图 A. The OPLS-DA model score diagram of the sample in positive ion mode; B. Model verification diagram in positive ion mode; C. The OPLS-DA model score diagram of the sample in negative ion mode; D. Model verification diagram in negative ion mode 图 5 正、负离子模式下两组样品的OPLS-DA模型得分图与模型验证图 Fig. 5 OPLS-DA model score diagram and model verification diagram of two groups of samples in positive and negative ion modes |
在正、负两种离子模式下共检测出699种具有已知结构的代谢物。和LT组相比,HT组中筛选出225个差异代谢物,正离子模式下159个(图 6A),其中上调代谢物107个,下调代谢物52个;负离子模式下66个(图 6B),其中上调代谢物47个,下调代谢物19个。

|
A. 正离子模式下差异代谢物火山图;B. 负离子模式下差异代谢物火山图。散点大小表示OPLS-DA模型的VIP值,红色表示代谢物含量增加,蓝色表示代谢物含量降低,灰色表示无显著差异 A. Volcanic diagram of differential metabolites in positive ion mode; B. Volcanic diagram of differential metabolites in negative ion mode. The scatter size indicates the VIP value of OPLS-DA model, red indicates the increase of metabolite content, blue indicates the decrease of metabolite content, gray indicates no significant difference in metabolite content 图 6 正、负离子模式差异代谢物火山图 Fig. 6 The differential metabolites volcano map in positive and negative ion modes |
将差异代谢物富集到KEGG数据库,结果发现,共有111条通路得到富集,其中有20条KEGG代谢通路显著富集(P < 0.05,图 7)。在这些代谢通路中,嘌呤代谢,磷酸戊糖途径,组氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,甘油磷脂代谢,谷胱甘肽代谢,FoxO信号通路,D-谷氨酰胺与D-谷氨酸代谢,柠檬酸盐循环,精氨酸生物合成,丙氨酸、天冬氨酸和谷氨酸代谢等11个通路可能与广灵驴的肉质嫩度有关。
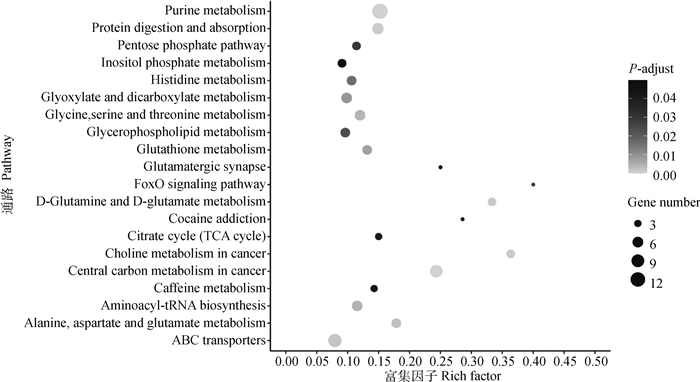
|
图 7 差异代谢物KEGG富集图 Fig. 7 KEGG enrichment map of differential metabolites |
为深入了解广灵驴肉质相关作用机制,本研究对相同分组的差异基因和代谢物进行KEGG联合分析。将HT组和LT组的差异代谢物与差异表达基因进行KEGG通路联合分析,结果发现共有57条共富集通路,有6条代谢通路(甘油磷脂代谢,丙氨酸、天冬氨酸和谷氨酸代谢,磷酸戊糖途径,精氨酸和脯氨酸代谢,胰高血糖素信号通路以及PPAR信号通路)在KEGG联合通路中富集(P < 0.1),并可能参与了广灵驴肉质嫩度的调控(表 2)。
|
|
表 2 转录组和代谢组联合KEGG富集分析部分通路 Table 2 Transcriptome and metabolome combined with KEGG enrichment analysis of some pathways |
对HT组和LT组差异表达基因和差异代谢物进行相关性分析,并通过相关性分析筛选KEGG通路中差异表达基因和差异代谢物。发现在甘油磷脂代谢,胰高血糖素信号通路,丙氨酸、天冬氨酸和谷氨酸代谢,磷酸戊糖途径,精氨酸和脯氨酸代谢中存在Spearman相关系数大于0.8的基因和代谢物,绘制相关性网络图并解释代谢物和基因之间的相互关系。甘油磷脂代谢通路中,上调代谢物胆碱、溶血磷脂酰胆碱(18:1(9Z))、溶血磷脂酰胆碱(17:0)、溶血磷脂酰胆碱(18:0)与上调基因GPAM的正相关性强;上调代谢物甘油磷酸胆碱与上调基因(GPAM、DGKE)的正相关性较强;上调代谢物甘油磷酰基乙醇胺与上调基因(PLA2G12A、DGKE、DGKH、GPAM)的正相关性强(图 8A)。在磷酸戊糖途径中,上调代谢物1-磷酸核糖与下调基因(PFKM、PGM1、GPI、LOC106841113、LOC106828083) 的负相关性较强;上调代谢物7-磷酸景天庚酮糖与下调基因(PFKM、PGM1、GPI)的负相关性强(图 8B)。在丙氨酸、天冬氨酸和谷氨酸代谢通路中,上调代谢物腺苷酸基琥珀酸和柠檬酸与上调基因RIMKLB和下调基因DDO有较强的相关性(图 8C)。在精氨酸和脯氨酸代谢通路中,下调代谢物肌酸与上调基因LOC106837908和下调基因GAMT的相关性强(图 8D)。在胰高血糖素信号通路中,上调代谢物柠檬酸与下调基因PRKAB2的负相关性强(图 8E)。
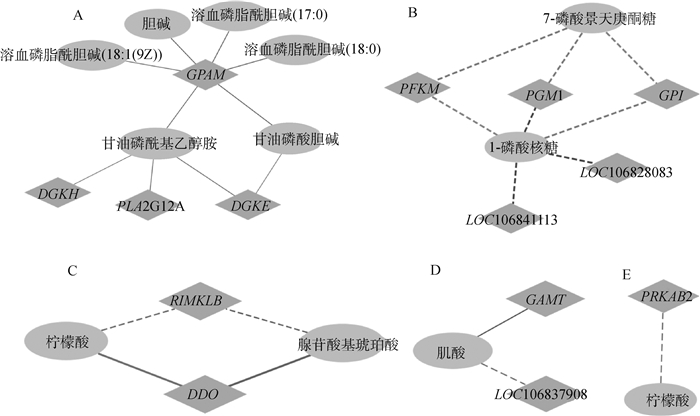
|
A. 甘油磷脂代谢;B. 磷酸戊糖途径;C. 丙氨酸、天冬氨酸和谷氨酸代谢;D. 精氨酸和脯氨酸代谢;E. 胰高血糖素信号通路。椭圆代表代谢物,菱形代表基因,实线表示正相关,虚线线表示负相关 A. Glycerophospholipid metabolism; B. Pentose phosphate pathway; C. Alanine, aspartate and glutamate metabolism; D. Arginine and proline metabolism; E. Glucagon signaling pathway. Ellipses represent metabolites, diamonds shape represent gene, solid lines represent positive correlation, and dotted lines represent negative correlation 图 8 共富集通路中差异表达基因和差异代谢物相关性网络图 Fig. 8 Correlation network map of differentially expressed genes and differential metabolites in co-enrichment pathway |
驴肉是常见的肉类食品之一,驴肉的品质和口感直接影响消费者的选择意愿,广灵驴作为山西地方品种,具有肉质鲜嫩、肌内脂肪含量高等特点。因此本试验以广灵驴为研究对象,对具有不同嫩度背最长肌的广灵驴进行了研究,找到了嫩度的相关差异表达基因,并通过结合差异代谢物进行联合分析,从转录和代谢水平共同探究调控广灵驴肉质嫩度的分子机制。
本试验对HT和LT两组进行了转录组分析,共发现有1 253个差异基因,其中发生上调的基因有832个,下调的基因有421个,KEGG通路涉及到碳水化合物代谢(糖酵解/糖异生、磷酸戊糖途径、果糖和甘露糖代谢),脂质代谢(甘油酯代谢、甘油磷脂代谢),内分泌系统(胰高血糖素信号通路、胰岛素信号通路、胰岛素抵抗),信号转导(HIF-1信号通路、AMPK信号通路)以及细胞过程(黏附斑激酶信号通路)等多种途径。代谢组分析发现,在HT组和LT组共筛选出225个差异代谢物,其中上调154个,下调71个。之后进行了KEGG富集分析,发现主要涉及到碳水化合物代谢(磷酸戊糖途径、柠檬酸循环),脂质代谢(甘油磷脂代谢),氨基酸代谢(组氨酸代谢、甘氨酸,丝氨酸和苏氨酸代谢、谷胱甘肽代谢、D-谷氨酰胺与D-谷氨酸代谢、精氨酸生物合成和丙氨酸,天冬氨酸和谷氨酸代谢),核苷酸代谢(嘌呤代谢)以及信号转导(FoxO信号通路)等多个途径。通过转录组和代谢组进行联合分析,发现富集到KEGG的共同通路有57条,其中甘油磷脂代谢,磷酸戊糖途径,丙氨酸、天冬氨酸和谷氨酸代谢,精氨酸和脯氨酸代谢以及胰高血糖素信号通路可能参与了广灵驴肉质嫩度的调控。
磷脂是肌内脂肪中主要的活性成分,而甘油磷脂是磷脂中含量最多的一种。甘油磷脂不仅能够参与生物体内细胞膜对蛋白质的识别和信号传导[24],还能活化细胞并促进脂肪代谢和血清胆固醇的降低等[25]。研究发现,胆碱类化合物是肉质嫩度的重要指标[17]。在甘油磷脂代谢通路中,胆碱、溶血磷脂酰胆碱(18:1(9Z))、溶血磷脂酰胆碱(17:0)、溶血磷脂酰胆碱(18:0)都与GPAM基因的正相关性强;代谢物甘油磷酸胆碱与GPAM和DGKE基因的正相关性较强;代谢物甘油磷酰基乙醇胺与PLA2G12A、DGKE、DGKH和GPAM基因的正相关性强。PLA2G12A基因在脂质催化过程和磷脂代谢过程中发挥了重要作用,并与肌内脂肪有一定的相关性,因此它可能有助于的脂肪沉积[26]。二甘油激酶(DGKs)能够将甘油二酯磷酸化并将其转化为磷脂酸,从而在细胞内发挥作用。作为DGKs的亚型,DGKE和DGKH基因在调节细胞内脂质代谢方面发挥了一定的作用从而对脂肪的沉积产生一定的影响[27-28]。而GPAM基因也在肌内脂肪的形成中起调控作用[29]。因此,甘油磷脂代谢通路中的相关基因可能通过参与磷脂代谢的相关过程来调控肌内脂肪的沉积,从而对肉质嫩度产生一定的影响。Hamill等[30]对猪肉嫩度和肌内脂肪含量相关基因进行了功能分析,发现与嫩度相关的差异基因显著富集在甘油磷脂代谢和磷酸戊糖途径中,与肌内脂肪相关的基因在磷酸戊糖途径中也得到显著富集,这与本研究结果相一致。
磷酸戊糖途径是葡萄糖代谢中的重要代谢途径,其中的NADPH可以参与生物大分子的合成,同时也可以使体内的氧化还原处于稳定状态,使得肌肉的抗氧化能力增强[31]。在磷酸戊糖途径中,1-磷酸核糖和7-磷酸景天庚酮糖分别与PFKM、PGM1、GPI、LOC106841113、LOC106828083基因以及PFKM、PGM1、GPI基因的负相关性强。PFKM是一个能够在糖酵解过程中进行调节的酶,也是葡萄糖代谢的主要控制点[32]。PGM1能够可逆地催化磷酸葡萄糖第1和第6位置间磷酸基的转移,在糖原代谢调节中起重要作用。有报道发现,PGM1可进行磷酸化、乙酰化和甲基化等翻译后修饰,翻译后修饰影响着新陈代谢和宰后肌肉肉质的转变[33],Silva等[34]利用蛋白质组学研究表明,包括PGM1在内的肌肉蛋白磷酸化可能是导致牛肉嫩度最终差异的原因。GPI是参与糖酵解的一种酶,能够促进葡萄糖-6-磷酸与果糖-6-磷酸的相互转换[35]。LOC106841113和LOC106828083两个基因都注释到果糖-1, 6-二磷酸酶基因(FBP)中,FBP是糖异生途径第二步反应的限速酶,在葡萄糖生成或糖原合成中发挥功能[36]。作为参与磷酸戊糖途径中的相关基因,PFKM、LOC106841113、LOC106828083、PGM1、GPI等基因可能参与肌肉能量代谢的调控,从而对肉质嫩度产生一定的影响。
肌肉中氨基酸含量不仅影响着蛋白质的营养价值,同时也影响着肉质嫩度和风味[37]。通常,氨基酸是动物死后早期肌肉的重要能量来源,因为它们都可以降解为柠檬酸盐循环的一部分或可以转换为该循环的一部分的中间化合物[38],从而改变动物死后早期能量状态的差异而影响蛋白水解并有利于肉的嫩化。在丙氨酸、天冬氨酸和谷氨酸代谢通路中,本研究发现代谢物腺苷酸基琥珀酸和柠檬酸与RIMKLB、DDO基因有较强的相关性。RIMKLB基因能够编码N-乙酰天冬氨酸谷氨酸合成酶I,并在HT组中上调。DDO是一种D-天冬氨酸氧化酶,是目前唯一能够降解双羧酸D-氨基酸的酶[39]。在此通路中,RIMKLB和DDO均与腺苷酸基琥珀酸和柠檬酸有一定的相关性,说明这两个基因可能参与了丙氨酸、天冬氨酸和谷氨酸代谢通路中的相关过程,并对肉质嫩度产生了一定的作用。在精氨酸和脯氨酸代谢通路中,代谢物肌酸与LOC106837908和GAMT基因的相关性强。肌肉中的肌酸主要以N-磷酸肌酸的形式存在,它是收缩肌肉纤维的主要能量来源[40],GAMT是肌酸生物合成最后一步的反应酶。Rosa等[41]比较了不同钙蛋白酶基因型内洛尔牛的肌肉蛋白质谱,发现GAMT基因与嫩度表型相关。另外,在胰高血糖素信号通路中,代谢物柠檬酸与PRKAB2基因的负相关性强。一磷酸腺苷活化蛋白激酶(AMPK)是一种能量稳态的主要调节器,在对外部应激反应的能量稳态控制中起着重要作用[42]。AMPK是由催化亚基α和两个调节亚基β和γ组成的异三聚丝氨酸/苏氨酸蛋白激酶,其中PRKAB2编码AMPKβ2亚基[43]。AMPK可以有效的促进肌肉对葡萄糖的吸收,保证骨骼肌中的糖原含量,骨骼肌代谢会影响肌肉结构与生物学特性,进一步改变肉质的嫩度[44]。在此通路中,柠檬酸与PRKAB2基因具有一定的相关性,并对肉质嫩度的调控具有一定的作用。
4 结论本研究通过转录组学和代谢组学对不同肉质嫩度的广灵驴的背最长肌进行研究,发现了精氨酸和脯氨酸代谢,甘油磷脂代谢,磷酸戊糖途径,丙氨酸、天冬氨酸和谷氨酸代谢以及胰高血糖素信号通路可能参与广灵驴不同肉质嫩度之间的调控,从而揭示了不同肉质嫩度的广灵驴的转录和代谢响应规律,涉及到PLA2G12A、DGKE、DGKH、GPAM、PFKM、PGM1、GPI、RIMKLB、DDO、GAMT等基因以及1-磷酸核糖、7-磷酸景天庚酮糖、甘油磷酸胆碱、溶血磷脂酰胆碱(18:1(9Z))、胆碱、溶血磷脂酰胆碱(17:0)、溶血磷脂酰胆碱(18:0)、甘油磷酰基乙醇胺、腺苷酸基琥珀酸、柠檬酸和肌酸等代谢物。该研究结果有助于解析具有不同背最长肌肌肉嫩度的广灵驴个体的遗传差异,为进一步研究广灵驴的分子育种提供了理论依据。
| [1] |
张旭, 乐宝玉, 成志敏, 等. 广灵驴成纤维细胞系的建立及其相关生物学特性研究[J]. 中国畜牧兽医, 2018, 45(3): 650-655. ZHANG X, LE B Y, CHENG Z M, et al. Establishment and biological characteristics analysis of fibroblast cell line of Guangling donkey[J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(3): 650-655. (in Chinese) |
| [2] |
闫俊峰. 广灵驴特性和生长规律[J]. 农业技术与装备, 2020(11): 165-166. YAN J F. Characteristics and growth law of Guangling donkey[J]. Agricultural Technology & Equipment, 2020(11): 165-166. DOI:10.3969/j.issn.1673-887X.2020.11.078 (in Chinese) |
| [3] |
BOUDON S, OUNAISSI D, VIALA D, et al. Label free shotgun proteomics for the identification of protein biomarkers for beef tenderness in muscle and plasma of heifers[J]. J Proteomics, 2020, 217: 103685. DOI:10.1016/j.jprot.2020.103685 |
| [4] |
侯旭, 张一敏, 毛衍伟, 等. 宰后盆骨吊挂方式及成熟时间对黄牛牛肉品质的影响[J]. 农业工程学报, 2014, 30(8): 251-256. HOU X, ZHANG Y M, MAO Y W, et al. Effect of pelvic suspension and aging time on meat quality of Chinese yellow cattle[J]. Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(8): 251-256. DOI:10.3969/j.issn.1002-6819.2014.08.029 (in Chinese) |
| [5] |
郝婉名, 祝超智, 赵改名, 等. 肌肉嫩度的影响因素及pH调节牛肉嫩化技术研究进展[J]. 食品工业科技, 2019, 40(24): 349-354. HAO W M, ZHU C Z, ZHAO G M, et al. Research progress on the influence factors of the tenderness of the muscle and the technology of adjusting the tenderization of the beef[J]. Science and Technology of Food Industry, 2019, 40(24): 349-354. (in Chinese) |
| [6] |
MARINO R, DELLA MALVA A, ALBENZIO M. Proteolytic changes of myofibrillar proteins in Podolian meat during aging: focusing on tenderness[J]. J Anim Sci, 2015, 93(3): 1376-1387. DOI:10.2527/jas.2014-8351 |
| [7] |
MUNIZ M M M, FONSECA L F S, MAGALHÃES A F B, et al. Use of gene expression profile to identify potentially relevant transcripts to myofibrillar fragmentation index trait[J]. Funct Integr Genomics, 2020, 20(4): 609-619. DOI:10.1007/s10142-020-00738-9 |
| [8] |
HE F Y, KIM H W, HWANG K E, et al. Effect of ginger extract and citric acid on the tenderness of duck breast muscles[J]. Korean J Food Sci Anim Resour, 2015, 35(6): 721-730. DOI:10.5851/kosfa.2015.35.6.721 |
| [9] |
JIANG H Z, YOON S C, ZHUANG H, et al. Tenderness classification of fresh broiler breast fillets using visible and near-infrared hyperspectral imaging[J]. Meat Sci, 2018, 139: 82-90. DOI:10.1016/j.meatsci.2018.01.013 |
| [10] |
FALKOVSKAYA A, GOWEN A. Literature review: spectral imaging applied to poultry products[J]. Poult Sci, 2020, 99(7): 3709-3722. DOI:10.1016/j.psj.2020.04.013 |
| [11] |
FERNANDEZ-BARROSO M A, CARABALLO C, SILIÓ L, et al. Differences in the loin tenderness of Iberian pigs explained through dissimilarities in their transcriptome expression profile[J]. Animals (Basel), 2020, 10(9): 1715. |
| [12] |
MUNIZ M M M, FONSECA L F S, DOS SANTOS SILVA D B, et al. Identification of novel mRNA isoforms associated with meat tenderness using RNA sequencing data in beef cattle[J]. Meat Sci, 2021, 173: 108378. DOI:10.1016/j.meatsci.2020.108378 |
| [13] |
MUROYA S, UEDA S, KOMATSU T, et al. MEATabolomics: muscle and meat metabolomics in domestic animals[J]. Metabolites, 2020, 10(5): 188. DOI:10.3390/metabo10050188 |
| [14] |
ZHU C L, PETRACCI M, LI C, et al. An untargeted metabolomics investigation of Jiulong yak (Bos grunniens) meat by 1H-NMR[J]. Foods, 2020, 9(4): 481. DOI:10.3390/foods9040481 |
| [15] |
MUROYA S, OE M, NAKAJIMA I, et al. CE-TOF MS-based metabolomic profiling revealed characteristic metabolic pathways in postmortem porcine fast and slow type muscles[J]. Meat Sci, 2014, 98(4): 726-735. DOI:10.1016/j.meatsci.2014.07.018 |
| [16] |
WANG Y, YANG Y, PAN D D, et al. Metabolite profile based on 1H NMR of broiler chicken breasts affected by wooden breast myodegeneration[J]. Food Chem, 2020, 310: 125852. DOI:10.1016/j.foodchem.2019.125852 |
| [17] |
熊火, 蔡欣, 刘静波, 等. 高脂饲粮对生长育肥猪肉品质和骨骼肌蛋白质组的影响[J]. 畜牧兽医学报, 2016, 47(10): 2052-2059. XIONG H, CAI X, LIU J B, et al. Effects of high-fat diet on meat quality traits and skeletal muscle proteome of growing-finishing pigs[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(10): 2052-2059. DOI:10.11843/j.issn.0366-6964.2016.10.014 (in Chinese) |
| [18] |
JEONG J Y, KIM M, JI S Y, et al. Metabolomics analysis of the beef samples with different meat qualities and tastes[J]. Food Sci Anim Resour, 2020, 40(6): 924-937. DOI:10.5851/kosfa.2020.e59 |
| [19] |
GONÇALVES T M, DE ALMEIDA REGITANO L C, KOLTES J E, et al. Gene co-expression analysis indicates potential pathways and regulators of beef tenderness in Nellore cattle[J]. Front Genet, 2018, 9: 441. DOI:10.3389/fgene.2018.00441 |
| [20] |
ARORA R, NAVEEN K S, SUDARSHAN S, et al. Transcriptome profiling of longissimus thoracis muscles identifies highly connected differentially expressed genes in meat type sheep of India[J]. PLoS One, 2019, 14(6): e217461. |
| [21] |
PIÓRKOWSKA K, UKOWSKI K, NOWAK J, et al. Genome-wide RNA-Seq analysis of breast muscles of two broiler chicken groups differing in shear force[J]. Anim Genet, 2016, 47(1): 68-80. DOI:10.1111/age.12388 |
| [22] |
LOVE M I, HUBER W, ANDERS S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2[J]. Genome Biol, 2014, 15(12): 550. DOI:10.1186/s13059-014-0550-8 |
| [23] |
XIE C, MAO X Z, HUANG J J, et al. KOBAS 2.0:a web server for annotation and identification of enriched pathways and diseases[J]. Nucleic Acids Res, 2011, 39(S2): W316-W322. |
| [24] |
马会芳. 基于质谱技术的甘油磷脂和甘油三酯高效分析方法及其应用研究[D]. 北京: 中国农业科学院, 2018. MA H F. High performance analysis of phospholipids and triglycerides based on mass spectrometry and its application[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. (in Chinese) |
| [25] |
YE J J, BIAN X, LIM J, et al. Adiponectin and related C1q/TNF-related proteins bind selectively to anionic phospholipids and sphingolipids[J]. Proc Natl Acad Sci U S A, 2020, 117(29): 17381-17388. DOI:10.1073/pnas.1922270117 |
| [26] |
PUIG-OLIVERAS A, REVILLA M, CASTELLÓ A, et al. Expression-based GWAS identifies variants, gene interactions and key regulators affecting intramuscular fatty acid content and composition in porcine meat[J]. Sci Rep, 2016, 6: 31803. DOI:10.1038/srep31803 |
| [27] |
MANNERÅS-HOLM L, KIRCHNER H, BJÖRNHOLM M, et al. mRNA expression of diacylglycerol kinase isoforms in insulin-sensitive tissues: effects of obesity and insulin resistance[J]. Physiol Rep, 2015, 3(4): e12372. DOI:10.14814/phy2.12372 |
| [28] |
MANNERÅS-HOLM L, SCHÖNKE M, BROZINICK J T, et al. Diacylglycerol kinase ε deficiency preserves glucose tolerance and modulates lipid metabolism in obese mice[J]. J Lipid Res, 2017, 58(5): 907-915. DOI:10.1194/jlr.M074443 |
| [29] |
YU H B, ZHAO Z H, YU X Z, et al. Bovine lipid metabolism related gene GPAM: Molecular characterization, function identification, and association analysis with fat deposition traits[J]. Gene, 2017, 609: 9-18. DOI:10.1016/j.gene.2017.01.031 |
| [30] |
HAMILL R M, MCBRYAN J, MCGEE C, et al. Functional analysis of muscle gene expression profiles associated with tenderness and intramuscular fat content in pork[J]. Meat Sci, 2012, 92(4): 440-450. DOI:10.1016/j.meatsci.2012.05.007 |
| [31] |
蔡洪容. 肿瘤细胞中磷酸戊糖途径概述[J]. 临床医药文献电子杂志, 2020, 7(13): 183. CAI H R. Overview of the pentose phosphate pathway in tumor cells[J]. Journal of Clinical Medical Literature, 2020, 7(13): 183. (in Chinese) |
| [32] |
王坤, 豆腾飞, 徐志强, 等. 大围山微型鸡和艾维茵肉鸡PFKM基因表达量与pH值及肌糖原含量相关性研究[J]. 中国家禽, 2018, 40(14): 10-13. WANG K, DOU T F, XU Z Q, et al. Correlation analysis on PFKM gene expression, pH value, muscle glycogen content in Daweishan mini chicken and Avian broiler[J]. China Poultry, 2018, 40(14): 10-13. (in Chinese) |
| [33] |
JIANG S W, LIU Y S, SHEN Z L, et al. Acetylome profiling reveals extensive involvement of lysine acetylation in the conversion of muscle to meat[J]. J Proteomics, 2019, 205: 103412. DOI:10.1016/j.jprot.2019.103412 |
| [34] |
SILVA L H P, RODRIGUES R T S, ASSIS D E F, et al. Explaining meat quality of bulls and steers by differential proteome and phosphoproteome analysis of skeletal muscle[J]. J Proteomics, 2019, 199: 51-66. DOI:10.1016/j.jprot.2019.03.004 |
| [35] |
KWAK S E, SHIN H E, ZHANG D D, et al. Potential role of exercise-induced glucose-6-phosphate isomerase in skeletal muscle function[J]. J Exerc Nutrition Biochem, 2019, 23(2): 28-33. DOI:10.20463/jenb.2019.0014 |
| [36] |
李清平, 张秀飞, 梁明, 等. 果糖1, 6-二磷酸酯酶研究进展[J]. 聊城大学学报: 自然科学版, 2021, 34(2): 73-80. LI Q P, ZHANG X F, LIANG M, et al. Research progress of fructose-1, 6-bisphosphatase[J]. Journal of Liaocheng University: Natural Science Edition, 2021, 34(2): 73-80. (in Chinese) |
| [37] |
巨晓军, 束婧婷, 章明, 等. 不同品种、饲养周期肉鸡肉品质和风味的比较分析[J]. 动物营养学报, 2018, 30(6): 2421-2430. JU X J, SHU J T, ZHANG M, et al. Comparison analysis of meat quality and flavor of different breeds and feeding periods of broilers[J]. Chinese Journal of Animal Nutrition, 2018, 30(6): 2421-2430. DOI:10.3969/j.issn.1006-267x.2018.06.048 (in Chinese) |
| [38] |
KAMEI Y, HATAZAWA Y, UCHITOMI R, et al. Regulation of skeletal muscle function by amino acids[J]. Nutrients, 2020, 12(1): 261. DOI:10.3390/nu12010261 |
| [39] |
KATANE M, MATSUDA S, SAITOH Y, et al. Glyoxylate reductase/hydroxypyruvate reductase regulates the free D-aspartate level in mammalian cells[J]. J Cell Biochem, 2021, 122(11): 1639-1652. DOI:10.1002/jcb.30110 |
| [40] |
KAZAK L, COHEN P. Creatine metabolism: energy homeostasis, immunity and cancer biology[J]. Nat Rev Endocrinol, 2020, 16(8): 421-436. DOI:10.1038/s41574-020-0365-5 |
| [41] |
ROSA A F, MONCAU C T, POLETI M D, et al. Proteome changes of beef in Nellore cattle with different genotypes for tenderness[J]. Meat Sci, 2018, 138: 1-9. DOI:10.1016/j.meatsci.2017.12.006 |
| [42] |
KIM J, YANG G, KIM Y, et al. AMPK activators: mechanisms of action and physiological activities[J]. Exp Mol Med, 2016, 48(4): e224. DOI:10.1038/emm.2016.16 |
| [43] |
HERZIG S, SHAW R J. AMPK: guardian of metabolism and mitochondrial homeostasis[J]. Nat Rev Mol Cell Biol, 2018, 19(2): 121-135. DOI:10.1038/nrm.2017.95 |
| [44] |
梁鹏, 邵顺成, 张稳, 等. PRKAG3基因与畜禽肉质性状相关性的研究进展[J]. 黑龙江畜牧兽医, 2021(3): 45-49, 53. LIANG P, SHAO S C, ZHANG W, et al. Research progress on the correlation between PRKAG3 gene and meat quality of livestock and poultry[J]. Heilongjiang Animal Science and Veterinary Medicine, 2021(3): 45-49, 53. (in Chinese) |
(编辑 郭云雁)



