2. 扬州大学 教育部农业与农产品安全国际合作联合实验室,扬州 225009
2. Joint International Research Laboratory of Agriculture & Agri-Product Safety, Yangzhou University, Yangzhou 225009, China
m6A广泛存在于各种真核生物mRNA和非编码RNA中,m6A修饰可以功能性地调节真核生物的基因转录表达,从mRNA在细胞核中的加工到在细胞质的翻译和降解,m6A几乎影响到了动物mRNA代谢的每个阶段[1-2]。此外,m6A参与了多种生物学过程,如干细胞分化、细胞分裂、配子发生和生物节律等,以及多种疾病的发生,包括肿瘤、肥胖和不育等[3]。研究发现,m6A甲基化修饰在病毒复制周期中扮演不同角色,在病毒的侵染复制过程中具有重要调控作用[4],同时m6A在免疫系统及其在宿主病原体相互作用中也发挥作用[5]。相比于人和小鼠,畜禽m6A对重要性状的调控作用及其机制研究还不够深入,关于猪m6A甲基化修饰的研究主要集中在脂肪沉积[6-7]、脂质代谢[8]、卵巢颗粒细胞发育[9]、多功能干细胞分化[10]和肝发育[11]等方面,由此表明,m6A甲基化修饰正在成为目前畜禽遗传领域RNA表观遗传学研究的一个新方向。
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)又称呕吐毒素,是镰刀菌的代谢产物之一,是目前农产品及饲料中污染率和超标率最高的一种霉菌毒素[12-13]。DON易于在人和动物体内传播,主要改变肠道营养吸收、屏障功能和免疫应答,诱导肠道病变[14-15]。肠道是猪机体抵御呕吐毒素侵害的第一道屏障,霉菌毒素可以直接通过激活细胞信号通路影响肠道黏蛋白的表达,还可以破坏黏液层及紧密连接,有利于病原菌等有害物质入侵,激活细胞信号通路或间接影响细胞因子的水平[16]。在涉及到猪肠上皮细胞系(IPEC-J2)的研究中表明,当IPEC-J2细胞受到DON的诱导会导致氧化应激和炎症反应,最终会加速细胞的凋亡并使其功能受损[17-18]。然而,迄今为止关于DON诱导的IPEC-J2细胞中的m6A发生变化的研究相对较少。研究发现,METTL3介导m6A修饰在免疫细胞的分化和功能分工上扮演着非常重要的角色,敲除METTL3基因会抑制CD4+T细胞分化,进而引起小鼠肠炎[19];METTL3通过激活NF-κВ信号通路促进LPS刺激的巨噬细胞活化和炎症反应[20]。
本研究在课题组前期构建的呕吐毒素感染猪小肠上皮(IPEC-J2)细胞研究模型(终浓度为1 μg·mL-1,作用时间48 h)基础上,探究猪m6A甲基化酶METTL3基因表达水平变化与DON诱导猪小肠上皮细胞损伤的相关性,以期为今后开展METTL3基因功能及其在抵抗DON损伤的育种工作中应用提供参考依据,为今后细致研究RNA甲基化修饰在仔猪抵抗脱氧雪腐镰刀菌烯醇损害调控中的作用机制提供理论基础。
1 材料与方法 1.1 试验样品及材料猪肠上皮细胞系(IPEC-J2)由本实验室保存;人肾上皮细胞系293T购自广州吉妮欧生物科技有限公司;脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)购自美国Sigma公司;DMEM培养基及胎牛血清(FBS)购自Gibco公司;动物RNA抽提试剂盒(离心柱式)及细胞周期检测试剂盒均购自上海碧云天生物技术有限公司;反转录试剂盒、SYBR荧光定量试剂盒及细胞增殖检测试剂均购自南京诺唯赞生物科技有限公司;ANNEXIN V-FITC/PI细胞凋亡检测试剂盒及活性氧检测试剂盒均购自北京索莱宝科技有限公司;甲基化转移酶METTL3基因干扰siRNA及慢病毒均购自苏州吉玛基因股份有限公司。
1.2 猪肠上皮细胞系IPEC-J2及人肾上皮细胞系293T细胞培养将IPEC-J2细胞和人肾上皮细胞系293T细胞以1×106个·孔-1的密度接种于6孔板内;使用DMEM培养基、10%胎牛血清(FBS)和1%抗生素(10 kU·mL-1青霉素、10 mg·mL-1链霉素)组成的完全培养液,将细胞放置在恒温培养箱(37 ℃,50 mL·L-1 CO2)进行培养。
1.3 siRNA瞬转及干扰效率鉴定IPEC-J2以5×104个·孔-1的密度接种到12孔板中,待融合度达到60%左右进行细胞转染。每孔的转染体系:向100 μL jetPRIME Buffer加入2 μL siRNA和3 μL jetPRIME reagent,轻轻吹打混匀,室温孵育15 min。将转染混合物加入孔中,每组3个重复。24 h后提取细胞RNA检测METTL3 mRNA表达。
1.4 慢病毒包装干扰载体293T细胞接种到15 cm培养皿中至细胞融合度60%左右,挑选上述干扰效率最高的siRNA序列,利用Gateway重组技术将干扰载体克隆到慢病毒载体上。将重组慢病毒载体和包装质粒(pGag/Pol、pRev、pVSV-G)共转染293T细胞,72 h后收集细胞上清液,4 ℃ 4 000 r·min-1离心5 min后过滤上清,4 ℃ 20 000 r·min-1离心2 h浓缩病毒液。
1.5 慢病毒滴度检测293T细胞以3×104个·孔-1的密度接种到96孔板中培养24 h。用DMEM完全培养基将10 μL慢病毒原液10倍稀释4个梯度(10-1、10-2、10-3、10-4),再将100 μL稀释液和0.5 μg Polybrene加入96孔板的孔中,每组3个重复。孵育24 h后更换新鲜DMEM完全培养基继续培养72 h。通过FACS计数荧光细胞,结合稀释倍数计算病毒滴度。
1.6 慢病毒侵染IPEC-J2细胞及干扰效果鉴定IPEC-J2以5×104个·孔-1的密度接种到12孔板中,待融合度达到60%左右进行慢病毒侵染。加入5 μL 1×108 TU·mL-1的慢病毒和5 μg Polybrene,同时设置阴性对照和空白对照组,每组3个重复,混匀后孵育48 h。在荧光显微镜下观察细胞荧光,每孔加入5 μg嘌呤筛选阳性细胞,直至无荧光细胞全部死亡。将阳性细胞消化传代,扩大培养。收集细胞提取RNA和蛋白,检测METTL3表达情况。
1.7 引物设计与合成根据NCBI(http://www.NCBI.Nlm.nih.govn/)数据库中猪TNF-α、Bax、Caspase3、Caspase9、GPXs、CAT、Mn-SOD、CuZn-SOD、IL-6、IL-12、β-actin等基因序列,为防止基因组DNA污染,使用Primer Premier 5.0设计跨外显子的实时荧光定量PCR引物(表 1),引物均由擎科生物科技(北京)有限公司合成。
|
|
表 1 实时荧光定量PCR引物 Table 1 Real-time PCR primers |
利用动物RNA抽提试剂盒(离心柱式)对处理过的每孔细胞的RNA进行抽提,并利用2.0%琼脂糖凝胶电泳及利用NanoDrop 1000核酸/蛋白浓度测定仪对抽提的RNA进行浓度和纯度测定后,在达到所规定要求后(A260/A280的比值在1.7~2.1之间)-80 ℃保存,将每个抽提出的RNA作为模板按反转录试剂盒说明书合成cDNA。反转录体系为10 μL:5×qRT SuperMix Ⅱ 2 μL,模板RNA 500 ng,RNase-free ddH2O补足至10 μL。反应程序:25 ℃ 10 min,50 ℃ 30 min,85 ℃ 5 min,4 ℃保存。
实时荧光定量PCR反应体系为20 μL:模板cDNA 2.0 μL,上、下游引物(10 μmol·L-1)各0.4 μL,50×ROX Reference Dye Ⅱ 0.4 μL, 2×Ace TM qPCR SYBR Green Master Mix 10 μL,ddH2O 6.8 μL。PCR反应程序:95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,40个循环,扩增结束后进行扩增熔解曲线并分析,熔解曲线程序:95 ℃ 15 s;60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。每个样本设置3个重复。
1.9 细胞活力测定收集转染后的IPEC-J2细胞(METTL3干扰组和对照组),以500个·μL-1的细胞密度接种200 μL含有DON的细胞液于96孔板中,在细胞培养箱中培养48 h后按照CCK8操作说明书进行操作,每孔加入10 μL CCK8溶液,然后37 ℃培养2 h,利用酶标仪检测450 nm处吸光度(A)值。
1.10 细胞周期检测待六孔板中转染后的IPEC-J2细胞(METTL3干扰组和对照组各3个重复)密度达到80%,加入含DON的DMEM完全培养液避光放置在细胞培养箱中48 h后按照试剂盒说明书进行细胞周期检测。用不含EDTA的胰酶消化细胞并收集到离心管中备用,1 000 r·min-1离心5 min后弃上清,用1 mL预冷PBS重悬细胞1 000 r·min-1离心5 min后弃上清,用1 mL预冷70%乙醇吹打混匀放置4 ℃过夜固定。1 000 r·min-1离心5 min后弃上清,用1 mL预冷PBS重悬细胞再次离心弃上清。每管加入0.5 mL碘化丙啶染色液,缓慢并充分悬浮细胞沉淀,37 ℃避光温浴30 min。使用标准程序用流式细胞仪进行检测,计数1万个细胞,结果用FlowJo 10.0分析细胞周期。
1.11 细胞凋亡检测待六孔板中转染后的IPEC-J2细胞(METTL3干扰组和对照组各3个重复)密度达到80%,加入含DON的DMEM完全培养液避光放置在细胞培养箱中48 h后按照试剂盒说明书进行细胞凋亡检测。用不含EDTA的胰酶消化细胞并收集到离心管中备用,300×g离心10 min后弃上清。用1 mL预冷PBS重悬细胞,300 r·min-1离心10 min后弃上清。用1 mL Binding Buffer重悬细胞,300 r·min-1离心10 min后弃上清。用100 μL Binding Buffer重悬细胞后加入5 μL Annexin V-FITC室温避光孵育10 min。加入5 μL PI室温避光孵育5 min,加入400 μL PBS轻吹混匀后按标准程序使用流式细胞仪进行检测,计数1万个细胞,结果用CytExpert分析细胞凋亡。
1.12 活性氧(ROS)检测待六孔板中转染后的IPEC-J2细胞(METTL3干扰组和对照组各3个重复)密度达到80%,加入含DON的DMEM完全培养液避光放置在细胞培养箱中48 h后按照试剂盒说明书进行试剂制备和ROS检测。用不含EDTA的胰酶消化细胞,使用含DCFH-DA的DMEM培养液(DCFH-DA∶DMEM培养液为1∶1 000)终止消化并收集到离心管中,放入细胞培养箱避光孵育20 min,每隔5 min颠倒混匀。用1 mL DMEM培养液洗涤细胞3次,每次以300 r·min-1离心10 min后弃上清。最后用500 μL PBS重悬细胞后按标准程序使用流式细胞仪进行检测,计数1万个细胞,结果用CytExpert分析ROS。
1.13 数据统计分析采用SPSS 20.0软件分析实时荧光定量PCR结果,使用2-ΔΔCt对相关基因在细胞水平的实际表达量进行计算,用单因素方差分析及T-TEST计算差异是否达到显著水平,分别以P < 0.05、P < 0.01作为差异显著与极显著的判断标准。采用Flow J 10.0分析细胞周期结果,CytExpert分析细胞凋亡及活性氧水平结果,使用Excel软件记录细胞凋亡数目及ROS水平,用T-TEST判断显著性。柱状图统一使用Graphpad prism 8.0.2软件进行绘图。
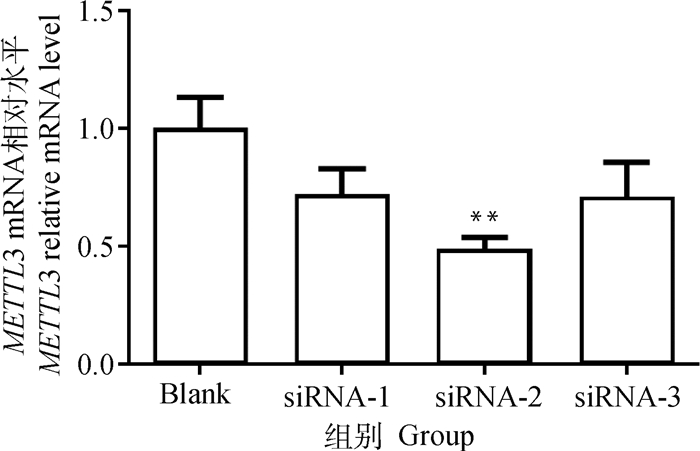
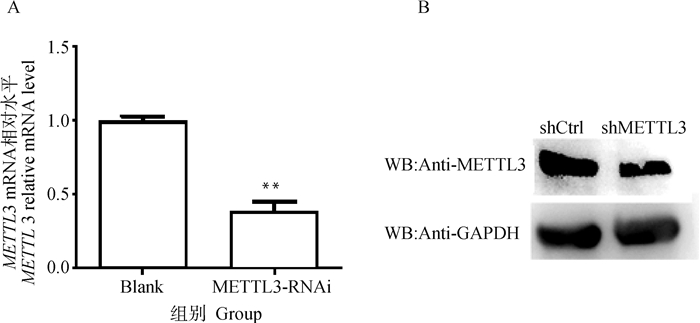
2 结果 2.1 METTL3基因稳定干扰IPEC-J2细胞系的建立通过设计3对siRNA干扰序列转染IPEC-J2细胞,通过qPCR检测METTL3的转录水平。如图 1所示,siRNA-2的干扰效率最高,为62.5%,METTL3的表达极显著下调(P < 0.01)。因此选择siRNA-2用慢病毒包装。将重组干扰慢病毒载体和包装质粒共转染293T细胞,培养24 h后细胞表达绿色荧光,说明慢病毒包装成功,收集浓缩病毒液并进行滴度测定。如图 2所示,分别加入稀释10-1、10-2、10-3、10-4倍的病毒浓缩液,均可观察到表达绿色荧光蛋白的细胞,且荧光细胞数量随着稀释倍数的增加而梯度减少。根据稀释10-4倍病毒浓缩液处理孔中观察到的荧光细胞计算病毒滴度为2×108 TU·mL-1,满足侵染细胞的浓度要求。慢病毒侵染IPEC-J2细胞,加入嘌呤药筛获得表达绿色荧光的shMETTL3及对照组细胞。通过qPCR和Western blot试验检测细胞METTL3的mRNA和蛋白表达水平,发现METTL3的转录水平和蛋白水平均极显著低于阴性对照组,结果表明, METTL3稳定干扰IPEC-J2细胞系构建成功(图 3)。
|
METTL3干扰组与对照组相比,*表示差异显著(P < 0.05),**表示差异极显著(P < 0.01),下同 METTL3 interference group compared with control group, * means significant difference (P < 0.05), ** means extremely significant difference (P < 0.01), the same as below 图 1 siRNA对METTL3基因的干扰效率 Fig. 1 The interference efficiency of siRNA to METTL3 gene |

|
图 2 人肾上皮细胞系293T慢病毒滴度检测(24 h,40×) Fig. 2 Detection of lentiviral titer in 293T(24 h, 40×) |
|
A.猪肠上皮细胞METTL3干扰细胞系中METTL3基因的mRNA水平检测;B猪肠上皮细胞METTL3干扰细胞系中METTL3的蛋白水平检测 A. The detection of METTL3 gene mRNA expression level in IPEC-J2 with METTL3 interference; B. The detection of METTL3 protein expression level in IPEC-J2 with METTL3 interference 图 3 猪肠上皮细胞中METTL3的干扰效率检测 Fig. 3 The detection of interference efficiency of METTL3 in IPEC-J2 |
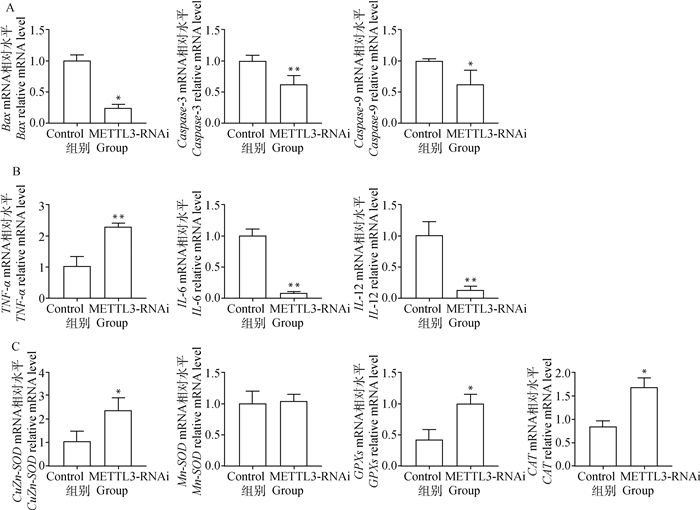
为了确定细胞水平DON诱导后,METLL3表达量与细胞凋亡、免疫和氧化酶指标的关系,利用实时荧光定量PCR对DON诱导处理之后的METTL3基因干扰组和对照组的IPEC-J2细胞中细胞凋亡相关基因、免疫相关基因及氧化酶指标相关基因基因进行表达水平检测。结果显示,凋亡相关的基因Bax和Caspase9在METTL3基因干扰组IPEC-J2细胞的表达量显著低于对照组(P < 0.05),Caspase3在METTL3基因干扰组IPEC-J2细胞中的表达水平则极显著低于对照组(P < 0.01,图 4A);如图 4B所示,干扰组细胞中TNF-α表达量极显著高于对照组,而IL-6、IL-12的表达量极显著低于对照组(P < 0.01);如图 4C所示,氧化酶指标相关基因CAT、GPXs、CuZn-SOD干扰组的表达水平显著高于对照组(P < 0.05)。
|
A.DON诱导48 h后凋亡相关基因mRNA水平检测;B.DON诱导48 h后免疫相关基因mRNA水平检测;C.DON诱导48 h后氧化酶相关基因mRNA水平检测 A.The detection of apoptosis-related genes mRNA expression level after DON-induced 48 h; B.The detection of immune-related genes mRNA expression level after DON-induced 48 h; C.The detection of oxidase-related genes mRNA expression level after DON-induced 48 h 图 4 DON诱导IPEC-J2细胞系METTL3干扰组和对照组48 h后各基因mRNA水平检测 Fig. 4 The detection of genes mRNA expression level in IPEC-J2 in METTL3 interference and control groups after DON-induced 48 h |
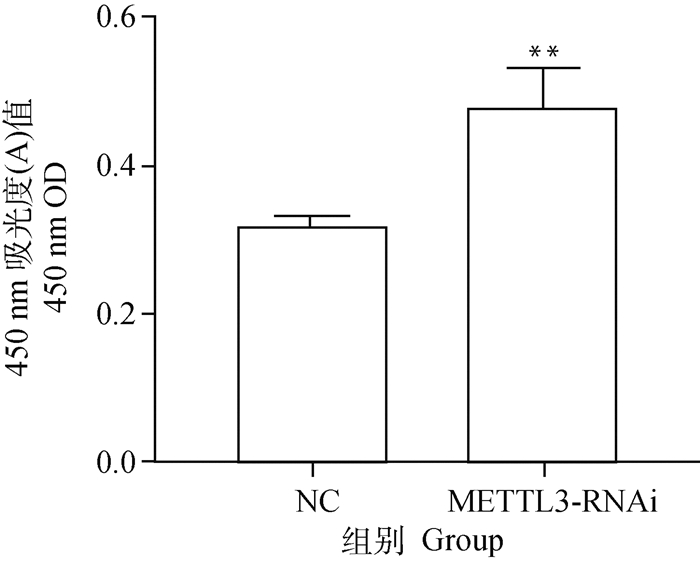
为分析细胞水平上DON诱导后METTL3干扰组与对照组细胞增殖活性的差异程度,在猪小肠上皮细胞系IPEC-J2细胞中干扰METTL3并经过DON诱导48 h,利用CCK8增殖试验检测处理之后IPEC-J2细胞的增殖活性,IPEC-J2细胞METTL3干扰组在450 nm处的光吸收值极显著高于对照组(图 5)。这说明经过DON诱导48 h之后,相比较对照组,干扰METTL3能极显著的增强IPEC-J2细胞的增殖活性(P < 0.01)。
|
图 5 DON诱导48 h METTL3干扰组和对照组的细胞增殖活性变化 Fig. 5 The cell proliferation activity changes between METTL3 interference and control groups after DON-induced 48 h |
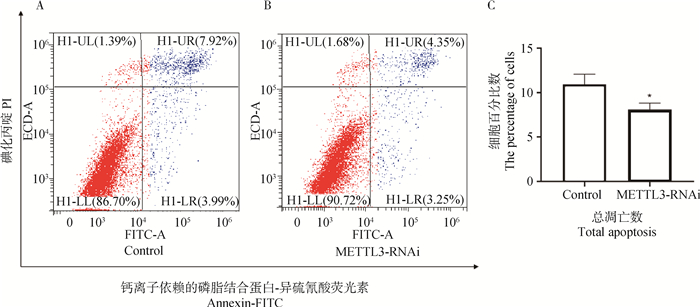
为分析细胞水平上DON诱导后METTL3干扰组与对照组细胞周期和凋亡的变化程度,在猪小肠上皮细胞系IPEC-J2细胞中干扰METTL3,DON诱导48 h,使用流式细胞术对IPEC-J2细胞进行细胞周期和凋亡检测,结果如图 6A所示,对照组IPEC-J2细胞在4N时期的细胞百分比为15.5%,如图 6B所示METTL3干扰组IPEC-J2细胞在4N时期的细胞百分比为17.4%,在4N时期的细胞百分比数METTL3干扰组比对照组多1.9%,这表明经DON诱导48 h后METTL3干扰组的细胞更多处于增殖状态;由图 7A、B可知,METTL3干扰组细胞的晚凋细胞百分比为4.35%,早凋细胞百分比为3.25%,对照组细胞的晚凋细胞百分比为7.92%,早凋细胞百分比为3.99%,将细胞凋亡数据汇总并进行统计分析,由图 7C可知,干扰组的细胞凋亡总数显著少于对照组,由此显示METTL3干扰组IPEC-J2细胞凋亡数显著减少(P < 0.05)。

|
A.猪肠上皮细胞对照组;B.猪肠上皮细胞METTL3干扰组 A.IPEC-J2 cell control group; B.IPEC-J2 cell METTL3 interference group 图 6 DON诱导猪肠上皮细胞48 h后细胞周期变化 Fig. 6 The cell cycle changes of IPEC-J2 after DON-induced 48 h |
|
A. 猪肠上皮细胞对照组;B.猪肠上皮细胞METTL3干扰组;C.细胞总凋亡数 A.IPEC-J2 cell control group; B.IPEC-J2 cell METTL3 interference group; C.Total apoptosis 图 7 DON诱导猪肠上皮细胞细胞48 h后细胞凋亡变化 Fig. 7 The apoptosis changes of IPEC-J2 cells after DON-induced 48 h |
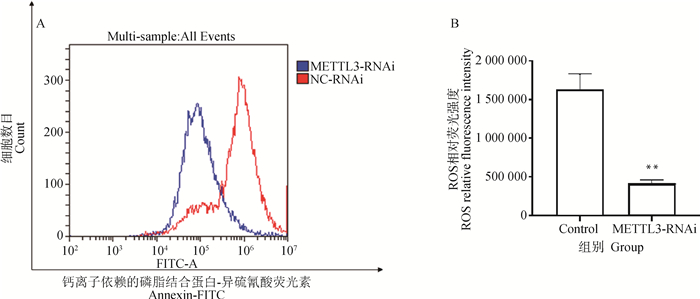
为确定细胞水平上DON诱导METTL3干扰组与对照组IPEC-J2细胞的活性氧(ROS)变化程度,在猪小肠上皮细胞系IPEC-J2细胞中干扰METTL3并经过DON诱导48 h后,使用流式细胞术对IPEC-J2细胞进行活性氧水平检测,并将ROS相对荧光强度数据汇总并进行统计分析,如图 8所示,METTL3干扰组细胞的活性氧相对荧光强度极显著低于对照组细胞(P < 0.01),活性氧相对荧光强度越高表示细胞受损伤程度越高,这表明METTL3干扰组细胞能一定程度抵抗由DON诱导而引起的细胞损伤。
|
A.钙离子依赖的磷脂结合蛋白-异硫氰酸荧光素通道下的不同ROS相对荧光强度细胞统计;B.对照组和METTL3干扰组的ROS相对荧光强度对比 A.The count of different ROS relative intensity of fluorescence cell in channel Annexin-FITC; B.The comparison about ROS relative fluorescence intensity between control and METTL3 interference groups 图 8 DON诱导48 h METTL3干扰组和对照组的ROS检测情况 Fig. 8 The detection of ROS levels changes after DON-induced 48 h |
在高等生物mRNA中,m6A是最丰富、最常见的转录修饰方式[21]。m6A修饰由m6A甲基转移酶进行修饰,去甲基化酶对修饰进行消除,这一系列过程通过m6A结合蛋白进行读取和识别。m6A修饰也参与多种生物学功能调控,其在干细胞发生、机体发育、癌症等多种生命进程中发挥重要的作用[22-24]。催化m6A修饰的甲基化转移酶在机体内部以复合物形式存在并发挥作用,并且分工协作地对mRNA上腺苷酸发生m6A修饰的过程进行催化。同时,m6A甲基化修饰过程是可逆的,这表明去甲基化酶在其中发挥着同样重要的功效,其拥有去除mRNA上甲基化的功能,以此参与促进m6A修饰mRNA的剪切、翻译和降解等过程[25]。相关研究表明[26],m6A甲基化修饰与机体肿瘤发生的过程密不可分。METTL3在乳腺癌组织的表达水平存在下降的变化,这说明m6A甲基转移酶可能在一定程度上提高了乳腺癌发生的概率。除此之外,多个研究结果说明METTL3可以影响细胞发育、分化、炎症等[27-28]。METTL3的缺失会显著影响斑马鱼的生育能力并产生多种发育缺陷[29-30],METTL3可通过调节MyD88的剪接来阻碍脂多糖(LPS)诱导而引发的炎症反应。可见METTL3甲基化酶在m6A甲基化修饰的过程中极其重要。本试验初步探讨了猪METTL3基因在脱氧雪腐镰刀菌烯醇诱导猪小肠上皮细胞中可能发挥的调节作用。
本试验在猪小肠上皮细胞(IPEC-J2)中对METTL3进行干扰,经DON诱导48 h后,对细胞凋亡相关基因、免疫相关基因及氧化酶指标相关基因进行实时荧光定量PCR检测,结果发现DON诱导48 h后IPEC-J2细胞中的METTL3干扰组免疫因子TNF-α表达量相较对照组出现极显著升高,IL-6、IL-12和Bax表达量相较对照组均出现显著或极显著下降,TNF-α是炎症反应的标志物且其可以促进细胞的增殖与分化,在炎症反应中起到非常重要的调控和指示作用[31],IL-6、IL-12和Bax为促细胞炎症反应基因,其可以反映细胞受到侵害产生炎症反应的状况,这表明在细胞受到DON的损伤之后会产生反应,METTL3干扰组细胞中可以一定程度上缓解因为DON诱导细胞而引起的炎症反应。METTL3干扰组的细胞凋亡相关基因中Caspase3和Caspase9两个基因出现了显著或极显著的下降,这表明DON诱导48 h之后,将METTL3基因干扰后能够调控细胞凋亡相关基因的表达,使其表达量呈显著或极显著下降。研究表明,DON可诱导细胞氧化应激,影响抗氧化系统,从而一定程度上损伤细胞,使抗氧化酶基因mRNA的表达量降低[32]。谷胱甘肽(GSH)是生物体内抗氧化防御系统中最重要的小分子活性寡肽,谷胱甘肽抗氧化系统包括GSH及相关代谢酶, 这形成生物体内最重要的抗氧化防御系统, 其可以保护细胞免受ROS的攻击[33]。脊椎动物则一般含有CuZn-SOD和Mn-SOD,其是生物体系中抗氧化酶系的重要组成成员,可以一定程度上反映机体清除氧自由基的能力[34]。过氧化氢酶(CAT)能够预防过量的过氧化氢对细胞产生的毒害作用,并与超氧化物歧化酶协同作用抵抗机体受有害自由基的侵害[35-36]。METTL3干扰组的氧化酶指标相关基因中CAT、GPXs和CuZn-SOD的表达相比对照组均出现显著上升,这表明降低METTL3基因的表达会通过某些途径参与调控,进而减弱因DON诱导IPEC-J2细胞而导致的抗氧化酶基因表达量下降的问题,在一定程度上帮助细胞进行抗氧化过程从而抵抗DON诱导的损害。
为了更直观地反映METTL3基因表达变化与DON诱导IPEC-J2细胞的关系及细胞的变化,本研究进行了细胞增殖、细胞周期、细胞凋亡及活性氧的检测。结果表明,使用DON对METTL3基因干扰组和对照组IPEC-J2细胞诱导48 h后,METTL3干扰组的细胞增殖活性极显著高于对照组,这说明干扰METTL3基因表达之后,极显著缓解了细胞因DON诱导所致增殖活性下降。王琴等[37]研究表明,细胞周期调节蛋白激酶抑制剂p21表达升高, 抑制SW480细胞从G0/G1期进入S期, 则会抑制细胞增殖,可以通过细胞周期检测以反映细胞增殖的情况,而在METTL3干扰组处于S期和4N期的细胞百分比占比更高,这表明METTL3干扰组的IPEC-J2细胞相较对照组具有更多处于分裂或增殖阶段的细胞[38]。相关研究表明,DON诱导IPEC-J2细胞之后会导致细胞凋亡出现上升的现象,本研究的细胞凋亡检测结果显示,METTL3干扰组的细胞凋亡数量显著低于对照组,这表明将METTL3干扰之后,会显著降低细胞因DON诱导而致细胞凋亡数量上升的现象。研究表明,DON可以诱导ROS的积累,增加脂质过氧化程度,改变细胞膜和抗氧化系统的完整性[32],活性氧(ROS)包括羟基自由基、超氧阴离子自由基、过氧化氢和脂质过氧化的不稳定中间体[39],ROS的生成增加和细胞抗氧化能力下降是细胞内氧化应激的主要原因, 并作为信号源干预细胞凋亡的进程,影响细胞的数量[40-41]。本研究活性氧检测结果说明,METTL3干扰组细胞的活性氧水平更低,因此推测,干扰METTL3基因的表达可以减弱细胞因受DON诱导产生过多ROS受损伤的程度。
本研究从细胞水平验证了METTL3对呕吐毒素诱导IPEC-J2细胞损伤的作用关系,发现在猪小肠上皮细胞中降低METTL3基因表达后,能一定程度帮助细胞抵抗因DON诱导所致细胞凋亡和炎症损伤,今后需要进一步利用m6A测序(MeRIP-seq)和转录组测序(RNA-seq)来深入探究METTL3介导m6A修饰对DON诱导细胞损伤的分子调控机制。
4 结论本研究成功构建了METTL3基因稳定干扰IPEC-J2细胞系,并经过DON诱导48 h后,通过实时荧光定量PCR、细胞增殖、细胞周期、细胞凋亡及活性氧试验检测表明,在IPEC-J2细胞中降低METTL3基因表达后,能一定程度帮助猪小肠上皮细胞抵抗因DON诱导所致的细胞凋亡和炎症。METTL3表达下调有利于缓解DON对细胞损伤产生的一系列炎症反应。
| [1] |
何波, 周小枫, 蒋瑶, 等. RNA甲基化修饰m6A在动物中的研究进展[J]. 畜牧与兽医, 2020, 52(3): 139-144. HE B, ZHOU X F, JIANG Y, et al. Progress in research on RNA methylation modified m6A in animals[J]. Animal Husbandry & Veterinary Medicine, 2020, 52(3): 139-144. (in Chinese) |
| [2] |
卢曾奎, 张利平, 李青, 等. mRNA中N6-甲基腺苷修饰及其在动物中的研究进展[J]. 畜牧兽医学报, 2019, 50(1): 1-13. LU Z K, ZHANG L P, LI Q, et al. N6-methyladenosine modification in mRNA and its research advance in animals[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(1): 1-13. (in Chinese) |
| [3] |
YANG Y, HSU P J, CHEN Y S, et al. Dynamic transcriptomic m6A decoration: writers, erasers, readers and functions in RNA metabolism[J]. Cell Res, 2018, 28(6): 616-624. DOI:10.1038/s41422-018-0040-8 |
| [4] |
薛鹏, 蒋涛, 沈兴家. m6A修饰及其对病毒复制过程调控研究进展[J]. 遗传, 2019, 41(5): 404-412. XUE P, JIANG T, SHEN X J. Advances in m6A modification and its regulation of viral replication[J]. Hereditas, 2019, 41(5): 404-412. (in Chinese) |
| [5] |
DURBIN A F, WANG C, MARCOTRIGIANO J, et al. RNAs containing modified nucleotides fail to trigger RIG-Ⅰ conformational changes for innate immune signaling[J]. mBio, 2016, 7(5): e00833-16. |
| [6] |
HENG J H, TIAN M, ZHANG W F, et al. Maternal heat stress regulates the early fat deposition partly through modification of m6A RNA methylation in neonatal piglets[J]. Cell Stress Chaperones, 2019, 24(3): 635-645. DOI:10.1007/s12192-019-01002-1 |
| [7] |
江芹. mRNA m6A修饰关键基因对猪肌内脂肪沉积的影响及机制[D]. 杭州: 浙江大学, 2018. JIANG Q. Effects and mechanisms of key mRNA m6A genes in porcine intramuscular fat deposition[D]. Hangzhou: Zhejiang University, 2018. (in Chinese) |
| [8] |
LU N, LI X M, YU J Y, et al. Curcumin attenuates lipopolysaccharide-induced hepatic lipid metabolism disorder by modification of m6A RNA methylation in piglets[J]. Lipids, 2018, 53(1): 53-63. DOI:10.1002/lipd.12023 |
| [9] |
CAO Z B, ZHANG D D, WANG Y Q, et al. Identification and functional annotation of m6A methylation modification in granulosa cells during antral follicle development in pigs[J]. Anim Reprod Sci, 2020, 219: 106510. DOI:10.1016/j.anireprosci.2020.106510 |
| [10] |
WU R F, LIU Y H, ZHAO Y L, et al. m6A methylation controls pluripotency of porcine induced pluripotent stem cells by targeting SOCS3/JAK2/STAT3 pathway in a YTHDF1/YTHDF2-orchestrated ma nner[J]. Cell Death Dis, 2019, 10(3): 171. DOI:10.1038/s41419-019-1417-4 |
| [11] |
HE S, WANG H, LIU R, et al. mRNA N6-methyladenosine methylation of postnatal liver development in pig[J]. PLoS One, 2017, 12(3): e0173421. DOI:10.1371/journal.pone.0173421 |
| [12] |
杜妮. 2018年我国部分地区饲料及饲用原料霉菌毒素污染调查报告[J]. 猪业科学, 2019, 36(2): 54-56. DU N. Survey report on mycotoxin contamination of feed and feed materials in some regions of my country in 2018[J]. Swine Industry Science, 2019, 36(2): 54-56. (in Chinese) |
| [13] |
王庆伟, 安纲, 王金勇, 等. 2019年中国饲料与原料霉菌毒素检测报告[J]. 饲料工业, 2020, 41(24): 52-57. WANG Q W, AN G, WANG J Y, et al. China mycotoxin survey of feed and raw material in 2019[J]. Feed Industry, 2020, 41(24): 52-57. (in Chinese) |
| [14] |
GHAREEB K, AWAD W A, BÖHM J, et al. Impacts of the feed contaminant deoxynivalenol on the intestine of monogastric animals: poultry and swine[J]. J Appl Toxicol, 2015, 35(4): 327-337. DOI:10.1002/jat.3083 |
| [15] |
REN Z H, GUO C Y, YU S M, et al. Progress in mycotoxins affecting intestinal mucosal barrier function[J]. Int J Mol Sci, 2019, 20(11): 2777. DOI:10.3390/ijms20112777 |
| [16] |
ANTONISSEN G, MARTEL A, PASMANS F, et al. The impact of Fusarium mycotoxins on human and animal host susceptibility to infectious diseases[J]. Toxins, 2014, 6(2): 430-452. DOI:10.3390/toxins6020430 |
| [17] |
JI X, ZHENG W J, YAO W. Protective role of hydrogen gas on oxidative damage and apoptosis in intestinal porcine epithelial cells (IPEC-J2) induced by deoxynivalenol: a preliminary study[J]. Toxins, 2019, 12(1): 5. DOI:10.3390/toxins12010005 |
| [18] |
ZHANG H, DENG X W, ZHOU C, et al. Deoxynivalenol induces inflammation in IPEC-J2 cells by activating P38 Mapk and Erk1/2[J]. Toxins, 2020, 12(3): 180. DOI:10.3390/toxins12030180 |
| [19] |
WU L, LI J J, LI Y H, et al. Aflatoxin B1, zearalenone and deoxynivalenol in feed ingredients and complete feed from different province in China[J]. J Anim Sci Biotechnol, 2016, 7(1): 63. DOI:10.1186/s40104-016-0122-8 |
| [20] |
张天择, 陈旭, 王微, 等. 甲基转移酶样蛋白3(METTL3)通过NF-κB信号通路促进小鼠巨噬细胞活化和炎症反应[J]. 细胞与分子免疫学杂志, 2019, 35(8): 727-732. ZHANG T Z, CHEN X, WANG W, et al. Methyltransferase-like protein 3 (METTL3) promotes mouse macrophage activation and inflammation through the NF-κB signaling pathway[J]. Chinese Journal of Cellular and Molecular Immunology, 2019, 35(8): 727-732. (in Chinese) |
| [21] |
ROUNDTREE I A, EVANS M E, PAN T, et al. Dynamic RNA modifications in gene expression regulation[J]. Cell, 2017, 169(7): 1187-1200. DOI:10.1016/j.cell.2017.05.045 |
| [22] |
韩娟娟, 张新安, 艾福录. m6A RNA甲基化修饰异常在肿瘤中的作用[J]. 中国生物化学与分子生物学报, 2020, 36(4): 383-391. HAN J J, ZHANG X A, AI F L. The role of m6A RNA methylated abnormality in tumor[J]. Chinese Journal of Biochemistry and Molecular Biology, 2020, 36(4): 383-391. (in Chinese) |
| [23] |
李炳琦. WTAP对胰腺癌恶性表型的调控及其分子机制研究[D]. 北京: 北京协和医学院, 2019. LI B Q. The investigation of WTAP on regulating pancreatic cancer malignant phenotype and associated molecular mechanism[D]. Beijing: Peking Union Medical College, 2019. (in Chinese) |
| [24] |
金春, 李蒙蒙, 李余佳, 等. 肝细胞癌的RNA甲基化修饰[J]. 中国病理生理杂志, 2019, 35(7): 1339-1344. JIN C, LI M M, LI Y J, et al. RNA methylation modifications in hepatocellular carcinoma[J]. Chinese Journal of Pathophysiology, 2019, 35(7): 1339-1344. DOI:10.3969/j.issn.1000-4718.2019.07.030 (in Chinese) |
| [25] |
刘畅, 陈洪艳, 张琦, 等. N6-甲基腺嘌呤RNA修饰研究进展[J]. 中国家禽, 2019, 41(14): 50-54. LIU C, CHEN H Y, ZHANG Q, et al. Research progress of N6-methyladenosine RNA modification[J]. China Poultry, 2019, 41(14): 50-54. (in Chinese) |
| [26] |
WU L P, WU D Y, NING J F, et al. Changes of N6-methyladenosine modulators promote breast cancer progression[J]. BMC Cancer, 2019, 19(1): 326. DOI:10.1186/s12885-019-5538-z |
| [27] |
XIA H, ZHONG C R, WU X X, et al. Mettl3 mutation disrupts gamete maturation and reduces fertility in zebrafish[J]. Genetics, 2018, 208(2): 729-743. DOI:10.1534/genetics.117.300574 |
| [28] |
FENG Z H, LI Q M, MENG R S, et al. METTL3 regulates alternative splicing of MyD88 upon the lipopolysaccharide-induced inflammatory response in human dental pulp cells[J]. J Cell Mol Med, 2018, 22(5): 2558-2568. DOI:10.1111/jcmm.13491 |
| [29] |
ZHAO B S, WANG X, BEADELL A V, et al. m6A-dependent maternal mRNA clearance facilitates zebrafish maternal-to-zygotic transition[J]. Nature, 2017, 542(7642): 475-478. DOI:10.1038/nature21355 |
| [30] |
PING X L, SUN B F, WANG L, et al. Mammalian WTAP is a regulatory subunit of the RNA N6-methyladenosine methyltransferase[J]. Cell Res, 2014, 24(2): 177-189. DOI:10.1038/cr.2014.3 |
| [31] |
纪莲, 叶晓琳. YAP修复TNF-α诱导的肠上皮细胞损伤[J]. 国际儿科学杂志, 2020, 47(8): 584-588. JI L, YE X L. YAP ameliorates TNF-α induced intestinal epithelial barrier damage[J]. International Journal of Pediatrics, 2020, 47(8): 584-588. DOI:10.3760/cma.j.issn.1673-4408.2020.08.016 (in Chinese) |
| [32] |
KANG R F, LI R N, DAI P Y, et al. Deoxynivalenol induced apoptosis and inflammation of IPEC-J2 cells by promoting ROS production[J]. Environ Pollut, 2019, 251: 689-698. DOI:10.1016/j.envpol.2019.05.026 |
| [33] |
LUSHCHAK V I. Glutathione homeostasis and functions: potential targets for medical interventions[J]. J Amino Acids, 2012, 2012: 736837. |
| [34] |
DORESWAMY K, SHRILATHA B, RAJESHKUMAR T, et al. Nickel-induced oxidative stress in testis of mice: evidence of DNA damage and genotoxic effects[J]. J Androl, 2004, 25(6): 996-1003. DOI:10.1002/j.1939-4640.2004.tb03173.x |
| [35] |
CABISCOL E, TAMARIT J, ROS J. Oxidative stress in bacteria and protein damage by reactive oxygen species[J]. Int Microbiol, 2000, 3(1): 3-8. |
| [36] |
KIRKMAN H N, GAETANI G F. Mammalian catalase: a venerable enzyme with new mysteries[J]. Trends Biochem Sci, 2007, 32(1): 44-50. DOI:10.1016/j.tibs.2006.11.003 |
| [37] |
王琴, 何峰, 刘强, 等. TNF-α通过调控miR-650/LATS1表达对结肠癌细胞增殖和凋亡的影响及其机制研究[J]. 中国免疫学杂志, 2020, 36(6): 699-706. WANG Q, HE F, LIU Q, et al. Effects of TNF-α on proliferation and apoptosis of colon cancer cells by regulating expression of miR-650/LATS1 and its mechanism[J]. Chinese Journal of Immunology, 2020, 36(6): 699-706. DOI:10.3969/j.issn.1000-484X.2020.06.012 (in Chinese) |
| [38] |
HORIUCHI K, UMETANI M, MINAMI T, et al. Wilms'Tumor 1-associating protein regulates G2/M transition through stabilization of cyclin A2 mRNA[J]. Proc Natl Acad Sci U S A, 2006, 103(46): 17278-17283. DOI:10.1073/pnas.0608357103 |
| [39] |
李素娟, 邢艳刚, 薛星晨, 等. 氟对小鼠睾丸谷胱甘肽抗氧化系统的影响[J]. 畜牧兽医学报, 2017, 48(5): 954-962. LI S J, XING Y G, XUE X C, et al. Effect of fluoride on glutathione antioxidant system in mice testis[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(5): 954-962. (in Chinese) |
| [40] |
陈祥兴, 李蛟龙, 邢通, 等. 过氧化氢对成肌细胞的氧化损伤作用研究[J]. 畜牧兽医学报, 2019, 50(5): 1016-1025. CHEN X X, LI J L, XING T, et al. Effects of H2O2 on oxidative damage of C2C12 cells[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(5): 1016-1025. (in Chinese) |
| [41] |
JIANG Y, ZHANG W H, GAO F, et al. Micro-encapsulated sodium butyrate attenuates oxidative stress induced by corticosterone exposure and modulates apoptosis in intestinal mucosa of broiler chickens[J]. Anim Prod Sci, 2014, 55(5): 587-594. |
(编辑 郭云雁)



