2. 塔里木大学动物科学与技术学院,阿拉尔 843300
2. College of Animal Science and Technology, Tarim University, Alaer 843300, China
急性肾衰作为发病率死亡率最高的肾疾病严重危害犬的健康[1],以往研究主要集中在急性肾衰所致的肾实质性损伤引起肾功能的改变,对治疗中离子代谢与凋亡关联性研究甚少。本研究以腺嘌呤为急性肾衰造模药物、纳米硒为急性肾衰治疗与预防药物,以急性肾衰犬肾组织为研究对象,旨在探究纳米硒对犬肾衰中重吸收与凋亡作用的影响。
硒(Se)是动物机体不可或缺的一种微量元素[2],近些年来,纳米硒(nano-Se)因其生物利用度、催化效率、吸附能力较亚硒酸盐高,在影响绵羊与山羊[3]、小鼠[3]、大鼠[4]及家禽[5]机体代谢中广为研究。纳米硒治疗与预防以往作用主要针对敏感组织和器官的氧化应激损伤,例如口服2 mg·kg-1的纳米硒通过减轻雄性小鼠睾丸组织氧化应激来抑制BPA引起的生殖毒性[6];提前口服0.5 mg·kg-1的纳米硒可通过上调转录因子Nrf2和血红素加氧酶-1(HO-1)表达来减轻氧化应激同时抑制脑组织炎症反应与凋亡级联反应,延缓戊四唑注射后小鼠全面性癫痫发作的持续时间[7]。急性肾衰治疗主要围绕恢复电解质、酸碱平衡,抗炎利尿进行,而其治疗策略本身需要评估具体肾排泄功能情况,防止过度补液导致的盐、水超负荷[8]。急性肾衰的特征是肾小球滤过率(glomerular filtration rate,GFR)急剧下降及急性肾小管坏死(acute tubular necrosis,ATN);与之有关的病理生理机制包括由肾小管上皮细胞从基底膜上脱离引起的肾小管阻塞,以及由于上皮细胞层破坏导致肾小球滤液回流重吸收功能受阻。SLC12A1基因是一种肾特异性的Na+-K+-2Cl-协同转运蛋白同种型,仅在髓袢升支粗段(thick ascending limb, TAL)的顶膜中表达。它的主要作用是介导Na+、K+和Cl-通过哺乳动物肾中的TAL顶膜的共转位[9]回收25%的超滤NaCl负载[10]。间质钙浓度升高会激活基底外侧CaSR直接调节细胞旁钙通透性[11],除了Ca2+运输系统,CaSR (钙敏感性受体)信号传导影响相关的肾小管远端NKCC2和NCC。NKCC2和NCC由包含无赖氨酸激酶(lysine deficient protein kinase, WNK)和两种同源Ste20相关激酶SPAK和OSR1的激酶级联激活[12]。WNK家族一方面感知细胞内Cl-浓度、细胞外渗透压和细胞体积的变化,并将这些信息最终传递给众多离子转运蛋白,以维持细胞和有机体的稳态并影响细胞形态和行为[13]。除肾小管上皮细胞外,神经细胞对体积变化同样敏感,以往的研究表明,抑制WNK-SPAK/OSR1信号通路可通过减少NKCC的磷酸化来缓解脑中风时渗透压变化引起的脑细胞肿胀引起的脑水肿[14],此外通过RNA干扰抑制内源性WNK3蛋白可加速细胞凋亡反应并促进Caspase-3的活化[15]。
1 材料与方法 1.1 实验动物本研究所使用的年龄1岁左右,体重约4 kg的20只健康贵宾犬均购自华中农业大学(武汉)实验动物中心。
1.2 仪器与试剂腺嘌呤(G1924214)购自Aladdin生物制品有限公司。纳米硒(纯度≥99%)购自Macklin生化有限公司。呋塞米注射液购自广东万事达动物药业有限公司。葡萄糖NaCl注射液购自武汉滨湖双鹤药业。肌酐测试盒(C011-1-1)、血尿素氮测试盒(C013-1-1)、钙测试盒(C004-2-1)、无机磷测试盒(C006-1-1)购自南京建成科技有限公司。Trizol Reagent(15596-026)购自Invitrogen Life Technologies公司。cDNA合成试剂盒、RT-qPCR试剂盒购自北京擎科新业生物技术有限公司。BCA蛋白定量试剂盒购自大连美仑生物技术有限公司。NKCC2、Caspase3、Caspase9、BAX、BCL-2抗体购自沈阳Wanleibio试剂公司。WNK1、WNK3、CaSR、ACTB抗体、HRP标记山羊抗兔二抗及蛋白Marker购自ABclonal试剂公司。PAGE凝胶快速制备试剂盒(8%)购自上海雅酶生物科技公司。
LightCycler96荧光定量PCR仪购自瑞士Roche集团,URIT-150Vet尿液分析仪购自桂林优利特医疗公司,OLYMPUS YCX41光学显微镜购自日本奥林巴斯光学株式会社。
1.3 试验设计及饲养管理20只体重约4 kg年龄1岁左右的贵宾犬在做基本健康检查并适应性喂养两周后随机分为空白对照组(Control,饲喂基础日粮30 d)、急性肾衰造模组(Model,15 d基础日粮+15 d腺嘌呤75 mg·(kg·d)-1)、常规输液治疗组(Infusion,15 d腺嘌呤75 mg·(kg·d)-1+ 15 d葡萄糖氯化钠注射液60 mL·(kg·d)-1、呋塞米2~4 mg·kg-1、纳米硒治疗组(Nano-Se,15 d添加饲喂腺嘌呤,75 mg·(kg·d)-1+15 d添加饲喂纳米硒0.5 mg·(kg·d)-1)、纳米硒预防组(Prevention,15 d添加饲喂纳米硒0.5 mg·(kg·d)-1+15 d添加饲喂腺嘌呤,75 mg·(kg·d)-1),每组4只犬,试验周期为30 d。
1.4 样本采集与处理跟踪记录30 d治疗周期内犬临床状态变化,包括精神状态、食欲饮欲、排尿排便情况、尿液粪便颜色状态变化,完成30 d造模与治疗流程周期后对实验犬进行静脉采血5 mL,用于血液生化检测,膀胱穿刺取尿用于尿常规检测,麻醉安乐死后肾组织取样用于石蜡切片、免疫组化以及核酸与蛋白提取等后续试验。
1.5 犬急性肾衰判断参考国际急性肾衰造模试验标准,在造模后犬7~15 d内出现稳定的血清CRE,BUN上升且超出正常范围,其中,血肌酐浓度需达到三级肾衰CRE 180~440 μmol·L-1标准。
1.6 血清肌酐与血清尿素氮含量的测定全血分离血清后分,别使用肌酐测定试剂盒(除蛋白法)及血清尿素氮测定试剂盒(二乙酰肟比色法)进行检测。
1.7 血清钙离子与磷离子浓度测定全血分离血清后,分别使用钙测试盒与无机磷测试盒测定浓度。
1.8 尿常规检测将5 mL注射器收集到的尿液转移到无菌离心管中,将尿常规检测试纸完全浸于尿液中1 min,将浸润的试纸条置于尿液分析仪中进行检测并记录。
1.9 RT-qPCR检测离子转运及凋亡相关基因表达水平Trizol法提取肾组织总RNA,并测定其浓度与纯度,根据cDNA合成试剂盒说明将RNA反转录为cDNA,最后根据RT-qPCR试剂盒说明测定离子转运及凋亡相关基因mRNA表达水平。引物序列见表 1。
|
|
表 1 引物序列 Table 1 Primer sequence |
提取肾组织蛋白,BCA试剂盒测定总蛋白浓度,用SDS-PAGE Loading Buffer将其稀释至同一浓度并煮沸。SDS-PAGE(8%)电泳分离蛋白样品,转膜,用5%脱脂奶粉封闭。一抗统一于4 ℃孵育过夜,TBST洗涤3次后,二抗常温孵育1 h,TBST洗涤后,ECL显色。用Image J(National Institutes of Helth,America)计算蛋白条带灰度值。
1.11 数据处理本研究使用GraphPad Prism 8.0软件处理数据并作图分析,统计结果均表示为“平均值±标准差(x±s)”,并且使用one-way ANOVA进行组间差异比较。
2 结果 2.1 纳米硒犬肾衰治疗对比试验中血清、尿液检测如图 1A、B所示,造模组CRE与BUN较空白组显著上升,且CRE达到三级肾衰标准判定为造模成功;补液治疗组、纳米硒治疗组、纳米硒预防组对比造模组CRE与BUN均出现极显著(P < 0.01)或显著(P < 0.05)下降。由图 1C、D显示,对比造模组,纳米硒治疗组血清钙浓度显著上升(P < 0.05),纳米硒治疗组与预防组血清磷浓度显著下降(P < 0.05)。如图 1E、F所示,对比造模组,纳米硒治疗组与预防组尿比重显著升高(P < 0.05),纳米硒治疗组尿pH显著升高(P < 0.05)。
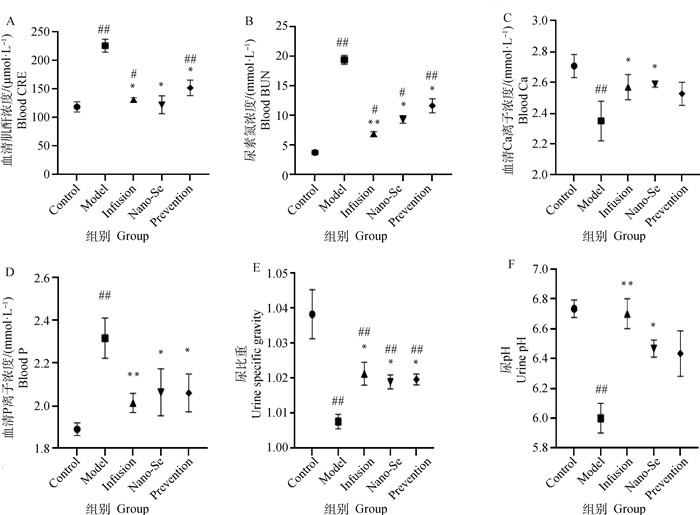
|
A、B.各组犬血清肌酐和尿素氮深度;C、D.各组犬血清钙离子、磷离子浓度;E、F.各组犬尿比重、尿液pH;Control. 空白对照组;Model. 肾衰造模组;Infusion. 输液治疗组;Nano-Se. 纳米硒治疗组;Prevention. 纳米硒预防组;对比造模组,*. P < 0.05,**. P < 0.01;对比空白对照组,#. P < 0.05,##. P < 0.01,下同;参考正常范围:CRE(44~159 μmol·L-1),BUN (2.9~7.5 mmol·L-1),尿比重(1.015~1.045),尿pH(5.4~7.4),血钙(2.25~3.00 mmol·L-1),血磷(0.97~1.76 mmol·L-1) A, B. Differences in serum creatinine (μmol·L-1) and blood urea nitrogen (mmol·L-1) of dogs in each group; C, D. Differences in serum calcium ion and phosphorus ion concentrations (mmol·L-1) in each group of dogs; E, F. Differences in urine specific gravity and urine pH of dogs in each group; Control. Blank control group; Model. Renal failure modeling group; Infusion. Infusion treatment group; Nano-Se. Nano-selenium treatment group; Prevention. Nano-selenium prevention group; Compared with modeling group, *. P < 0.05, **. P< 0.01; Compared with blank control group, #. P < 0.05, ##. P < 0.01, the same as below; reference normal range: CRE (44-159 μmol·L-1), BUN (2.9-7.5 mmol·L-1), urine specific gravity (1.015-1.045), urine pH (5.4-7.4), blood calcium (2.25-3.00 mmol·L-1), blood phosphorus (0.97-1.76 mmol·L-1) 图 1 血清、尿液检测结果 Fig. 1 Serum and urine test results |
如图 2A~C所示,对比造模组,纳米硒治疗组CaSR mRNA表达量显著增加(P < 0.05),纳米硒预防组WNK1 mRNA表达量显著减少(P < 0.05),纳米硒治疗组NKCC2 mRNA表达量极显著减少(P < 0.01)。如图 2D、E~G显示,对比造模组,纳米硒治疗组CaSR蛋白表达量显著上升,WNK1、NKCC2蛋白表达量显著下降(P < 0.05),纳米硒预防组WNK1蛋白表达量显著下降(P < 0.05)。
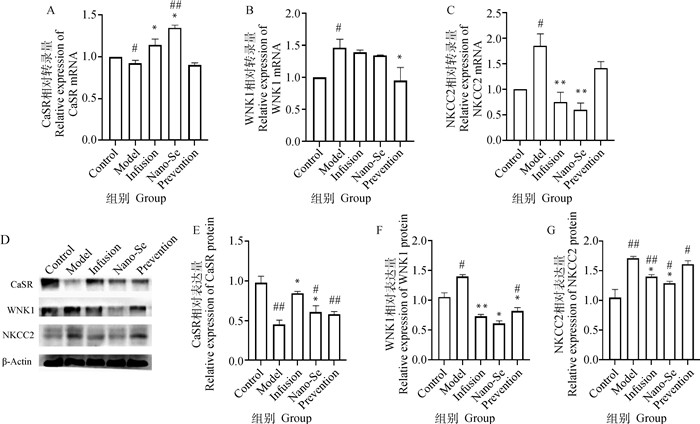
|
A~C. 各组犬肾组织CaSR、WNK1、NKCC2 (mRNA)表达差异;D、E~G.各组犬肾组织CaSR、WNK1、NKCC2蛋白的Western blot检测结果与灰度值分析结果 A-C. Differences in the expressions of CaSR, WNK1, NKCC2 (mRNA) in kidney tissue of dogs in each group; D, E-G. Western blot detection results and gray value analysis results of CaSR, WNK1, NKCC2 proteins in dog kidney tissues of each group 图 2 肾组织离子转运相关RT-qPCR与Western blot结果 Fig. 2 Results of RT-qPCR and Western blot related to ion transport in renal tissue |
如图 3所示,NKCC2蛋白在造模组表达量明显升高,且在坏死肾小管上皮细胞、肾小管间隔周围高表达,肾小管间质炎性细胞增多,补液治疗组、纳米硒治疗组、纳米硒预防组NKCC2蛋白表达量相比造模组均下降,且各治疗组肾小管间质炎性细胞数量下降。
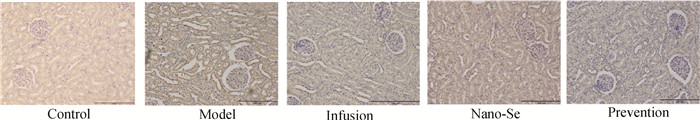
|
图 3 犬肾组织切片NKCC2抗体免疫组化结果(200×) Fig. 3 Immunohistochemical results of NKCC2 antibody in canine kidney tissue sections (200×) |
如图 4A~D所示,相对造模组,纳米硒治疗组与预防组BCL-2/BAX相对转录量为增加趋势,纳米硒治疗组WNK3 mRNA极显著增加(P < 0.01),Caspase3与Caspase9 mRNA显著降低(P < 0.05)。如图 4E、F~I所示纳米硒治疗组BCL-2/BAX表达量较造模组相对增加,WNK3与Caspase9表达量较造模组极显著(P < 0.01)或显著(P < 0.05)增加,Caspase3表达量相对造模组极显著下降(P < 0.01)。
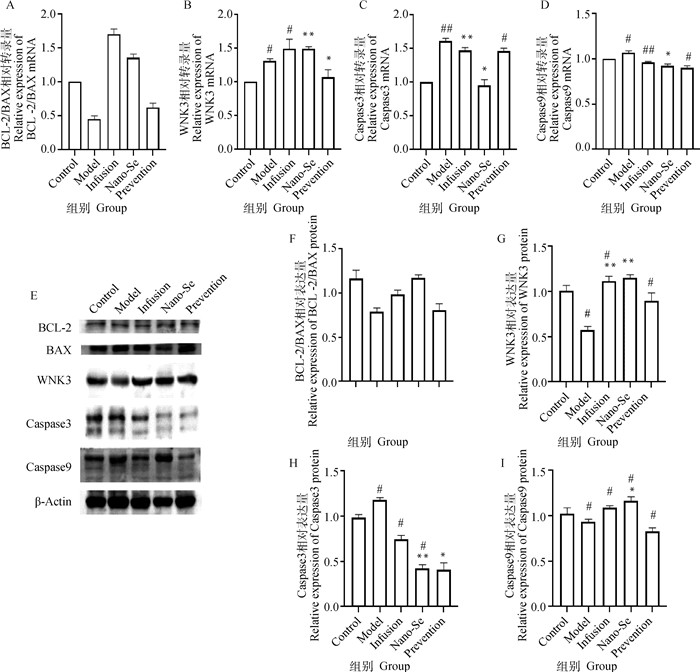
|
A~D.各组犬肾组织BCL-2/BAX,WNK3、Caspase3、Caspase9 (mRNA)表达差异;E、F~I.各组犬肾组织BCL-2/BAX,WNK3、Caspase3、Caspase9蛋白的Western blot检测结果与灰度值分析结果 A-D. Differences in the expressions of BCL-2/BAX, WNK3, Caspase3, Caspase9 (mRNA)in kidney tissue of dogs in each group; E, F-I. Western blot detection results and gray value analysis results of BCL-2/BAX, WNK3, Caspase3, Caspase9 proteins in dog kidney tissues of each group 图 4 肾组织凋亡相关RT-qPCR与Western blot结果 Fig. 4 Results of RT-qPCR and Western blot related to apoptosis in renal tissue |
治疗周期结束时,各组犬血清生化检测结果显示,补液治疗组、纳米硒治疗组与纳米硒预防组的CRE与BUN较造模组均有数值上的显著下降;尿常规检测结果也显示,补液治疗组、纳米硒治疗组与纳米硒预防组的尿比重较造模组显著上升,尿pH较造模组显著下降。从肾血清生化指标与尿常规指标变化来看,补液利尿与纳米硒治疗对于犬急性肾衰的治疗均有积极作用且效果显著。
造模组发生肾衰时表现出明显的血钙含量下降,血磷含量上升,在肾功能正常的患者中,钙和磷酸盐的循环水平通过甲状旁腺激素、1, 25-二羟基维生素D和成纤维细胞生长因子23三者与钙磷盐通过多个内分泌反馈通路相互作用,这三种激素的主要靶器官为肾、骨骼、肠道与甲状旁腺[16],高磷血症可以直接刺激甲状旁腺使PTH过度分泌,一方面,增加肾钙转运蛋白的表达促进钙离子重吸收,另一方面,可以通过下调肾钠依赖性磷酸盐转运蛋白表达增加磷酸盐排泄以此调节钙磷代谢失衡。试验结果显示,补液治疗组、纳米硒治疗组、纳米硒预防组的血磷相对造模组均显著降低,并增加血钙含量,3种方法均可以减轻由急性肾衰引起的钙磷代谢失调。
CaSR是一种G偶联蛋白受体,通常在甲状旁腺与肾小管中表达[17],其活化效应通过响应细胞外液钙离子浓度,增加细胞内液Ca2+作为第二信使调控下游信号通路,肾小管上皮细胞内Ca2+信号通过激活钙调神经磷酸酶参与调控WNK1/SPAK通路最终促进或抑制肾小管顶膜上NKCC2的磷酸化[18]。Western blot结果显示,造模组CaSR相对空白对照组表达量降低而最终调控的NKCC2过表达,此时生理效应可能为肾在组织受损的情况下通过感应机体内血清Ca2+浓度下降CaSR-WNK1/SPAK-NKCC2通路过表达来补偿受损肾小管上皮细胞对尿液的重吸收功能;由于NKCC2是一类布美他尼类敏感受体蛋白故补液利尿治疗中利尿剂的选择为速尿,通过速尿特异性刺激NKCC2蛋白表达与纳米硒治疗效果进行对比,在补液治疗与使用纳米硒后,CaSR表达量较造模组明显增加,WNK1与NKCC2表达量相比造模组显著减少,其原因可能为血清钙离子的上升带动激活肾组织中CaSR表达量的增加,通过WNK/SPAK-NKCC2通路最终减少了下游NKCC2的表达量,减弱了急性肾衰中过度代偿的重吸收功能,进一步促进肾与机体的电解质水平衡。
肾组织凋亡效应增强伴随急性肾衰的发展,在急性肾衰病程中调往与坏死效应既有积极作用也有其带来的消极作用。通过Western blot验证了治疗周期BCL-2与BAX的表达量,结果发现,通过补液治疗与添加纳米硒治疗后促凋亡基因BAX的表达相比造模组显著下降,抗凋亡基因BCL-2的表达显著增加,从一方面证明了两种治疗方法对肾组织凋亡趋势都具有抑制作用;治疗组CaSR表达量增加,进而下游WNK家族整体表达量增加,而低WNK3表达对下游Caspase-3具有直接效应,当WNK3被抑制时可加速细胞凋亡,并促进Caspase-3的活化[15]。首先在造模组可以看到明显的Caspase3表达增强,说明细胞凋亡效应的增加,纳米硒治疗后,WNK3表达量增加,同时Caspase-3表达量减少,Caspase-9作为凋亡的触发剂可激活Caspase 3直接通过自身介导的信号传导途径导致细胞发生凋亡, 而治疗组Caspase9 mRNA减少进一步反映了此时活化Caspase-3效应减弱,从另一方面证明了两种治疗方法均可以下调急性肾衰中的调亡效应。
4 结论纳米硒可能在发生急性肾衰时改善机体钙磷代谢,一方面,通过CaSR-WNK/SPAK-NKCC2通路间接地降低肾组织由于急性肾衰发生而过表达的离子转运蛋白从而调节肾的重吸收功能,另一方面,通过CaSR-WNK-Caspase3通路减少肾组织促凋亡蛋白的表达从而减轻肾损伤,纳米硒在机体内具体代谢及作用机制需进一步研究。
| [1] |
PROWLE J R, ECHEVERRI J E, LIGABO E V, et al. Fluid balance and acute kidney injury[J]. Nat Rev Nephrol, 2010, 6(2): 107-115. DOI:10.1038/nrneph.2009.213 |
| [2] |
HATFIELD D L, TSUJI P A, CARLSON B A, et al. Selenium and selenocysteine: roles in cancer, health, and development[J]. Trends Biochem Sci, 2014, 39(3): 112-120. DOI:10.1016/j.tibs.2013.12.007 |
| [3] |
SHI L G, XUN W J, YUE W B, et al. Effect of elemental Nano-selenium on feed digestibility, rumen fermentation, and purine derivatives in sheep[J]. Anim Feed Sci Technol, 2011, 163(2-4): 136-142. DOI:10.1016/j.anifeedsci.2010.10.016 |
| [4] |
WANG H L, ZHANG J S, YU H Q. Elemental selenium at Nano size possesses lower toxicity without compromising the fundamental effect on selenoenzymes: comparison with selenomethionine in mice[J]. Free Radic Biol Med, 2007, 42(10): 1524-1533. DOI:10.1016/j.freeradbiomed.2007.02.013 |
| [5] |
JIA T, OLAUSON H, LINDBERG K, et al. A novel model of adenine-induced tubulointerstitial nephropathy in mice[J]. BMC Nephrol, 2013, 14: 116. DOI:10.1186/1471-2369-14-116 |
| [6] |
KHALAF A A, AHMED W, MOSELHY W A, et al. Protective effects of selenium and Nano-selenium on bisphenol-induced reproductive toxicity in male rats[J]. Hum Exp Toxicol, 2019, 38(4): 398-408. DOI:10.1177/0960327118816134 |
| [7] |
YUAN X N, FU Z S, JI P F, et al. Selenium Nanoparticles pre-treatment reverse behavioral, oxidative damage, neuronal loss and neurochemical alterations in pentylenetetrazole-induced epileptic seizures in mice[J]. Int J Nanomedicine, 2020, 15: 6339-6353. DOI:10.2147/IJN.S259134 |
| [8] |
章安源, 李淑花, 张志民, 等. 犬急性肾功能衰竭的临床诊断与治疗[J]. 中兽医学杂志, 2015(4): 56-57. ZHANG A Y, LI S H, ZHANG Z M, et al. Clinical diagnosis and treatment of acute renal failure in dogs[J]. Chinese Journal of Traditional Veterinary Science, 2015(4): 56-57. DOI:10.3969/j.issn.1003-8655.2015.04.040 (in Chinese) |
| [9] |
KAPLAN M R, PLOTKIN M D, LEE W S, et al. Apical localization of the Na-K-Cl cotransporter, rBSC1, on rat thick ascending limbs[J]. Kidney Int, 1996, 49(1): 40-47. DOI:10.1038/ki.1996.6 |
| [10] |
ROCHA A S, MAGALDI J B, KOKKO J P. Calcium and phosphate transport in isolated segments of rabbit Henle's loop[J]. J Clin Invest, 1977, 59(5): 975-983. DOI:10.1172/JCI108720 |
| [11] |
LOUPY A, RAMAKRISHNAN S K, WOOTLA B, et al. PTH-independent regulation of blood calcium concentration by the calcium-sensing receptor[J]. J Clin Invest, 2012, 122(9): 3355-3367. DOI:10.1172/JCI57407 |
| [12] |
BAZÚA-VALENTI S, ROJAS-VEGA L, CASTAÑEDA-BUENO M, et al. The calcium-sensing receptor increases activity of the renal NCC through the WNK4-SPAK pathway[J]. J Am Soc Nephrol, 2018, 29(7): 1838-1848. DOI:10.1681/ASN.2017111155 |
| [13] |
ALESSI D R, ZHANG J W, KHANNA A, et al. The WNK-SPAK/OSR1 pathway: master regulator of cation-chloride cotransporters[J]. Sci Signal, 2014, 7(334): re3. |
| [14] |
BEGUM G, YUAN H, KAHLE K T, et al. Inhibition of WNK3 kinase signaling reduces brain damage and accelerates neurological recovery after stroke[J]. Stroke, 2015, 46(7): 1956-1965. DOI:10.1161/STROKEAHA.115.008939 |
| [15] |
VERÍSSIMO F, SILVA E, MORRIS J D, et al. Protein kinase WNK3 increases cell survival in a caspase-3-dependent pathway[J]. Oncogene, 2006, 25(30): 4172-4182. DOI:10.1038/sj.onc.1209449 |
| [16] |
LEAF D E, CHRISTOV M. Dysregulated mineral metabolism in AKI[J]. Semin Nephrol, 2019, 39(1): 41-56. DOI:10.1016/j.semnephrol.2018.10.004 |
| [17] |
VEZZOLI G, SOLDATI L, GAMBARO G. Roles of calcium-sensing receptor (CaSR) in renal mineral ion transport[J]. Curr Pharm Biotechnol, 2009, 10(3): 302-310. DOI:10.2174/138920109787847475 |
| [18] |
OSTROVERKHOVA D S, HU J D, TARASOV V V, et al. Calcium-sensing receptor and regulation of WNK kinases in the kidney[J]. Cells, 2020, 9(7): 1644. DOI:10.3390/cells9071644 |
(编辑 白永平)



