2. 河北医科大学附属邢台人民医院病理科,邢台 054031;
3. 南京农业大学动物医学院农业部动物生理生化重点开放实验室,南京 210095
2. Department of Pathology, Xingtai People 's Hospital, Hebei Medical University Affiliated Hospital, Xingtai 054031, China;
3. Key Laboratory of Animal Physiology and Biochemistry, Ministry of Agriculture, College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是一种以三酰甘油(triglyceride,TG)在肝蓄积为特征的疾病,近年来,由于脂肪和高糖等摄入增加、激素食品泛滥等因素,使NAFLD发病率逐年增高。NAFLD在鸡、狗、猪、牛、羊以及鱼等动物也可发生,是各种动物的原发或者继发性疾病,在鸡、鸭的发病率较高,该病不仅影响着养殖业的发展,也会带来一定的食品安全问题,给禽类养殖业造成严重的经济损失[1]。近年来,NAFLD越来越受到关注,因其发病机制复杂、诊断困难,已成为世界上最常见的慢性肝病。NAFLD通常与高血压、血脂异常、肥胖、胰岛素抵抗、代谢综合征、2型糖尿病和心血管疾病密切相关[2]。目前,NAFLD没有有效的治疗方案,主要以改变动物的饮食方式为主。
乙酸是一种短链脂肪酸(SCFA),它是由摄入的膳食纤维刺激,经动物盲肠和结肠发酵产生[3-4]。据报道,膳食纤维可以降低餐后血糖反应、血浆胆固醇和三酰甘油浓度以及脂肪储存[5]。并且,Hara等[6]研究发现含有SCFA的无纤维饮食也能降低血清胆固醇。乙酸除了由结肠细菌发酵产生外,许多食物中均含有乙酸的成分。
肝是动物调节脂质代谢和维持脂质稳态的重要器官,通过肝切片发现,肝含有多种细胞类型,如肝细胞、库普弗细胞、内皮细胞和成纤维细胞[7]。研究表明,乙酸可以使小鼠肝TG含量降低,脂质氧化基因表达增加[8]。此外,乙酸可激活糖尿病KK-A(y)小鼠肝腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)蛋白,而AMPK作为能量的“传感器”和“调节器”,对肝的脂质代谢的调节具有重要作用[9]。目前,乙酸在调控肝代谢方面的研究较少,且不深入。因此,本试验通过油酸诱导BRL-3A细胞建立脂肪变性模型,分析乙酸钠是否对BRL-3A细胞脂肪变性模型具有调控作用,为乙酸钠对动物摄食调控及改善肥胖、健康方面的研究提供理论依据。
1 材料与方法 1.1 细胞来源大鼠肝成纤维细胞(BRL-3A)购自中国科学院昆明细胞库,本实验室冻存。
1.2 主要试剂乙酸钠、油酸购自美国Sigma公司;TG试剂盒、油红O染色试剂盒、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶试剂盒均购自南京建成生物技术有限公司;P-AMPK-兔/AMPK-兔抗体均购自艾博抗上海贸易有限公司;山羊抗兔IgG购自上海生物工程有限公司;BCA蛋白定量试剂盒购自上海碧云天生物技术公司;DMEM培养基、胎牛血清和青霉素/链霉素购自南京泽优生物科技有限公司。
1.3 BRL-3A细胞脂肪变性模型建立1.3.1 BRL-3A细胞的培养与处理 BRL-3A细胞在DMEM高糖培养基中进行培养,内含10%胎牛血清、100 U·mL-1青霉素/链霉素,置于含5% CO2的恒温培养箱(37 ℃)中培养,根据细胞生长状态,及时更换新鲜培养基,每隔2~3 d将细胞重新传代1次。当细胞融合度达到80%~90%时,贴壁细胞用含0.25%胰酶和0.02% EDTA胰酶消化液进行消化处理,将细胞接种于6孔板和96孔板中,加入新鲜培养基,置于恒温培养箱中培养。
1.3.2 不同浓度油酸处理BRL-3A细胞相对活力检测 接种于96孔板内的BRL-3A细胞融合度达到70%~80%时,弃去培养液。PBS洗涤后,分别加入含有不同浓度油酸(0.03、0.06、0.12、0.24、0.48 mmol·L-1)的无血清培养基;在5% CO2的恒温培养箱(37 ℃)中培养24 h。随后每孔细胞加入含0.5 mg·mL-1 MTT的无胎牛血清培养液20 μL,继续培养4 h后,弃上清液,再加入150 μL DMSO充分溶解,用酶标仪检测各孔的吸光值,检测其细胞相对活力。
1.3.3 不同浓度油酸处理BRL-3A细胞总脂滴面积、TG、AST和ALT指标检测 将细胞按照合适密度接种于6孔板中,待细胞融合至80%时,弃去培养液,对细胞进行饥饿处理后,加入含有不同浓度油酸(0.03、0.06、0.12、0.24 mmol·L-1)的无血清培养基,在37 ℃、5% CO2条件下培养24 h后,PBS冲洗3遍,10%福尔马林将细胞固定30 min,室温条件下,PBS冲洗3遍,用油红O染液染色10 min,PBS缓冲液洗2次;倒置显微镜观察细胞内脂滴染色情况,并进行统计分析。另外,在37 ℃、5% CO2条件下培养24 h后收集细胞,弃上清进行TG含量、AST和ALT活性检测。
1.4 不同浓度乙酸钠处理BRL-3A细胞凋亡率指标检测将细胞培养于6孔板中,当细胞融合度达到80%~90%时,用低(2 mmol·L-1)、中(4 mmol·L-1)、高(8 mmol·L-1)浓度的乙酸钠处理细胞24 h。收集细胞后加入200 μL的Annexin V-异硫氰酸荧光素(FITC)原液重悬细胞,4 ℃避光孵育30 min,再加入10 μL碘化丙啶(PI),避光孵育15 min,采用美国BD FACS Calibur型流式细胞术检测荧光强度,计算细胞凋亡率。
1.5 乙酸钠对油酸诱导的BRL-3A细胞脂肪变性模型的影响1.5.1 不同浓度乙酸钠处理脂肪变性细胞模型胞内脂滴变化检测 将细胞按照合适密度接种于6孔板中,待细胞融合至80%时,弃去培养液,对细胞进行饥饿处理后,将细胞分为油酸处理组(加入含有终浓度为0.12 mmol·L-1油酸的无血清培养基),2 mmol·L-1乙酸钠+油酸处理组,4 mmol·L-1乙酸钠+油酸处理组和8 mmol·L-1乙酸钠+油酸处理组。在2 mmol·L-1乙酸钠+油酸处理组、4 mmol·L-1乙酸钠+油酸处理组和8 mmol·L-1乙酸钠+油酸处理组中,均为2 h后加入乙酸钠。在37 ℃、5% CO2条件下培养24 h后, PBS冲洗3遍,10%福尔马林将细胞固定30 min,室温条件下,PBS冲洗3遍,用油红O染液染色10 min,PBS缓冲液洗2次;倒置显微镜观察细胞内脂滴染色情况,并进行统计分析。
1.5.2 不同浓度乙酸钠处理脂肪变性细胞模型TG、AST和ALT指标检测 接种于6孔板的细胞经过上述同样处理后,在37 ℃、5% CO2条件下培养24 h后,收集细胞,弃上清,进行TG含量、AST和ALT活性检测,操作步骤按照说明书进行。提取细胞总蛋白,BCA蛋白浓度测定试剂盒测定并计算出蛋白浓度。
1.5.3 不同浓度乙酸钠处理脂肪变性细胞模型AMPK通路蛋白检测 Western blot检测各处理细胞中P-AMPK/AMPK蛋白的表达变化,参照李林等[10]的方法进行操作。用ECL发光液进行Western blot图像处理。用Image Lab 6.0分析条带灰度值。
1.5.4 不同浓度乙酸钠处理脂肪变性细胞模型脂代谢相关关键基因检测 将收集的细胞采用TRIzol法直接提取总RNA,利用BioPhotometer测定样品总RNA浓度,分析OD260 nm/OD280 nm值,判断提取总RNA的纯度,OD260 nm/OD280 nm需要为1.8~2.0。取1 μg总RNA进行反转录得到cDNA, 详细操作步骤参照说明书进行。
参照GenBank序列,用Primer Premier 5软件自行设计,设计完成后送上海Sangon公司合成,引物序列见表 1。
|
|
表 1 目的基因及β-Actin引物序列 Table 1 Prime sequence of targeted gene and β-Actin |
数据通过SPSS 17.0统计软件进行统计分析,试验结果均为单因子方差分析(one way ANOVA, LSD) 进行差异显著性检验。所有数值以“x±s”表示。
2 结果 2.1 不同浓度油酸对BRL-3A细胞相对活力的影响图 1所示,向细胞中添加不同浓度(0.03、0.06、0.12、0.24、0.48 mmol·L-1)的油酸后,发现与对照组(0 mmol·L-1油酸)相比,0.48 mmol·L-1油酸对细胞有明显的抑制作用,且差异显著(P < 0.05)。其他浓度的油酸处理细胞后与对照组相比,均无差异。结果提示:0.03~0.24 mmol·L-1的油酸对BRL-3A细胞无毒副作用。
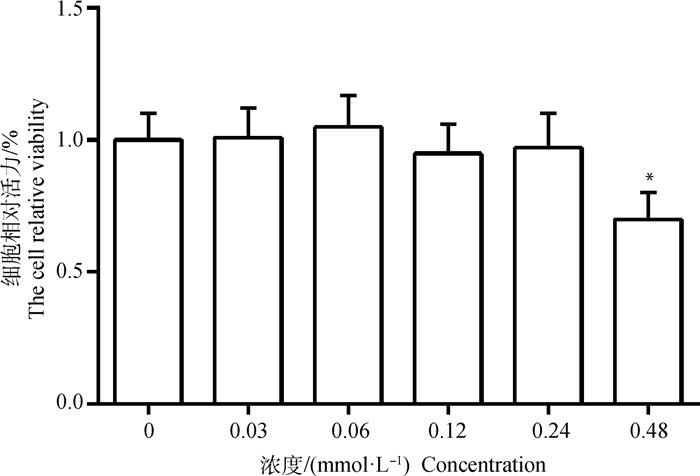
|
与对照组(0 mmol·L-1)相比,*. P < 0.05 Compared with control group(0 mmol·L-1), *. P < 0.05 图 1 油酸对BRL-3A细胞相对活力分析 Fig. 1 Analysis of the relative activity of oleic acid on BRL-3A cells |
图 2所示,与对照组相比,0.12和0.24 mmol·L-1油酸处理后细胞总脂滴面积均极显著上升(P < 0.01)。
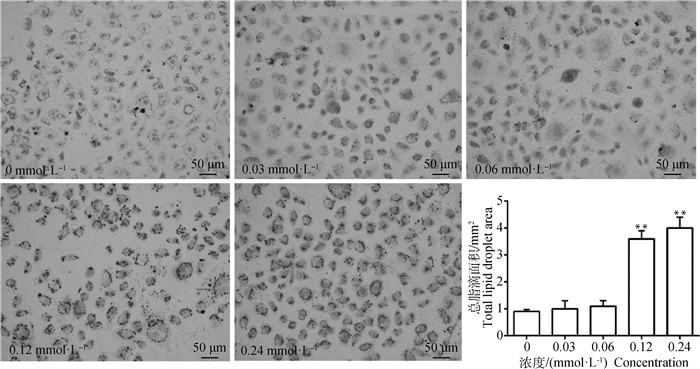
|
与对照组相比,**表示差异极显著(P < 0.01) Compared with control group, **.P < 0.01 图 2 油酸处理BRL-3A细胞总脂滴面积结果分析 Fig. 2 Analysis of total lipid droplet area of BRL-3A cells treated with oleic acid |
表 2所示,向细胞中添加不同浓度(0.03、0.06、0.12、0.24 mmol·L-1)的油酸。发现与对照组相比,0.06 mmol·L-1油酸处理后,TG含量显著上升(P < 0.05);并且在0.12和0.24 mmol·L-1油酸处理后,TG含量极显著上升(P < 0.01),提示造成了BRL-3A细胞的脂质蓄积。与对照组相比,0.12和0.24 mmol·L-1油酸处理后,BRL-3A细胞AST和ALT活性显著上升(P < 0.05);其他浓度的油酸处理细胞后,AST和ALT活性均无显著差异。
|
|
表 2 油酸对BRL-3A细胞三酰甘油(TG)、天门冬氨酸氨基转移酶(AST)及丙氨酸氨基转移酶(ALT)的影响分析(x±s) Table 2 Analysis of oleic acid on TG, AST and ALT in BRL-3A cells (x±s) |
综合以上细胞活力、细胞总脂滴面积、TG含量和AST、ALT活性测定结果,本试验用不同浓度油酸诱导建立BRL-3A细胞体外脂肪变性模型的条件: 0.12 mmol·L-1油酸,培养时间为24 h。因此,后续选取0.12 mmol·L-1油酸进行诱导脂肪变性细胞模型处理试验。
2.4 不同浓度乙酸钠对脂肪变性细胞模型总凋亡率的影响分别用低(2 mmol·L-1)、中(4 mmol·L-1)、高(8 mmol·L-1)浓度的乙酸钠作用BRL-3A细胞24 h后,通过流式细胞术检测细胞凋亡率,发现不同浓度的乙酸钠对细胞凋亡率均无影响(图 3),证明乙酸钠对细胞无毒害作用,可以进行下一步试验。
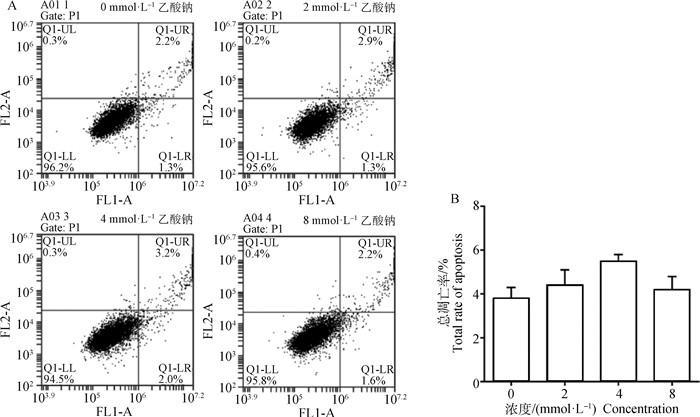
|
图 3 乙酸钠对BRL-3A细胞总凋亡率分析 Fig. 3 Analysis of sodium acetate on total apoptosis rate of BRL-3A cells |
图 4所示,用0.12 mmol·L-1油酸分别和2、4、8 mmol·L-1的乙酸钠共同孵育细胞24 h后,与油酸处理组相比,4 mmol·L-1乙酸钠+油酸处理组和8 mmol·L-1+油酸处理组细胞总脂滴面积和每平方毫米脂滴数极显著下降(P < 0.01)。提示,4和8 mmol·L-1的乙酸钠可以显著降低脂肪变性细胞模型的脂质堆积。
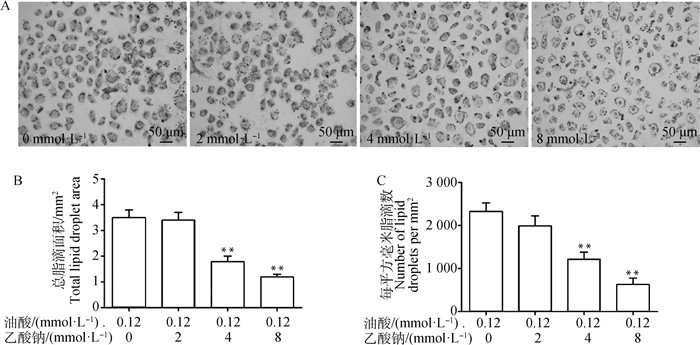
|
与油酸处理组相比,**. P < 0.01 Compared with oleic acid treatment group, **.P < 0.01 图 4 乙酸钠对脂肪变性细胞模型脂滴影响分析 Fig. 4 Analysis of sodium acetate on lipid droplets in steatosis cell models |
表 3所示,向细胞中添加不同浓度的乙酸钠后,发现与油酸处理组相比,4 mmol·L-1乙酸钠+油酸处理后,TG含量、AST活性和ALT活性均显著下降(P < 0.05);并且在8 mmol·L-1乙酸钠+油酸处理后,与对照组相比,TG含量极显著下降(P < 0.01),ALT、AST活性均显著下降(P < 0.05)。
|
|
表 3 乙酸钠对脂肪变性细胞模型三酰甘油(TG)、天门冬氨酸氨基转移酶(AST)及丙氨酸氨基转移酶(ALT)的影响分析(x±s) Table 3 Analysis of sodium acetate on TG, AST and ALT in steatosis cell models (x±s) |
进一步检测细胞AMPK相关信号通路,结果发现(图 5),与油酸处理组相比,4 mmol·L-1乙酸钠+油酸处理组P-AMPK表达水平显著上调(P < 0.05);8 mmol·L-1乙酸钠+油酸处理组P-AMPK表达水平极显著上调(P < 0.01)。提示,乙酸钠激活了脂肪变性细胞模型的AMPK信号通路。
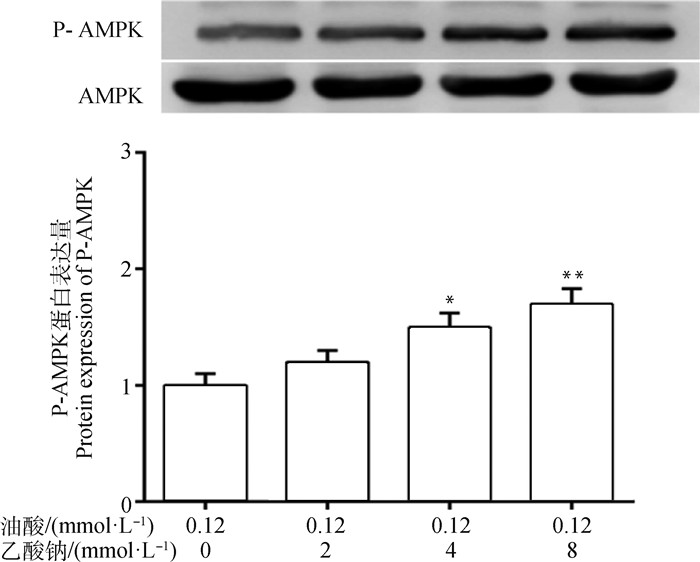
|
与油酸处理组相比,*.P < 0.05, **.P < 0.01 Compared with oleic acid treatment group, *.P < 0.05, **.P < 0.01 图 5 脂肪变性细胞模型P-AMPK蛋白表达水平变化 Fig. 5 The P-AMPK protein expression level in steatosis cell models |
通过检测与AMPK信号通路下游相关的关键脂合成代谢基因,图 6A发现, 与油酸处理组相比,4 mmol·L-1乙酸钠+油酸处理组和8 mmol·L-1乙酸钠+油酸处理组ACC mRNA表达含量均显著下降(P < 0.05);图 6B发现, 与油酸处理组相比,8 mmol·L-1乙酸钠+油酸处理组FAS mRNA表达含量显著下降(P < 0.05),而其他乙酸钠+油酸处理组与油酸处理组相比,均无显著差异;图 6C发现与油酸处理组相比,2、4、8 mmol·L-1乙酸钠+油酸处理组SCD-1 mRNA表达含量均显著下降(P < 0.05)。
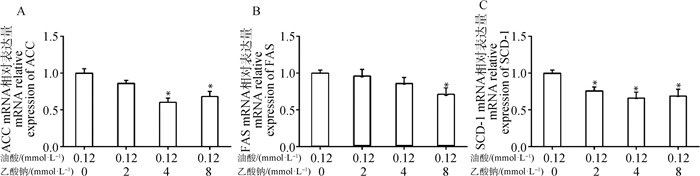
|
与油酸处理组相比,*.P < 0.05 Compared with oleic acid treatment group, *.P < 0.05 图 6 脂肪变性细胞模型脂合成代谢基因表达 Fig. 6 The expression levels of lipid anabolism genes in steatosis cell models |
通过检测与AMPK信号通路下游相关的关键脂分解代谢基因,图 7A发现与油酸处理组相比,4 mmol·L-1乙酸钠+油酸处理组和8 mmol·L-1乙酸钠+油酸处理组CPT-1 mRNA表达量均显著上升(P < 0.05);图 7B发现,与油酸处理组相比,8 mmol·L-1乙酸钠+油酸处理组CPT-2 mRNA表达量显著上升(P < 0.05);而图 7C发现,2、4、8 mmol·L-1乙酸钠+油酸处理组ACO mRNA表达量,与油酸处理组相比,均无显著差异。
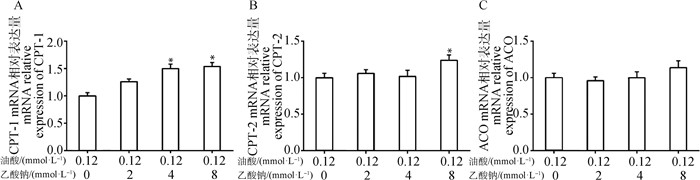
|
与油酸处理组相比,*.P < 0.05 Compared with oleic acid treatment group, *.P < 0.05 图 7 脂肪变性细胞模型脂分解代谢基因表达 Fig. 7 The expression levels of lipid catabolism genes in steatosis cell models |
脂肪肝的发生与动物肝脂质代谢的异常有关。NAFLD是一种以肝细胞内脂质过度积聚为特征的疾病。如果动物没有得到及时治疗,NAFLD就可能从单纯性肝脂肪变性发展为非酒精性脂肪性肝炎,或者发展为肝纤维化、肝硬化甚至肝细胞癌。动物超重、胰岛素抵抗、圈养、饮食模式改变、遗传因素以及肠道屏障功能的紊乱都有可能导致NAFLD[11]。
目前,脂肪肝动物模型的构建通常通过高脂、高糖、四环素等毒物或药物构建[12-13];而体外脂肪变性模型的构建通常采用油酸、脂肪酸、棕榈酸等处理方法[14-15]。本试验首先用不同浓度的油酸诱导BRL-3A细胞,经细胞活力测定分析发现,向细胞中添加(0.03、0.06、0.12、0.24、0.48)mmol·L-1油酸后,与对照组相比,只有0.48 mmol·L-1油酸对细胞有明显的抑制作用,证明0.48 mmol·L-1油酸对BRL-3A细胞毒性较大,并且通过显微镜观察发现细胞出现受损死亡等情况,而其他浓度的油酸对BRL-3A细胞无毒副作用。通过油红O染色进一步检测细胞总脂滴面积,发现与对照组相比,0.12和0.24 mmol·L-1油酸处理后细胞总脂滴面积极显著上升。转氨酶是肝损伤的主要标志物,主要由AST和ALT组成。其中,AST主要分布于心肌、肝、肾等组织,而ALT则主要分布于肝组织中[16]。医学上当超过5%脂肪堆积在肝中时,就称为脂肪肝。本试验油酸浓度为0.06 mmol·L-1时,TG含量就增加了一倍;并且在0.12和0.24 mmol·L-1油酸处理后,TG含量极显著上升,同时AST和ALT活性皆升高,提示肝细胞出现损伤。所以结合上述细胞总脂滴面积结果,当油酸浓度为0.12 mmol·L-1,刺激时间为24 h,即可成功构建脂肪变性细胞模型。
短链脂肪酸是肠道菌群膳食纤维的主要代谢产物。乙酸、丙酸和丁酸是人类肠道中最丰富的短链脂肪酸[17]。短链脂肪酸不仅是代谢底物,也是调节肝代谢的信号分子[18]。乙酸是动物机体内最主要的短链脂肪酸之一,占体循环内短链脂肪酸含量的一半以上。乙酸除了能作为能量底物和碳源参与机体内代谢活动外,还对机体脂肪代谢、食欲调节和胰岛素抵抗等方面具有重要作用[19-21]。白鸽等[22]研究发现,向牛肝细胞中添加乙酸钠,会加速肝脂肪酸的氧化。本试验通过流式细胞术检测细胞凋亡率,发现不同浓度的乙酸钠对正常的BRL-3A细胞凋亡率均无影响,证明乙酸钠对细胞无毒副作用,可用于后续研究。进一步用4和8 mmol·L-1乙酸钠处理脂肪变性细胞模型后,均使细胞总脂滴面积、每平方毫米脂滴数、TG含量下降,AST和ALT活性皆下调,这与前人的研究结果一致。提示乙酸钠可以显著降低脂肪变性细胞模型的脂质堆积,缓解肝细胞损伤,具体机制有待进一步研究证实。
肝是调节脂质代谢、维持脂质稳态的重要器官。AMPK是肝细胞中能量的“传感器”和“调节器”。AMPK可调控脂质代谢酶的表达来调节肝脂质代谢。因此,AMPK信号通路在肝脂质代谢中起中心作用[23]。研究表明,乙酸可激活AMPK,AMPK进而上调肝中脂质氧化基因的表达,减少脂肪堆积[9, 24-25]。小鼠肝特异性AMPK缺失导致血浆TG含量和肝脂肪生成增加[26]。AMPK还可以通过调控骨骼肌中葡萄糖摄取和游离脂肪酸氧化,抑制肝中的糖异生、糖酵解、脂肪生成和胆固醇形成[27]。本试验发现,用不同浓度乙酸钠处理脂肪变性细胞模型后,4和8 mmol·L-1乙酸钠均可激活AMPK信号通路关键蛋白。
TG是细胞内和血浆中脂肪酸储存和运输的主要形式。肝是脂肪酸代谢的中心器官,肝细胞通过从血浆中摄取和从头生物合成的方式在肝中积累脂肪酸[28]。脂肪酸的从头合成主要受相关关键酶所调控,其中,乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)可以将乙酰辅酶A羧化生成丙二酰辅酶A[29];脂肪酸合成酶(fatty acid synthetase,FAS)是催化脂肪酸从头生成的最后一步[30];SCD-1是单不饱和脂肪酸合成的关键调控因子[31]。而脂肪酸的分解代谢受CPT-1、CPT-2等酶的调控,主要是将脂肪酸转运到线粒体进行氧化分解,这是脂肪酸在β-氧化过程中的限速步骤[32]。本研究发现,用不同浓度的乙酸钠处理脂肪变性细胞模型后,4和8 mmol·L-1乙酸钠均会导致细胞ACC mRNA表达量显著下降;8 mmol·L-1乙酸钠会导致FAS mRNA表达量显著下降;而2、4、8 mmol·L-1乙酸钠均可使SCD-1 mRNA表达量显著下降。4和8 mmol·L-1乙酸钠会导致与脂肪酸分解代谢的相关酶CPT-1 mRNA表达量显著上调;而8 mmol·L-1乙酸钠会导致CPT-2 mRNA表达量显著上调。提示,乙酸钠主要通过CPT-1促进了脂肪变性细胞模型胞液中脂肪酸转运到线粒体进行氧化分解,并且通过SCD-1进一步抑制了饱和脂肪酸催化合成单不饱和脂肪酸,进而降低了细胞中脂质的含量。以上结果表明,乙酸钠可通过AMPK信号通路调控脂肪变性细胞模型脂代谢关键酶的活性,促使脂肪酸的从头合成途径被抑制,激活脂肪酸的分解途径,进而减少BRL-3A细胞TG的合成。
4 结论油酸诱导的脂肪变性细胞模型,会造成肝细胞受到一定程度的损伤。而用不同浓度乙酸钠会通过AMPK信号通路促进脂肪酸的分解代谢,进而减少TG的合成,同时可以抑制肝细胞损伤,从而缓解脂肪变性所带来的负面影响,为今后NAFLD的治疗提供了新的理论依据和切入点。
| [1] |
崔一喆, 王秋菊, 张秀英, 等. 核转录因子NF-E2相关因子基因缺失对高脂饲粮诱导非酒精性脂肪肝模型小鼠肝脏的影响[J]. 动物营养学报, 2015, 27(4): 1310-1315. CUI Y Z, WANG Q J, ZHANG X Y, et al. Effects of nuclear factor erythroid 2-like 2 deficiency on the liver of high fat diet induced nonalcoholic fatty liver disease mouse model[J]. Chinese Journal of Animal Nutrition, 2015, 27(4): 1310-1315. DOI:10.3969/j.issn.1006-267x.2015.04.038 (in Chinese) |
| [2] |
LIN H, TENG H L, WU W, et al. Pharmacokinetic and metabolomic analyses of Mangiferin calcium salt in rat models of type 2 diabetes and non-alcoholic fatty liver disease[J]. BMC Pharmacol Toxicol, 2020, 21(1): 59. DOI:10.1186/s40360-020-00438-x |
| [3] |
ROSS M S C M, POLUHOWICH J J. The effect of apple cider vinegar on adjuvant arthritic rats[J]. Nutr Res, 1984, 4(4): 737-741. DOI:10.1016/S0271-5317(84)80049-4 |
| [4] |
REN H F, ENDO H, WATANBE E, et al. Chemical and sensory characteristics of Chinese, Korean, and Japanese vinegars[J]. J Tokyo Univ Fish, 1997, 84(1): 1-11. |
| [5] |
ARITSUKA T, TANAKA K, KIRIYAMA S. Effect of beet dietary fiber on lipid metabolism in rats fed a cholesterol-free diet in comparison with pectin and cellulose[J]. Eiyo to Shokuryo, 1989, 42(4): 295-304. |
| [6] |
HARA H, HAGA S, AOYAMA Y, KIRIYAMA S. Short-chain fatty acids suppress cholesterol synthesis in rat liver and intestine[J]. J Nutr, 1999, 129(5): 942-948. DOI:10.1093/jn/129.5.942 |
| [7] |
PALMA E, JAN DOORNEBAL E, CHOKSHI S. Precision-cut liver slices: a versatile tool to advance liver research[J]. Hepatol Int, 2019, 13(1): 51-57. DOI:10.1007/s12072-018-9913-7 |
| [8] |
KONDO T, KISHI M, FUSHIMI T, et al. Acetic acid upregulates the expression of genes for fatty acid oxidation enzymes in liver to suppress body fat accumulation[J]. J Agric Food Chem, 2009, 57(13): 5982-5986. DOI:10.1021/jf900470c |
| [9] |
SAKAKIBARA S, YAMAUCHI T, OSHIMA Y, et al. Acetic acid activates hepatic AMPK and reduces hyperglycemia in diabetic KK-A(y) mice[J]. Biochem Biophys Res Commun, 2006, 344(2): 597-604. DOI:10.1016/j.bbrc.2006.03.176 |
| [10] |
李林, 李建嫄, 赵梅, 等. 基于AMPK信号通路研究LPS对奶牛乳腺上皮细胞脂代谢的调控机理[J]. 畜牧与兽医, 2021, 53(12): 41-48. LI L, LI J Y, ZHAO M, et al. Determination of the regulation mechanism of LPS on lipid metabolism in bovine mammary epithelial cells based on the AMPK signaling pathway[J]. Animal Husbandry & Veterinary Medicine, 2021, 53(12): 41-48. (in Chinese) |
| [11] |
孙立平, 洪彩玲, 李晶华, 等. 非肥胖型与肥胖型非酒精性脂肪性肝病进展性肝纤维化临床特点分析[J]. 现代临床医学, 2022, 48(1): 6-8. SUN L P, HONG C L, LI J H, et al. Clinical characteristics of non-obese and obese patients with nonalcoholic fatty liver disease and advanced fibrosis[J]. Journal of Modern Clinical Medicine, 2022, 48(1): 6-8. (in Chinese) |
| [12] |
李美蕖, 田书云, 张迪. 非酒精性脂肪肝C57BL/6 J小鼠模型建立[J]. 山东化工, 2021, 50(20): 162-164, 167. LI M Q, TIAN S Y, ZHANG D. Establishment of non-alcoholic fatty liver model in mice[J]. Shandong Chemical Industry, 2021, 50(20): 162-164, 167. DOI:10.3969/j.issn.1008-021X.2021.20.058 (in Chinese) |
| [13] |
颜思宇. 四环素诱导非酒精性脂肪肝的生化机制研究[D]. 长沙: 湖南师范大学, 2014. YAN S Y. The biochemical mechanism studied on tetracycline-induced nonalcoholic fatty liver disease[D]. Changsha: Hunan Normal University, 2014. (in Chinese) |
| [14] |
王换换, 刘颖, 李帅, 等. 肾素-血管紧张素系统2条通路在油酸致大鼠BRL-3A细胞非酒精性脂肪肝中的作用[J]. 南京农业大学学报, 2020, 43(5): 910-918. WANG H H, LIU Y, LI S, et al. Role of two pathways of renin-angiotensin system in oleic acid-induced non-alcoholic fatty liver disease in mouse BRL-3A cells[J]. Journal of Nanjing Agricultural University, 2020, 43(5): 910-918. (in Chinese) |
| [15] |
ZHANG H Y, WANG J C, YANG L, et al. Effect of oleic acid on induction of steatosis and cytotoxicity in BRL 3A cells[J]. J Cell Biochem, 2019, 120(12): 19541-19554. DOI:10.1002/jcb.29262 |
| [16] |
PIRIMOǔLU B, SADE R, POLAT G, et al. Analysis of correlation between liver fat fraction and AST and ALT levels in overweight and obese children by using new magnetic resonance imaging technique[J]. Turk J Gastroenterol, 2020, 31(2): 156-162. DOI:10.5152/tjg.2020.18594 |
| [17] |
WANG C, GAO Z P, QIAN Y J, et al. Effects of different concentrations of Ganpu tea on fecal microbiota and short chain fatty acids in mice[J]. Nutrients, 2021, 13(11): 3715. DOI:10.3390/nu13113715 |
| [18] |
MORRISON D J, PRESTON T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism[J]. Gut Microbes, 2016, 7(3): 189-200. DOI:10.1080/19490976.2015.1134082 |
| [19] |
FROST G, SLEETH M L, SAHURI-ARISOYLU M, et al. The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism[J]. Nat Commun, 2014, 5: 3611. DOI:10.1038/ncomms4611 |
| [20] |
BOSE S, RAMESH V, LOCASALE J W. Acetate metabolism in physiology, cancer, and beyond[J]. Trends Cell Biol, 2019, 29(9): 695-703. DOI:10.1016/j.tcb.2019.05.005 |
| [21] |
HERNÁNDEZ M A G, CANFORA E E, JOCKEN J W E, et al. The short-chain fatty acid acetate in body weight control and insulin sensitivity[J]. Nutrients, 2019, 11(8): 1943. DOI:10.3390/nu11081943 |
| [22] |
白鸽, 许远靖, 王冲, 等. 乙酸和β-羟丁酸对体外培养牛肝细胞脂代谢部分关键酶表达的影响[J]. 中国兽医学报, 2012, 32(1): 69-72, 88. BAI G, XU Y J, WANG C, et al. Effects of acetic acid and β-hydroxybutyrate on expression of key enzyme genes involved to fatty acid metabolism in bovine hepatocytes cultured in vitro[J]. Chinese Journal of Veterinary Science, 2012, 32(1): 69-72, 88. (in Chinese) |
| [23] |
WANG Q, LIU S D, ZHAI A H, et al. AMPK-mediated regulation of lipid metabolism by phosphorylation[J]. Biol Pharm Bull, 2018, 41(7): 985-993. |
| [24] |
李林, 曹萌, 宫彬彬, 等. 丁酸钠通过AMPK通路调控LPS造成牛乳腺上皮细胞脂代谢紊乱的作用机制[J]. 畜牧兽医学报, 2022, 53(9): 3221-3230. LI L, CAO M, GONG B B, et al. The mechanism of sodium butyrate through AMPK pathway to regulate lipid metabolism disorder caused by LPS in bovine mammary epithelial cells[J]. Acta Veterinaria Et Zootechnica Sinica, 2022, 53(9): 3221-3230. (in Chinese) |
| [25] |
SABATER A G, RIBOT J, PRIEGO T, et al. Consumption of a mango fruit powder protects mice from high-fat induced insulin resistance and hepatic fat accumulation[J]. Cell Physiol Biochem, 2017, 42(2): 564-578. |
| [26] |
ANDREELLI F, FORETZ M, KNAUF C, et al. Liver adenosine monophosphate-activated kinase-α2 catalytic subunit is a key target for the control of hepatic glucose production by adiponectin and leptin but not insulin[J]. Endocrinology, 2006, 147(5): 2432-2441. |
| [27] |
HARDIE D G. AMP-activated protein kinase: a master switch in glucose and lipid metabolism[J]. Rev Endocr Metab Disord, 2004, 5(2): 119-125. |
| [28] |
HEEREN J, SCHEJA L. Metabolic-associated fatty liver disease and lipoprotein metabolism[J]. Mol Metab, 2021, 50: 101238. |
| [29] |
孙梅, 李大彪, 邢媛媛, 等. 氢化可的松对奶牛乳腺上皮细胞乳脂肪合成的影响[J]. 中国细胞生物学学报, 2017, 39(9): 1156-1164. SUN M, LI D B, XING Y Y, et al. The effect of hydrocortisone on milk fat synthesis in bovine mammary epithelial cells[J]. Chinese Journal of Cell Biology, 2017, 39(9): 1156-1164. (in Chinese) |
| [30] |
SCHVTTER M, GIAVALISCO P, BRODESSER S, et al. Local fatty acid channeling into phospholipid synthesis drives Phagophore expansion during autophagy[J]. Cell, 2020, 180(1): 135-149. e14. |
| [31] |
LEE S M, LEE M H, SON Y K, et al. Omega-3 fatty acid decreases oleic acid by decreasing SCD-1 expression in the liver and kidney of a cyclosporine-induced nephropathy rat model[J]. Ren Fail, 2019, 41(1): 211-219. |
| [32] |
JOSHI P R, ZIERZ S. Muscle carnitine Palmitoyltransferase Ⅱ (CPT Ⅱ) deficiency: a conceptual approach[J]. Molecules, 2020, 25(8): 1784. |
(编辑 白永平)



