2. 江苏动物重要疫病与人兽共患病防控协同创新中心,扬州 225009;
3. 江苏省人兽共患病学重点实验室,扬州 225009;
4. 宿迁学院,宿迁 223800
2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China;
3. Jiangsu Key Laboratory of Zoonosis, Yangzhou 225009, China;
4. Suqian University, Suqian 223800, China
鸡球虫病是集约化养鸡场最常见的疾病之一,由艾美耳属(Eimeria)的一种或多种球虫混合感染引起,其病原有7种,其中毒害艾美耳球虫(Eimeria necatrix)主要危害8~18周龄的青年鸡,可引起鸡的急性小肠球虫病,导致育成鸡的大批死亡[1]。艾美耳球虫的发育经历裂殖生殖、配子生殖和孢子生殖三个发育阶段[2]。迄今,对艾美耳球虫的发育过程和虫体形态结构的研究已较为清晰,但有关调控艾美耳球虫生长发育和性别分化的调控机制尚不清楚。AP2(Apetala2)结构域最初发现于多种植物的转录因子中,能与含特定基序的DNA序列结合,在调控植物发育进程中发挥重要作用,参与包括植物生长、发育、损伤、病菌防御、耐旱等多种生物学过程[3]。在疟原虫(Plasmodium spp.)、弓形虫(Toxoplasma gondii)、泰勒虫(Theileria spp.)和隐孢子虫(Cryptosporidium spp.)等顶复门原虫(Apicomplexa)的基因组中也存在含编码AP2结构域的基因[4-7],且AP2结构域高度保守,可能是调控顶复门原虫生长发育的转录因子[8],称为ApiAP2(apicomplexan AP2)转录因子[9]。虽然含有编码AP2结构域的假定基因也见于艾美耳球虫的基因组,但迄今尚未见有艾美耳球虫ApiAP2蛋白及其功能的报道。本研究室前期对毒害艾美耳球虫第2、3代裂殖子和配子体进行转录组测序分析时,获得了5个编码ApiAP2假定蛋白的mRNA完整序列[10]。为了进一步证实毒害艾美耳球虫ApiAP2假定蛋白是否真实存在,本文选取其中一个ApiAP2基因(ENH_00077450)进行克隆与表达,用重组蛋白rEnApiAP2制备鼠多克隆抗体,再用鼠多克隆抗体检测裂殖子中天然EnApiAP2蛋白,用间接免疫荧光技术分析EnApiAP2蛋白在虫体中的亚细胞定位,最后用荧光定量PCR方法分析该基因的表达特性。研究结果为进一步分析EnApiAP2蛋白在毒害艾美耳球虫生长发育与性别分化进程中的作用奠定了基础。
1 材料与方法 1.1 虫株、菌株、质粒与实验动物毒害艾美耳球虫扬州株,由扬州大学兽医学院寄生虫学教研室经单卵囊分离建株;毒害艾美耳球虫第2、3代裂殖子,由本实验室分离保存;感受态细胞DH5α和BL21(DE3),由本实验室保存;克隆载体pMD18-T购自TaKaRa公司;原核表达载体pET28a(+)购自Invitrogen公司;6周龄BALB/c雄性小鼠购自扬州大学比较医学中心。本项研究中所有试验方案符合扬州大学动物伦理、福利等相关条例规定,符合江苏省科技厅动物福利保护条例,许可证编号:SCXK(苏)2021-0013。
1.2 主要试剂PrimeSTAR Max DNA Polymerase,TaKaRa Taq,DNA Ligation Kit,MiniBEST Universal RNA Extraction Kit,Mighty TA-cloning Reagent Set for PrimeSTAR,MiniBEST DNA Fragment Purification Kit,MiniBEST Plasmid Purification Kit,6×Loading Buffer,BamH Ⅰ限制性内切酶和Sal Ⅰ限制性内切酶,购自TaKaRa公司;HiScript III 1st Strand cDNA Synthesis Kit,SYBR Green Master Mix,购自诺唯赞公司;QuickAntibody-Mouse3 W,购自博奥龙免疫技术有限公司;硝酸纤维素膜,购自默克公司;ECL化学发光试剂,购自Tanon公司;Anti-6×His标签小鼠单抗和HRP标记的兔抗鼠IgG,购自BBI公司;HRP标记的羊抗鸡IgG和FITC标记的羊抗鼠IgG (H+L),购自HPL公司;Ni-NTA亲和层析介质,购自金斯瑞公司;鸡抗毒害艾美耳球虫、抗柔嫩艾美耳球虫、抗巨型艾美耳球虫和抗堆型艾美耳球虫康复血清,由本实验室制备保存。
1.3 EnApiAP2基因的扩增与克隆用Primer 5.0软件设计特异性引物,预计扩增片段为1 830 bp左右。上游引物:5′-ATGGCCGGACTAGACGCT-3′,下游引物:5′-TTATTTACTTTTGCACACCATTC-3′,引物由六合华大基因科技股份有限公司合成。参照RNA提取试剂盒步骤,提取毒害艾美耳球虫第3代裂殖子的总RNA,RT-PCR扩增目的基因。PCR产物回收、纯化后,克隆至pMD18-T载体中,选取经克隆载体通用引物鉴定为阳性的克隆送六合华大公司测序,并将重组质粒命名为pMD18-T-EnApiAP2。
1.4 核苷酸及其编码的氨基酸序列、抗原性分析将测序得到的EnApiAP2基因序列与GenBank中收录的毒害艾美耳球虫Houghton株和柔嫩艾美耳球虫Houghton株基因序列进行比对,并使用Lasergene软件对其编码的氨基酸进行蛋白亲水性、抗原性、二级结构等参数分析。用网站(http://www.moseslab.csb.utoronto.ca/NLStradamus/)在线软件预测蛋白的核定位信号序列。
1.5 表达载体的构建与鉴定根据表达质粒pET28a(+)上具备的酶切位点及EnApiAP2基因序列,设计得到特异性引物。上游引物:5′-CGCGGATCCATGGCCGGACTAGACGCT-3′,含BamH Ⅰ酶切位点(划线部分)和3个保护性碱基;下游引物:5′-ACGCGTCGACTTTACTTTTGCACACCATTC-3′,含SalⅠ酶切位点(划线部分)和4个保护性碱基。以重组质粒pMD18-T-EnApiAP2为模板,PCR扩增后回收目的条带,与表达载体pET28a(+)分别进行BamHⅠ和SalⅠ双酶切;solution I连接酶连接目的片段和表达载体,构建重组表达质粒pET28a(+)-EnApiAP2并转化至感受态细胞BL21(DE3);选取经BamHⅠ和SalⅠ双酶切鉴定为阳性的克隆送至六合华大公司测序。
1.6 重组蛋白的诱导表达、鉴定和纯化复性将重组菌接种于含有卡那霉素(100 μg·mL-1) 的LB液体培养基中,37 ℃,200 r·min-1震荡培养3 h。接着加入终浓度1 mmol·L-1的异丙基硫代半乳糖苷(IPTG),37 ℃,180 r·min-1诱导表达4 h。同时设置pET-28a(+)空质粒转化菌和未转化的BL21(DE3)作对照。取1 mL诱导菌,PBS洗涤3次,150 μL PBS重悬菌体,加入50 μL 4×SDS-PAGE上样缓冲液并煮沸10 min,12 000 r·min-1离心10 min,取上清进行12% SDS-PAGE检测表达情况。
为鉴定重组蛋白,将诱导的阳性重组菌蛋白和pET-28a(+)空质粒转化菌蛋白进行12% SDS-PAGE电泳,并转印至NC膜上。将NC膜置于含3% BSA的封闭液中,37 ℃封闭1 h。以6×HIS标签单克隆抗体(按1∶5 000倍稀释)为一抗、HRP标记的兔抗鼠IgG(按1∶15 000倍稀释)为二抗进行孵育,滴加ECL显色,用化学发光成像系统观察结果并扫描拍照。
鉴定后取4 mL诱导菌,PBS洗涤3次,500 μL PBS重悬菌体,冰浴超声裂解,4 ℃ 12 000 r·min-1离心10 min,上清和沉淀分别进行SDS-PAGE分析,确定重组蛋白的存在形式。
将上述阳性菌体进行扩大培养,诱导表达500 mL菌液,离心收集洗涤重悬菌体,超声破碎,收集沉淀获得大量重组蛋白。用Ni-NTA亲和层析柱纯化重组蛋白,并分别经6、4、2、1 mol·L-1尿素浓度的透析液和0.1 mol·L-1 PBS复性[11],A280紫外光吸收法测定蛋白浓度。
1.7 小鼠抗rEnApiAP2多克隆抗体的制备参照QuickAntibody-Mouse3 W使用说明书,将纯化复性后的重组蛋白用生理盐水稀释至2 μg·μL-1,取50 μL佐剂与50 μL稀释后的重组蛋白混匀,采取小鼠腿部肌肉注射方式,每只小鼠注射量为100 μL。第14天按相同方式和剂量加强免疫1次,第21天对小鼠摘眼球采血,3 000 r·min-1离心10 min分离血清。阴性对照为未免疫小鼠血清。间接ELISA方法[12]测定血清抗体滴度,以阳性血清大于阴性血清2倍的最大稀释倍数为血清的效价。
1.8 重组蛋白的抗原性与交叉反应原性分析Western blot检测重组蛋白的抗原性,取诱导的阳性重组菌蛋白和pET28a(+)空质粒转化菌蛋白进行12% SDS-PAGE电泳,并转移到NC膜上。一抗分别为鼠抗rEnApiAP2多克隆抗体和鸡抗毒害艾美耳球虫康复血清,二抗分别为HRP标记的兔抗鼠IgG和羊抗鸡IgG。
同样的方法进行Western blot,检测重组蛋白分别对柔嫩艾美耳球虫、巨型艾美耳球虫和堆型艾美耳球虫的交叉反应原性,一抗分别为3种鸡抗艾美耳球虫康复血清,二抗为HRP标记的羊抗鸡IgG。
1.9 天然虫体EnApiAP2蛋白检测取毒害艾美耳球虫第2代和第3代裂殖子,3 000 r·min-1离心6 min,300 μL PBS重悬,分别冰浴超声裂解;分别加入100 μL 4×SDS-PAGE上样缓冲液并煮沸10 min,8 000 r·min-1离心1 min,取上清进行12% SDS-PAGE电泳,并转移到NC膜上;将NC膜置于含3% BSA的封闭液中,37 ℃封闭1 h。以鼠抗rEnApiAP2多克隆抗体(按1∶200倍稀释)为一抗、HRP标记的兔抗鼠IgG(按1∶10 000倍稀释)为二抗进行孵育,滴加ECL显色,用化学发光成像系统观察结果并扫描拍照。
1.10 EnApiAP2蛋白在虫体中的定位取毒害艾美耳球虫第2代和第3代裂殖子分别均匀涂布于载玻片上,在涂布处滴加适量甲醇,置于-20 ℃作用10 min,PBST洗涤3次,每次5 min;滴加适量0.1%的Triton X-100,室温作用10 min,PBST洗涤3次,每次5 min;置于含3% BSA的封闭液中,37 ℃封闭1 h;以鼠抗rEnApiAP2多克隆抗体(按1∶200倍稀释)为一抗,湿盒内37 ℃作用1 h,PBST洗涤3次,每次5 min;以FITC标记的羊抗鼠IgG (H+L)(按1∶1 000倍稀释)为二抗,湿盒内37 ℃作用1 h,PBST洗涤3次,每次5 min;待载玻片自然晾干后,滴加抗荧光淬灭封片液(含DAPI),盖玻片封片,超高分辨率激光共聚焦显微镜观察结果并拍照。同时,设置阴性小鼠血清对照组。
1.11 EnApiAP2基因的转录水平检测用荧光定量PCR方法对EnApiAP2基因在第2代和第3代裂殖子发育阶段转录水平进行检测。使用Primer 5.0软件设计引物,上游引物:5′-CAAGATTGCTGTGCGAGTGGT-3′,下游引物:5′-TCCATTGCCTTGTGCTTAGTG-3′。将毒害艾美耳球虫5.8S rRNA作为内参基因,设计特异性引物,上游引物:5′-TTCATACTGCGTCTAATGCACC-3′;下游引物:5′-CGAGTCCCTACCGCAGTACTA-3′。采用SYBR Green Master Mix荧光定量试剂盒进行定量。每个样品设置3个重复,记录每个基因在不同样品中表达的Ct值,运用近似值法2-ΔΔCt计算各组样品的相对表达量[13]。用GraphPad Prism软件对相对表达量进行分析,用t检验分析两组间差异性(P<0.01,表示差异极显著)。
2 结果 2.1 EnApiAP2基因的克隆及序列分析通过RT-PCR扩增,获得片段大小为1 830 bp左右,与预期相符(图 1)。测序与序列分析显示,EnApiAP2基因全长1 830 bp,编码610个氨基酸,预测分子质量为67.69 ku,等电点(PI)为9.20。将此序列提交至GenBank,获取的蛋白质登录号为OM909016。与收录在GenBank中的7种鸡艾美耳球虫ApiAP2蛋白全长及其AP2结构域的氨基酸序列比对,发现此序列与毒害艾美耳球虫豪顿株(XP_0134438482.1)、柔嫩艾美耳球虫(XP_013232114.1)的相似性较高,分别为99.7%、100%和90.4%、100%,而与其他5种鸡球虫的相似性在19.8%~30.3%、64.1%~82.1%。BepiPred软件预测该基因编码蛋白含有25个抗原决定簇;NCBI网站预测第119—157位氨基酸含有一个AP2结构域;NLStradamus网站预测第361—372位氨基酸为核定位信号序列。用Lasergene软件比较毒害艾美耳球虫与另外6种鸡艾美耳球虫和6种顶复门原虫的ApiAP2蛋白氨基酸序列,发现它们的AP2结构域高度保守,均包含1个α-螺旋和3个β-折叠结构(图 2)。
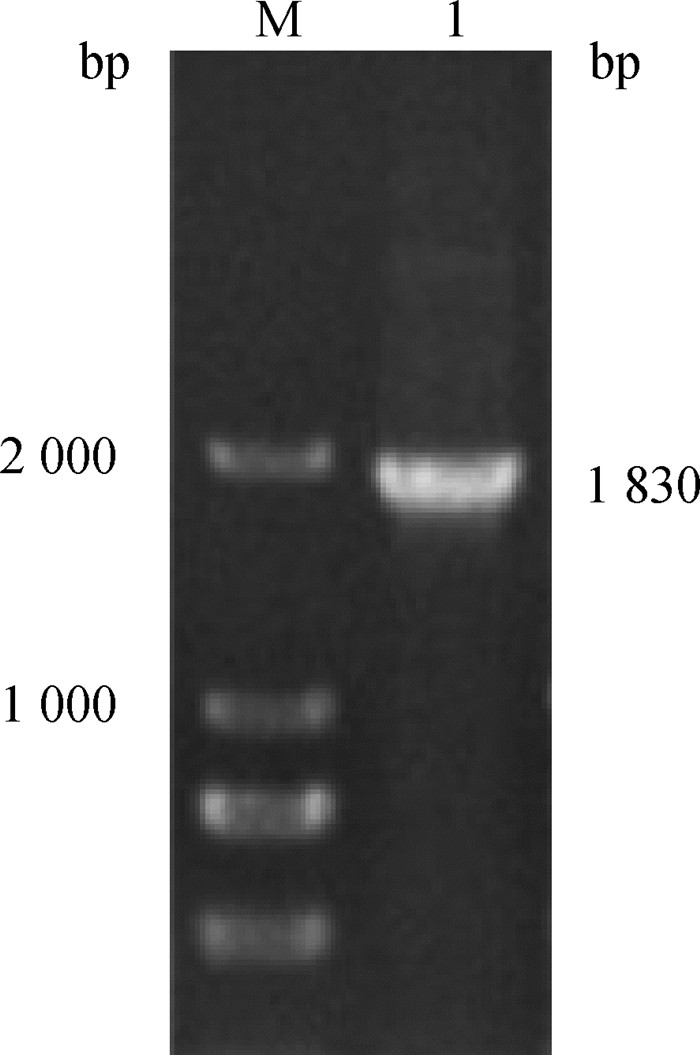
|
M. DNA分子质量标准;1. EnApiAP2基因扩增产物 M. DL 2000 DNA marker; 1. The amplification of EnApiAP2 gene 图 1 EnApiAP2基因的PCR扩增 Fig. 1 Amplification of EnApiAP2 gene by PCR |
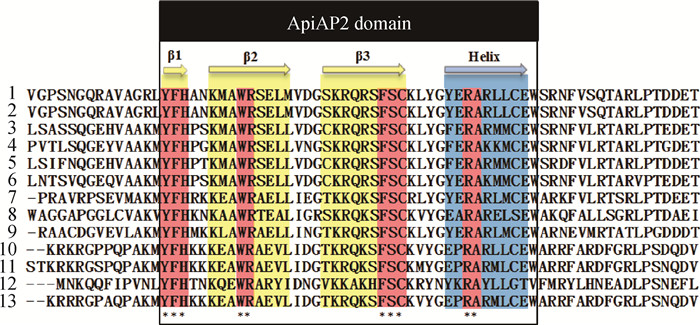
|
1.毒害艾美耳球虫(扬州株);2.柔嫩艾美耳球虫;3.早熟艾美耳球虫;4.和缓艾美耳球虫;5.巨型艾美耳球虫;6.布氏艾美耳球虫;7.堆型艾美耳球虫;8.猪囊等孢球虫;9.卡耶塔环孢子虫;10.贝氏贝诺孢子虫;11.犬新孢子虫;12.马泰勒虫;13.刚第弓形虫 1. Eimeria necatix (Yangzhou strain); 2. E. tenella; 3. E. praecox; 4. E. mitis; 5. E. maxima; 6. E. brunetti; 7. E. acervulina; 8. Cystoisopora suis; 9. Cyclospora cayetanensis; 10. Besnoitia besnoiti; 11. Neospora caninum; 12. Theileria equi; 13. Toxoplasma gondii 图 2 13种顶复门原虫ApiAP2基因编码的ApiAP2结构域比较 Fig. 2 Comparison of ApiAP2 domains from thirteen apicomplexan |
构建的重组表达质粒经BamHⅠ和SalⅠ双酶切鉴定(图 3),获得大小约5 350和1 830 bp的条带,与预期大小相符。测序结果显示, 目的基因未发生碱基突变,表明重组表达质粒pET28a(+)-EnApiAP2构建成功。
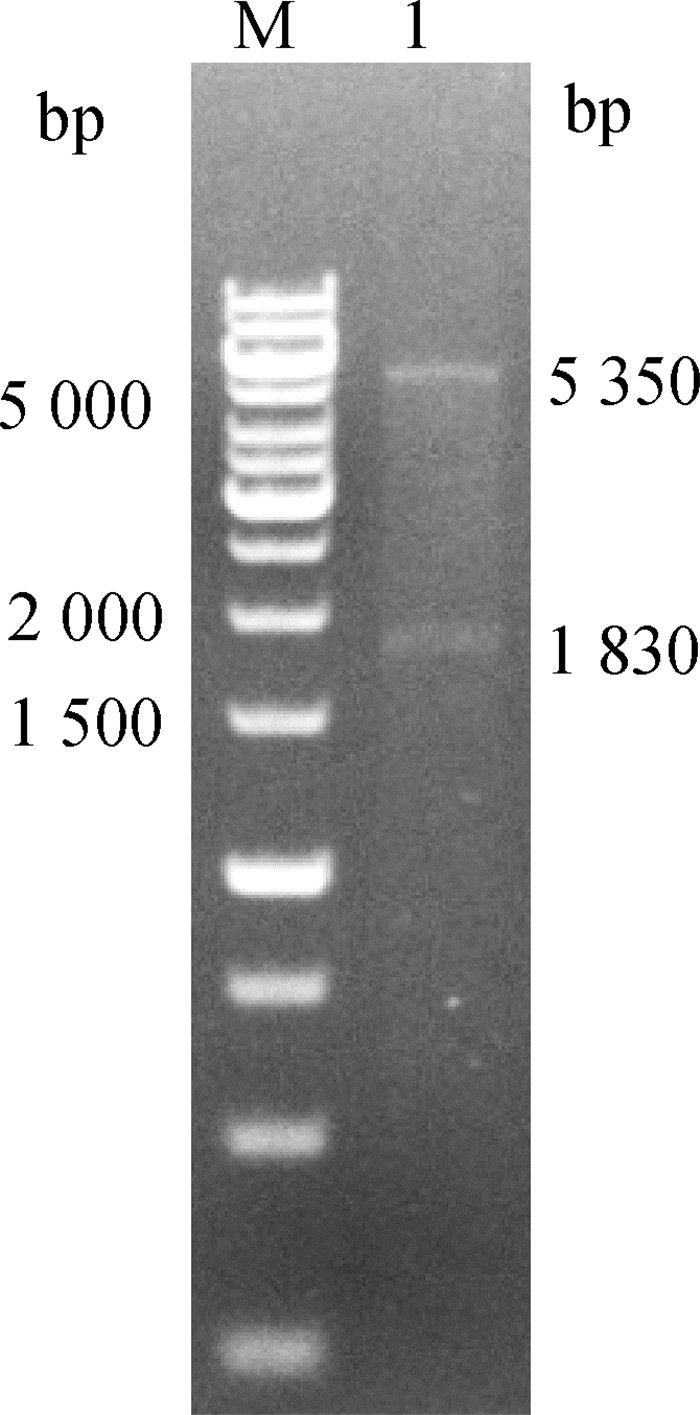
|
M. DNA分子质量标准;1. Bam HⅠ和SalⅠ双酶切产物 M. GeneRuler 1 kb DNA marker; 1. Recombinant plasmid digested by Bam HⅠ and SalⅠ 图 3 重组表达载体的酶切鉴定结果 Fig. 3 Recombinant plasmid digested by restriction enzyme |
将重组表达质粒pET28a(+)-EnApiAP2转化BL21(DE3),IPTG诱导表达后进行SDS-PAGE分析,结果显示,重组蛋白大小约74 ku,与预期相符(图 4A),主要以包涵体形式表达(图 4B);Western blot检测结果显示,重组蛋白能被6×HIS标签单克隆抗体特异性识别(图 4C)。
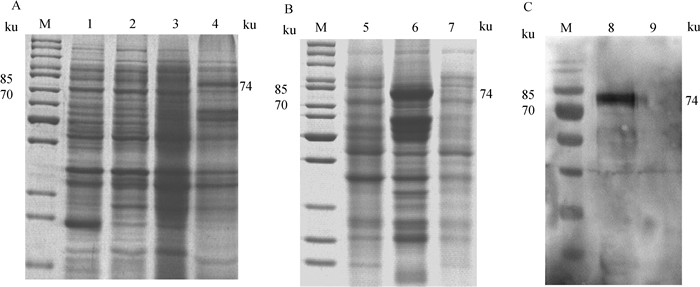
|
M. 蛋白质分子质量标准;1. BL21 IPTG诱导;2. pET28a(+)/BL21 IPTG诱导;3. pET28a(+)-EnApiAP2/BL21 IPTG未诱导;4. pET28a(+)-EnApiAP2/BL21IPTG诱导;5. pET28a(+)/BL21 IPTG诱导;6. 重组菌诱导后超声裂解沉淀;7. 重组菌诱导后超声裂解上清;8. pET28a(+)-EnApiAP2/BL21 IPTG诱导;9. pET28a(+)/BL21 IPTG诱导 M. Protein marker; 1. BL21 with IPTG induction; 2. pET28a(+)/BL21 with IPTG induction; 3. pET28a(+)-EnApiAP2/BL21 without IPTG induction; 4. pET28a(+)-EnApiAP2/BL21 with IPTG induction; 5. pET28a(+)/BL21 with IPTG induction; 6. Sediments of bacterial sonicates; 7. Supernatant of bacterial sonicates; 8. pET28a(+)-EnApiAP2/BL21 with IPTG induction; 9. pET28a(+)/BL21 with IPTG induction 图 4 重组蛋白的SDS-PAGE分析(A、B)和Western blot鉴定(C) Fig. 4 The SDS-PAGE (A, B) and Western blot (C) analysis of rEnApiAP2 |
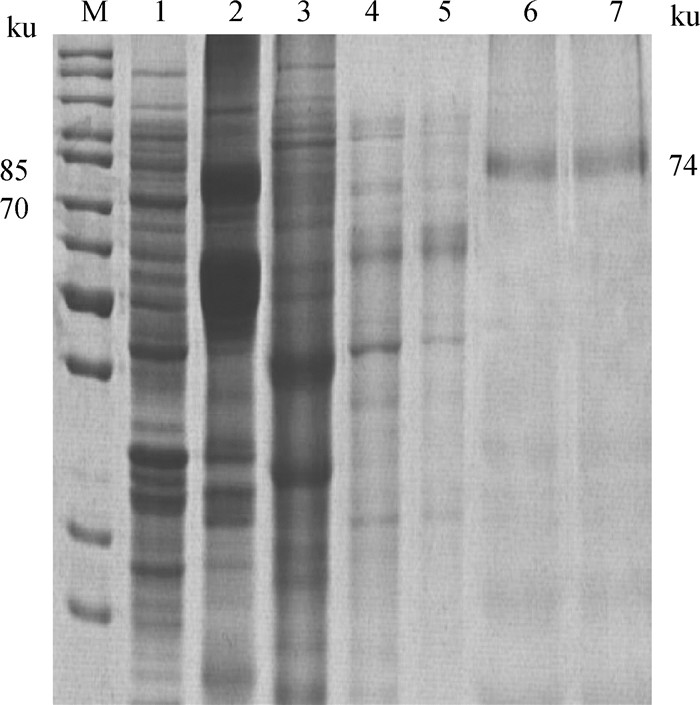
大量诱导表达重组蛋白rEnApiAP2,超声裂解释放包涵体,经含有6×HIS标签的Ni-NTA亲和纯化层析柱纯化,收集不同阶段的流出液。SDS-PAGE分析结果显示(图 5),重组蛋白几乎全部结合到层析柱上,经过3次Washing Buffer洗涤,杂条带基本清除,经过Elution Buffer洗脱,重组蛋白纯化效果较好。
|
M. 蛋白质分子质量标准;1. 重组菌诱导后超声裂解上清;2. 重组菌诱导后超声裂解沉淀;3. 裂解液与Ni-NTA结合后流出液;4. Washing Buffer第1次洗脱液;5. Washing Buffer第3次洗脱液;6. Elution Buffer洗脱液;7. 透析复性后的目的蛋白 M. Protein marker; 1. Supernatant of bacterial sonicates; 2. Sediments of bacterial sonicates; 3. Effluent after binding with Ni-NTA; 4. Washing buffer for the first time; 5. Washing buffer for the third time; 6. Effluent of Elution Buffe; 7. Renaturation protein of dialysis 图 5 重组蛋白的纯化复性 Fig. 5 The purification and renaturation of rEnApiAP2 |
免疫两次BALB/c小鼠后,间接ELISA法测定血清抗体滴度。阳性血清按1∶200倍稀释时,D450值为2.5;按1∶51 200倍稀释时,D450值仍大于阴性血清的2.1倍,因此阳性血清的抗体效价为1∶51 200,而阴性对照组小鼠血清未检测到相应抗体,表明重组蛋白rEnApiAP2能刺激小鼠产生高水平抗体。
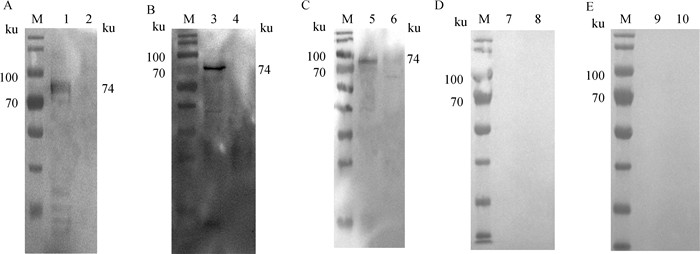
2.6 重组蛋白的抗原性与交叉反应性分析Western blot分析显示,重组蛋白rEnApiAP2能被鼠抗重组蛋白多克隆抗体(图 6A)、鸡抗毒害艾美耳球虫康复血清(图 6B)和鸡抗柔嫩艾美耳球虫康复血清识别(图 6C),但不能被抗巨型艾美耳球虫(图 6D)和抗堆型艾美耳球虫(图 6E)鸡康复血清识别,表明重组蛋白具有良好的抗原性,仅对柔嫩艾美耳球虫有交叉反应原性。
|
M. 蛋白质分子质量标准;1、3、5、7、9. pET28a(+)-EnApiAP2/BL21 IPTG诱导;2、4、6、8、10. pET28a(+)/BL21 IPTG诱导 M. Protein marker; 1, 3, 5, 7, 9. pET28a(+)-EnApiAP2/BL21 with IPTG induction; 2, 4, 6, 8, 10. pET28a(+)/BL21 with IPTG induction 图 6 重组蛋白的抗原性(A、B)与交叉反应原性检测(C、D、E) Fig. 6 Detection of antigenicity (A, B) and cross reactivity (C, D, E) of rEnApiAP2 |
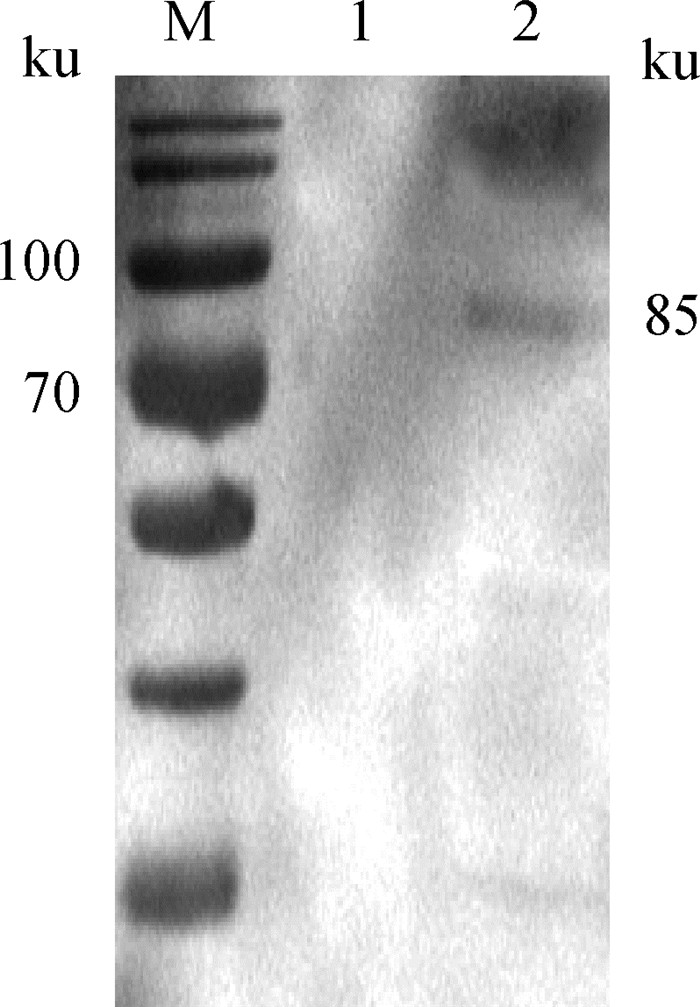
以鼠抗重组蛋白多克隆抗体为一抗进行Western blot分析,结果显示,在毒害艾美耳球虫第3代裂殖子蛋白中有1条带能被鼠抗重组蛋白多克隆抗体特异性识别,其大小约85 ku,而在第2代裂殖子蛋白中未检测到条带(图 7)。
|
M.蛋白质分子质量标准;1.第2代裂殖子;2.第3代裂殖子 M. Protein marker; 1. The second generation merozoites; 2. The third generation merozoites 图 7 鼠抗重组蛋白多抗对天然裂殖子蛋白的识别 Fig. 7 Recognition of natural merozoite proteins by mouse anti-rEnApiAP2 antibody |
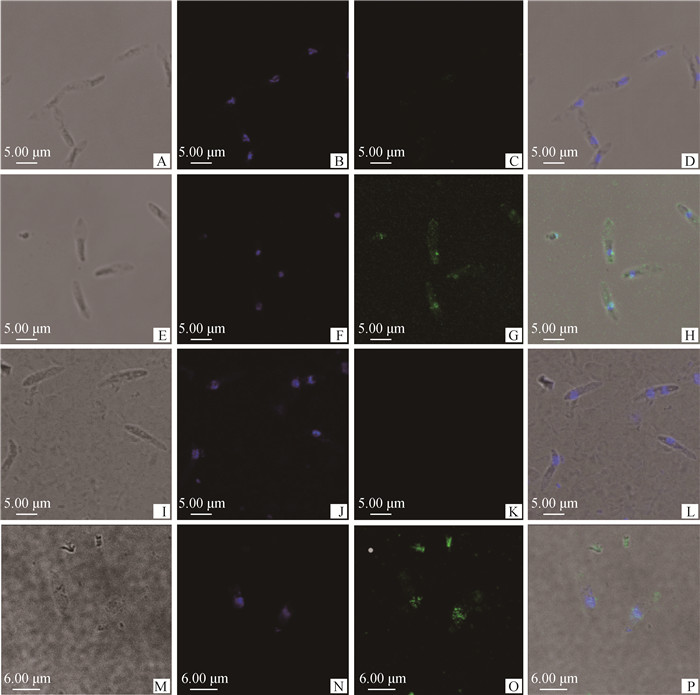
以鼠抗rEnApiAP2多克隆抗体为一抗,FITC标记的羊抗鼠IgG为二抗,对毒害艾美耳球虫第2代和3代裂殖子进行免疫荧光定位分析。结果显示,在第2代和第3代裂殖子的细胞核上均观察到明显绿色荧光,尤其在第3代裂殖子,在细胞质中绿色荧光相对较弱,表明EnApiAP2蛋白主要定位于虫体细胞核内(图 8)。
|
A~D.第2代裂殖子/鼠阴性血清;E~H.第2代裂殖子/鼠抗rEnApiAP2多克隆抗体;I~L.第3代裂殖子/鼠阴性血清;M~P.第3代裂殖子/鼠抗rEnApiAP2多克隆抗体;A、E、I、M.微分干涉;B、F、J、N.DAPI染色;C、G、K、O.FITC标记的羊抗鼠IgG孵育;D、H、L、P.不同荧光的叠加 A-D. MZ-2/mouse negative control serum; E-H. MZ-2/polyclonal mouse anti-EnApiAP2 antibodies; I-L. MZ-3/mouse negative control serum; M-P. MZ-3/polyclonal mouse anti-EnApiAP2;A, E, I, M. The images taken under differential interference contrast; B, F, J, N. Counter-stained with DAPI; C, G, K, O. Stained using FITC sheep anti-mouse IgG; D, H, L, P. The superposition of different fluorescences (Merge) 图 8 EnApiAP2蛋白的免疫荧光定位(标尺=5 μm) Fig. 8 Localization of EnApiAP2 protein in the second and third generation merozoites (bar=5 μm) |
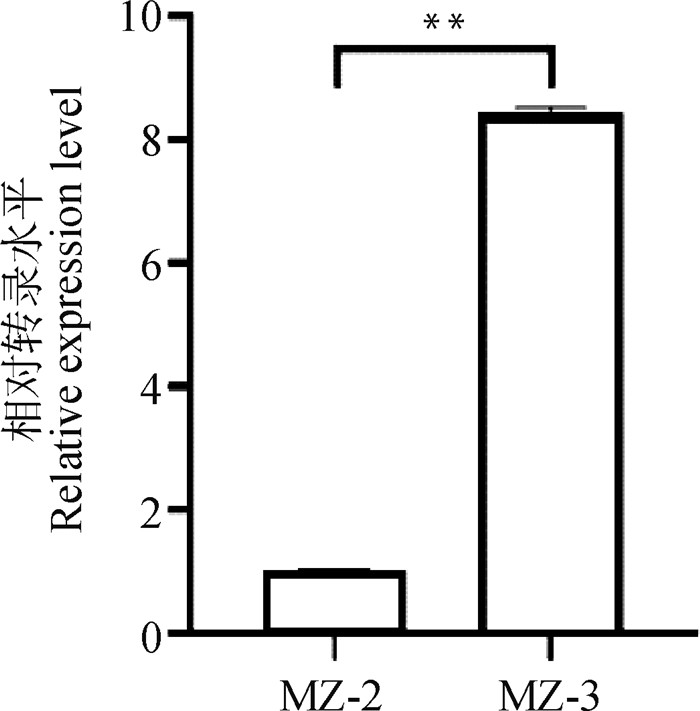
荧光定量PCR结果显示(图 9),第3代裂殖子EnApiAP2基因转录水平极显著高于第2代裂殖子(P < 0.01)。
|
MZ-2.第2代裂殖子;MZ-3.第3代裂殖子。**.P<0.01 MZ-2.The second generation merozoites; MZ-3. The third generation merozoites. **. P<0.01 图 9 EnApiAP2基因在两个发育阶段虫体中mRNA转录水平 Fig. 9 The transcriptional levels of EnApiAP2 at two development stages of E.necatrix |
ApiAP2蛋白是Balaji等[4]用生物信息学方法在恶性疟原虫(P. falciparum)蛋白组中搜索DNA结合域时发现的一类含AP2 DNA结合域的蛋白质。多数ApiAP2蛋白只含有1个AP2结构域,其长度约60个氨基酸残基,结构与植物AP2域相类似,包括1条α-螺旋和3条β-折叠[14]。本文中克隆的EnApiAP2基因推导的氨基酸序列中,在第119—157位氨基酸组成AP2结构域,该结构域包含1个α-螺旋和3个β-折叠结构,与另外6种鸡艾美耳球虫和6种顶复门原虫ApiAP2蛋白的AP2结构域相一致。此外,用NLStradamus软件预测该基因编码的氨基酸序列,发现在第361—372位存在核定位信号序列,且EnApiAP2蛋白定位于第2、3代裂殖子的细胞核。因此,可以推论本文克隆的基因为EnApiAP2基因。
AP2域大多高度保守,但AP2域外的氨基酸通常没有序列同源性[15]。同样,作者在比较不同鸡球虫ApiAP2蛋白氨基酸序列,也发现EnApiAP2除了与柔嫩艾美耳球虫相似性较高(达90.4%)外,与其他5种鸡球虫的相似性较低,仅为19.8%~30.3%。但组成AP2结构域的氨基酸序列相似性明显高于ApiAP蛋白全长氨基酸序列,其中,与柔嫩艾美耳球虫的相似性高达100%,与其他5种鸡球虫的相似性在64.1%~82.1%。在7种鸡球虫中毒害艾美耳球虫与柔嫩艾美耳球虫的ApiAP2蛋白氨基酸序列相似性最高,且Western blot分析显示重组蛋白rEnApiAP2能被鸡抗柔嫩艾美耳球虫康复血清识别,不能被抗巨型艾美耳球虫和抗堆型艾美耳球虫鸡康复血清识别,显示毒害艾美耳球虫与柔嫩艾美耳球虫间的亲缘关系最近,这与早期文献报道的7种鸡球虫系统进化分析结果相一致[16]。
完整的ApiAP2蛋白在大小上有很大差异,氨基酸残基数从200~4 000个以上不等[9]。本文克隆的EnApiAP2基因全长1 830 bp,编码610个氨基酸,推导的理论分子质量为67.69 ku。但用Western blot检测裂殖子全虫体蛋白,在第3代裂殖子中发现天然EnApiAP2蛋白为85 ku,较推导的理论分子质量要大,两者差异的原因有待进一步研究。但在在第2代裂殖子中未检测到天然EnApiAP2蛋白,与免疫荧光定位结果不一致,推测其原因可能是免疫荧光定位的敏感性高于Western blot方法、以及EnApiAP2蛋白在第3代裂殖子中的表达量高于第2代裂殖子。荧光定量PCR结果显示,EnApiAP2基因在第3代裂殖子中的转录水平显著高于第2代裂殖子,这一结果也本课题组前期的转录组测序结果相一致[10]。
迄今,ApiAP2蛋白作为转录因子调控顶复门原虫生长发育的研究主要见于疟原虫和弓形虫[15],在恶性疟原虫中,PfAP2-G是配子体形成的主要转录激活因子,PfAP2-G5和PfAP2-G2则作为转录抑制因子,协同阻断虫体无性期发育所需基因表达[17]。在弓形虫中,TgAP2XI-4是缓殖子阶段基因表达的激活因子,促进缓殖子形成[18];TgAP2IX-9和TgAP2IX-4是基因表达的抑制因子,与虫体毒力和包囊形成相关[19-20]。除了通过转录激活或转录抑制来直接调控靶基因编码蛋白表达水平外,ApiAP2蛋白还具有其他功能。恶性疟原虫PfAP2-G5转录因子可使PfAP2-G下调,从而间接调控由PfAP2-G激活的早期配子体基因[21]。PfAP2-HC不参与基因表达调控,但是参与组成疟原虫异染色质的核心部分[22]。本研究克隆的ApiAP2基因在毒害艾美耳球虫生长发育与性别分化进程中是否发挥类似的功能还有待进一步研究。
4 结论成功克隆并原核表达了EnApiAP2基因,该基因在第3代裂殖子转录水平显著高于第2代裂殖子;EnApiAP2蛋白定位在第2、3代裂殖子细胞核内;天然EnApiAP2蛋白分子质量约为85 ku。
| [1] |
HAO L L, LIU X Y, ZHOU X Y, et al. Transient transfection of Eimeria tenella using yellow or red fluorescent protein as a marker[J]. Mol Biochem Parasitol, 2007, 153(2): 213-215. DOI:10.1016/j.molbiopara.2007.02.005 |
| [2] |
BURRELL A, TOMLEY F M, VAUGHAN S, et al. Life cycle stages, specific organelles and invasion mechanisms of Eimeria species[J]. Parasitology, 2020, 147(3): 263-278. DOI:10.1017/S0031182019001562 |
| [3] |
CHUCK G, MEELEY R B, HAKE S. The control of maize spikelet meristem fate by the APETALA2-like gene indeterminate spikelet 1[J]. Genes Dev, 1998, 12(8): 1145-1154. DOI:10.1101/gad.12.8.1145 |
| [4] |
BALAJI S, BABU M M, IYER L M, et al. Discovery of the principal specific transcription factors of Apicomplexa and their implication for the evolution of the AP2-integrase DNA binding domains[J]. Nucleic Acids Res, 2005, 33(13): 3994-4006. DOI:10.1093/nar/gki709 |
| [5] |
BISCHOFF E, VAQUERO C. In silico and biological survey of transcription-associated proteins implicated in the transcriptional machinery during the erythrocytic development of Plasmodium falciparum[J]. BMC Genomics, 2010, 11(1): 34. DOI:10.1186/1471-2164-11-34 |
| [6] |
ALTSCHUL S F, WOOTTON J C, ZASLAVSKY E, et al. The construction and use of log-odds substitution scores for multiple sequence alignment[J]. PLoS Comput Biol, 2010, 6(7): e1000852. DOI:10.1371/journal.pcbi.1000852 |
| [7] |
PIESZKO M, WEIR W, GOODHEAD I, et al. ApiAP2 factors as candidate regulators of stochastic commitment to merozoite production in Theileria annulata[J]. PLoS Negl Trop Dis, 2015, 9(8): e0003933. DOI:10.1371/journal.pntd.0003933 |
| [8] |
OBERSTALLER J, PUMPALOVA Y, SCHIELER A, et al. The Cryptosporidium parvum ApiAP2 gene family: insights into the evolution of apicomplexan AP2 regulatory systems[J]. Nucleic Acids Res, 2014, 42(13): 8271-8284. DOI:10.1093/nar/gku500 |
| [9] |
DE SILVA E K, GEHRKE A R, OLSZEWSKI K, et al. Specific DNA-binding by apicomplexan AP2 transcription factors[J]. Proc Natl Acad Sci U S A, 2008, 105(24): 8393-8398. DOI:10.1073/pnas.0801993105 |
| [10] |
SU S J, HOU Z F, LIU D D, et al. Comparative transcriptome analysis of second and third-generation merozoites of Eimeria necatrix[J]. Parasit Vectors, 2017, 10(1): 388. DOI:10.1186/s13071-017-2325-z |
| [11] |
刘丹丹. 毒害艾美耳球虫配子体抗原基因的克隆表达与功能研究[D]. 扬州: 扬州大学, 2014. LIU D D. Cloning, expression and function research of gametocyte antigen genes of Eimeria necatrix[D]. Yangzhou: Yangzhou University, 2014. (in Chinese) |
| [12] |
LIU D D, CAO L Q, ZHU Y L, et al. Cloning and characterization of an Eimeria necatrix gene encoding a gametocyte protein and associated with oocyst wall formation[J]. Parasit Vectors, 2014, 7: 27. DOI:10.1186/1756-3305-7-27 |
| [13] |
SALMELA L, RIVALS E. LoRDEC: accurate and efficient long read error correction[J]. Bioinformatics, 2014, 30(24): 3506-3514. DOI:10.1093/bioinformatics/btu538 |
| [14] |
LINDNER S E, DE SILVA E K, KECK J L, et al. Structural determinants of DNA binding by a P. falciparum ApiAP2 transcriptional regulator[J]. J Mol Biol, 2010, 395(3): 558-567. DOI:10.1016/j.jmb.2009.11.004 |
| [15] |
JENINGA M D, QUINN J E, PETTER M. ApiAP2 transcription factors in apicomplexan parasites[J]. Pathogens, 2019, 8(2): 47. DOI:10.3390/pathogens8020047 |
| [16] |
MORRISON D A, BORNSTEIN S, THEBO P, et al. The current status of the small subunit rRNA phylogeny of the coccidia (Sporozoa)[J]. Int J parasitol, 2004, 34(4): 501-514. DOI:10.1016/j.ijpara.2003.11.006 |
| [17] |
SINGH S, SANTOS J M, ORCHARD L M, et al. The PfAP2-G2 transcription factor is a critical regulator of gametocyte maturation[J]. Mol Microbiol, 2021, 115(5): 1005-1024. DOI:10.1111/mmi.14676 |
| [18] |
WALKER R, GISSOT M, CROKEN M M, et al. The Toxoplasma nuclear factor TgAP2XI-4 controls bradyzoite gene expression and cyst formation[J]. Mol Microbiol, 2013, 87(1): 641-655. |
| [19] |
HONG D P, RADKE J B, WHITE M W. Opposing transcriptional mechanisms regulate Toxoplasma development[J]. mSphere, 2017, 2(1): e00347-16. |
| [20] |
HUANG S, HOLMES M J, RADKE J B, et al. Toxoplasma gondii AP2IX-4 regulates gene expression during bradyzoite development[J]. mSphere, 2017, 2(2): e00054-17. |
| [21] |
SHANG X M, SHEN S J, TANG J X, et al. A cascade of transcriptional repression determines sexual commitment and development in Plasmodium falciparum[J]. Nucleic Acids Res, 2021, 49(16): 9264-9279. DOI:10.1093/nar/gkab683 |
| [22] |
CARRINGTON E, COOIJMANS R H M, KELLER D, et al. The ApiAP2 factor PfAP2-HC is an integral component of heterochromatin in the malaria parasite Plasmodium falciparum[J]. iScience, 2021, 24(5): 102444. DOI:10.1016/j.isci.2021.102444 |
(编辑 白永平)



