2. 美国华盛顿州立大学动物科学系,普耳曼 99164-6310
2. Department of Animal Sciences, Washington State University, Pullman WA 99164-6310, USA
驴(Equus asinus)是地方农业生产中不可缺少的畜力,因其独特的肉质特征而逐渐开始面向市场受到大众的青睐。驴肉肉质鲜美,含有多种营养物质和不饱和脂肪酸,利于人体消化吸收,大多数品种的驴肉脂肪含量在2%左右,远低于猪肉的脂肪含量[1-2],是典型的高蛋白、低脂肪食品[3]。驴肉肉质的适口性主要受嫩度、肌内脂肪、多汁性、风味、剪切力等多种肉质性状的综合影响,其中嫩度和风味是衡量肉品质的重要感官指标[4]。
风味是指通过味觉、嗅觉感知到食物的感官印象[5]。依据是否具有挥发性,风味物质分为两类即滋味物质与香味物质。肉类可通过高温诱导产生香味,包括美拉德反应、脂肪氧化和硫胺素降解等形成醛、酸、酮、碳氢化合物、醇、氮和含硫化合物等分子量低的有机小分子挥发物质[6]。脂类和水溶性化合物是构成熟肉风味最重要的前体物质[7]。前者是指肉品中的脂肪和脂溶性物质,后者主要是游离糖、游离氨基酸、肽、核苷酸和其他含氮化合物等[8]。Wang等[9]发现,谷胱甘肽与木糖相互作用的美拉德效应产生的2-甲基噻吩、2-戊基噻吩和2-甲基-3-呋喃硫醇挥发性风味物质均来源于木糖,谷胱甘肽可在谷氨酰和半胱氨酰位置裂解,形成5-氧代脯氨酸或焦谷氨酸、半胱氨酸和Cys-Gly二肽。L-赖氨酸和L-组氨酸具有显著提高脂肪酶活性和不饱和脂肪酸含量的功能,可作为盐替代品添加于干腌牛肉中提升脂氧合酶活性,促进脂质氧化[10]。在干腌驴肉火腿发酵过程中亚油酸为主要的游离脂肪酸,风味物质亚麻酸的相对含量下降最显著,说明亚麻酸是影响驴肉火腿特殊风味的重要脂质氧化产物[11]。肉质风味受动物的品种或部位等多种因素影响,造成风味具有明显差异。与杜泊羔羊相比,滩羊和湖羊具有更多的肌内脂肪和饱和脂肪酸含量,检测出的风味挥发性物质各不相同[12]。杜洛克-巴美二元杂交猪背最长肌的必需氨基酸和风味相关氨基酸含量高于肋肌和肌腱肉;肌腱肉中饱和以及不饱和脂肪酸的含量与种类更丰富于背最长肌和肋骨肌肉;背最长肌中挥发性物质的总含量高于肋肌和肌腱肉[13]。将驴腿肉与猪、牛、羊腿肉的风味物质进行鉴定,发现驴腿肉中风味化合物种类最丰富,醛类相对含量较高且与猪腿肉比例最接近,驴腿肉与牛腿肉风味差异最大且不饱和脂肪酸/饱和脂肪酸比例较高,肉质更鲜嫩,能更好的满足人体营养需求[14]。
风味物质检测集成了分离、浓缩及鉴定技术,其中气相色谱-质谱(gas chromatography-mass spectrometry, GC-MS)可以对香味物质进行定性定量分析,固相微萃取气相色谱质谱联用(solid-phase microextraction GC-MS,SPME-GC-MS)则将采集、萃取、浓缩、进样、分离、鉴定功能相综合,被证明是用来分析肉制品中挥发性化合物的快速、可靠和经济的方法。本试验以剪切力和肌内脂肪为表型,通过SPME-GC-MS技术检测不同嫩度驴肉背最长肌挥发性物质的差异,并结合多元统计方法筛选与嫩度相关的关键差异风味物质,联合转录组数据分析解析驴肉嫩度风味差异,为改善驴肉品质奠定基础。
1 材料与方法 1.1 试验材料1.1.1 研究材料与数据的获取 试验动物广灵驴来源于山西省忻州市,选取30头24~36月龄的雌性广灵驴(平均体重236.10 kg),饲养条件以苜蓿和干草混合的粗料与麸皮、玉米和豆粕组成的精料搭配钙粉和食盐为主,喂养时保证饮水自由,充足光照,饲料少给勤添、先粗后精的顺序。屠宰后取背最长肌组织迅速放于液氮中冷冻保存,通过剪切力与肌内脂肪测定从中挑选出了8头33~36月龄的广灵驴用于本试验的分析,动物获取途径来源于山西省忻州市繁峙县田源毛驴养殖科技发展有限公司。转录组数据来源于课题组前期对高、低嫩度广灵驴背最长肌进行的测序[15],共8个样本,分成高嫩度组(HT,n=4)和低嫩度组(LT,n=4)。
1.1.2 试剂、仪器与设备 氯化钠(AR分析纯)购自天津市凯通化学试剂有限公司;甲醇(色谱纯)购自费希尔控制设备国际有限公司;邻二氯苯(>99.8%(GC))购自上海麦克林生化科技有限公司;20 mL顶空钳口样品瓶购自赛默飞世尔科技公司;气相色谱-质谱联用仪购自赛默飞世尔科技公司;-20 ℃低温冰箱购自海信科龙电器股份有限公司。
1.2 试验方法1.2.1 测定剪切力和肌内脂肪含量 剪切力测定:参照《肉嫩度的测定剪切力测定法》对驴背最长肌进行测定。将驴肉置于水浴锅80 ℃加热,利用温度计监测肉样中心温度,升至70 ℃后取出驴肉放置至室温,后用肌肉嫩度仪计算肉样的剪切力数值,每头驴设置3个样本重复。
肌内脂肪含量测定:参照《食品安全国家标准食品中脂肪的测定》要求提取广灵驴背最长肌的肌内脂肪,并测定其含量。利用索氏抽提仪提取驴肉肌内脂肪,溶剂为石油醚,每个样本3个重复。
1.2.2 样品制备 将冷冻驴肉取出,去除结缔组织后迅速搅拌成肉糜,将3 g肉糜装入20 mL的顶空瓶内,加入3 mL质量分数20%的氯化钠溶液,充分混匀。在顶空瓶内加入2 μL溶剂为甲醇的邻二氯苯内标,内标浓度为1.306 mg·mL-1。
1.2.3 SPME-GC-MS条件 SPME条件:在90 ℃恒温孵化炉中对盛有肉糜的顶空瓶持续加热15 min,使用已活化完毕的萃取头进行化合物萃取,90 ℃吸附30 min后插入GC进样口,解吸附5 min,之后进行GC-MS分析。
GC条件:进样口温度250 ℃;进样模式为不分流;进样时间1 min;载气(He)流速1 mL·min-1;柱温箱升温程序:40 ℃保存2 min,随之从每分钟8 ℃升到160 ℃,以每分钟5 ℃升到230 ℃后,持续4 min。
MS条件:电子电离源;电子能量70 eV;离子源温度230 ℃;接口温度250 ℃;质量扫描范围40~400 m·z-1。
1.2.4 定性定量分析 定性分析:得到的总离子流图后经系统检索后比对NIST质谱图确定挥发性物质成分。
定量分析:参照谢恬等[16]的方法,采用内标法半定量分析,按照公式(1)计算风味化合物的相对含量,邻二氯苯为内标。
| $ C_i=\frac{s_i}{s_A} \times C_A \times \frac{V_i}{m_s} \times n_{0 / i} $ | (1) |
式中,Ci为待检测化合物的含量(μg·g-1);Si为邻二氯苯的质量浓度(μg·mL-1);CA为待检测化合物的峰面积;SA为邻二氯苯的峰面积;Vi为萃取液的体积(mL);no/i为混合液中邻二氯苯体积与Vi之比;ms为前处理前样品的质量(g)。
1.2.5 OAV计算 按公式(2)计算香气活性值:
| $ O A V=\frac{C_i}{O T_i} $ | (2) |
式中,Ci为化合物的含量(μg·g-1);OTi为该化合物在水中的阈值(mg·kg-1)。
1.3 数据分析群体间不同剪切力及肌内脂肪含量测定采用“平均值±标准误(standard error of mean, SEM)”进行计算,P < 0.000 1表明HT组与LT组间测定的剪切力和肌内脂肪含量存在极显著差异。用SIMCA(14.1)软件进行多元统计分析。应用R语言计算Pearson相关系数,以Pearson相关系数大于0.7标准绘制嫩度差异基因与挥发性物质相关性热图。运用R软件Cluster Profiler 3.16.1包进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)功能富集分析,当P < 0.05时认为该信号通路的富集具有显著性。
2 结果 2.1 广灵驴背最长肌剪切力和肌内脂肪含量测定剪切力与肌内脂肪含量的指标呈负相关,二者是展现肉质嫩度的重要表型数据,高嫩度组(HT,n=4)和低嫩度组(LT,n=4)的广灵驴肌内脂肪含量和剪切力值如表 1所示,LT组与HT组差异极显著(P < 0.000 1)。
|
|
表 1 广灵驴肉质性状相关的描述性统计 Table 1 Descriptive statistics of meat quality traits in Guangling donkey |
利用SPME-GC-MS法检测驴肉中的挥发性物质,得到的化合物总离子图如图 1所示,共鉴定出41种物质,包括醇类6种、醛类22种、烃类7种、酮类3种、酯类1种以及亚硝基甲烷和2-正戊基呋喃2种其他物质。其中含量最高的是醛类(3.69 μg·g-1),其次是醇类(0.55 μg·g-1)、酮类(0.25 μg·g-1)、其他(0.13 μg·g-1)、烃类(0.11 μg·g-1)、酯类(0.01 μg·g-1),具体化合物种类及含量可见表 2。
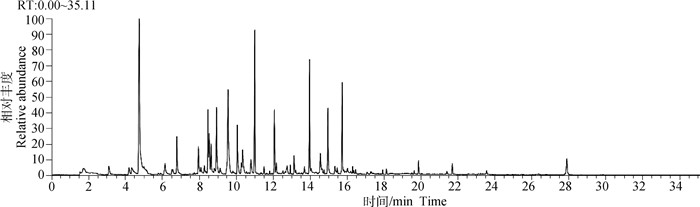
|
图 1 SPME萃取驴肉得到的挥发性化合物总离子流图 Fig. 1 Total ion chromatogram of volatile compounds obtained from SPME extraction of donkey meat |
|
|
表 2 广灵驴挥发性风味物质定性定量结果 Table 2 Qualitative and quantitative results of volatile flavor compounds in Guangling donkey |
本研究利用OAV>1筛选广灵驴背最长肌关键风味物质,OAV值高低表示对驴肉风味的贡献值大小。在41种驴肉挥发性物质成分中,OAV值大于1的风味化合物共13种,包括2种醇类物质,10种醛类物质,1种其他物质(2-正戊基呋喃)。其中醛类物质含量最多且OAV值最大,说明醛类是广灵驴背最长肌的关键风味物质,具体结果见表 3。
|
|
表 3 OAV确定驴肉中的关键风味物质 Table 3 Determination of key flavor active compounds in donkey meat by OAV |
2.4.1 挥发性物质PCA分析 PCA是在无监督模式下进行的多元统计分析,利用SIMCA软件分析不同嫩度背最长肌广灵驴的挥发性物质成分,结果如图 2所示。结果发现R2X=0.826>0.5、Q2=0.752>0.5,说明模型拟合准确性和预测能力较好。从图 2中可以看出所有样本均在95%的置信区间内,有一个高嫩度样本处于低嫩度样本之间,因此从无监督的PCA分析中无法完全区分高、低嫩度背最长肌的挥发性物质,还需进行有监督的OPLS-DA分析。
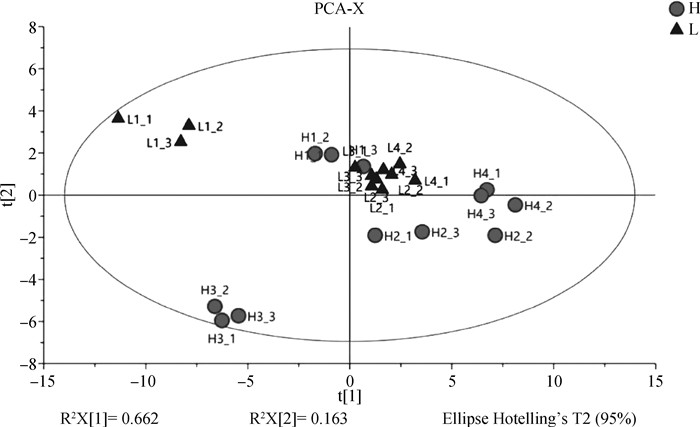
|
图 2 不同嫩度驴肉挥发性风味物质PCA分析图 Fig. 2 PCA analysis of volatile flavor compounds in donkey meat with different tenderness |
2.4.2 挥发性物质OPLS-DA分析 由图 3可知OPLS-DA模型将高、低嫩度的样本区分开来,且拟合模型预测成分的累计统计量R2X=0.925、模型解释率参数R2Y=0.984、预测能力参数Q2=0.922,均高于0.5,表示OPLS-DA模型对驴肉挥发性物质分析的预测能力较好。此外本研究还进行OPLS-DA模型验证(置换检验n=200),发现R2=0.675、Q2=-1.39,右侧的R2和Q2均高于左侧,且Q2与y轴交于负半轴,说明该模型可靠不存在过拟合现象。
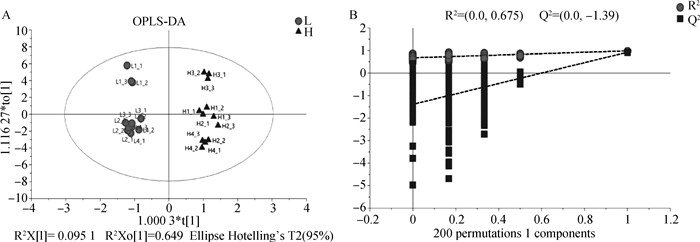
|
图 3 不同嫩度驴肉挥发性风味物质OPLS-DA(A)和置换检验图(B) Fig. 3 OPLS-DA (A) and permutation test plot (B) of volatile flavor compounds in donkey meat with different tenderness |
VIP值可以反映风味物质对模型分类的贡献程度,将VIP>1作为筛选差异风味物质的标准。各挥发性风味物质的VIP值结果见图 4,其中共有19个物质的VIP值大于1,包括醇类4个、醛类5个、烃类7个、酮类2个、酯类1个,具体的差异风味化合物种类如表 4所示。结合多元统计分析结果中的VIP值以及气味活性值OAV筛选关键风味物质。基于VIP>1以及OAV>1总共筛选出3种挥发性物质,即1-辛烯-3-醇(A4)、1-辛醇(A5)以及月桂醛(B19),此3种物质既是嫩度的关键差异物质又是对驴肉风味贡献度较大的物质。
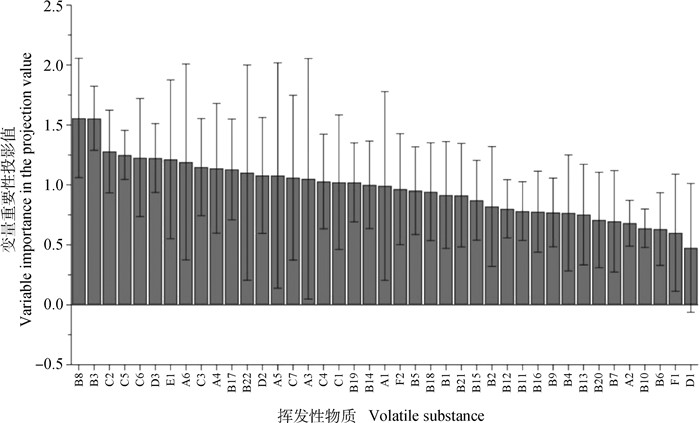
|
图 4 驴肉各挥发性成分VIP值图 Fig. 4 VIP value chart of volatile components in donkey meat |
|
|
表 4 广灵驴挥发性物质VIP得分表 Table 4 VIP score table of volatile compounds in Guangling donkey |
2.6.1 差异基因与风味物质的相关性分析 基于前期课题组筛选出高、低嫩度广灵驴的背最长肌的差异基因,利用R语言计算差异基因、挥发性物质二者之间的Pearson相关性并绘制聚类热图(图 5)。通过相关性分析鉴定到广灵驴肉关键风味物质与MYLPD、PFKM、MAF、APT2A1、ACSL6、ENO3、SCN1B等嫩度差异基因呈显著相关。

|
图 5 差异基因与挥发性化合物间的Pearson相关性热图 Fig. 5 Heat map of Pearson correlations between differential genes and volatile compounds |
2.6.2 关键风味物质相关基因KEGG富集分析 基于Pearson相关系数绝对值大于0.7且P < 0.05筛选与关键风味物质1-辛烯-3-醇、1-辛醇以及月桂醛相关的差异基因,对相关基因进行KEGG富集分析。图 6展示了关键风味相关基因KEGG代谢通路top10的富集结果。与1-辛醇相关的基因共有7个,富集到23条通路,10条通路显著富集(P < 0.05),主要有胰岛素信号通路、丁酸代谢、Ⅱ型糖尿病、缬氨酸,亮氨酸和异亮氨酸降解、脂肪细胞因子信号通路等。与1-辛烯-3-醇相关的基因共有67个,富集到61条通路,16条通路显著富集(P < 0.05),主要有糖酵解/糖异生、氨基酸生物合成、胰高血糖素信号通路、果糖和甘露糖代谢、MAPK信号通路、AMPK信号通路等。与月桂醛相关的基因共有109个,富集到158条通路,27条通路显著富集(P < 0.05),主要有糖酵解/糖异生、次生代谢物的生物合成、氨基酸生物合成、HIF-1信号通路、胰高血糖素信号通路、胰岛素信号通路、果糖和甘露糖代谢、戊糖磷酸途径等。
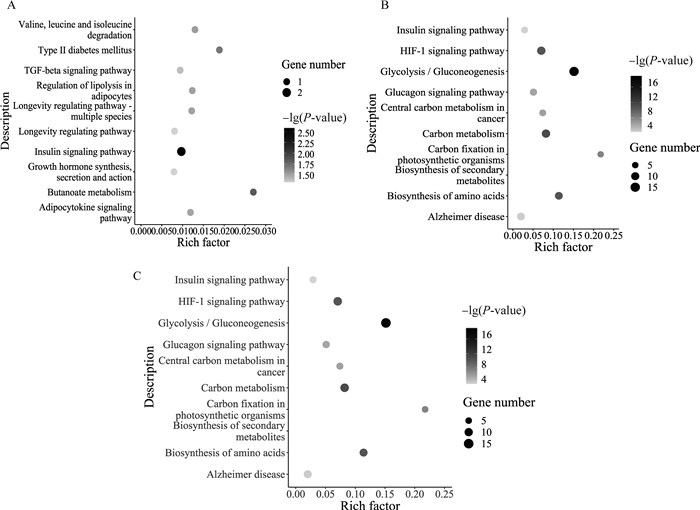
|
图 6 1-辛醇(A)、1-辛烯-3-醇(B)以及月桂醛(C)相关基因KEGG富集散点图 Fig. 6 KEGG enrichment analysis scatter plot of genes related to 1-octanol(A), 1-octen-3-ol(B) and dodecanal(C) |
本研究利用SPME-GC-MS技术共检测到41种挥发性化合物,其中醛的种类和含量最高。醛类共22种,占总风味物质的54%,在醛类中己醛含量最高,占26.29%,说明醛类及己醛是驴肉风味的主要贡献者和关键物质。这与Li等[17]的结果相一致,该研究分析了驴与牛、羊、猪颈肉的风味差异,证实了正己醛、1-辛烯-3-醇是最重要的影响驴颈肉风味的两种化合物。己醛因其草香味而在食品香精行业中十分盛行[18],还有研究发现,兔肉的气味来自中间醛,其主要成分是己醛[19]。李旭等[20]对驴肉4个部位挥发性化合物进行了比较,发现醛、醇和烃类是驴肉的主体风味物质组成,而醛类中的己醛含量最高。李秀等[21]也发现,具有清香和青草气味的正己醛在驴肉中含量最高,均与本研究结果一致。关于对滩羊肉煮制加工中化合物成分变化的研究结果发现,醛类、酮类、醇类等物质含量会随煮制温度的升高而下降,美拉德反应与硫胺素降解对肉香气味的产生具有重要影响[22]。Hammer等[23]研究表明,与其他挥发性化合物相比醛类对肉味的贡献更大,本试验利用OAV>1筛选出13种驴肉关键风味物质,而醛类物质占10种,可能是由于驴肉醛类物质含量高且阈值较低造成的。
在多元统计方面,王藤等[24]利用多元统计方法分析了大河乌猪火腿自然发酵过程中风味特征,基于VIP>1筛选出54种关键风味物质。Li等[25]利用脂质组学方法研究了德州驴不同肌肉部位的脂质特征,在驴肉中共鉴定出1 143种脂质,显著差异的脂质主要富集在关键调节肌内脂肪的甘油酯、甘油磷脂和鞘脂合成途径中。崔岩[26]通过SPME-GC-MS技术对延边黄牛6种肌肉组织(脊肋排、牛柳、上脑、臀肉、胸腩和眼肉)进行了挥发性风味化合物检测,发现醛类化合物中的壬醛在6种肌肉组织中均存在,是牛肉风味的重要组成部分,使牛肉具有香草味和油脂味。肖智超[27]利用代谢组学方法分析了不同品种及日龄鸡肉的风味差异,基于VIP>1的筛选标准得到肌肽、乳酸盐、鹅肌肽和牛磺酸等水溶性化合物均对武定鸡、盐津乌骨鸡及大围山微型鸡的肌肉风味具有重要贡献。这些研究都说明,多组学及多元统计分析方法已广泛应用于风味物质的研究中。本研究通过OPLS-DA模型分析以VIP>1为标准共筛选到19种差异风味物质,结合OAV值发现,1-辛烯-3-醇、1-辛醇以及月桂醛既是嫩度差异物质又是对驴肉风味有贡献的关键风味物质。
1-辛烯-3-醇是蘑菇独特香味的来源[28],Calkins和Hodgen[29]认为,1-辛烯醇和己醛与多不饱和脂肪酸的脂质氧化有关。Jin等[30]研究发现,正己醛和1-辛烯-3-醇是中国地方鸡的主要挥发性化合物。Takakura等[31]对牛肉进行香气提取物稀释分析,发现2, 3, 5-三甲基吡嗪、1-辛烯-3-醇、3-甲基丁酸和4-羟基-2, 5-二甲基3(2H)-呋喃酮是影响提取物香气的主要活性物质,然而,高浓度的1-辛烯-3醇与不利的脂质氧化气味也有关,包括酸败、鱼腥味和草腥味[32]。1-辛醇是一种脂肪族分子,可以由1-辛醛通过醛还原酶得到。1-辛醛主要由3种代谢前体合成,辛酰-ACP(酰基载体蛋白)、辛酰-CoA和辛酸,这些代谢物来自于脂肪酸生物合成和由硫解酶驱动的逆转β氧化[33]。1-辛醇、1-辛烯-3-醇和2,3-辛二酮等是自然干燥时间较长的牦牛肉干总体可接受性挥发性化合物[34]。月桂醛(十二醛)是一种长链脂肪醛,具有脂肪香气,可由月桂醇氧化或月桂酸还原获得。Yang等[35]利用主成分分析发现,月桂醛、己醛、1-辛烯-3-醇、1-辛醇与皖南花猪熟肉样风味有强相关性。1-辛烯-3-醇、1-辛醇以及月桂醛均是与脂肪酸相关的挥发性物质,在大多数肉类中常见,可能是评判不同嫩度肉质风味差异的关键指标。
本研究基于Pearson相关系数筛选与1-辛烯-3-醇、1-辛醇以及月桂醛相关的差异基因,其中鉴定到MYLPF、ENO3、ATP2A1、PFKM、ACSL6等均是与3种关键风味物质共同显著相关的嫩度差异表达基因,均与脂肪相关代谢有关。快肌肌浆球蛋白可调节磷酸化轻链基因(myosin light chain, phosphorylatable, fast skeletal muscle, MYLPF)对肌肉收缩的作用,是粗肌丝的调节成分[36],近年来许多研究都关注MYLPF基因与肉质性状的关联性,其对于骨骼肌的快速和缓慢发育至关重要[37-38]。ENO3与PFKM基因都参与葡萄糖和糖原代谢过程,ENO3在糖酵解第二阶段起重要作用,与热休克蛋白和氧化应激等其他途径相关[39];Moriggi等[40]对小鼠进行高脂饮食处理后发现,ENO3蛋白以及肌型磷酸果糖激酶FPKM的表达均受到影响。ATP2A1被认为是调节肉质持水力的候选基因,其编码的肌内质网钙ATP酶是胞浆Ca+重新摄取到的肌浆网主要调节器[41]。对显著相关的基因进行KEGG富集分析,发现KEGG结果主要富集在有糖酵解/糖异生、胰高血糖素信号通路、PPAR信号通路、果糖和甘露糖代谢、MAPK信号通路、胰岛素信号转导等与脂质代谢相关的通路中。骨骼肌的糖原代谢很大程度上会受糖酵解的影响[42],然而,与关键风味物质相关的差异基因ENO3与PFKM的编码蛋白是糖酵解代谢途径的重要功能酶;与月桂醛显著相关的差异基因ACSL6属于长链酰基辅酶A合成酶的亚型之一,其主要在骨骼肌中表达[43],Teodoro等[44]探究了ACSL6酶在骨骼肌脂质代谢中的作用,ACSL6能推动酰基辅酶A向脂质合成,避免其在线粒体中氧化,同时ACSL6参与了AMPK/PGC1-α通路的激活,这些都说明驴肉嫩度相关风味物质与脂质密切相关。本研究结果进一步证实,关键风味物质的特性及形成过程与脂质相关,并为风味形成的相关机制研究提供理论基础。
4 结论本研究利用SPME-GC-MS技术和OAV值筛选发现醛类是驴肉风味的主要贡献者和关键物质。利用VIP>1和OAV>1筛选出1-辛烯-3-醇、1-辛醇以及月桂醛既是嫩度的差异物质又是对驴肉风味有贡献的关键风味物质。利用Pearson相关筛选与关键风味相关的基因并对其进行KEGG富集分析,发现糖酵解/糖异生、胰高血糖素信号通路、PPAR信号通路、果糖和甘露糖代谢、MAPK信号通路、胰岛素信号转导等通路可能参与了驴肉关键风味物质1-辛烯-3-醇、1-辛醇以及月桂醛的形成。本研究分析了不同嫩度广灵驴肉的挥发性风味物质差异,探究与其相关的差异基因与代谢通路,为解析广灵驴驴肉的风味形成及分子育种提供一定的理论基础。
| [1] |
周楠, 韩国才, 柴晓峰, 等. 驴的产肉、理化指标及加工特性比较研究[J]. 畜牧兽医学报, 2015, 46(12): 2314-2321. ZHOU N, HAN G C, CHAI X F, et al. A comparative study of donkey meat production, physicochemical indicators and processing properties[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(12): 2314-2321. (in Chinese) |
| [2] |
谭林, 姜海龙. 肌内脂肪含量与猪肉品质的相关性分析[J]. 饲料博览, 2010(12): 11-13. TAN L, JIANG H L. Correlation analysis of intramusclar fat content and pork quality[J]. Feed Review, 2010(12): 11-13. (in Chinese) |
| [3] |
曹春红. 简述广灵驴的特性[J]. 中国畜禽种业, 2020, 16(5): 79-80. CAO C H. Briefly describe the characteristics of Guangling donkey[J]. The Chinese Livestock and Poultry Breeding, 2020, 16(5): 79-80. (in Chinese) |
| [4] |
KHALED A Y, PARRISH C A, ADEDEJI A. Emerging nondestructive approaches for meat quality and safety evaluation-A review[J]. Compr Rev Food Sci Food Saf, 2021, 20(4): 3438-3463. DOI:10.1111/1541-4337.12781 |
| [5] |
KHAN M I, JO C, TARIQ M R. Meat flavor precursors and factors influencing flavor precursors-A systematic review[J]. Meat Sci, 2015, 110: 278-284. DOI:10.1016/j.meatsci.2015.08.002 |
| [6] |
LORENZO J M, DOMÍNGUEZ R. Cooking losses, lipid oxidation and formation of volatile compounds in foal meat as affected by cooking procedure[J]. Flavour Fragr J, 2014, 29(4): 240-248. DOI:10.1002/ffj.3201 |
| [7] |
RESCONI V C, ESCUDERO A, CAMPO M M. The development of aromas in ruminant meat[J]. Molecules, 2013, 18(6): 6748-6781. DOI:10.3390/molecules18066748 |
| [8] |
崔小燕, 苟钟勇, 蒋守群, 等. 鸡肉风味的形成机制与调控研究进展[J]. 动物营养学报, 2019, 31(2): 500-508. CUI X Y, GOU Z Y, JIANG S Q, et al. Research advance of formation mechanism of chicken meat flavor and regulation[J]. Chinese Journal of Animal Nutrition, 2019, 31(2): 500-508. (in Chinese) |
| [9] |
WANG R, YANG C, SONG H L. Key meat flavour compounds formation mechanism in a glutathione-xylose Maillard reaction[J]. Food Chem, 2012, 131(1): 280-285. DOI:10.1016/j.foodchem.2011.08.079 |
| [10] |
LIU S X, ZHANG Y W, ZHOU G H, et al. Lipolytic degradation, water and flavor properties of low sodium dry cured beef[J]. Int J Food Prop, 2019, 22(1): 1322-1339. DOI:10.1080/10942912.2019.1642354 |
| [11] |
张静静. 干腌驴肉火腿加工过程中理化特性、脂质氧化及挥发性风味成分变化的研究[D]. 聊城: 聊城大学, 2020. ZHANG J J. Study on the changes of physicochemical properties, lipid oxidation and volatile flavor components of dry-cured donkey ham during its processing[J]. Liaocheng: Liaocheng University, 2020. (in Chinese) |
| [12] |
ZHANG C, ZHANG H, LIU M, et al. Effect of breed on the volatile compound precursors and odor profile attributes of lamb meat[J]. Foods, 2020, 9(9): 1178. DOI:10.3390/foods9091178 |
| [13] |
CHEN G S, CAI Y, SU Y Y, et al. Study of meat quality and flavour in different cuts of Duroc‐Bamei binary hybrid pigs[J]. Vet Med Sci, 2021, 7(3): 724-734. DOI:10.1002/vms3.409 |
| [14] |
李秀, 桑潘婷, ABIOLA D S A, 等. 驴腿肉与其他畜腿肉挥发性风味物质差异研究[J]. 食品与机械, 2019, 35(9): 50-54, 162. LI X, SANG P T, ABIOLA D S A, et al. Comparative study on volatile flavor among the leg meat from donkey and other livestock animals[J]. Food & Machinery, 2019, 35(9): 50-54, 162. (in Chinese) |
| [15] |
李武峰, 关家伟, 邱丽霞, 等. 基于转录组学和代谢组学研究调控驴背最长肌嫩度的分子机制[J]. 畜牧兽医学报, 2022, 53(3): 743-754. LI W F, GUAN J W, QIU L X, et al. Study on the molecular mechanism of regulating tenderness of Longissimus dorsi muscle of donkey based on transcriptomics and metabolomics[J]. Acta Veterinaria et Zootechnica Sinica, 2022, 53(3): 743-754. (in Chinese) |
| [16] |
谢恬, 王丹, 马明娟, 等. OAV和GC-O-MS法分析五香驴肉风味活性物质[J]. 食品科学, 2018, 39(8): 123-128. XIE T, WANG D, MA M J, et al. Identification of flavor-active compounds in spiced donkey meat by odor activity value (OAV) calculation and gas chromatography-olfactometry-mass spectrometry[J]. Food Science, 2018, 39(8): 123-128. (in Chinese) |
| [17] |
LI X, AMADOU I, ZHOU G Y, et al. Flavor components comparison between the neck meat of donkey, swine, bovine, and sheep[J]. Food Sci Anim Resour, 2020, 40(4): 527-540. DOI:10.5851/kosfa.2020.e30 |
| [18] |
ZHAO Q Y, YOUSAF L, XUE Y, et al. Changes in flavor of fragrant rice during storage under different conditions[J]. J Sci Food Agric, 2020, 100(8): 3435-3444. DOI:10.1002/jsfa.10379 |
| [19] |
XIE Y J, HE Z F, LV J Z, et al. Identification the key odorants in different parts of hyla rabbit meat via solid phase microextraction using gas chromatography mass spectrometry[J]. Korean J Food Sci Anim Resour, 2016, 36(6): 719-728. DOI:10.5851/kosfa.2016.36.6.719 |
| [20] |
李旭, 章海风, 周晓燕, 等. 驴肉4个部位挥发性物质分析比较[J]. 美食研究, 2019, 36(2): 28-32. LI X, ZHANG H F, ZHOU X Y, et al. Analysis of volatile compounds in four parts of donkey meat[J]. Journal of Researches on Dietetic Science and Culture, 2019, 36(2): 28-32. (in Chinese) |
| [21] |
李秀, 杨燕, ABIOLA D S A, 等. 不同部位驴肉风味物质差异分析[J]. 食品与发酵工业, 2019, 45(12): 227-234. LI X, YANG Y, ABIOLA D S A, et al. Differences in flavor compounds in different parts of donkey meat[J]. Food and Fermentation Industries, 2019, 45(12): 227-234. (in Chinese) |
| [22] |
赵晓策. 滩羊肉煮制过程中挥发性风味物质形成及变化研究[D]. 银川: 宁夏大学, 2019. ZHAO X C. The formation and change of volatile flavor compounds from Tan sheep meat during cooking[D]. Yinchuan: Ningxia University, 2019. (in Chinese) |
| [23] |
HAMMER A K, ALBRECHT F, HAHNE F, et al. Biotechnological production of odor-active methyl-branched aldehydes by a novel α-Dioxygenase from crocosphaera subtropica[J]. J Agric Food Chem, 2020, 68(38): 10432-10440. DOI:10.1021/acs.jafc.0c02035 |
| [24] |
王藤, 施娅楠, 李祥, 等. 基于气相色谱-质谱技术与多元统计方法分析大河乌猪火腿自然发酵过程中风味特征[J]. 肉类研究, 2021, 35(5): 29-35. WANG T, SHI Y N, LI X, et al. Analysis of flavor characteristics of Dahe black pig ham during natural fermentation by gas chromatography-mass spectrometry and multivariate statistical analysis[J]. Meat Research, 2021, 35(5): 29-35. (in Chinese) |
| [25] |
LI M M, ZHU M X, CHAI W Q, et al. Determination of lipid profiles of Dezhou donkey meat using an LC-MS-based lipidomics method[J]. J Food Sci, 2021, 86(10): 4511-4521. |
| [26] |
崔岩. 延边黄牛不同肌肉组织风味物质差异比较和代谢组学分析[D]. 延吉: 延边大学, 2021. CUI Y. Comparison of flavor compounds and metabolomics analysis in different muscle tissues of Yanbian yellow cattle[D]. Yanji: Yanbian University, 2021. (in Chinese) |
| [27] |
肖智超. 基于代谢组学对不同品种和日龄地方鸡风味物质变化规律的研究[D]. 南京: 南京农业大学, 2018. XIAO Z C. Study on changes of flavor compounds of Chinese local chicken with different age and breed based on metabolomic[D]. Nanjing: Nanjing Agricultural University, 2018. (in Chinese) |
| [28] |
MACEDO G E, DE BRUM VIEIRA P, RODRIGUES N R, et al. Fungal compound 1-octen-3-ol induces mitochondrial morphological alterations and respiration dysfunctions in Drosophila melanogaster[J]. Ecotoxicol Environ Saf, 2020, 206: 111232. |
| [29] |
CALKINS C R, HODGEN J M. A fresh look at meat flavor[J]. Meat Sci, 2007, 77(1): 63-80. |
| [30] |
JIN Y X, CUI H X, YUAN X Y, et al. Identification of the main aroma compounds in Chinese local chicken high-quality meat[J]. Food Chem, 2021, 359: 129930. |
| [31] |
TAKAKURA Y, SAKAMOTO T, HIRAI S, et al. Characterization of the key aroma compounds in beef extract using aroma extract dilution analysis[J]. Meat Sci, 2014, 97(1): 27-31. |
| [32] |
BARRAGÁN-HERNÁNDEZ W, DUGAN M E R, AALHUS J L, et al. Effect of feeding barley, corn, and a barley/corn blend on beef composition and end-product palatability[J]. Food, 2021, 10(5): 977. |
| [33] |
LOZADA N J H, SIMMONS T R, XU K, et al. Production of 1-octanol in Escherichia coli by a high flux thioesterase route[J]. Metab Eng, 2020, 61: 352-359. |
| [34] |
HAN G, ZHANG L, LI Q X, et al. Impacts of different altitudes and natural drying times on lipolysis, lipid oxidation and flavour profile of traditional Tibetan yak jerky[J]. Meat Sci, 2020, 162: 108030. |
| [35] |
YANG J J, PAN J, ZHU S J, et al. Application of PCA and SLDA methods for the classification and differentiation of cooked pork from Chinese indigenous pig breeds and a hybrid pig breed[J]. Int J Food Prop, 2014, 17(7): 1518-1528. |
| [36] |
STULL J T, KAMM K E, VANDENBOOM R. Myosin light chain kinase and the role of myosin light chain phosphorylation in skeletal muscle[J]. Arch Biochem Biophys, 2011, 510(2): 120-128. |
| [37] |
LEE Y H, KWON E J, CHO E S, et al. Association analysis of polymorphism in KIAA1717, HUMMLC2B, DECR1 and FTO genes with meat quality traits of the Berkshire breed[J]. Afr J Biotechnol, 2011, 10(25): 5068-5074. |
| [38] |
ZHANG J, XU X, LIU Y, et al. EPA and DHA inhibit myogenesis and downregulate the expression of muscle-related genes in C2C12 myoblasts[J]. Genes (Basel), 2019, 10(1): 64. |
| [39] |
GAGAOUA M, TERLOUW E M C, MULLEN A M, et al. Molecular signatures of beef tenderness: underlying mechanisms based on integromics of protein biomarkers from multi-platform proteomics studies[J]. Meat Sci, 2021, 172: 108311. |
| [40] |
MORIGGI M, BELLOLI S, BARBACINI P, et al. Skeletal muscle proteomic profile revealed gender-related metabolic responses in a diet-induced obesity animal model[J]. Int J Mol Sci, 2021, 22(9): 4680. |
| [41] |
CIOBANU D, BASTIAANSEN J, MALEK M, et al. Evidence for new alleles in the protein kinase adenosine monophosphate-activated γ3-subunit gene associated with low glycogen content in pig skeletal muscle and improved meat quality[J]. Genetics, 2001, 159(3): 1151-1162. |
| [42] |
LIANG J F, YANG Q Y, ZHU M J, et al. AMP-activated protein kinase (AMPK) α2 subunit mediates glycolysis in postmortem skeletal muscle[J]. Meat Sci, 2013, 95(3): 536-541. |
| [43] |
KUROTAKI A, KUWATA H, HARA S. Substrate specificity of human long-chain Acyl-CoA synthetase ACSL6 variants[J]. Biol Pharm Bull, 2021, 44(10): 1571-1575. |
| [44] |
TEODORO B G, SAMPAIO I H, BOMFIM L H M, et al. Long-chain acyl-CoA synthetase 6 regulates lipid synthesis and mitochondrial oxidative capacity in human and rat skeletal muscle[J]. J Physiol, 2017, 595(3): 677-693. |
(编辑 郭云雁)



