疟疾是由疟原虫引起的世界上危害最严重的疾病之一。据WHO报告统计,自青蒿素的普及以来,全球疟疾控制取得了前所未有的成功,但每年仍有超过40万人死于疟疾。一方面和最近几年出现的抗青蒿素虫株有关[1-3];另一方面,和疟原虫复杂且精密的免疫逃避方式有关。这表明,寻找有效的药物靶标及开发疟疾疫苗迫在眉睫。已有研究表明,针对抗疟原虫免疫反应方面设计的药物,可以有效地控制疟原虫在所有发育阶段的感染[4]。因此,研究疟原虫感染引起宿主的免疫反应过程尤为重要。
疟原虫在宿主体内寄生可引起强烈的免疫应答反应,免疫机制复杂多样。T细胞是清除机体疟原虫的重要组成部分[5-6],可通过直接产生如IFN-γ和TNF-α等促炎细胞因子,引发巨噬细胞和其他组分的抗寄生虫免疫应答[7],或激活产生抗疟原虫抗体的特异性B细胞从而介导间接的抗寄生虫免疫反应[8]。NK细胞可通过细胞毒性和产生促炎细胞因子来破坏受损、功能失调或被感染的宿主细胞,从而控制感染的进程[9]。在机体的免疫清除进程中,T细胞免疫球蛋白黏蛋白3(T-cell immunoglobulin and mucin-domain containing molecule 3, Tim-3)作为一种免疫检查点分子,对T细胞和NK均具有负性调节功能[10-12],在肿瘤以及一些病原体的免疫逃避进程中发挥着重要作用。
在所有人类疟原虫感染中,恶性疟原虫引起的疾病是导致死亡的主要因素,感染后常出现脑型疟的症状。而可以感染小鼠的伯氏疟原虫ANKA株是一种致命的强毒力虫株,已有的研究表明,在恶性疟原虫感染的患者和伯氏疟原虫ANKA株感染的C57BL/6小鼠的体内,关键免疫细胞表面Tim-3表达均升高[13],但整个感染进程中Tim-3的表达变化及相关细胞因子的变化还未可知。一项在昆明小鼠体内的研究显示:利用荧光定量PCR检测技术,发现感染伯氏疟原虫ANKA株后,小鼠脾Tim-3、IFN-γ、TNF-α、IL-4、IL-10和TGF-β的转录水平均升高[14],但这些仅是在转录水平上的变化情况,此外,不同品系小鼠感染疟原虫引起的病理和免疫反应也存在差异[15-16]。伯氏疟原虫ANKA株感染C57BL/6小鼠后也常会引起脑型疟发生,故已被广泛用作研究人类恶性疟疾疾病的试验模型。因此,本研究以伯氏疟原虫ANKA株和C57BL/6小鼠为试验材料,对疟原虫感染引起的宿主免疫应答特点进行了分析。
1 材料与方法 1.1 材料1.1.1 实验动物与虫株 SPF级雌性C57BL/6小鼠(N型),鼠龄6~8周龄,体重20~22 g,购自辽宁本溪长生生物技术有限公司。
伯氏疟原虫ANKA株由沈阳农业大学动物科学与医学学院人畜共患病重点实验室保存。
1.1.2 抗体 Pacific BlueTM anti-mouse CD45 Antibody、APC anti-mouse CD3 Antibody、FITC anti-mouse CD8a Antibody、APC/FireTM 750 anti-mouse CD4 Antibody、FITC anti-mouse NK1.1 Antibody、PE anti-mouse CD366 (Tim-3) Antibody、Pacific BlueTM Rat IgG2b, κ Isotype Ctrl Antibody、APC/FireTM 750 Rat IgG2b, κ Isotype Ctrl Antibody、APC Rat IgG2b, κ Isotype Ctrl Antibody、FITC Rat IgG2a, κ Isotype Ctrl Antibody、PE Rat IgG2a, κ Isotype Ctrl Antibody、LEAFTM Purified anti-mouse CD16/32 Antibody、7-AAD Viability Staining Solution和Mouse Th Cytokine Panel (5-plex)细胞因子检测试剂盒购自北京达科为生物技术有限公司。
1.2 方法1.2.1 试验设计 以感染伯氏疟原虫强毒株ANKA株的C57BL/6小鼠为研究对象,分别于感染后0、4、7、9、11、13、16和19 d采集小鼠脾及外周血免疫细胞,利用流式细胞术检测小鼠主要免疫细胞亚群及Tim-3的表达水平的变化,同时检测血清中细胞因子水平的变化(图 1)。
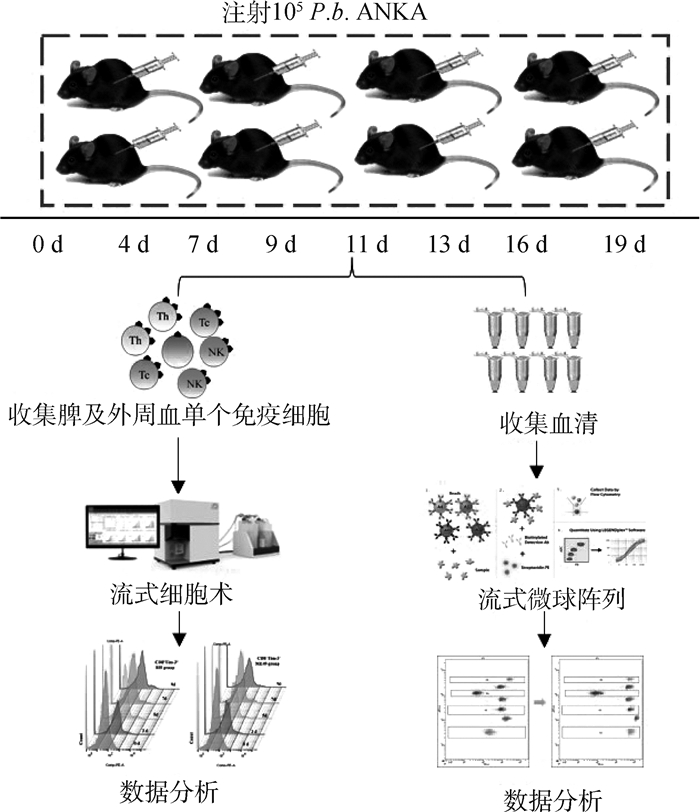
|
图 1 试验分组及试验流程 Fig. 1 Experimental group and process |
1.2.2 虫株的准备 将伯氏疟原虫ANKA株从液氮罐中复苏,离心洗涤后将虫体迅速腹腔注射至C57BL/6小鼠体内。大约3 d后采取尾尖血制作血涂片,Giemsa染色检测染虫情况。约5 d后采集尾尖血至预冷的1×PBS中准备接种下一批小鼠,这批小鼠为第二代染虫小鼠。如此反复传三代,待虫株毒力稳定后,即可用于后续感染模型建立试验。
1.2.3 伯氏疟原虫ANKA株感染模型的建立 第三代染虫小鼠体内染虫率到达2%~3%时,取小鼠外周全血准备攻虫:64只雌性C57BL/6小鼠随机分为8组:0 d组、4 d组、7 d组、9 d组、11 d组、13 d组、16 d组和19 d组,每组8只。除8只健康小鼠(即0 d组)外,其余小鼠每只腹腔注射2×105个染虫红细胞,在相同的环境中饲养。
1.2.4 样本的采集 利用眼球采血的方法采集小鼠外周血,其中一部分放于抗凝管中用于免疫细胞的流式细胞术检测,一部分用于血清的分离。小鼠断颈处死,采取脾并称重。分离的血清置于-80 ℃冰箱保存,用于检测细胞因子。
1.2.5 脾单细胞悬液的制备 将脾放置于200目细胞筛,置于50 mL离心管上,边加PBS边用注射器尾部充分研磨;研磨好的细胞悬液转移至15 mL离心管中,1 500 r·min-1离心7 min,弃上清,根据沉淀体积加入3~10 mL的红细胞裂解液,充分震荡混匀,冰上孵育3~5 min;1 500 r·min-1离心7 min后弃掉上清,沉淀用10 mL的1×PBS重悬,重复2次。显微镜下计算细胞数量。
1.2.6 流式细胞术检测不同免疫细胞亚群 从每只小鼠采取的抗凝血中取出100 μL加入离心管中,之后加入相应的抗体组合,充分混匀;4 ℃避光孵育30 min后,加入红细胞裂解液裂解红细胞,冰上孵育3 min,1 500 r·min-1离心7 min后弃上清;加入1 mL 1×PBS重悬细胞,离心,弃上清;加入300 μL 1×PBS重悬细胞,将细胞悬液通过200目滤网,准备上机检测。
将脾细胞悬液调整每管细胞的终浓度为每100 μL含1×106个细胞;加入CD16/32抗体,冰上孵育10 min封闭Fc位点;将上述细胞每管取100 μL加入离心管中;加入相应的抗体组合,充分震荡混匀;4 ℃避光孵育30 min,离心,清洗3遍。最终,加入300 μL 1×PBS重悬细胞,细胞悬液通过200目滤网,上机检测。
1.2.7 血清中细胞因子(IFN-γ、TNF-α、IL-2、IL-6和IL-10)的检测 按照试剂盒说明书方法进行操作。
1.2.8 统计与分析 所有分析均使用GraphPad Prism 6进行。多组间比较时,采用双尾t检验或方差分析对结果进行分析。结果使用Excel进行计算,以“平均值±标准差(Mean±SD)”表示。P值小于0.05被认为具有统计学意义。
2 结果 2.1 感染伯氏疟原虫不同时期小鼠脾指数变化如图 2所示,感染伯氏疟原虫后小鼠的脾指数(脾指数=脾重量(mg)/体重(g)×10)在0~13 d逐渐升高(P<0.001);16~19 d小鼠脾指数不再继续升高,感染19 d小鼠与16 d小鼠相比,脾指数降低(P<0.05),但仍显著高于健康对照组(0 d组)(P<0.001)。
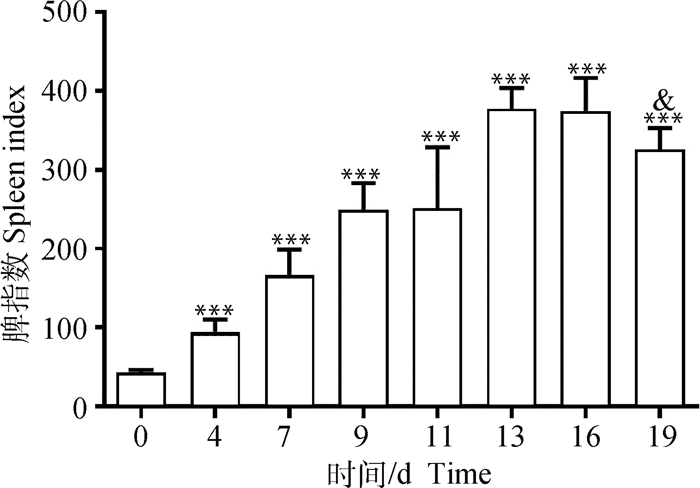
|
& . P < 0.05, ***. P < 0.001, *代表与0 d组进行比较;& 代表 19 d组与16 d组进行比较 & . P < 0.05, ***. P < 0.001, *indicates compared with the day 0 group, & indicates day 19 group compared with the day 16 group 图 2 小鼠感染伯氏疟原虫后脾指数的变化 Fig. 2 Spleen index of mice post infected with P. berghei |
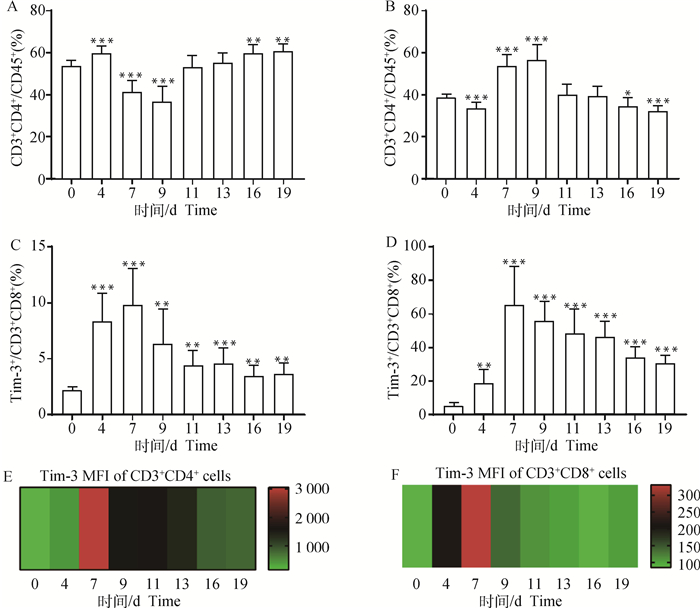
利用流式细胞术检测伯氏疟原虫ANKA株感染小鼠后脾T细胞主要亚群比例及Tim-3的表达情况的变化,图 3A为细胞圈门方案。与未感染组(0 d组)相比,感染4 d,小鼠脾CD3+CD4+ T细胞比例显著降低(P<0.001),且随感染时间的延长,除7 d外,脾CD3+CD4+ T细胞比例均显著低于0 d未感染组(图 3B)。与未感染组(0 d组)相比,小鼠脾CD3+CD8+ T细胞比例随感染时间的延长逐渐降低(P<0.001, 图 3C)。如图 3D和图 3E所示,随感染时间延长,小鼠脾Tim-3+CD3+CD4+ T细胞和Tim-3+CD3+CD8+ T细胞比例逐渐升高(P<0.001)。为了进一步确认CD3+CD4+ T细胞和CD3+CD8+ T细胞表面Tim-3的表达情况,利用流式细胞术检测了这两种细胞表面Tim-3分子的平均荧光强度(median fluorescence intensity,MFI)。结果显示,Tim-3分子在CD3+CD4+ T细胞(图 3F) 和CD3+CD8+ T细胞(图 3G)表面的表达均逐渐增加。

|
A. 流式细胞圈门方案;B. CD3+CD4+ T细胞比例统计结果;C. CD3+CD8+ T细胞比例统计结果;D. Tim-3+CD3+CD4+ T细胞比例统计结果;E. Tim-3+CD3+CD8+ T细胞比例统计结果;F. Tim-3在CD3+CD4+ T细胞的表达变化;G. Tim-3在CD3+CD8+ T细胞的表达变化。*. P < 0.05, **. P < 0.01, ***. P < 0.001, *代表与0 d组进行比较。下图同 A. Flow cytometry gate strategy; B. Frequency of CD3+CD4+ T cells; C. Frequency of CD3+CD8+ T cells; D. Frequency of Tim-3+CD3+CD4+ T cells; E. Frequency of Tim-3+CD3+CD8+ T cells; F. Tim-3 expression on CD3+CD4+ T cells; G. Tim-3 expression on CD3+CD8+ T cells. *. P < 0.05, **. P < 0.01, ***. P < 0.001, * indicates compared with the day 0 group. The same as below 图 3 小鼠感染伯氏疟原虫后脾T细胞比例及其表面Tim-3表达变化 Fig. 3 The proportion of T cells and the expression of Tim-3 on the surface of certain cells in spleen of mice post infected with P. berghei |
采用流式细胞术检测伯氏疟原虫ANKA株感染小鼠的外周血T细胞主要亚群比例及Tim-3的表达情况的变化。结果显示:与未感染组(0 d组)相比,感染4 d,小鼠外周血CD3+CD4+ T细胞比例显著升高(P<0.001),在感染第7和第9天又逐渐降低(P<0.001),在感染第16和第19天逐渐升高(P<0.01),整体呈先降低后升高的趋势(图 4A);与未感染组(0 d组)相比,感染4 d小鼠外周血CD3+CD8+ T细胞比例显著降低(P<0.001),在感染的第7和第9天又逐渐升高(P<0.001),在感染的第16和第19天均发生降低(P<0.05、P<0.001),整体呈先升高后降低的趋势(图 4B)。如图 4C和图 4D所示,随感染时间的延长,小鼠外周血Tim-3+CD3+CD4+ T细胞和Tim-3+CD3+CD8+ T细胞比例均呈先升高后降低的趋势(P<0.01),但感染末期Tim-3+CD3+CD4+ T细胞和Tim-3+CD3+CD8+ T细胞的比例仍显著高于未感染组(0 d组)。利用流式细胞术检测的外周血中这两种细胞表面Tim-3分子的MFI,如图 4E和图 4F所示:Tim-3分子在CD3+CD4+ T细胞和CD3+CD8+ T细胞表面的表达均呈先升高后降低的趋势,但感染末期Tim-3分子的表达量也均高于未感染组(0 d组)。
|
A. CD3+CD4+ T细胞比例统计结果;B. CD3+CD8+ T细胞比例统计结果;C. Tim-3+CD3+CD4+ T细胞比例统计结果;D. Tim-3+CD3+CD8+ T细胞比例统计结果;E. Tim-3在CD3+CD4+ T细胞的表达变化;F. Tim-3在CD3+CD8+ T细胞的表达变化 A. Frequency of CD3+CD4+ T cells; B. Frequency of CD3+CD8+ T cells; C. Frequency of Tim-3+CD3+CD4+ T cells; D. Frequency of Tim-3+CD3+CD8+ T cells; E. Tim-3 expression on CD3+CD4+ T cells; F. Tim-3 expression on CD3+CD8+ T cells 图 4 小鼠感染伯氏疟原虫后外周血T细胞比例及其表面Tim-3表达变化 Fig. 4 The proportion of T cells and the expression of Tim-3 on the surface of certain cells in peripheral blood of mice post infected with P. berghei |
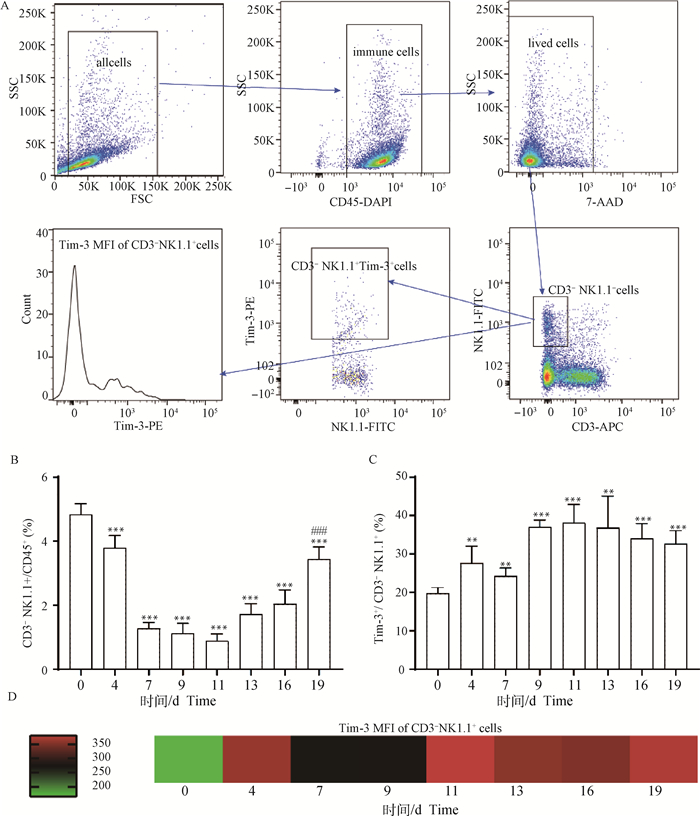
利用流式细胞术检测小鼠脾中NK细胞及NK细胞表面Tim-3的变化,图 5A为流式圈门方案。如图 5B所示:与未感染组(0 d组)相比,感染4 d,小鼠脾CD3-NK1.1+细胞比例显著降低(P<0.001),感染第11天比例降到最低(P<0.001),感染第13~19天逐渐升高,但CD3-NK1.1+细胞的比例仍显著低于未感染组(0 d组)。与未感染组(0 d组)相比,感染4 d,小鼠脾Tim-3+CD3-NK1.1+细胞的比例显著升高(P<0.01),感染的第11天比例升到最高(P<0.001),随后逐渐降低,但感染后期脾Tim-3+CD3-NK1.1+细胞仍显著高于未感染组(图 5C)。在感染疟原虫后,小鼠脾CD3-NK1.1+细胞细胞表面的Tim-3分子的表达量均显著高于未感染组(图 5D)。
|
A. 流式细胞圈门方案;B. CD3-NK1.1+细胞比例统计结果;C. Tim-3+CD3-NK1.1+细胞比例统计结果;D. Tim-3在CD3-NK1.1+细胞的表达变化。*. P < 0.05, **. P < 0.01, ###、***. P < 0.001, *.代表与0 d组进行比较,#.代表 19 d组与16 d组进行比较 A. Flow cytometry gate strategy; B. Frequency of CD3-NK1.1+ cells; C. Frequency of Tim-3+CD3-NK1.1+ cells; D. Tim-3 expression on CD3-NK1.1+ cells. *. P < 0.05, **. P < 0.01, ###, ***. P < 0.001, *. Indicates compared with the day 0 group, #. Indicates day 19 group compared with the day 16 group 图 5 小鼠感染伯氏疟原虫后脾NK细胞比例及其表面Tim-3表达变化 Fig. 5 The proportion of NK cells and the expression of Tim-3 on the surface of certain cells in spleen of mice post infected with P. berghei |
小鼠外周血中CD3-NK1.1+细胞的比例在感染后第4天发生显著升高(P<0.05),随后降低,直至感染末期,且在感染的第9~19天,CD3-NK1.1+细胞的比例均显著低于未感染组(P < 0.001, 图 6A)。外周血Tim-3+CD3-NK1.1+细胞的比例在感染后显著升高(P<0.001,图 6B)。流式细胞术MFI结果显示:外周血中,CD3-NK1.1+细胞表面Tim-3分子的表达量呈不规则升高趋势,感染末期升至最高(图 6C)。
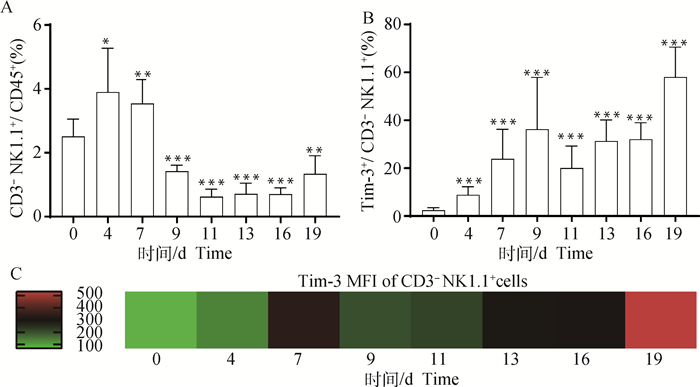
|
A. CD3-NK1.1+细胞比例统计结果;B. Tim-3+CD3-NK1.1+细胞比例统计结果;C. Tim-3在CD3-NK1.1+细胞的表达变化。*. P < 0.05, **. P < 0.01, ***. P < 0.001, *.代表与0 d组进行比较 A. Frequency of CD3-NK1.1+ cells; B. Frequency of Tim-3+CD3-NK1.1+ cells; C. Tim-3 expression on CD3-NK1.1+ cells. *. P < 0.05, **. P < 0.01, ***. P < 0.001, *. Indicates compared with the day 0 group 图 6 小鼠感染伯氏疟原虫后外周血NK细胞比例及其表面Tim-3表达变化 Fig. 6 The proportion of NK cells and the expression of Tim-3 on the surface of certain cells in peripheral blood of mice post infected with P. berghei |
利用细胞因子微球检测技术检测了小鼠血清中IFN-γ、TNF-α、IL-2、IL-6和IL-10的分泌情况。如图 7A和图 7F,感染疟原虫后的第4天,血清中IFN-γ的分泌急剧增多,且差异极显著(P<0.001),之后逐渐降低,直至感染的第13~19天, IFN-γ的分泌量与未感染组几乎相同(P>0.05);图 7B和图 7F为血清中IL-2的分泌情况,结果显示感染疟原虫后的第4~19天,血清中IL-2的分泌量均显著高于未感染组(P<0.05);如图 7C、图 7D和图 7F所示,感染疟原虫后,小鼠血清中IL-6和TNF-α的分泌均出现了先升高后降低的趋势(P<0.05)。血清中IL-10的含量在小鼠感染疟原虫后逐渐升高,且在感染末期达到最高(P<0.001, 图 7E、图 7F)。
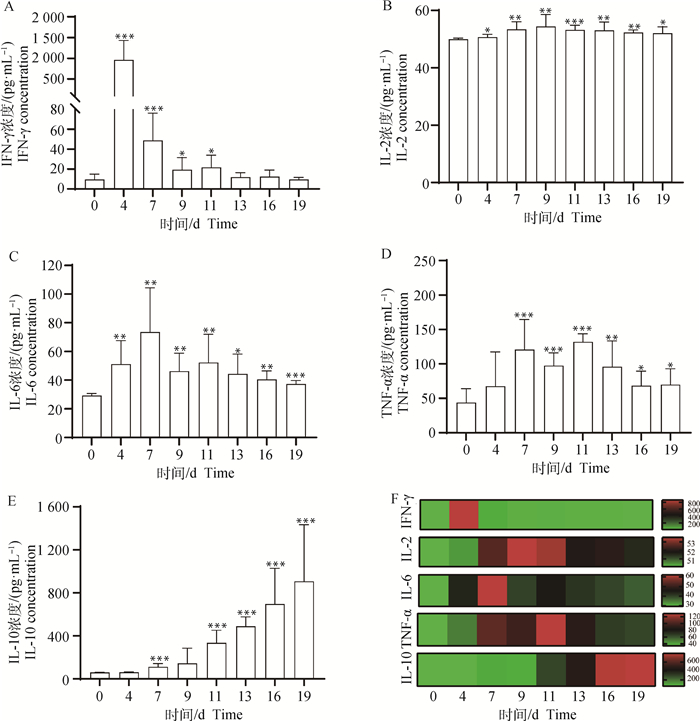
|
A~E. 血清中细胞因子IFN-γ、IL-2、IL-6、TNF-α和IL-10的检测结果统计;F. 对血清中IFN-γ、IL-2、IL-6、TNF-α和IL-10检测数据进行的热图分析结果。*. P < 0.05, **. P < 0.01, ***. P < 0.001, *.代表与0 d组进行比较 A-E. Secretion level statistics of IFN-γ, IL-2, IL-6, TNF-α and IL-10 in mice serum, respectively; F. Heat map analysis of IFN-γ, IL-2, IL-6, TNF-α and IL-10 in mice serum. *. P < 0.05, **. P < 0.01, ***. P < 0.001, *. Indicates compared with the day 0 group 图 7 小鼠感染伯氏疟原虫后血清中细胞因子的变化 Fig. 7 Changes of cytokines in serum of mice infected with P. berghei |
脾是机体重要的免疫器官,在机体的造血和免疫监视功能中都起着非常重要的作用,脾肿大可能是严重疾病的第一个征兆[17]。本研究发现,在感染疟原虫第4天小鼠脾肿大非常明显,且随感染时间的延长,小鼠脾持续增大。脾的功能之一是清除异常红细胞,因此,这可能意味着在感染疟原虫的小鼠脾中存在更多的受感染红细胞。此外,本研究发现感染疟原虫小鼠脾非淋巴细胞亚群的细胞比例显著增多,而已有研究表明,脾肿大与非淋巴细胞(例如中性粒细胞)的脾浸润有关[17],这也可能是导致本研究中小鼠脾增大的原因之一。
T细胞是清除红内期疟原虫的重要组成部分[5],可产生如IFN-γ和TNF-α等促炎细胞因子,从而引发巨噬细胞和其他组分的抗寄生虫免疫应答[7]。本研究显示, 外周血T细胞,尤其是CD3+CD8+ T细胞在感染前期显著升高,而血清中的IFN-γ的分泌量也在此时达到最高。除T细胞外,IFN-γ也可由NK细胞产生,是NK细胞清除疟原虫所必需的细胞因子[18],NK细胞通过细胞毒性和产生促炎细胞因子来破坏受损、功能失调或被感染的宿主细胞,从而控制疟原虫感染的进程[9]。本研究发现,感染早期外周血NK细胞的比例也达到了最高。具有抗虫活性的TNF-α也可通过活化的巨噬细胞分泌[19-20]。IL-2也是一种促炎细胞因子,因其具有促进T细胞体外增殖和分化的能力而被命名为T细胞生长因子(T cell growth factor,TCGF)。IL-2主要由活化的T细胞产生,尤其是活化的CD4+T细胞[21]。IL-6主要由单核巨噬细胞、Th2细胞、血管内皮细胞、成纤维细胞等产生,可与IL-1一起协同促进T细胞增殖,它还可促使B细胞分化。疟原虫红内期感染期间,IL-6可以促进CD4+ T细胞活化和B细胞应答反应及分化,刺激早期疟原虫特异性IgM的产生,是疟原虫感染期间免疫应答的重要组成部分[22]。在本研究中,血清IFN-γ、IL-2、IL-6和TNF-α的分泌在感染疟原虫后显著升高,在感染后4、7或9 d达到最高水平,表明机体此时在进行积极的抗虫免疫反应。
然而,疟原虫感染会引起T细胞的耗竭[23]。已有研究表明,在疟原虫感染中,表达Tim-3的T细胞亚群比例升高,而阻断Tim-3可增强宿主介导的细胞免疫应答反应[13]。Tim-3作为一种免疫抑制分子,在包括T细胞、NK细胞、巨噬细胞和单核细胞等多种免疫细胞上均有表达。在对荷瘤小鼠的研究中发现,抗Tim-3抗体可减弱小鼠对抗PD-1治疗产生耐药性[24]。也有研究表明,给感染日本血吸虫的小鼠注射Tim-3-Fc融合蛋白,表达IFN-γ的CD4+ T细胞的比例会增加,表明Tim-3抑制了机体的Th1型免疫反应[11]。本研究发现,在感染疟原虫后小鼠脾和外周血T细胞和NK细胞表达的Tim-3的水平均出现升高趋势,虽然Tim-3分子在外周血CD3+CD4+ T细胞和CD3+CD8+ T细胞表面的表达均呈现了先升高后降低的趋势,但感染末期Tim-3分子的表达量仍高于未感染小鼠。有研究表明,Tim-3在抑制细胞因子(如TNF和INF-γ)的表达方面也发挥着关键作用[25]。在多发性硬化和结肠直肠癌的小鼠模型中,Tim-3和IL-10的升高伴随着IFN-γ和TNF-α表达的减少[26]。此外,由Th2细胞产生的IL-10也可抑制IL-2、IL-12和IFN-γ的分泌,并降低树突状细胞的抗原提呈和MHC Ⅱ类分子表达[27]。也有研究发现,在约氏疟原虫感染的小鼠中,IL-10和TGF-β的产生与高寄生虫血症和严重贫血有关[28]。在本研究中,Tim-3分子的持续升高表达以及血清中IL-10的急剧持续升高可能是引起IFN-γ、TNF-α和IL-6在感染中期和后期逐渐降低的原因之一。表明感染后期,机体的免疫抑制过程加剧,这也可能是机体免疫反应最终未能成功杀灭疟原虫的原因之一。
4 结论综上,本研究结果表明,感染疟原虫后,小鼠的T细胞与NK细胞介导的免疫应答反应发挥了一定的杀伤作用,在感染前期有一些促炎细胞因子如IFN-γ、TNF-α、IL-2和IL-6参与了抗疟原虫免疫,但由于Tim-3免疫检查点分子及一些发挥免疫抑制作用的细胞因子(IL-10)的过度表达,推测这可能导致小鼠在感染后期处于过度的免疫抑制状态,从而有利于疟原虫逃避宿主的免疫捕杀作用。这提示从宿主免疫抑制角度出发,针对抗疟原虫免疫反应方面设计药物具有重要意义。
| [1] |
NOEDL H, SE Y, SCHAECHER K, et al. Evidence of artemisinin-resistant malaria in western Cambodia[J]. N Engl J Med, 2008, 359(24): 2619-2620. DOI:10.1056/NEJMc0805011 |
| [2] |
张逸龙, 潘卫庆. 恶性疟原虫对青蒿素产生抗性的研究进展[J]. 中国寄生虫学与寄生虫病杂志, 2015, 33(6): 418-424. ZHANG Y L, PAN W Q. Research progress on artemisinin resistance in Plasmodium falciparum[J]. Chinese Journal of Parasitology and Parasitic Diseases, 2015, 33(6): 418-424. (in Chinese) |
| [3] |
FAIRHURST R M, DONDORP A M. Artemisinin-resistant Plasmodium falciparum malaria[J]. Microbiol Spectr, 2016, 4(3). DOI:10.1128/microbiolspec.EI10-0013-2016 |
| [4] |
LONG C A, ZAVALA F. Immune responses in malaria[J]. Cold Spring Harb Perspect Med, 2017, 7(8): a025577. DOI:10.1101/cshperspect.a025577 |
| [5] |
CHOTIVANICH K, UDOMSANGPETCH R, MCGREADY R, et al. Central role of the spleen in malaria parasite clearance[J]. J Infect Dis, 2002, 185(10): 1538-1541. DOI:10.1086/340213 |
| [6] |
SPENCE P J, LANGHORNE J. T cell control of malaria pathogenesis[J]. Curr Opin Immunol, 2012, 24(4): 444-448. DOI:10.1016/j.coi.2012.05.003 |
| [7] |
NASR A, ALLAM G, HAMID O, et al. IFN-gamma and TNF associated with severe falciparum malaria infection in Saudi pregnant women[J]. Malar J, 2014, 13: 314. DOI:10.1186/1475-2875-13-314 |
| [8] |
KAFUYE-MLWILO M Y, MUKHERJEE P, CHAUHAN V S. Kinetics of humoral and memory B cell response induced by the Plasmodium falciparum 19-kilodalton merozoite surface protein 1 in mice[J]. Infect Immun, 2012, 80(2): 633-642. DOI:10.1128/IAI.05188-11 |
| [9] |
CAMPBELL K S, HASEGAWA J. Natural killer cell biology: An update and future directions[J]. J Allergy Clin Immunol, 2013, 132(3): 536-544. DOI:10.1016/j.jaci.2013.07.006 |
| [10] |
DA SILVA I P, GALLOIS A, JIMENEZ-BARANDA S, et al. Reversal of NK-cell exhaustion in advanced melanoma by Tim-3 blockade[J]. Cancer Immunol Res, 2014, 2(5): 410-422. DOI:10.1158/2326-6066.CIR-13-0171 |
| [11] |
QI Y, SONG X R, SHEN J L, et al. Tim-2 up-regulation and galectin-9-Tim-3 pathway activation in Th2-biased response in Schistosoma japonicum infection in mice[J]. Immunol Lett, 2012, 144(1-2): 60-66. DOI:10.1016/j.imlet.2012.03.007 |
| [12] |
SHARMA S, SUNDARARAJAN A, SURYAWANSHI A, et al. T cell immunoglobulin and mucin protein-3 (Tim-3)/Galectin-9 interaction regulates influenza A virus-specific humoral and CD8 T-cell responses[J]. Proc Natl Acad Sci U S A, 2011, 108(47): 19001-19006. DOI:10.1073/pnas.1107087108 |
| [13] |
HOU N, ZOU Y, PIAO X Y, et al. T-cell immunoglobulin- and mucin-domain-containing molecule 3 signaling blockade improves cell-mediated immunity against malaria[J]. J Infect Dis, 2016, 214(10): 1547-1556. DOI:10.1093/infdis/jiw428 |
| [14] |
HUANG B, LIU M, HUANG S G, et al. Expression of tim-1 and tim-3 in Plasmodium berghei ANKA infection[J]. Parasitol Res, 2013, 112(7): 2713-2719. DOI:10.1007/s00436-013-3442-z |
| [15] |
EUGUI E M, ALLISON A C. Malaria infections in different strains of mice and their correlation with natural killer activity[J]. Bull World Health Organ, 1979, 57 Suppl 1(Suppl): 231-238. |
| [16] |
SCHELLER L F, WIRTZ R A, AZAD A F. Susceptibility of different strains of mice to hepatic infection with Plasmodium berghei[J]. Infect Immun, 1994, 62(11): 4844-4847. DOI:10.1128/iai.62.11.4844-4847.1994 |
| [17] |
MOTYCKOVA G, STEENSMA D P. Why does my patient have lymphadenopathy or splenomegaly?[J]. Hematol Oncol Clin North Am, 2012, 26(2): 395-408. DOI:10.1016/j.hoc.2012.02.005 |
| [18] |
PRAKASH D, FESEL C, JAIN R, et al. Clusters of cytokines determine malaria severity in Plasmodium falciparum-infected patients from endemic areas of central India[J]. J Infect Dis, 2006, 194(2): 198-207. DOI:10.1086/504720 |
| [19] |
HEALER J, MCGUINNESS D, CARTER R, et al. Transmission-blocking immunity to Plasmodium falciparum in malaria-immune individuals is associated with antibodies to the gamete surface protein Pfs230[J]. Parasitology, 1999, 119(Pt 5): 425-433. |
| [20] |
DODOO D, OMER F M, TODD J, et al. Absolute levels and ratios of proinflammatory and anti-inflammatory cytokine production in vitro predict clinical immunity to Plasmodium falciparum malaria[J]. J Infect Dis, 2002, 185(7): 971-979. DOI:10.1086/339408 |
| [21] |
KEENE J A, FORMAN J. Helper activity is required for the in vivo generation of cytotoxic T lymphocytes[J]. J Exp Med, 1982, 155(3): 768-782. DOI:10.1084/jem.155.3.768 |
| [22] |
ROBINSON L J, D'OMBRAIN M C, STANISIC D I, et al. Cellular tumor necrosis factor, gamma interferon, and interleukin-6 responses as correlates of immunity and risk of clinical Plasmodium falciparum malaria in children from Papua New Guinea[J]. Infect Immun, 2009, 77(7): 3033-3043. DOI:10.1128/IAI.00211-09 |
| [23] |
WIPASA J, XU H J, STOWERS A, et al. Apoptotic deletion of Th cells specific for the 19-kDa carboxyl-terminal fragment of merozoite surface protein 1 during malaria infection[J]. J Immunol, 2001, 167(7): 3903-3909. DOI:10.4049/jimmunol.167.7.3903 |
| [24] |
ROMERO D. Immunotherapy: PD-1 says goodbye, TIM-3 says hello[J]. Nat Rev Clin Oncol, 2016, 13(4): 203. |
| [25] |
LIU Y, SHU Q, GAO L F, et al. Increased Tim-3 expression on peripheral lymphocytes from patients with rheumatoid arthritis negatively correlates with disease activity[J]. Clin Immunol, 2010, 137(2): 288-295. DOI:10.1016/j.clim.2010.07.012 |
| [26] |
RANGACHARI M, ZHU C, SAKUISHI K, et al. Bat3 promotes T cell responses and autoimmunity by repressing Tim-3-mediated cell death and exhaustion[J]. Nat Med, 2012, 18(9): 1394-1400. DOI:10.1038/nm.2871 |
| [27] |
VAILLANT A A J, QURIE A. Interleukin[M]//StatPearls[Internet]. Treasure Island: StatPearls Publishing, 2022.
|
| [28] |
OMER F M, DE SOUZA J B, RILEY E M. Differential induction of TGF-β regulates proinflammatory cytokine production and determines the outcome of lethal and nonlethal Plasmodium yoelii infections[J]. J Immunol, 2003, 171(10): 5430-5436. DOI:10.4049/jimmunol.171.10.5430 |
(编辑 范子娟)



