2. 陕西科技大学食品与生物工程学院,西安 710021;
3. 江苏大学食品与生物工程学院, 镇江 212013;
4. 西北农林科技大学,杨凌 712100
2. School of Food and Biological Engineering, Shaanxi University of Science and Technology, Xi'an 710021, China;
3. Jiangsu University-School of Food and Biological Engineering, Zhenjiang 212013, China;
4. Northwest A & F University, Yangling 712100, China
产气荚膜梭菌(Clostridium perfringens,Cp)是一种革兰阳性厌氧菌,通常存在于人和动物的肠道中,是一种重要的人畜共患病原菌[1]。生肉及其制品在加工过程中可能会被Cp污染而引起人的气性坏疽、食物中毒、胃肠紊乱、肝肾损害等疾病[1-3]。该菌可分泌多种毒素,目前,已报道有17种以上,根据其分泌的主要致病毒素(α、β、ε、ι)不同可分成A、B、C、D、E共5个类型[2]。其中,A型可分泌α毒素,B型可分泌α、β和ε 3种毒素,C型可分泌α和β2种毒素,D型可分泌α和ε2种毒素,E型可分泌α和ι2种毒素[3]。A型Cp是引起鸡坏死性肠炎(necrotic enteritis,NE)的主要病原菌, 然而细菌耐药及抗生素残留问题日益突出,抗生素作为生长促进剂(antimicrobial growth promoters,AGP)被限制、禁止,从而导致全球范围内鸡NE的发病率显著上升[4-5]。鸡感染Cp后,会出现肠道黏膜慢性损伤,采食量降低、体重下降、腹泻等症状,料重比升高,产蛋量下降,甚至死亡,给养禽业带来巨大的经济损失[6-7]。因此,亟需有效的防控细菌性疾病手段和途径。
噬菌体是一类能够感染细菌、支原体、螺旋体、放线菌以及蓝细菌等的病毒,亦称为细菌病毒[8-10]。其广泛存在于水体、土壤,具有繁殖速度快且容易分离等特点,成为潜在的防控细菌性疾病的候选。噬菌体高度特异,不影响其他菌群;高效且无需反复多次给药;安全无副作用,不会出现抗生素治疗常见的过敏反应和继发感染,同时不会残留在机体内,污染环境等优势[11],目前,已广泛用于食品、医疗及农业领域[1, 9]。本研究针对禽养殖行业和加工环境中持续存在且难以解决的Cp污染进行了噬菌体的分离鉴定并明晰其作用特性,以期能够用于养殖领域。
1 材料与方法 1.1 Cp菌种来源Cp菌株CMCC64722及43株不同地区养殖场禽源分离株(表 1)均由江苏省食品质量安全重点实验室-省部共建国家重点实验室培育基地保存和鉴定。Cp通过厌氧肉汤培养基(含疱肉牛肉粒、石蜡油),40 ℃厌氧培养18~24 h。
|
|
表 1 噬菌体vB_CpeS_SD72宿主谱测定 Table 1 Results of phage vB_CpeS_SD72 host spectrum determination |
针对山东地区某养殖场肉鸡肠道组织样品,以CMCC 64722为宿主菌进行噬菌体分离。将采集到的病死鸡肠道组织匀浆后,用0.1%缓冲蛋白胨水悬浮,静置过夜,取上清液,5 000×g离心20 min,再收集上清液,用0.22 μm微孔滤器过滤。取上述滤液1 mL加入5 mL LB培养液,再加入1 mL对数期(OD600 nm=0.6) 宿主菌悬液,室温静置20 min,37 ℃厌氧培养24 h,过滤后得到噬菌体原液。通过点滴法进行验证:取100 μL宿主菌悬液与0.6% LB混匀后倾注在LB底层平板上,晾干,滴加噬菌体原液5 μL,同时滴加等量LB培养液作为阴性对照,室温放置5 min,干燥后,37 ℃厌氧培养12 h,观察噬菌斑。
1.3 Cp噬菌体电镜形态观察取纯化后的噬菌体悬液7 μL(>108 PFU·mL-1) 滴至铜网上吸附30 min,使用2%磷钨酸(phosphotungstic acid,PTA)负染10 min,室温干燥后,用透射电子显微镜观察并拍摄噬菌体的形态,同时测量头部直径、尾部长度。
1.4 Cp噬菌体外体抗菌活性分别取1 mL对数生长期的宿主菌CMCC 64722与1 mL 108 PFU·mL-1的噬菌体悬液混匀,静置孵育20 min,加入5 mL厌氧肉干汤,OD600 nm调至0.3左右,设置细菌CMCC 64722对照组,于0、0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6 h读取OD600 nm值。
1.5 Cp噬菌体裂解谱取冻存的43株Cp分离株,挑取单菌落于5 mL厌氧肉汤中,37 ℃厌氧培养。分别取400 μL菌悬液与0.6% LB混匀后倾注在LB底层平板上,待吸收干燥后,滴加10 μL噬菌体裂解液,待吸收后,于37 ℃厌氧培养过夜,次日观察细菌和噬菌斑的生长情况。对各细菌的裂解情况进行统计,分析裂解谱。
1.6 Cp噬菌体一步生长曲线将噬菌体和宿主菌按照感染复数为10的比例混合,将混合物置于37 ℃培养箱孵育15 min,使噬菌体与宿主菌充分吸附,将混合物以10 000×g离心2 min,去除上清,将沉淀用厌氧肉汤液体重悬并加至10 mL厌氧肉汤液中,37 ℃、200 r·min-1摇床振荡培养。每隔10 min取上清,直至120 min,利用双层平板法测定噬菌体效价,重复3次。以时间为横坐标,噬菌体效价的对数值为纵坐标绘制一步生长曲线,并计算爆发量。爆发量=爆发末期噬菌体数目/感染初期宿主菌数目。
1.7 Cp噬菌体最佳感染复数(MOI)取对数期宿主菌,按MOI 1 000、100、10、1、0.1、0.01、0.001加入噬菌体,37 ℃、150 r·min-1振荡培养5 h,10 000×g、4 ℃离心10 min,取上清,测定各组噬菌体效价。重复3次,各试验组中效价最高的感染复数即为最佳感染复数。
1.8 Cp噬菌体pH及热稳定性使用浓盐酸或氢氧化钠溶液将PBS缓冲液调整至pH为2~13,取100 μL噬菌体滴加到900 μL不同pH的PBS缓冲液中,37 ℃孵育培养2 h后,利用双层平板法测定不同pH条件作用的噬菌体效价。
取噬菌体液(1×109PFU·mL-1)置于温度为30、40、50、60和70 ℃的水浴锅内,孵育培养,并于30和60 min分别取样100 μL,利用双层平板法测定其效价。
1.9 Cp噬菌体全基因组测序及生物信息学分析参照High Pure Viral DNA Kit说明书步骤提取Cp噬菌体基因组。采用全基因组鸟枪法(whole genome shotgun,WGS)策略,构建不同插入片段的文库,利用第二代测序技术(nextGeneration sequencing,NGS),基于Illumina NovaSeq测序平台,对这些文库进行末端(paired-end,PE)测序。使用ABSS(http://www.bcgsc.ca/platform/software/abyss)和GapCloser(https://sourceforge.net/projects/soapdenovo2/files/GapCloser/)软件拼接全基因组序列,RAST在线数据库(https://rast.nmpdr.org/)注释全基因组序列,所有的开放阅读框使用BLASTp (https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线比对确定基因功能。采用MEGA20.0软件中neighbor-joining方法对噬菌体进行进化分析。
1.10 Cp噬菌体模拟环境减菌应用将超净工作台(840 cm×700 cm×540 cm) 紫外线杀菌1 h后进行环境模拟喷洒噬菌体,采用5 mL无菌喷雾小瓶,在超净工作台内设置5个检测点,编号为A、B、C、D、E (分别位于工作台四角及中心),每个检测点分别放置3个无盖的含有D-环丝氨酸的LB固体平板。在距离台面40 cm的高度,均匀喷洒细菌及噬菌体;其中,对照组中仅喷洒5 mL CMCC64722(1×104 CFU·mL-1)宿主菌,而试验组喷洒5 mL宿主菌,于5 min后,再次喷洒5 mL噬菌体SD72 (1×109 PFU·mL-1)。在喷洒后,室温作用0.5、1、2 h,利用双层平板法将0.6% LB倾注于LB(含D-环丝氨酸)底层平板上,加盖取出平板,并置于37 ℃厌氧箱过夜培养,检测菌落数量,重复试验3次。
2 结果 2.1 Cp噬菌体分离与鉴定分析以CMCC 64722为宿主菌,从鸡养殖场中的病死鸡体内分离到1株Cp噬菌体vB_CpeS_SD72(简称SD72),经纯化后观察到清晰的噬菌斑,直径约0.5 mm,呈透明、针尖、无晕圈(图 1)。透射电镜观察显示(图 2),该噬菌体具有典型的二十面体头部结构,直径约(50±1)nm,尾部长度约(150±1)nm。根据国际病毒分类委员会(ICTV)第九次报告的病毒分类系统,噬菌体SD72在分类上可能属于尾病毒目(Caudovirales)长尾病毒科(Siphoviridae)。
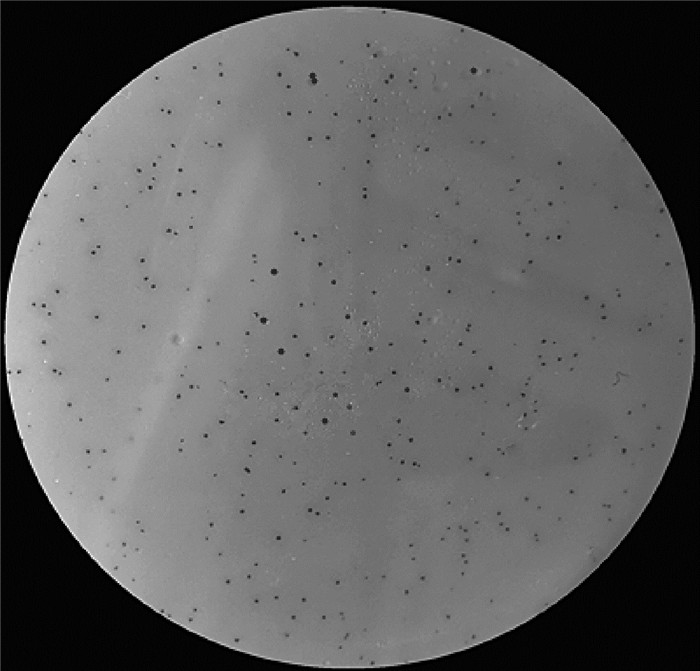
|
图 1 vB_CpeS_SD72噬菌斑形态 Fig. 1 Plaques of phage vB_CpeS_SD72 |
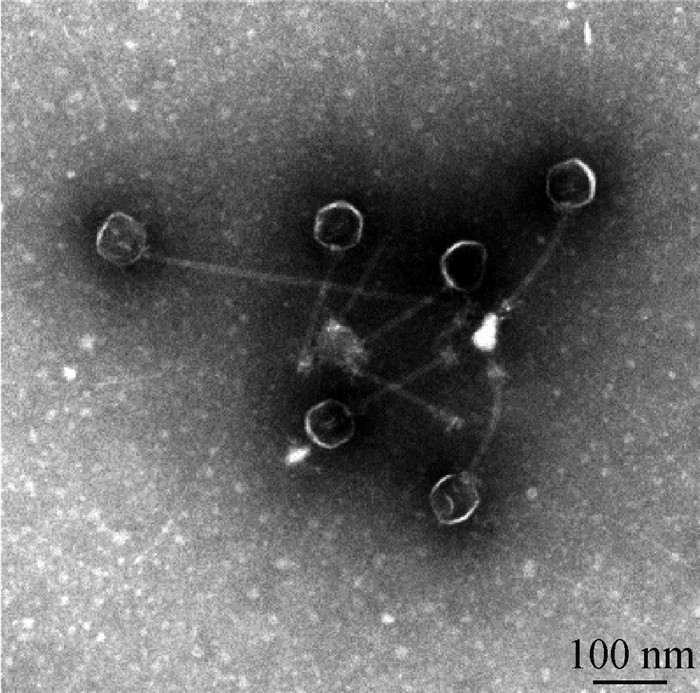
|
图 2 噬菌体vB_CpeS_SD72电镜图 Fig. 2 Transmission electron microscopy of phage vB_CpeS_ SD72 |
由图 3可知,SD72噬菌体体外裂解效果良好,在作用的前2.5 h有一定抑菌效果,此后至6 h其OD600 nm值降至0.2,与宿主菌对照呈显著性差异且菌液显著澄清。
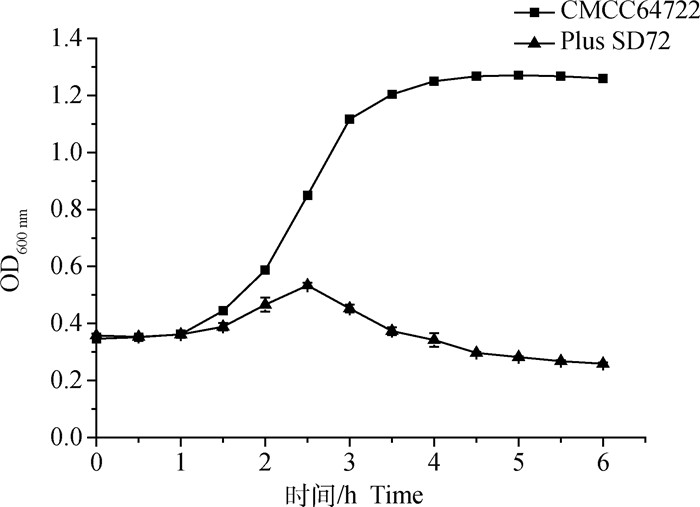
|
图 3 噬菌体vB_CpeS_SD72体外抗菌活性 Fig. 3 In vitro antibacterial activity of phage vB_CpeS_SD72 |
由表 1可知,噬菌体SD72对43株不同组织来源的A型Cp呈现不同的裂解效果,对36株菌能够被SD72完全裂解,形成清晰且透亮的噬菌斑,裂解率为83.72%。
2.3 Cp噬菌体一步生长曲线由图 4可知,噬菌体SD72的潜伏期为20 min,噬菌体持续增加,此阶段为噬菌体胞外吸附和感染阶段,在20~100 min时,噬菌体通过其特有的裂解系统裂解宿主菌,导致大量的子代噬菌体释放,噬菌体的效价呈指数增加,是噬菌体的裂解期。100~120 min,噬菌体效价趋于平稳,此阶段噬菌体完成了噬菌体的裂解周期,释放的噬菌体量达到了最高值,爆发生长量为28.5 PFU·cell-1。
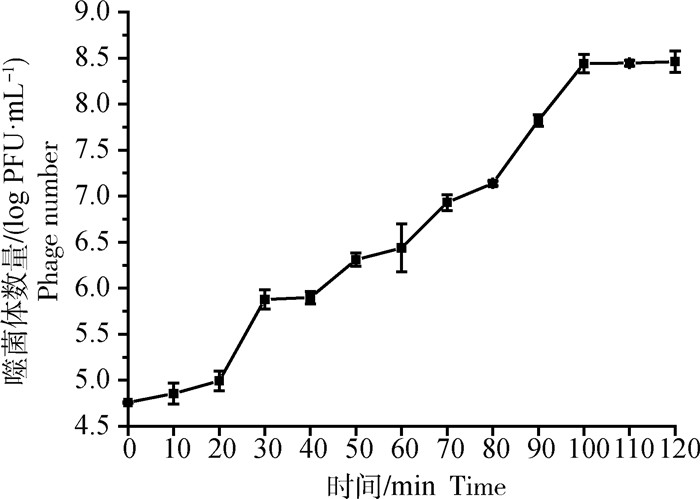
|
图 4 噬菌体vB_CpeS_SD72的一步生长曲线 Fig. 4 One-step growth curve of phage vB_CpeS_SD72 |
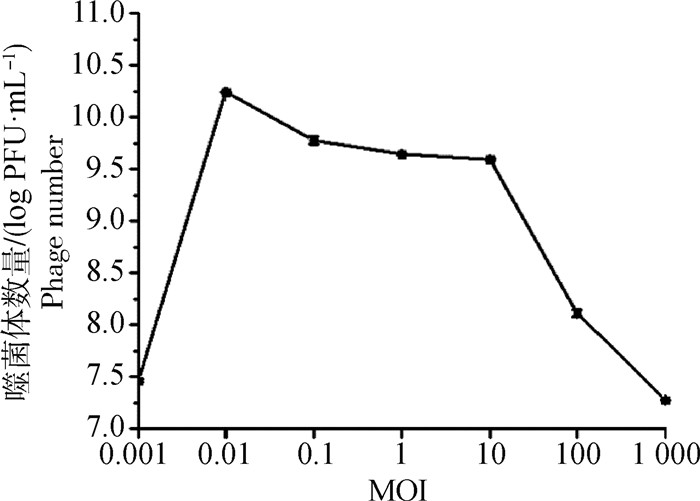
当感染复数为0.01时,噬菌体SD72释放的子代噬菌体数量最多,高达1.02×1010 PFU·mL-1,其效价为所有感染复数中最高值,是噬菌体SD72的最佳感染复数(图 5)。
|
图 5 噬菌体vB_CpeS_SD72 MOI Fig. 5 MOI of phage vB_CpeS_SD72 |
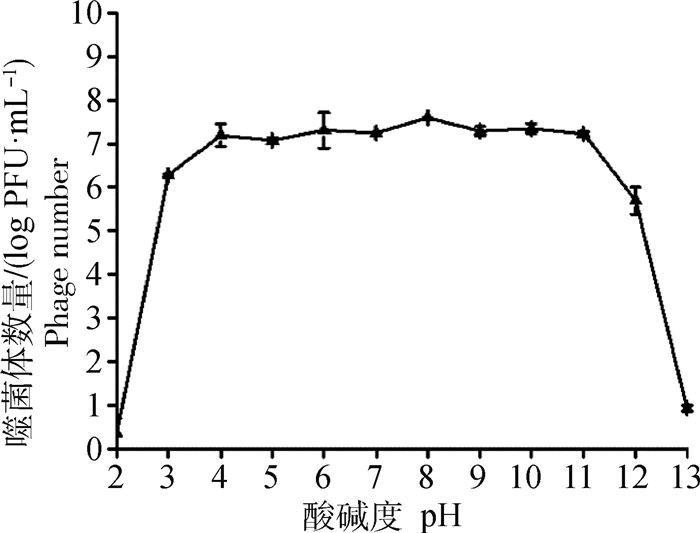
噬菌体SD72在pH 3~12的条件下无显著性变化(图 6),能够维持较高活力,表明对pH的耐受范围较广,其在pH为8左右时侵染能力仍不受影响,pH分别为3和12时,效价均可维持在90%以上,具有较强的酸碱适应能力。
|
图 6 噬菌体vB_CpeS_SD72 pH稳定性 Fig. 6 pH stability of phage vB_CpeS_SD72 |
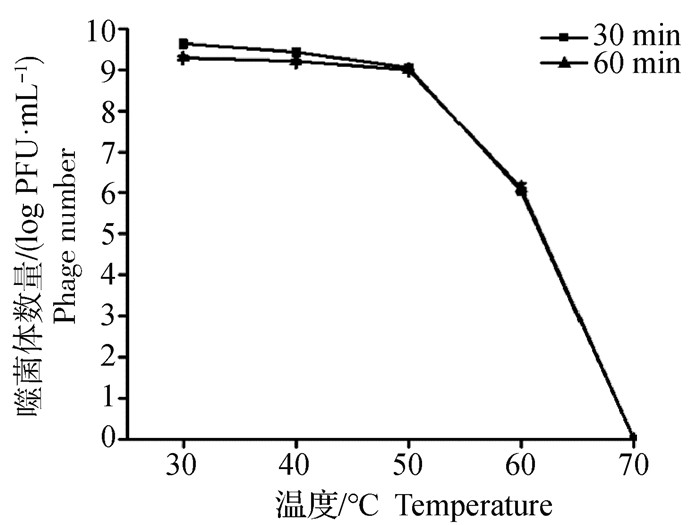
噬菌体SD72置于不同温度(30、40、50、60、70 ℃)下60 min后测定噬菌体的效价变化(图 7)。结果表明,噬菌体vB_CpeS_SD72的生物学活性在30~50 ℃的温度比较稳定,当温度升高至50 ℃以上时噬菌体的效价有下降趋势,但仍能够大量存活,70 ℃水浴处理1 h后,噬菌体SD72效价降低至0, 完全失活。表明该噬菌体在一定温度(30~50 ℃)下可保持良好的热稳定性,能够耐受高温环境,易于保存。
|
图 7 噬菌体vB_CpeS_SD72热稳定性 Fig. 7 The thermal stability curve of vB_CpeS_SD72 |
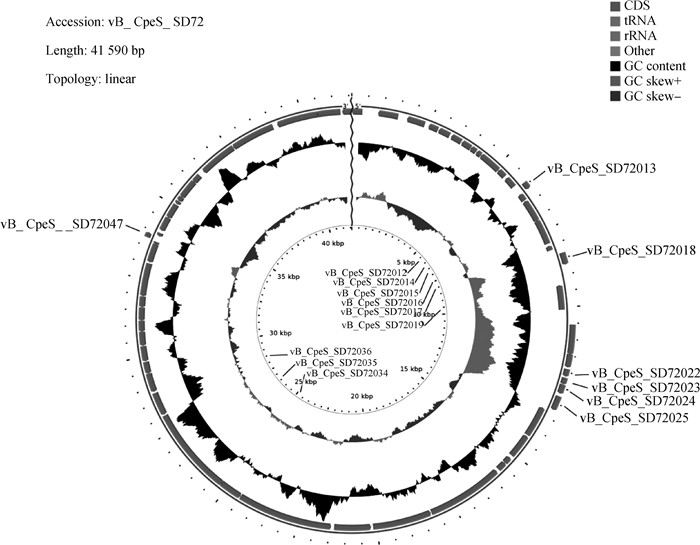
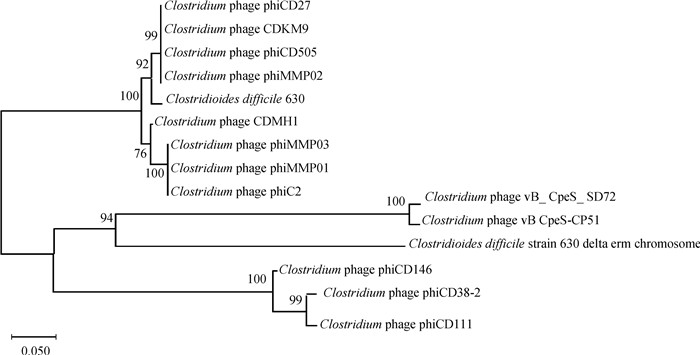
全基因组测序结果分析表明(图 8),vB_CpeS_SD72基因组为线性双链DNA,全长41 590 bp,GC含量为28.46 %,平均基因长度为645 bp,未检测到耐药基因、毒力基因及tRNA。vB_CpeS_SD72共注释得到59个开放阅读框(open reading frame,ORF),其中,33个ORF与数据库中已公开的功能蛋白有较高相似性(表 2),其他26个ORF注释为功能未知的假定蛋白。此外,在基因组中未发现编码阻遏蛋白、整合酶等与溶源性相关的序列或基因。从基因组结构上分析,预测包装模块:末端酶小亚基(ORF58,terminase small subunit)、尾部蛋白(ORF34,tail component protein)、原头蛋白酶(ORF53,the prohead protease)、主要衣壳蛋白(ORF44、ORF55,major capsid protein),该噬菌体基因组中未发现末端酶大亚基序列。预测ORF28穿孔素(holin)是关于裂解细菌的蛋白,导致细胞质膜电位的崩溃和膜的通透性改变。预测ORF12(single-stranded DNA-binding protein)、ORF1、ORF59(DNA-invertase)ORF2(site-specific recombinase)是参与噬菌体复制与调节的蛋白,包括DNA结合酶、DNA转化酶、重组酶。为探究噬菌体SD72与其他噬菌体的进化关系,选择ORF58末端酶小亚基蛋白进行系统进化树的构建。从基于小亚基终止酶构建的系统进化树可以看出(图 9),噬菌体SD72与Clostridium phage vB CpeS-CP51在同一分支,亲缘关系较近,后者在分类上也同样属于长尾噬菌体科。综上所述,噬菌体SD72在分类上应归属有尾噬菌体目长尾噬菌体科。
|
扫描文章首页OSID码可查看彩图 The color picture can be found by scanning the OSID code on the front page of the article 图 8 噬菌体vB_CpeS_SD72全基因组结构示意图 Fig. 8 Schematic diagram of the whole genome structure of phagevB_CpeS_SD72 |
|
|
表 2 噬菌体vB_CpeS_SD72 ORF功能分析 Table 2 ORFs function analysis of phage vB_CpeS_SD72 |
|
图 9 基于噬菌体末端酶小亚基蛋白序列的系统进化树 Fig. 9 Phylogenetic tree of phagesterminase small subunit |
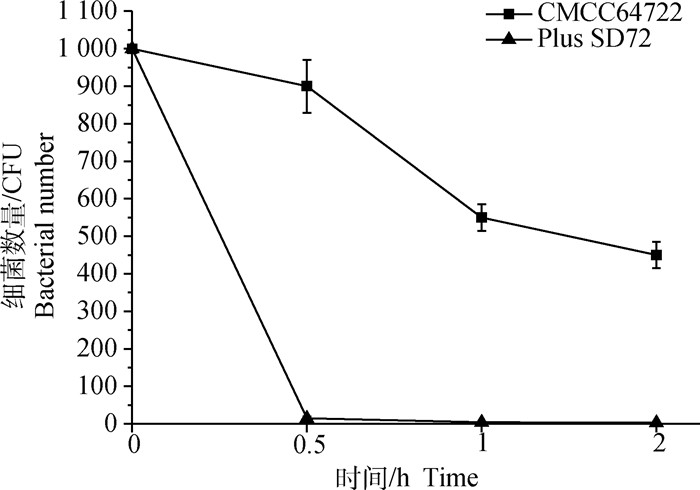
与细菌对照组CMCC64722相比(图 10),在喷洒噬菌体SD72作用0.5 h后,细菌CMCC64722数即从900 CFU(检测点平均值)降至14.8 CFU(检测点平均值),抑菌效率可达98.36%,能有效抑制细菌生长,起到一定的灭菌作用。噬菌体SD72作用1和2 h后,存活的CMCC64722的数量接近于0,抑菌效率为99.60%。由此可知,0.5 h内SD72可快速高效抑菌,在1~2 h内能达到几乎清除Cp的效果。
|
图 10 噬菌体vB_CpeS_SD72的喷雾灭菌时间分析 Fig. 10 Bactericidal efficiency of phage vB_CpeS_SD72 spraying based on time |
随着新冠疫情影响趋缓,经济逐步复苏,美国农业部(USDA,https://www.ers.usda.gov/data-products/livestock-and-meat-international-trade-data/)报告分析称,全球经济复苏将推动鸡肉需求温和增长,2021年,全球鸡肉产量达到创纪录的1.021亿t,美国鸡肉零售量和年产量位居肉类产品最高,而中国紧随其后成为全球第二大鸡肉消费国。为了满足全球人口动物性食品需求的增量,在规模化食用动物养殖中会添加预防剂量的抗生素以提升生产量,但随之引发了肠道菌耐药性加剧,部分人畜共患病原菌已出现严重的多重耐药性[12-14]。在欧美国家,由于抗生素的限制性使用[15-16],Cp引起的NE发病率呈上升趋势(10%~50%)[1],在我国禁抗时代的到来,Cp的感染也将会给家禽养殖业造成经济损失。
噬菌体来源于环境,能够特异性对抗细菌且不影响正常菌群,从而受到研究人员及药品研发企业的高度关注。应用噬菌体控制Cp可以在养殖过程中也可以在屠宰加工环节[17]。目前,针对Cp噬菌体的相关研究较少,在国际报道中,Seal等[18]从肉鸡内脏和家禽粪便中分离获得噬菌体ΦCP39O和ΦCP26F,两种噬菌体均有直径57 nm的对称头部,100 nm的非收缩尾,具有尾病毒目成员的特征。俄罗斯联邦莫斯科地区分离到1株强毒短尾噬菌体ΦCPV1及2株短尾噬菌体,即ΦCPV4和ΦZP2,与美国东南部分离出噬菌体ΦCP7R密切相关[19]。Bae等[20]从养鸡场的粪便样本中分离出噬菌体4CJ22,降低了肉鸡肠道中Cp载菌量。Morales等[21]从一个废物处理厂的原始污水中分离出噬菌体ΦCP24R,并对A型Cp具有裂解活性。Volozhantsev等[22]从禽养殖场污水、粪便和肉鸡肠道内容物中分离出烈性噬菌体CPV1,为双链DNA,基因组为16 747 bp,包含22个开放阅读框。在国内,仅有于旭磊[23]从养殖场污水、粪便等分离纯化2株具有高裂解率噬菌体CPYS4和CPYS48。
本研究分离获得1株源于禽肠道的新型烈性Cp噬菌体,该噬菌体属于长尾病毒科,潜伏期短,爆发量大,在pH为3~12的环境下具有良好的活力,从而能够适应肠道环境提升其应用潜力;此外,其对温度也能够有良好的耐受特性,在50 ℃仍能够维持高效价。噬菌体SD72的潜伏期为20 min,在100~120 min,噬菌体效价趋于平稳,在制备噬菌体制剂时具有一定的时间优势。噬菌体具有相对较广的裂解范围,裂解率高达83.72%,表明SD72是1株强裂解性噬菌体。由此可见,噬菌体SD72作为一种有效、稳定和特异的生物抑菌剂,在预防治疗Cp感染方面有着较为广阔的应用前景和研究意义。
基因组分析表明,SD72呈线性双链DNA,基因组全长约为41 590 bp,与大多数Cp噬菌体基因组相比较大。SD72与Cp vB CpeS-CP51噬菌体全基因组相似性为98.22%,ORF49预测为假定噬菌体蛋白,与vB CpeS-CP51相似性高达79.1%,相关研究针对vB CpeS-CP51进行裂解酶表达,其抑菌效果显著[23]。ORF26预测SD72基因组中包含溶菌酶功能蛋白,与Clostridium phage phiSM101噬菌体具有一定的相似性。预测ORF28 (holin)穿孔素是关于裂解细菌的蛋白,因此SD72被鉴定为一株烈性噬菌体,不具备溶原特性,具有安全性,可以作为一种生物制剂在多领域中应用。
由于Cp是以产孢子的形式存活于自然环境中,不易被杀灭,因此对畜禽养殖及食品生产加工环境构成一定威胁[24]。先前已有将噬菌体以喷雾的方式用于控制养殖环境中的致病菌的报道[25]。此外,噬菌体因其特异高效等特点被认为是对抗致病菌的重要武器,在食品中应用不影响最终产品的感官特性[26-28]。例如,单核增生李斯特菌噬菌体P100用于奶酪中并不影响奶酪中的功能性乳酸菌,也不会改变食品特性[27]。国外市售的产品,ListShieldTM(含有单核增生李斯特菌噬菌体的混合物),应用后不会影响预烤火鸡胸肉、熟火腿、博隆尼亚肉和烤牛肉的感官特性(包括味道、视觉和嗅觉)[28]。目前,噬菌体被食品加工厂靶向用于许多病原体,如沙门菌、大肠杆菌O157:H7、志贺菌、产气荚膜梭菌等[29-30]。本研究中,SD72以高浓度作用于模拟环境控制Cp的污染,在室温作用1~2 h能够有效抑制Cp,减除率高达99.60%,有效降低Cp在环境中的污染风险。
4 结论本研究分离获得1株新型的Cp噬菌体vB_CpeS_SD72,该噬菌体潜伏期短,耐酸碱及高温,具有较宽的裂解谱,在环境消减的应用中显示其高效的控制Cp污染潜力,为畜禽健康养殖和降低食品加工环境中Cp污染风险,保障畜禽肉品安全提供新的抑菌参考策略。
| [1] |
张辉, 包红朵. 产气荚膜梭菌耐药及防控研究进展[J]. 食品安全质量检测学报, 2020, 11(6): 1846-1851. ZHANG H, BAO H D. Research progress of antimicrobial resistance and bio-control of Clostridium perfringens[J]. Journal of Food Safety & Quality, 2020, 11(6): 1846-1851. (in Chinese) |
| [2] |
王晓婷, 乔军, 孟庆玲, 等. 反刍动物源产气荚膜梭菌新疆流行株的分离鉴定及分型研究[J]. 中国动物传染病学报, 2019, 27(6): 22-28. WANG X T, QIAO J, MENG Q L, et al. Isolation and molecular typing of Clostridium perfringens from Rumianants in Xingjiang[J]. Chinese Journal of Animal Infectious Diseases, 2019, 27(6): 22-28. (in Chinese) |
| [3] |
范学政, 李文平, 秦玉明, 等. 产气荚膜梭菌及其公共卫生危害[J]. 中国兽药杂志, 2021, 55(9): 57-64. FAN X Z, LI W P, QIN Y M, et al. Review of Clostridium perfringens and its hazards to public health[J]. Chinese Journal of Veterinary Drug, 2021, 55(9): 57-64. (in Chinese) |
| [4] |
FAN Y C, WANG C L, WANG C, et al. Incidence and antimicrobial susceptibility to Clostridium perfringens in premarket broilers in Taiwan[J]. Avian Diseases, 2016, 60(2): 444-449. DOI:10.1637/11315-110915-Reg |
| [5] |
张娜. 羊源产气荚膜梭菌的分离鉴定及耐药性分析[D]. 杨凌: 西北农林科技大学, 2019. ZHANG N. Isolation, identification and drug resistance analysis of Clostridium perfringens from sheep[D]. Yangling: Northwest A&F University, 2019. (in Chinese) |
| [6] |
NGAMWONGSATIT B, TANOMSRIDACHCHAI W, SUTHIENKUL O, et al. Multidrug resistance in Clostridium perfringens isolated from diarrheal neonatal piglets in Thailand[J]. Anaerobe, 2016, 38: 88-93. DOI:10.1016/j.anaerobe.2015.12.012 |
| [7] |
司南. 禽源弯曲菌和产气荚膜梭菌分离鉴定和耐药性研究[D]. 长春: 吉林农业大学, 2019. SI N. Isolation and drug resistance evaluation of Campylobacter and Clostridium perfringens from poultry origin[D]. Changchun: Jilin Agricultural University, 2019. (in Chinese) |
| [8] |
KIM J S, HOSSEINDOUST A, LEE S H, et al. Bacteriophage cocktail and multi-strain probiotics in the feed for weanling pigs: effects on intestine morphology and targeted intestinal coliforms and Clostridium[J]. Animal, 2017, 11(1): 45-53. DOI:10.1017/S1751731116001166 |
| [9] |
曹振辉, 金礼吉, 徐永平, 等. 噬菌体控制主要食源性致病菌的研究进展[J]. 食品科学, 2013, 34(5): 274-278. CAO Z H, JIN L J, XU Y P, et al. Application of bacteriophages in control of foodborne pathogens[J]. Food Science, 2013, 34(5): 274-278. (in Chinese) |
| [10] |
吕梦娜, 龙航宇, 王丽梅, 等. A型产气荚膜梭菌噬菌体裂解酶Cp51的原核表达及活性检测[J]. 华南农业大学学报, 2017, 38(5): 19-23. LÜ M N, LONG H Y, WANG L M, et al. Prokaryotic expression and activity detection of bacteriophage lysin Cp51 against Clostridium perfringens type A[J]. Journal of South China Agricultural University, 2017, 38(5): 19-23. (in Chinese) |
| [11] |
NELSON D, LOOMIS L, FISCHETTI V A. Prevention and elimination of upper respiratory colonization of mice by group A streptococci by using a bacteriophage lytic enzyme[J]. Proc Natl Acad Sci U S A, 2001, 98(7): 4107-4112. |
| [12] |
HA E, SON B, RYU S. Clostridium perfringens virulent bacteriophage CPS2 and its thermostable endolysin lysCPS2[J]. Viruses, 2018, 10(5): 251. |
| [13] |
何依蓉, 张奕杰, 杨伟, 等. 鼠伤寒沙门菌烈性噬菌体的分离鉴定与生物学特性[J]. 畜牧兽医学报, 2021, 52(3): 763-771. HE Y R, ZHANG Y J, YANG W, et al. Isolation, identification and biological properties of a lytic phage against Salmonella Typhimurium[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(3): 763-771. (in Chinese) |
| [14] |
SCHMITZ J E, OSSIPRANDI M C, RUMAH K R, et al. Lytic enzyme discovery through multigenomic sequence analysis in Clostridium perfringens[J]. Appl Microbiol Biotechnol, 2011, 89(6): 1783-1795. |
| [15] |
KIM K P, BORN Y, LURZ R, et al. Inducible Clostridium perfringens bacteriophages ΦS9 and ΦS63[J]. Bacteriophage, 2012, 2(2): 89-97. |
| [16] |
LINDSTRÖM M, HEIKINHEIMO A, LAHTI P, et al. Novel insights into the epidemiology of Clostridium perfringens type A food poisoning[J]. Food Microbiol, 2011, 28(2): 192-198. |
| [17] |
MEIJER W J J, HORCAJADAS J A, SALAS M. φ29 family of phages[J]. Microbiol Mol Biol Rev, 2001, 65(2): 261-287. |
| [18] |
SEAL B S, FOUTS D E, SIMMONS M, et al. Clostridium perfringens bacteriophages ΦCP39O and ΦCP26F: genomic organization and proteomic analysis of the virions[J]. Arch Virol, 2011, 156(1): 25-35. |
| [19] |
SEAL B S. Characterization of bacteriophages virulent for Clostridium perfringens and identification of phage lytic enzymes as alternatives to antibiotics for potential control of the bacterium[J]. Poult Sci, 2013, 92(2): 526-533. |
| [20] |
BAE D, LEE J W, CHAE J P, et al. Characterization of a novel bacteriophage φCJ22 and its prophylactic and inhibitory effects on necrotic enteritis and Clostridium perfringens in broilers[J]. Poult Sci, 2021, 100(1): 302-313. |
| [21] |
MORALES C A, OAKLEY B B, GARRISH J K, et al. Complete genome sequence of the podoviral bacteriophage ΦCP24R, which is virulent for Clostridium perfringens[J]. Arch Virol, 2012, 157(4): 769-772. |
| [22] |
VOLOZHANTSEV N V, VEREVKIN V V, BANNOV V A, et al. The genome sequence and proteome of bacteriophage ΦCPV1 virulent for Clostridium perfringens[J]. Virus Res, 2011, 155(2): 433-439. |
| [23] |
于旭磊. 产气荚膜梭菌流行特点及其噬菌体遗传背景分析[D]. 泰安: 山东农业大学, 2020. YU X L. The epidemic characteristics of Clostridium perfringens and analysis of its bacteriophage's genetic background[D]. Taian: Shandong Agricultural University, 2020. (in Chinese) |
| [24] |
SAWIRES Y S, SONGER J G. Clostridium perfringens: insight into virulence evolution and population structure[J]. Anaerobe, 2006, 12(1): 23-43. |
| [25] |
包红朵, 张辉, 李国峰, 等. 多种噬菌体单独及混合使用的喷雾灭菌研究[J]. 食品科学, 2013, 34(19): 10-13. BAO H D, ZHANG H, LI G F, et al. Sterilization of foodborne pathogens by aerosol spray treatments with phages and their cocktails[J]. Food Science, 2013, 34(19): 10-13. (in Chinese) |
| [26] |
OAKLEY B B, TALUNDZIC E, MORALES C A, et al. Comparative genomics of four closely related Clostridium perfringens bacteriophages reveals variable evolution among core genes with therapeutic potential[J]. BMC Genomics, 2011, 12(1): 282. |
| [27] |
SAWIRES Y S, SONGER J G. Clostridium perfringens: insight into virulence evolution and population structure[J]. Anaerobe, 2006, 12(1): 23-43. |
| [28] |
MAURA D, DEBARBIEUX L. Bacteriophages as twenty-first century antibacterial tools for food and medicine[J]. Appl Microbiol Biotechnol, 2011, 90(3): 851-859. |
| [29] |
KAWACKA I, OLEJNIK-SCHMIDT A, SCHMIDT M, et al. Effectiveness of phage-based inhibition of Listeria monocytogenes in food products and food processing environments[J]. Microorganisms, 2020, 8(11): 1764. |
| [30] |
GRASS J E, GOULD L H, MAHON B E. Epidemiology of foodborne disease outbreaks caused by Clostridium perfringens, United States, 1998-2010[J]. Foodborne Pathog Dis, 2013, 10(2): 131-136. |
(编辑 白永平)



