2. 中国兽医药品监察所,北京 100081;
3. 扬州大学 江苏省动物重要疫病与人畜共患病协同创新中心,扬州 225009
2. China Institute of Veterinary Drug Control, Beijing 100081, China;
3. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou University, Yangzhou 225009, China
禽偏肺病毒(avian metapneumovirus, aMPV)属于副黏病毒科,肺病毒亚科,偏肺病毒属,为单股不分节段的负链RNA病毒。根据编码G蛋白的基因将aMPV分为A、B、C和D4个亚型[1-3]。aMPV的自然宿主是火鸡,其次是鸡。aMPV感染火鸡可引起火鸡鼻气管炎(turkey rhinotracheitis, TRT),是除禽流感之外对火鸡影响最大的呼吸道疾病。感染蛋鸡导致产蛋量下降、软壳蛋率增高,也是导致肉鸡肿头综合征(swollen head syndrome, SHS)的主要病原体,对养禽业造成巨大的经济损失。
aMPV最早于20世纪70年代末在南非发现[4],随后相继出现在欧洲、亚洲、南美等地。血清学调查发现大多数火鸡饲养国家除澳大利亚和加拿大外均有该病的存在[5-10]。1999年,沈瑞忠等[11]首次在国内分离报道aMPV,随后各地相继有该病的报道。2009年,郭龙宗和曲立新[12]在山东胶东地区对种鸡群进行血清学检测,发现aMPV的感染是普遍存在的;2012年,贠炳岭等[13]调查表明黑龙江、吉林、河北、湖北等地区的鸡群也普遍感染aMPV,部分鸡场的血清阳性率甚至高达100%;2012—2015年,江苏、辽宁、河南、山东和河北5个省份也存在aMPV的感染,阳性率为50.7%[14];2016年,本实验室从辽宁某肉种鸡场分离到B亚型aMPV(LN16株),且证实该分离株对SPF、商品蛋鸡、肉鸡和黄羽鸡均有明显的致病性[15-16];2017年,安徽、河北、北京、上海等地的不同品种(系)鸡群中均存在aMPV抗体,且出现临床症状[17-20];近几年来,本课题组发现河北井陉县和辽宁海城地区的多个蛋鸡鸡群以及黑龙江、山东等地的多个鸡群出现了疑似aMPV感染的症状,其aMPV抗体阳性率和抗体滴度均较高[16]。以上数据说明aMPV在我国鸡群中已流行甚广,但由于病毒分离困难,国内关于aMPV分离鉴定报道和致病性研究相对较少。
本研究从疑似aMPV感染发病鸡群的鼻甲骨内成功分离到3株病毒,经RT-PCR、病毒分离、G/F基因序列分析、间接免疫荧光试验(IFA)等试验鉴定为B亚型aMPV,分别命名为SD2001、SD2002和HLJ2101。致病性研究发现,我国鸡群流行的B亚型aMPV对鸡有明显的致病性,这为aMPV的流行病学调查研究、疫苗的研制以及该病的有效防控提供了理论依据。
1 材料与方法 1.1 病料来源山东省、福建和黑龙江等地区的养鸡场的鸡出现疑似aMPV感染的临床症状:甩头、精神萎靡、严重者出现肿头等。本研究从山东省某蛋鸡规模化养殖场的病鸡群内采集了35份喉拭子(35/100)、30份鼻甲骨(30/50)及10份肺(10/20);从福建某肉种鸡场的父母代肉鸡采集了40份喉拭子(40/100)和10份鼻甲骨(10/50);黑龙江某肉种鸡场的祖代肉鸡采集了25份喉拭子(25/100)、10份鼻甲骨(10/50)及10份肺(10/20),以上鸡场均未免疫过aMPV疫苗。将采集的病料冷藏保存,送往实验室进行病原学检测和分离。
1.2 细胞、质粒和实验动物Vero细胞、aMPV-N基因的阳性质粒PCAGGS-N、aMPV/B阳性血清均由中国农业科学院哈尔滨兽医研究所禽免疫抑制病团队鉴定、保管和供应;SPF鸡由中国农业科学院哈尔滨兽医研究所动物实验中心提供。
1.3 常用试剂RNAiso Plus、pMD18-T载体、rTaq酶、Premix Taq(EX Taq)DNA聚合酶、Prime STAR Max预混酶和DL2000 Marker、E. coli DH5α感受态细胞等均购自大连宝生物工程有限公司;BioRT高灵敏cDNA第一链合成试剂盒购自博日科技有限公司;核酸胶回收试剂盒购自AXYGEN公司;FITC标记的兔抗鸡IgY荧光二抗购自Sigma试剂公司。
1.4 病料的处理取适量组织样品放入1 mL预冷的无菌PBS内,研磨匀浆,喉拭子内加入1 mL PBS漩涡振荡混匀1 min。将所有样品利用低温高速离心机在4 ℃条件下,6 000 g离心10 min,取上清,经0.45 μm的滤器过滤后,-20 ℃保存备用。
1.5 RT-PCR鉴定根据GenBank上已发表的LN16毒株序列(MH745147.1),利用DNAStar里面的Megalign软件对不同亚型的N基因序列进行比较,选择其保守区域设计aMPV的特异性检测引物:上游引物aMPVNF:5′-ATGCAAGCTTATGGAGCTGG-3′/下游引物aMPVNR: 5′-ATGCAAGCTTATGGAGCTGG-3′,引物由吉林长春库美生物有限公司合成。取“1.4”处理好的病料各200 μL,利用Trizol提取总RNA,然后根据BioRT高灵敏cDNA第一链合成试剂盒说明书进行反转录。
以上述反转录cDNA产物为模板,采用aMPVNF/NR进行PCR检测,以aMPV-N基因阳性质粒PCAGGS-N作为阳性对照。反应体系为25 μL:aMPVNF 2 μL,aMPVNR 2 μL,cDNA 2 μL,EX Taq预混酶12.5 μL,RNase Deionized水6.5 μL。反应程序:95 ℃预变性5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃延伸10 min。利用1%的琼脂糖凝胶电泳检测PCR产物,若在228 bp处出现条带判断为阳性,用于后续的病毒分离。
1.6 病毒分离取400 μL“1.4”处理好的病料接种于6孔板内单层的Vero细胞,37 ℃、5% CO2温箱内孵育1 h后,将培养液换成含1%青链霉素、2%胎牛血清的DMEM细胞维持液。每天观察Vero细胞的状态,持续观察7 d,然后将接毒的细胞反复冻融3次,然后在4 ℃条件下,6 000 g离心10 min去除细胞碎片,收集上清,盲传5代后,将仍未出现特征性的细胞病变(CPE)的弃去,出现CPE则进行进一步的鉴定。
1.7 G和F基因测序根据LN16(MH745147.1)的G和F基因设计并合成扩增G和F基因的引物。扩增G基因引物序列为aMPV-GF: 5′-ATGGGGTCAGAGCTCTACAT-3′;aMPV-GR: 5′-TTATTGACTAGTACAGCACC-3′。扩增F基因引物序列为aMPV-FF: 5′-ATGTACCTCAAACTGCTACT-3′;aMPV-FR: 5′-TCAACTGATGTAGCCCATGT-3′。以病毒分离阳性样品的cDNA为模板进行G和F基因的扩增。反应体系为50 μL:上下游引物各2 μL,cDNA 2 μL,Prime STAR Max预混酶25 μL,加水至50 μL。反应程序:98 ℃ 5 min;98 ℃ 15 s,53 ℃ 15 s,72 ℃ 50 s,35个循环;72 ℃延伸10 min。PCR产物中加入1 μL rTaq酶在72 ℃ 10 min加poly A尾巴。PCR产物用1%的琼脂糖凝胶进行电泳,G和F基因的预期目的条带分别为1 263和1 617 bp,然后按照Axygen的胶回收试剂盒说明书对PCR产物纯化。
按照pMD18-T载体说明书将胶回收产物与pMD18-T载体分别进行连接,挑取菌落进行PCR筛选阳性单克隆菌。最后选择3个阳性质粒送吉林库美生物公司进行测序。利用DNAStar和MEGA7.0软件进行同源性分析和绘制遗传演化进化树。
1.8 IFA检测取50 μL“1.6”分离的病毒培养液接种于6孔板内单层的Vero细胞37 ℃、5% CO2温箱内孵育1 h,将培养液换成含1%青链霉素,2%血清的DMEM细胞维持液,每天观察细胞状态,培养72 h后进行IFA检测。具体操作:弃去细胞培养液,用预冷的PBST洗3次;然后加入500 μL无水乙醇室温固定15 min,PBST洗5遍,加入500 μL 100倍稀释的aMPV阳性血清在37 ℃条件下孵育1 h,PBST洗5遍,再加入500 μL 200倍稀释的FITC标记兔抗鸡IgY的荧光二抗,37 ℃避光孵育1 h,PBST洗5遍。将处理好的样品置于荧光倒置显微镜下观察试验结果。
1.9 RT-qPCR检测参考文献[12]中aMPV/B的RT-qPCR检测方法,根据LN16的核苷酸序列设计引物和探针,引物aMPV-F: 5-AATAGTCCTCAAGCAAGTCCTCAGA-3′/aMPV-R: 5′-CTGTTGTAATTTGACCTGTTCTACACT-3′;探针:5′-FAM-CTGGTGTTATCAGCCTTAGGCTTGACGCTTAMRA-3′。反应体系: 10×PCR Buffer 10.0 μL,上、下游引物(10 μmol·L-1)和探针各0.7 μL,模板cDNA 2.0 μL,H2O 5.9 μL;反应条件:95 ℃预变性30 s;95 ℃变性3 s,60 ℃ 20 s,共40个循环。根据标准质粒拷贝数,计算样品中病毒拷贝数。
1.10 病毒含量(TCID50)测定用无血清的DMEM在1.5 mL离心管内10倍倍比稀释病毒,涡旋混匀,每个稀释度做18个重复,接种于96孔细胞培养板中的Vero细胞,其中,96孔板的第一行(A)和最后一行(H)设为阴性对照孔,100 μL·孔-1)。将96孔细胞培养板在37 ℃、5% CO2细胞培养箱中连续培养7 d,每天观察病变,统计各稀释度产生的CPE孔数。根据Reed-Muench方法计算病毒的TCID50。
1.11 外源病毒检测将分离的病毒各取200 μL按照Axygen的DNA提取试剂盒说明书提取DNA,然后根据文献进行鸡毒支原体(MG)[21]和鸡传染性喉气管炎(ILTV)[22]的检测。同时以病毒分离阳性样品的cDNA为模板,进行新城疫病毒(NDV)[23]和传染性支气管炎病毒(IBV)[24]的检测。
1.12 动物感染试验将40只3周龄SPF鸡随机分为两组:感染组和空白组各20只,其中,感染组采用滴鼻点眼的方法进行攻毒,每只接种200 μL, 105.0TCID50·mL-1的SD2001病毒液,空白组也采用滴鼻点眼的方式接种200 μL无菌的PBS,分开饲养于负压隔离器内,每天观察并记录临床症状。感染后2、3、4、5及6 d采集攻毒组和空白组的鼻裂拭子,进行排毒检测;于感染后第9天每组随机抽取3只采集喉头、气管和鼻甲骨固定于福尔马林内,用于组织病理学观察。
2 结果 2.1 临床样品RT-PCR检测以220份样品的cDNA为模板,利用aMPV的N基因的特异性检测引物aMPV-NF/NR进行RT-PCR扩增。结果显示,有3份(山东2份,黑龙江1份)鼻甲骨样品扩增出了228 bp左右的特异性条带,与预期目的片段大小一致(图 1)。
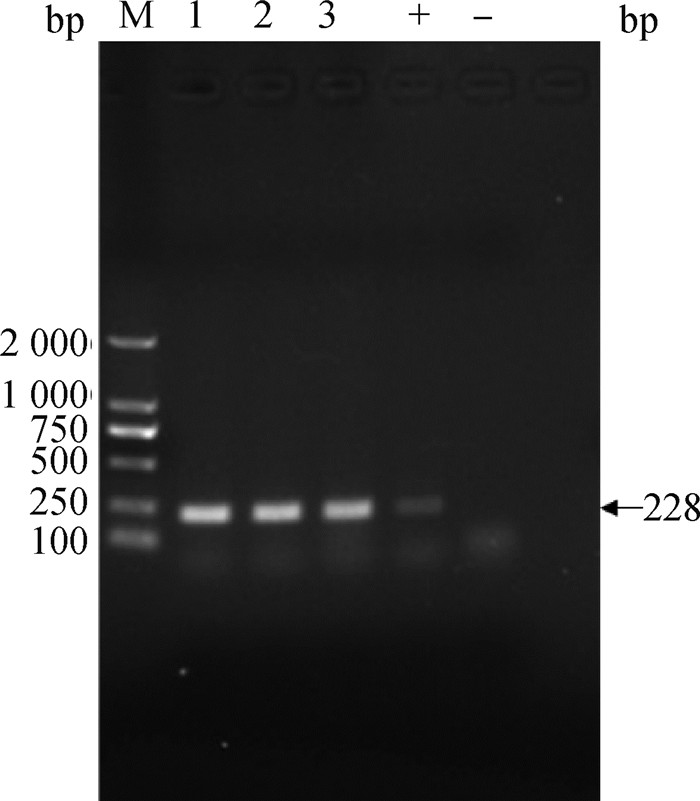
|
M. DNA相对分子质量标准(DL2000); 1~3. 3份鼻甲骨样品;+. 阳性性对照;-. 阴性对照 M. DNA marker (DL2000); 1-3. Three samples of nasal turbinate; +. Positive control; -. Negative control 图 1 aMPV N基因的RT-PCR检测 Fig. 1 RT-PCR detection of aMPV N gene |
将RT-PCR检测阳性的样品分别接种于Vero细胞,盲传5代。结果显示,3份鼻甲骨样品接种的Vero细胞出现细胞变圆、聚集和融合等明显的CPE(图 2),符合aMPV所形成的特征性CPE,初步判断分离到的病毒为aMPV,同时在分离的病毒内未检测到引起鸡呼吸道症状的其他致病性病毒:IBV、NDV、ILTV和MG等(结果没显示),将其命名为SD2001、SD2002和HLJ2101。

|
SD2001、SD2002和HLJ2101在Vero细胞上形成的细胞变圆、聚集和融合等明显的CPE(箭头) Obvious CPE (arrow) such as cell rounding, aggregation and fusion formed by SD2001, SD2002 and HLJ2101 on Vero cells 图 2 SD2001、SD2002、HJL2101分离株在Vero细胞上的CPE(标尺=100 μm) Fig. 2 CPE of SD2001, SD2002, HJL2101 isolates on Vero cell (bar=100 μm) |
以SD2001、SD2002和HLJ2101分离株提取的RNA反转录产物为模板利用aMPV-GF/GR和aMPV-FF/FR引物分别进行G和F基因的扩增,测序结果显示,3个分离株的G基因全长1 263 bp,编码414个氨基酸;F基因全长1 617 bp,编码539个氨基酸。
利用DNA Star中MegAlign软件对3个分离株的G和F基因的核苷酸和氨基酸序列相似性进行分析,结果显示,3个分离株的G基因与其他国家B亚型aMPV毒株的核苷酸和氨基酸序列的相似性分别为93.4%~96.0%和88.7%~92.8.%,与我国B亚型LN16分离株的核苷酸和氨基酸序列的相似性分别为98.4%~98.6%和97.3%~97.8%,与A、C和D亚型aMPV毒株的核苷酸和氨基酸的相似性仅为27.1%~61.8%和16.1%~36.7%。3个分离株的F基因与B亚型aMPV毒株的核苷酸和氨基酸序列的相似性分别为95.6%~98.2%和97.6%~98.9%,与我国B亚型LN16分离株的核苷酸和氨基酸的相似性为99.3%~100.0%和99.4%~ 100.0%,与A、C和D亚型aMPV毒株的核苷酸和氨基酸的相似性为66.8%~74.8%和72.5%~86.5%。遗传进化分析结果表明,3个分离株的G基因(图 3A)和F基因(图 3B)均与B亚型aMPV毒株在同一分枝上,表明SD2001、SD2002和HLJ2101分离株均属于B亚型aMPV。
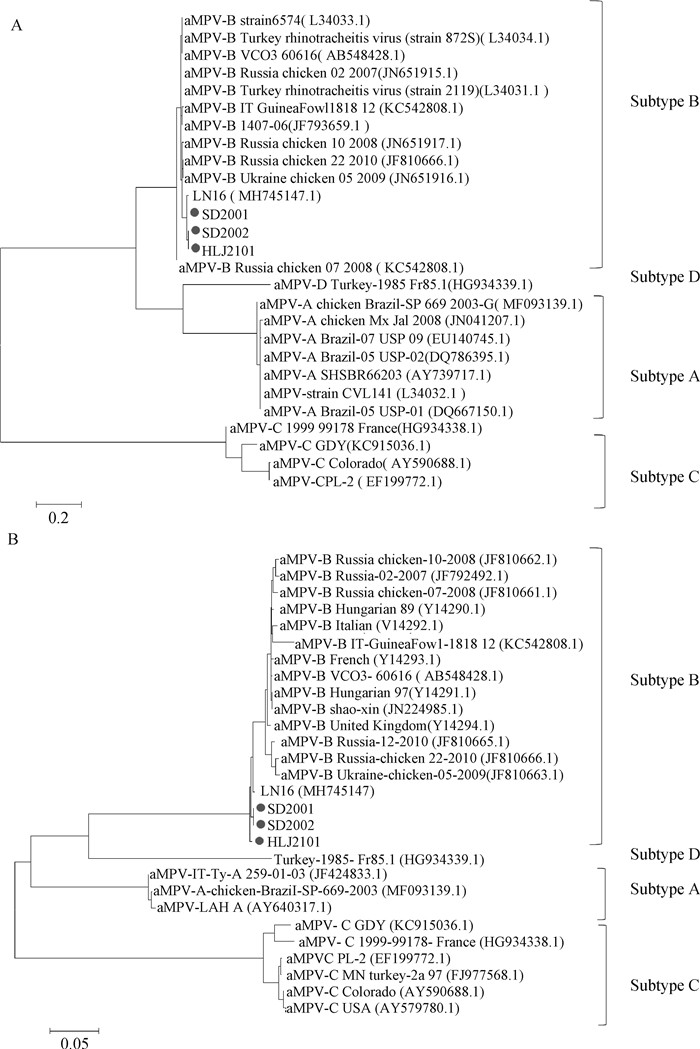
|
SD2001、SD2002和HLJ2101分离株用●标记;括号中显示的是毒株的GenBank登录号 SD2001, SD2002 and HLJ2101 strains were marked with ●; The GenBank accession number of the strain is shown in parentheses 图 3 SD2001、SD2002和HLJ2101分离株的G基因(A)和F基因(B)核苷酸序列的遗传进化树 Fig. 3 Phylogenetic analysis of G gene (A) and F gene (B) nucleotide sequences of SD2001, SD2002 and HLJ2101 strains |
将SD2001、SD2002和HLJ2101分离株接种于6孔板中的Vero细胞,在37 ℃、5% CO2温箱内培养72 h后,利用B亚型特异的阳性血清进行IFA检测,倒置荧光显微镜观察结果显示,感染SD2001、SD2002和HLJ2101分离株的Vero细胞呈现特异性的绿色荧光信号,而阴性对照的Vero细胞没有荧光信号(图 4),进一步表明SD2001、SD2002和HLJ2101分离株属于B亚型的aMPV。
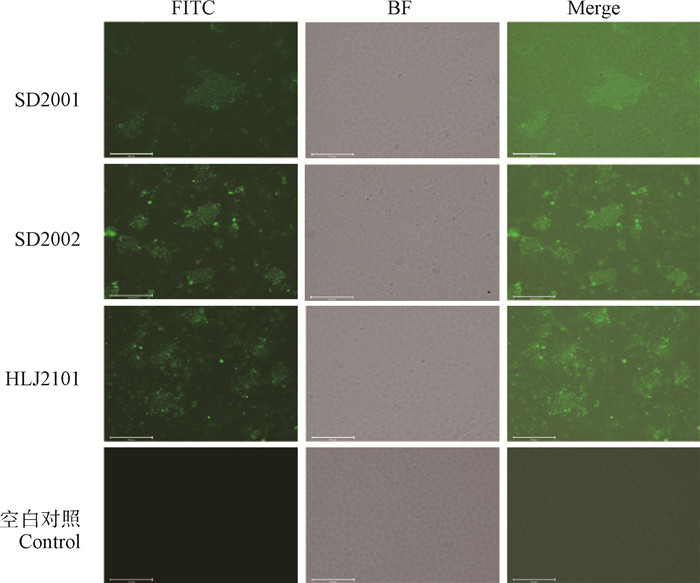
|
图 4 SD2001、SD2002和HLJ2101分离株感染Vero细胞的间接免疫荧光检测(标尺=125 μm) Fig. 4 Indirect immunofluorescence detection of Vero cells infected by SD2001、SD2002 and HLJ2101 strains (bar=125 μm) |
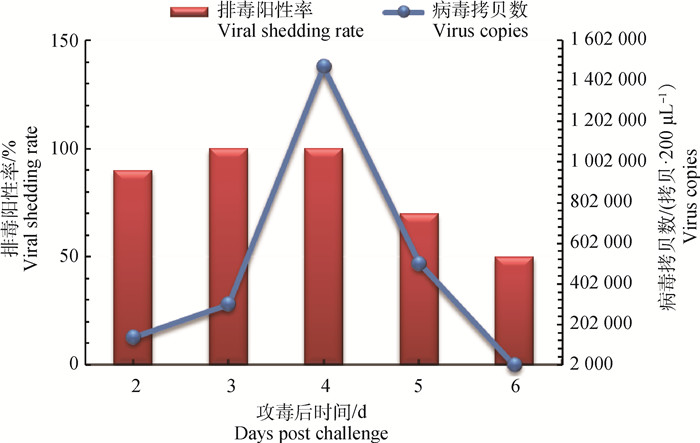
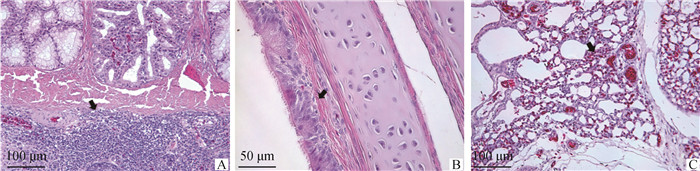
G和F基因分析表明,3个分离株的同源性较高,所以选择病毒毒价为105.0TCID50·mL―1的SD2001分离株感染3周龄的SPF鸡,感染组SPF鸡在感染后第3~6天出现精神萎靡、流鼻涕、鼻痂和甩头等症状(图 5),第5天症状最明显,该组的发病率为90%,空白组SPF鸡未见明显的症状。鼻裂拭子的排毒检测结果显示,攻毒后的2~6 d鸡出现排毒,第4天的排毒率达到100%,且病毒的平均拷贝数达到峰值,为1 472 406拷贝·200 μL―1(图 6)。病理组织学结果显示,感染病毒后9 d,鸡的鼻甲骨黏膜固有层淋巴组织增生,个别黏液腺萎缩,腺上皮细胞变性,少量炎性细胞浸润(图 7A);气管的黏膜上皮细胞少量变性(图 7B);肺轻度淤血(图 7C)。空白对照组鸡则没有任何临床症状和组织病理损伤。以上结果表明,SD2001分离株对SPF鸡有明显的致病性。
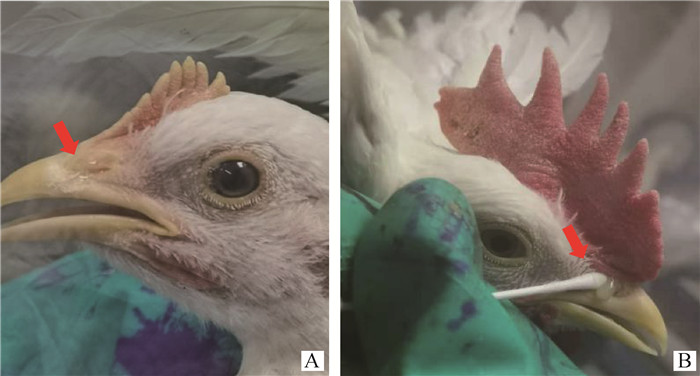
|
A.鼻痂; B.脓鼻涕 A. Nasal scabs; B. Purulent snot 图 5 SPF鸡感染SD2001分离株后的临床症状 Fig. 5 Clinical symptoms of SPF chickens infected with SD2001 strain |
|
图 6 SPF鸡感染SD2001分离株后排毒情况 Fig. 6 Viral shedding of SPF chickens infected with SD2001 strain |
|
A. 鸡的鼻甲骨出现腺体萎缩,炎性细胞浸润(标尺=100 μm);B. 鸡的气管出现黏膜上皮细胞少量变性(标尺=50 μm);C. 鸡的肺出现轻度淤血(标尺=100 μm) A. Gland atrophy and inflammatory cell infiltration appeared in the turbinate bone of chickens 9 days after infection (100 μm); B. A small amount of degeneration of mucosal epithelial cells appeared in the trachea of chickens 9 days after infection (50 μm); C. Mild congestion appeared in the lungs of chickens 9 days after infection (100 μm) 图 7 SPF鸡感染SD2001毒株9 d的鼻甲骨、气管和肺的HE染色 Fig. 7 HE staining of nasal turbinate, trachea and lung of SD2001 infected SPF chickens 9 days after infection |
1999年,我国鸡群首次检测到aMPV,随后国内许多研究人员对aMPV的流行情况展开了调查,血清学结果表明我国家禽养殖场普遍存在aMPV的感染,有些地区的鸡群血清阳性率高达100%[13-14, 17-20]。aMPV感染蛋鸡导致产蛋率和孵化率下降,产软壳蛋和薄壳蛋率增高;感染肉鸡导致肿头综合征,同时也影响肉质、增重比及饲料转化率。若仅有aMPV感染时,鸡的恢复速度很快,但继发其他细菌或病毒时发病率高达100%,成年鸡的死亡率为0.5%,幼龄鸡的死亡率可高达80%。
近些年,在河北、山东、黑龙江、福建等地的蛋鸡和肉鸡养殖场中常出现鸡群精神沉郁、流泪、流鼻涕、眼睑和头部肿胀等症状,死淘率增加,产蛋率明显下降,有的鸡场下降达30%以上,经济损失严重。本研究从这些鸡群采集发病鸡的喉拭子,鼻甲骨和肺组织等病料,进行了病毒分离鉴定,从蛋鸡中分离到2株B亚型aMPV(SD2001和SD2002),从肉鸡中分离到1株B亚型aMPV(HLJ2101)。尽管大量的研究数据表明,我国蛋鸡存在aMPV的感染,但是由于病毒分离困难,一直没有蛋鸡源的分离株的报道[16-17, 25],所以SD2001和SD2002的成功分离是我国内首次从蛋鸡上分离到B亚型的aMPV,这为蛋鸡群开展aMPV的流行病调查、遗传演化分析和防控提供了参考。
G和F蛋白是aMPV的主要抗原结构蛋白和保护性抗原,根据G基因不同可将aMPV分为A、B、C和D 4个亚型。F蛋白决定aMPV的宿主范围,介导病毒囊膜与细胞膜相互融合,是病毒感染最关键的一步[26]。本研究分析了3个分离株与其他B亚型aMPV毒株的遗传演化关系,G和F基因同源性分析结果显示,3个分离株与其他国家的不同宿主(火鸡和鸡)来源的B亚型aMPV的G基因的核苷酸相似性为93.4%~96.0%,F基因的核苷酸相似性为95.6%~98.2%,相对保守,这与之前的报道相似[15];3个分离株的G和F基因与我国2016年辽宁某肉种鸡场分离的B亚型aMPV(LN16株)的核苷酸的相似性更高,均在98.4%以上,高度保守,且遗传演化树显示,我国毒株已经形成独立的分支,这证实我国流行的B亚型aMPV的主要保护性抗原非常保守,为aMPV疫苗的研制提供了理论依据。
SPF鸡感染肉鸡源的分离株和肉鸡感染火鸡源的分离株后主要出现精神沉郁、流鼻涕和咳嗽等症状和上呼吸道出现炎性细胞浸润的现象[15, 27]。在本研究中,SPF鸡感染蛋鸡SD2001分离株后的临床症状和病理损伤等指标与感染肉鸡源或火鸡源的指标无明显的差异,这说明宿主来源对B亚型aMPV的致病性影响不大。
4 结论本研究从疑似aMPV感染的鸡群采集病料,首先利用aMPV特异性的RT-PCR方法对临床样品进行初步检测,再将RT-PCR检测阳性的样品利用Vero细胞进行病毒分离,然后通过CPE、IFA和基因序列测定分析等方法证实,本研究成功分离到3株B亚型aMPV(SD2001、SD2002和HLJ2101)。SD2001分离株感染SPF鸡后导致90%的鸡出现临床症状,第4天排毒率达100%,引起鼻甲骨、气管和肺等组织出现病理性损伤,对SPF鸡有明显的致病性。
| [1] |
BÄYON-AUBOYER M H, ARNAULD C, TOQUIN D, et al. Nucleotide sequences of the F, L and G protein genes of two non-A/non-B avian pneumoviruses (APV) reveal a novel APV subgroup[J]. J Gen Virol, 2000, 81(Pt 11): 2723-2733. |
| [2] |
GUIONIE O, TOQUIN D, SELLAL E, et al. Laboratory evaluation of a quantitative real-time reverse transcription PCR assay for the detection and identification of the four subgroups of avian metapneumovirus[J]. J Virol Methods, 2007, 139(2): 150-158. DOI:10.1016/j.jviromet.2006.09.022 |
| [3] |
EASTON A J, DOMACHOWSKE J B, ROSENBERG H F. Animal pneumoviruses: molecular genetics and pathogenesis[J]. Clin Microbiol Rev, 2004, 17(2): 390-412. DOI:10.1128/CMR.17.2.390-412.2004 |
| [4] |
BUYS S B, DU PREEZ J H, ELS H J. The isolation and attenuation of a virus causing rhinotracheitis in turkeys in South Africa[J]. Onderstepoort J Vet Res, 1989, 56(2): 87-89. |
| [5] |
BENNETT R S, LARUE R, SHAW D, et al. A wild goose metapneumovirus containing a large attachment glycoprotein is avirulent but immunoprotective in domestic turkeys[J]. J Virol, 2005, 79(23): 14834-14842. DOI:10.1128/JVI.79.23.14834-14842.2005 |
| [6] |
BANET-NOACH C, SIMANOV L, LAHAM-KARAM N, et al. Longitudinal survey of avian metapneumoviruses in poultry in Israel: infiltration of field strains into vaccinated flocks[J]. Avian Dis, 2009, 53(2): 184-189. DOI:10.1637/8466-090408-Reg.1 |
| [7] |
CHACÓN J L, MIZUMA M, VEJARANO M P, et al. Avian metapneumovirus subtypes circulating in Brazilian vaccinated and nonvaccinated chicken and turkey farms[J]. Avian Dis, 2011, 55(1): 82-89. DOI:10.1637/9501-081310-Reg.1 |
| [8] |
TANAKA M, TAKUMA H, KOKUMAI N, et al. Turkey rhinotracheitis virus isolated from broiler chicken with swollen head syndrome in Japan[J]. J Vet Med Sci, 1995, 57(5): 939-941. DOI:10.1292/jvms.57.939 |
| [9] |
FRANZO G, LEGNARDI M, MESCOLINI G, et al. Avian metapneumovirus subtype B around Europe: a phylodynamic reconstruction[J]. Vet Res, 2020, 51(1): 88. DOI:10.1186/s13567-020-00817-6 |
| [10] |
CHABOKI P M, GHALYANCHILANGEROUDI A, KARIMI V, et al. Prevalence of avian metapneumovirus subtype B in live bird market in Gilan Province, Iran[J]. Vet Res Forum, 2018, 9(1): 93-97. |
| [11] |
沈瑞忠, 曲立新, 于康震, 等. 禽肺病毒的分离鉴定[J]. 中国预防兽医学报, 1999, 21(1): 76-77. SHEN R Z, QU L X, YU K Z, et al. Isolation and characterization of an avian pneumovirus form chickens in China[J]. Chinese Journal of Preventive Veterinary Medicine, 1999, 21(1): 76-77. (in Chinese) |
| [12] |
郭龙宗, 曲立新. 种鸡禽肺病毒感染的血清学调查[J]. 中国畜牧兽医, 2009, 36(4): 149-150. GUO L Z, QU L X. Serological investigation of avian pneumoviruses infection in breeders[J]. China Animal Husbandry & Veterinary Medicine, 2009, 36(4): 149-150. (in Chinese) |
| [13] |
贠炳岭, 刘在斯, 吴关, 等. 我国部分地区种鸡禽肺病毒感染的血清学调查[J]. 中国家禽, 2012, 34(12): 64-65. YUN B L, LIU Z S, WU G, et al. Serological investigation of avian pneumoviruses infection in breeding chickens in some areas of China[J]. China Poultry, 2012, 34(12): 64-65. DOI:10.3969/j.issn.1004-6364.2012.12.023 (in Chinese) |
| [14] |
朱艳梅, 宫晓, 郭伟伟, 等. 2012年—2015年我国部分地区禽偏肺病毒的分子流行病学分析[J]. 动物医学进展, 2016, 37(10): 30-34. ZHU Y M, GONG X, GUO W W, et al. Molecular epidemiology analysis of aMPV in some regions in China during 2012 to 2015[J]. Progress in Veterinary Medicine, 2016, 37(10): 30-34. (in Chinese) |
| [15] |
YU M M, XING L X, CHANG F F, et al. Genomic sequence and pathogenicity of the first avian metapneumovirus subtype B isolated from chicken in China[J]. Vet Microbiol, 2019, 228: 32-38. DOI:10.1016/j.vetmic.2018.11.009 |
| [16] |
包媛玲, 何锡栋, 于蒙蒙, 等. B亚型禽偏肺病毒对蛋鸡的致病性研究[J]. 中国家禽, 2021, 43(6): 25-30. BAO Y L, HE X D, YU M M, et al. Pathogenicity of avian metapneumovirus subtype B on layer chicken[J]. China Poultry, 2021, 43(6): 25-30. (in Chinese) |
| [17] |
张丹俊, 戴银, 赵瑞宏, 等. 安徽省部分地区鸡群禽偏肺病毒感染的血清学调查[J]. 动物医学进展, 2017, 38(2): 126-129. ZHANG D J, DAI Y, ZHAO R H, et al. Serological survey on avian metapneumovirus infection in chicken flocks in Anhui Province[J]. Progress in Veterinary Medicine, 2017, 38(2): 126-129. (in Chinese) |
| [18] |
梅晨, 李淑芳, 闫旭, 等. 北京油鸡混合感染副鸡禽杆菌和禽偏肺病毒的诊治[J]. 中国兽医杂志, 2017, 53(6): 56-58. MEI C, LI S F, YAN X, et al. Diagnosis and treatment of mixed infection of paraavian bacilli and avian metapneumovirus in Beijing oil chickens[J]. Chinese Journal of Veterinary Medicine, 2017, 53(6): 56-58. (in Chinese) |
| [19] |
付岳林, 崔明仙, 白晓, 等. 规模化肉鸡场鼻气管鸟杆菌、禽呼肠孤病毒和禽偏肺病毒感染状况的血清学调查[J]. 今日畜牧兽医, 2019, 35(2): 3-4. FU Y L, CUI M X, BAI X, et al. Serological investigation on the infection of avian bacilli, avian reovirus and avian metapneumovirus in nasotracheal of large-scale broiler farms[J]. Today Animal Husbandry and Veterinary Medicine, 2019, 35(2): 3-4. (in Chinese) |
| [20] |
葛菲菲, 齐新永, 李鑫, 等. 雉鸡禽偏肺病毒、鸡毒支原体及细菌混合感染的诊断[J]. 中国家禽, 2017, 39(10): 65-66. GE F F, QI X Y, LI X, et al. Diagnosis of mixed infection of avian metapneumovirus, mycoplasma gallisepticum and bacteria in pheasants[J]. China Poultry, 2017, 39(10): 65-66. (in Chinese) |
| [21] |
RICKETTS C, PICKLER L, MAURER J, et al. Identification of strain-specific sequences that distinguish a Mycoplasma gallisepticum vaccine strain from field isolates[J]. J Clin Microbiol, 2017, 55(1): 244-252. |
| [22] |
CHANG P C, LEE Y L, SHIEN J H, et al. Rapid differentiation of vaccine strains and field isolates of infectious laryngotracheitis virus by restriction fragment length polymorphism of PCR products[J]. J Virol Methods, 1997, 66(2): 179-186. |
| [23] |
XIE Z X, XIE L J, CHEN A L, et al. Complete genome sequence analysis of a newcastle disease virus isolated from a wild egret[J]. J Virol, 2012, 86(24): 13854-13855. |
| [24] |
DE WIT J J, KOCH G, KANT A, et al. Detection by immunofluorescent assay of serotype-specific and group-specific antigens of infectious bronchitis virus in tracheas of broilers with respiratory problems[J]. Avian Pathol, 1995, 24(3): 465-474. |
| [25] |
陈秀琴, 郑敏, 黄梅清, 等. 福建省规模化鸡场禽偏肺病毒感染情况的血清学调查[J]. 动物医学进展, 2021, 42(1): 130-133. CHEN X Q, ZHENG M, HUANG M Q, et al. Serosurvey of avian metapneumovirus in scaled chicken farms of Fujian[J]. Progress in Veterinary Medicine, 2021, 42(2): 130-133. (in Chinese) |
| [26] |
NAYLOR C J, LUPINI C, BROWN P A. Charged amino acids in the AMPV fusion protein have more influence on induced protection than deletion of the SH or G genes[J]. Vaccine, 2010, 28(41): 6800-6807. |
| [27] |
HTUT AUNG Y, LIMAN M, NEUMANN U, et al. Reproducibility of swollen sinuses in broilers by experimental infection with avian metapneumovirus subtypes A and B of turkey origin and their comparative pathogenesis[J]. Avian Pathol, 2008, 37(1): 65-74. |
(编辑 白永平)



