2. 石河子大学动物科技学院, 石河子 832000
2. College of Animal Science and Technology, Shihezi University, Shihezi 832000, China
包虫病是由棘球绦虫幼虫寄生于人或动物脏器引起的一种危害严重的人兽共患寄生虫病,该病是被世界卫生组织严重忽视的疾病之一[1]。其中,细粒棘球绦虫的幼虫寄生导致的囊型包虫病,是造成我国包虫病流行的主要因素。同时由多房棘球绦虫幼虫寄生引起的泡型包虫病在我国也有发生[1]。包虫病给患者及其家庭造成严重的健康危害和沉重的经济负担,同时给畜牧业带来巨大损失。目前,该病已在全国二十几个省份发生,主要分布在西北部分牧区,包括青海、西藏、新疆等地。据估计,我国包虫病患者人数约为100万,受威胁人口近6 600万,患者数量巨大。与现有的全球包虫病流行数据相比,中国包虫病受威胁人口数和患者人数仍居世界首位[1-2]。同时据农业部门推算,全国每年患包虫病的家畜在5 000万头以上,因家畜死亡和脏器废弃造成的直接经济约30亿元,是导致我国西部农牧区群众因病致贫、因病返贫的主要原因之一。
最近在免疫学方面的研究已经发现了一些关于宿主应对细粒棘球绦虫固有免疫系统建立相关的一些证据。有学者利用流式细胞仪分析了感染细粒棘球蚴和多房棘球蚴的BALB/c小鼠脾和血液中淋巴细胞亚群变化情况,为进一步研究细粒棘球蚴和多房棘球蚴感染的免疫机制提供试验依据[3]。也有学者报道了宿主MHC-DRB1基因多态性与包虫病抗性相关性方面的研究[4]。然而,有关棘球绦虫与宿主动物相互作用的机制尚未被广泛研究[5]。同时,由于细粒棘球绦虫复杂的生命周期,以及各种免疫调节功能导致难以对其实施有效的控制措施,也阻碍了人用疫苗以及终末宿主疫苗的研发进程。有文献证明蠕虫感染可以刺激宿主产生Th2型免疫保护反应[6]。宿主对棘球绦虫的免疫反应可以经典地分为适应性免疫反应和先天性免疫反应[6]。先天性免疫反应是宿主抵御各种寄生虫感染的第一道防线[7],寄生虫通过模式识别受体(pattern recognition receptors,PRRs),如toll样受体(TOLLs)和核苷酸结合寡聚结构域(NOD)样受体(NLRs),识别与病原体相关的分子模式(PAMPs)。这些受体主要表达于宿主的免疫细胞,包括巨噬细胞、中性粒细胞、内皮细胞、树突状细胞和淋巴细胞,它们通过不同的机制调节宿主的免疫反应[7-9]。
巨噬细胞是一种重要的免疫细胞,在宿主固有免疫和适应性免疫过程中均发挥着重要的作用。已有的研究表明,宿主巨噬细胞在抗细粒棘球绦虫感染的先天和适应性免疫反应中发挥着至关重要的作用[10]。但目前仍未见系统解析巨噬细胞应对细粒棘球绦虫原头蚴感染时其基因差异表达及调控机制的文献报道。因此,本研究采用RNA-seq测序技术系统分析了巨噬细胞RAW264.7应对细粒棘球绦虫原头蚴刺激过程中其基因的表达谱特性,以期筛选鉴定巨噬细胞RAW264.7抗细粒棘球绦虫原头蚴感染相关的功能分子。这些数据将为进一步研究这些功能分子在巨噬细胞应对细粒棘球绦虫感染过程中发挥的作用及其调控机制提供新的视角,同时有望为控制包虫病提供新的药物以及疫苗靶点。
1 材料与方法 1.1 材料在屠宰场收集被细粒棘球绦虫感染的带有包囊的羊肝,带回实验室,无菌条件下抽取含有原头蚴的包囊液,离心收集原头蚴,用加有双抗的PBS洗涤3~5次,最后将收集的原头蚴培养至含有10%胎牛血清以及双抗的RPMI1640培养液中,放至37 ℃二氧化碳培养箱中培养备用。在细胞培养瓶中培养RAW264.7细胞,待细胞生长稳定时将其传代培养至新的培养瓶,当培养瓶中细胞交汇率达到80%时,接种细粒棘球绦虫原头蚴,接种浓度为每毫升2 000个,设PBS为对照组,每组3个生物学重复,共培养6、24和72 h后,弃去培养上清液,然后胰酶消化收集RAW264.7细胞,将每组3个生物学重复做混池测序。
1.2 总RNA的提取、lncRNA库的建立以及测序使用美国Clontech公司的SMARTer Ultra Low RNA Kit for Illumina Sequencing试剂盒进行RAW264.7细胞的裂解和第一条cDNA链的合成,使用美国Beckman公司的AMPure XP beads试剂盒纯化后,用美国Clontech公司的Advantage 2 PCR kit试剂盒扩增第一条cDNA链,并再次纯化,最终得到双链cDNA。Qubit 2.0定量检测,合格后用Covaris系统超声打断双链cDNA短片段进行末端修复,加A尾并连接测序接头后,纯化,选择片段大小在200 bp左右的文库进行PCR富集得到最终的cDNA文库。先使用Qubit 2.0进行文库的初步定量,稀释文库至2 ng·μL-1,随后用Agilent 2100对文库的insert size进行检测,符合预期后,使用qPCR方法对文库的有效浓度进行准确定量(文库有效浓度>2 nmol·μL-1),以保证文库质量。文库检验合格后,把不同文库按照有效浓度及目标数据量的需求,进行Hiseq/MiSeq测序。
使用Tophat v2.0.12将得到的原始测序序列比对到小鼠参考基因组上,用Cufflinks v2.1.1软件组装出高质量的转录本,用Cuffcompare v2.2.1将其与已注释的转录本信息进行比较,得到潜在的转录本。
1.3 差异基因的表达分析使用Stringtie v2.1.1软件对转录本在转录水平上进行表达量分析,皮尔逊相关系数表示样品间基因的表达水平相关性,使用R语言的procmp函数,根据表达量对各样品进行PCA主成分分析。采用DESeq(1.18.0)对转录本表达进行差异分析,筛选条件为表达差异倍数|log2Fold Change|>1,显著性P value < 0.05。
使用R语言ggplots 2 v3.3.5软件包绘制差异表达转录本的火山图,Pheatmap v1.0.12软件包根据同一转录本在不同样品中的表达水平和同一样品中不同转录本的表达模式进行聚类,采用Euclidan方法计算距离,使用层次聚类最长距离法进行聚类。
1.4 差异表达基因的GO分析对于差异表达的转录本,利用GO(gene ontology,www.geneontology.org)对其进行功能聚类分析。研究差异表达转录本在Gene Ontology中的分布状况将阐明试验中样本差异在基因功能上的体现。
1.5 差异表达基因的KEGG分析采用KEGG(kyoto encyclopedie of genes and genomes,www.kegg.jp/kegg/pathway)数据库对差异表达的基因进行了信号通路分析,通过Pathway显著性富集能确定特异基因参与的最主要生化代谢途径和信号转导途径。具体分析方法是以KEGG Pathway为单位,应用超几何检验,找出与整个基因组背景相比,在特异基因中显著性富集的pathway,最终将FDR≤0.05的pathway定义为在差异表达基因中显著富集的pathway。
1.6 部分差异表达基因的转录水平分析将无菌采集的细粒棘球绦虫原头蚴保存于液氮中,备用。总RNA提取采用美国Invitrogen公司的Trizol Reagent试剂,提取方法参照试剂说明书实验步骤进行。反转录采用康为世纪公司10 μL反转录体系的CW2582 cDNA合成试剂盒。靶标基因的qRT-PCR扩增引物由本实验室采用Primer 3.0在线软件设计,详细情况见表 1。
|
|
表 1 实时定量PCR试验相关引物 Table 1 Primer used for qRT-PCR |
以上述cDNA为模板,以gapdh为内参基因,对随机筛选的差异表达基因进行qRT-PCR扩增,反应体系:SYBR Premix Ex Taq Mix(2×) 10 μL,上游引物(10 mmol·L-1)0.4 μL,下游引物(10 mmol·L-1)0.4 μL,cDNA1 μL,加ddH2O至20 μL。反应条件为:95 ℃预变性30 s; 95 ℃ 5 s,60 ℃ 20 s,共40个循环。每个基因做三个重复,采用相对比较△Ct (Qr=2-△△Ct)[11]法计算目的基因的相对表达量。
2 结果 2.1 巨噬细胞RAW264.7与细粒棘球绦虫原头蚴共培养6 h差异基因表达分析当巨噬细胞RAW264.7与细粒棘球绦虫原头蚴共培养6 h时,和PBS对照组相比,原头蚴处理组的RAW264.7细胞共有848个基因的表达出现显著变化,其中415个基因出现上调表达,433个基因出现下调表达。GO分析结果显示,差异表达基因主要富集在GO功能聚类的生物过程(BP)中的细胞代谢过程等; 细胞组分(CC)中的细胞以及细胞组分等; 分子功能(MF)中的DNA、RNA、蛋白及各种酶的结合等。KEGG信号通路的分析结果表明差异表达的基因主要参与自然杀伤细胞介导的细胞毒性、病毒致癌物形成、HIF-1信号通路、AMPK信号通路、胰岛素信号通路以及FoxO等信号通路。详见图 1。
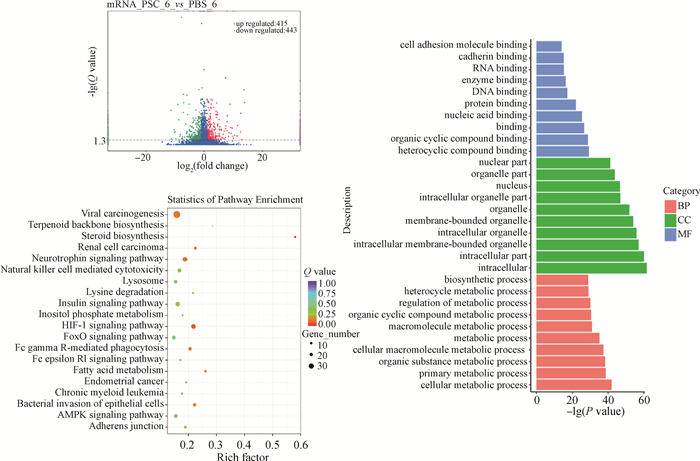
|
图 1 原头蚴(PSC)与RAW264.7共培养6 h差异表达基因的火山图、GO分析以及KEGG分析图 Fig. 1 Volcano plot, heatmap and KEGG of differentially expressed genes in RAW264.7 co-cultured with Echinococcus granulosus protoscoleces(PSC)for 6 hours |
当巨噬细胞RAW264.7与细粒棘球绦虫原头蚴共培养6 h时,共有31个Th1、Th2型免疫反应相关基因的表达出现显著变化,其中16个基因出现显著上调,15个出现显著下调。包括8个germline-encode receptor,其中3个上调,5个下调; 15个PRRs下游相关分子,其中5个上调,10个下调; 以及8个PRRs下游相关效应分子,其中7个上调,1个下调。详见图 2、表 2。
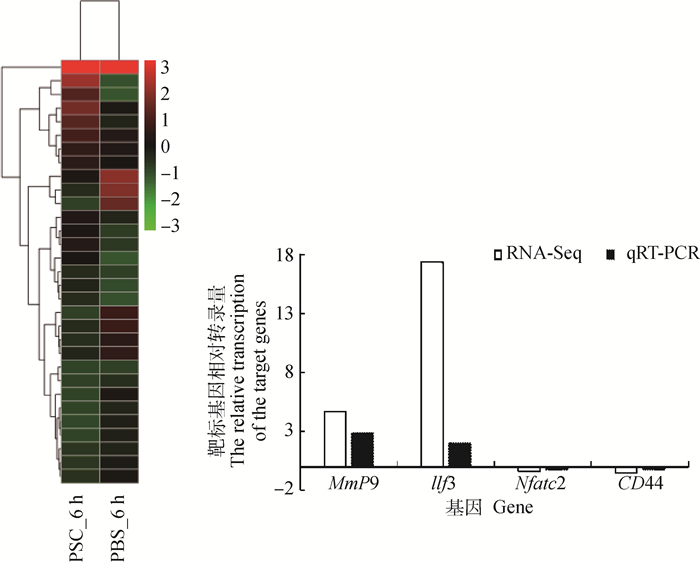
|
图 2 原头蚴(PSC)与RAW264.7共培养6 h Th1、Th2免疫反应相关基因差异表达聚类热图及部分基因的qRT-PCR验证 Fig. 2 The heatmap of the differential expression genes in the RAW264.7 related to Th1 and Th2 immune response during the protoscoleces(PSC)and RAW264.7 co-cultured for 6 hours and validation of the differntially expressed genes by qRT-PCR |
|
|
表 2 巨噬细胞RAW264.7与细粒棘球绦虫原头蚴共培养6 h Th1、Th2型免疫反应相关基因的差异表达 Table 2 Differential expression of Th1 and Th2 related genes in macrophages RAW264.7 co-cultured whit Echinococcus granulosus protoscoleces for 6 hours |
当巨噬细胞RAW264.7与细粒棘球绦虫原头蚴共培养24 h时,和PBS对照组相比,原头蚴处理组的RAW264.7细胞共有3 745个基因的表达出现显著变化,其中1 159个基因出现上调表达,2 586个基因出现下调表达。GO分析结果显示,差异表达基因主要富集在GO功能聚类的生物过程(BP)中的代谢过程、初级代谢过程、有机物代谢过程以及细胞代谢过程等; 细胞组分(CC)中的细胞内组分、细胞内、细胞器以及膜结构细胞器等。KEGG信号通路的分析结果表明差异表达的基因主要参与代谢通路、核糖体通路、剪接体通路、RNA转运以及泛素介导的蛋白水解等通路。详见图 3。
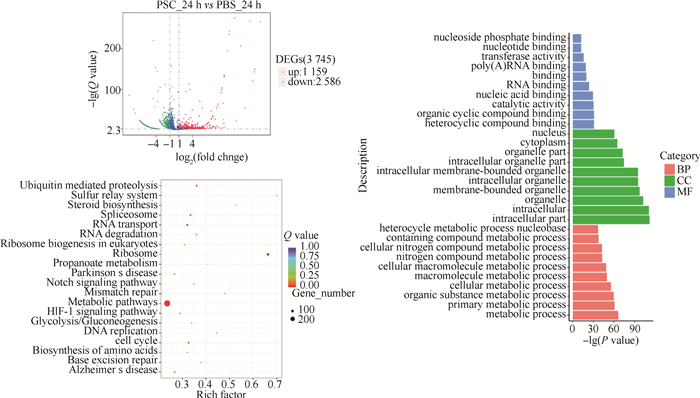
|
图 3 原头蚴(PSC)与RAW264.7共培养24 h差异表达基因的火山图、GO分析以及KEGG分析图 Fig. 3 Volcano plot, heatmap and KEGG of differentially expressed genes in RAW264.7 co-cultured with Echinococcus granulosus protoscoleces(PSC)for 24 hours |
当巨噬细胞RAW264.7与细粒棘球绦虫原头蚴共培养24 h时,共有111个Th1、Th2型免疫反应相关基因的表达出现显著变化,其中34个基因出现显著上调,78个出现显著下调。包括50个germline-encode receptor,其中18个上调,32个下调; 53个PRRs下游相关分子,其中12个上调,41个下调; 以及8个PRRs下游相关效应分子,其中4个上调,4个下调。详见图 4、表 3。
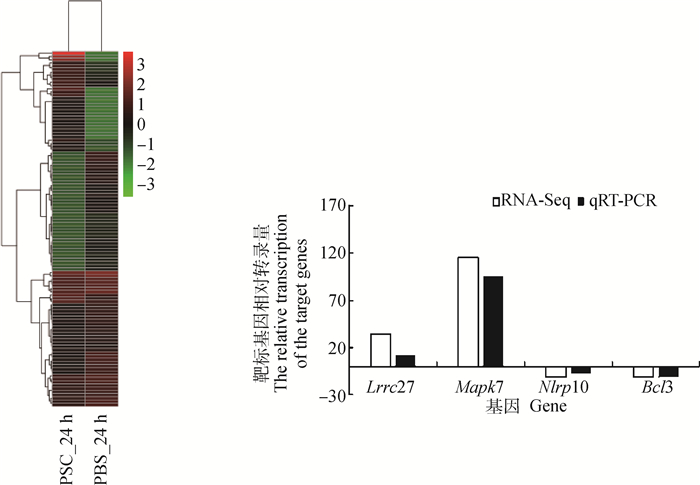
|
图 4 原头蚴(PSC)与RAW264.7共培养24 h Th1、Th2免疫反应相关基因差异表达聚类热图及部分基因的qRT-PCR验证 Fig. 4 The heatmap of the differential expression genes in the RAW264.7 related to Th1 and Th2 immune response during the protoscoleces(PSC)and RAW264.7 co-cultured for 24 hours and validation of the differntially expressed genes by qRT-PCR |
|
|
表 3 巨噬细胞RAW264.7与细粒棘球绦虫原头蚴共培养24 h Th1、Th2型免疫反应相关基因的差异表达 Table 3 Differential expression of Th1 and Th2 related genes in RAW264.7 during the protoscoleces and RAW264.7 co-cultured for 24 hours |
当巨噬细胞RAW264.7与细粒棘球绦虫原头蚴共培养72 h时,和PBS对照组相比,原头蚴处理组的RAW264.7细胞共有7 009个基因的表达出现显著变化,其中2 237个基因出现上调表达,4 772个基因出现下调表达。GO分析结果显示,差异表达基因主要富集在GO功能聚类的生物过程(BP)中的代谢过程、初级代谢过程、有机物代谢过程以及细胞代谢过程等; 细胞组分(CC)中的细胞、细胞组分、细胞内组分、细胞内、细胞器以及细胞内细胞器等。KEGG信号通路的分析结果表明差异表达的基因主要参与代谢通路、老年痴呆症通路、亨廷顿氏病通路、癌症通路、PI3K-Akt通路、内吞通路以及MAPK等通路。详见图 5。
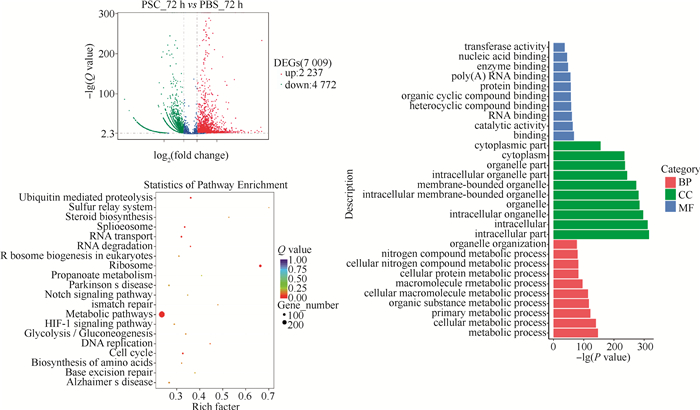
|
图 5 原头蚴(PSC)与RAW264.7共培养72 h差异表达基因的火山图、GO分析以及KEGG分析图 Fig. 5 Volcano plot, heatmap and KEGG of differentially expressed genes in RAW264.7 co-cultured with Echinocolcus granulosus protoscoleces(PSC)for 72 hours |
我们的分析结果显示,当巨噬细胞RAW264.7与细粒棘球绦虫原头蚴共培养72 h时,共有212个Th1、Th2型免疫反应相关基因的表达出现显著变化,其中50个基因出现显著上调,162个出现显著下调。包括78个germline-encode receptor,其中20个上调,58个下调; 97个PRRs下游相关分子,其中16上调,81下调; 以及37个PRRs下游相关效应分子,其中14个上调,23个下调。详见图 6、表 4。
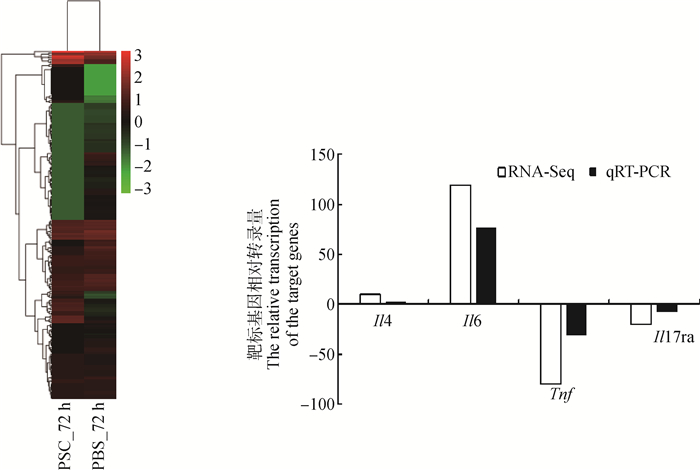
|
图 6 原头蚴(PSC)与RAW264.7共培养72 h Th1、Th2免疫反应相关基因差异表达聚类热图及部分基因的qRT-PCR验证 Fig. 6 The heatmap of the differential expression genes in the RAW264.7 related to Th1 and Th2 immune response during the protoscoleces(PSC)and RAW264.7 co-cultured for 72 hours and validation of the differntially expressed genes by qRT-PCR |
|
|
表 4 巨噬细胞RAW264.7与细粒棘球绦虫原头蚴共培养72 h Th1、Th2型免疫反应相关基因的差异表达 Table 4 Differential expression of Th1 and Th2 related genes in RAW264.7 during the protoscoleces and RAW264.7 co-cultured for 72 hours |
迄今为止,研究者已经对先天免疫系统控制1型免疫反应抵抗病原微生物做了大量研究。宿主体内有一组胚系基因编码受体,也称为模式识别受体(PRRs),可以识别病原体相关的分子模式(PAMPs),这些分子是来自病原体的保守分子[12]。PRRs对PAMPs的识别可以激活下游信号通路,诱导炎症细胞因子的转录[13]。相比之下,寄生虫已经发展出复杂的策略,可以将宿主的免疫反应转变为抗炎性的2型免疫反应[14-16],而人们对先天免疫系统如何控制2型免疫却知之甚少。一些来自蠕虫的产物可以作为免疫调节剂被宿主PRRs识别。TLR4可以识别啮齿类丝虫的排泄分泌产物ES-62,使宿主的免疫反应偏向于抗炎的Th2表型[17]。由曼氏血吸虫卵可溶性提取物制备的碳水化合物免疫调节剂LNFPIII通过激活非典型NF-κB家族成员BCL3,以DC-SIGN和TLR4依赖的方式驱动Th2极化[18-19]。此外,来源于曼氏血吸虫虫卵和成虫的脂质,可以激活TLR2并使树突状细胞成熟极化,导致机体偏向Th2免疫反应[20-21]。
本研究结果表明,当细粒棘球绦虫原头蚴刺激巨噬细胞RAW264.7时,可引起巨噬细胞内相关基因的差异表达。并且不同的时间点,差异表达的基因也在发生变化,进而调控不同的免疫反应。当细粒棘球绦虫原头蚴刺激巨噬细胞RAW264.7 6 h后,上调表达的基因主要参与MAPK通路、TNF通路、Rap1通路、TGF-beta通路、趋化因子通路、泛素介导的蛋白水解通路以及Fc受体介导的吞噬通路等。其中MAPK通路在细胞将外界刺激转化为一系列细胞反应过程起着关键作用,包括细胞生长、迁移、增殖、分化和凋亡[22-23]。而TNF是由活化的巨噬细胞和淋巴细胞表达的一种强有力的促炎性细胞因子,能诱导不同的细胞反应,参与调控从细胞凋亡到早期炎症和获得性免疫反应相关基因的表达。TNF可以诱导NF-κB介导的细胞存活(和促炎症)途径,或者根据细胞情况诱导凋亡反应[24]。研究发现克氏锥虫、弓形虫、恶性疟原虫等的感染,都能激活NF-κB的表达,抑制细胞凋亡,从而增强寄生虫的复制[25-28]。同时研究还表明,胞内寄生的旋毛虫的感染,可以诱导机体感染肌肉细胞中TNF、TNFR1、TRADD、caspase-3、caspase-8、TRAF-2以及RIP的表达,进而诱导细胞凋亡或者诱导肌肉细胞转化为滋养细胞[29]。而FcγR受体是机体体液免疫和细胞免疫的重要纽带,表达于淋巴细胞的FcγR受体具有介导细胞吞噬、抗体依赖性细胞毒性、释放炎症介质、产生氧自由基和调节抗体产生等免疫效应功能[30]。Rap1属于RAS家族中小的GTPases,它参与了多种细胞信号转导通路,与癌症的发生和转移相关。Rap1在哺乳动物细胞中的功能相对保守,包括细胞极性、底物和细胞-细胞黏附以及其他涉及细胞骨架动力学调节的过程[31]。当细粒棘球绦虫原头蚴刺激巨噬细胞RAW264.7 24 h后,上调表达的基因主要富集在代谢通路、核糖体通路、Rap1通路、HIF-1通路、PI3K-Akt通路、MAPK通路以及泛素介导的蛋白水解等通路。当细粒棘球绦虫原头蚴刺激巨噬细胞RAW264.7 72 h后,上调表达的基因主要富集在代谢通路、HIF-1通路、剪切体及泛素介导的蛋白水解等通路,但与细胞炎性免疫相关的MAPK通路、TNF通路和Fc受体介导的吞噬通路等均出现下调表达的趋势,在整个过程中,泛素介导的蛋白水解通路一直处于上调表达的状态。综上,从细粒棘球绦虫原头蚴刺激巨噬细胞RAW264.7不同时间点差异表达基因的KEGG富集结果可以得出以下结论,在虫体刺激巨噬细胞RAW264.7 6、24 h时,巨噬细胞的免疫反应主要以炎性反应为主,而当互作72 h,巨噬细胞的免疫反应则变为以抑炎反应为主。
模式识别受体(PRRs)能识别病原体相关的分子模式,激活下游信号通路,调节宿主对病原体的免疫反应。PRRs包括Toll样受体(TLR)、NOD样受体(NLR)、RIG样受体(RLR)、C型凝集素受体(CLR)、甘露糖受体以及清道夫受体等。因此,为了解析巨噬细胞中PRRs在应对细粒棘球绦虫原头蚴刺激时功能,本研究系统分析了不同作用时间点巨噬细胞PRRs及其相关分子的差异表达情况。结果表明,原头蚴刺激可引起巨噬细胞中PRRs及其相关分子的差异表达,并随着刺激时间的不同而不同。当原头蚴刺激巨噬细胞6 h时,清道夫受体CD36以及G蛋白偶联受体Adgre5的表达出现上调,同时PRRs下游相关效应分子Tnfrsf1a和Ifnar1的表达也出现上调。其中,CD36是一种膜蛋白,存在于各种类型的细胞中,包括单核细胞和巨噬细胞等。是一种多配体受体,参与葡萄糖和脂质代谢、免疫反应、炎症反应、血栓形成和纤维化等过程[32]。巨噬细胞CD36通过与氧化型低密度脂蛋白的相互作用,进而引发炎症反应[33]。Tnfrsf1a属于肿瘤坏死因子超家族,其编码的受体可以调控炎型细胞因子的活性[34]。而Ifnar1是一种可以激活细胞表达一型干扰素的受体,该受体表达于所有的有核细胞[35]。当原头蚴刺激巨噬细胞24 h时,C型凝集素受体Reg1、Reg2、Reg3b、Reg3d、Reg3a和Reg3g的表达出现上调,研究表明,C型凝集素受体作为模式识别受体的重要成员,通过识别和结合微生物表面的碳水化合物,在区分自我和非自我的先天免疫系统中发挥着重要作用[36]。近期的研究表明,有3个宿主来源的C型凝集素受体可以识别弓形虫卵囊壁抗原,可能在宿主的先天免疫中起到重要作用[37]。同时,研究发现宿主来源的C型凝集素受体Mgl-1和mcl是犬弓首蛔虫感染过程中潜在的免疫调节基因[38]。PRRs下游相关效应分子Fam132a、Cbln2和Tnfrsf12a的表达出现上调,其中Fam132a和Cbln2属于肿瘤坏死因子样的结构域,而Tnfrsf12a属于肿瘤坏死因子受体12,都属于炎型细胞因子调节因子。当原头蚴刺激巨噬细胞72 h时,有12个富亮氨酸重复结构域的蛋白LRRCs包括Lrrc7、Fbxl22、Lrrc4b、Lrrc63、Epyc、Xrra1、Snrpa1、Atp5s、Anp32a、Lrrc28、Anp32b和Lrrc40的表达出现上调,LRRCs是一种与先天免疫反应相关的蛋白,在许多物种中相对保守。国内的研究者发现长角血蜱体内表达LRRCs,此蛋白可以抑制蜱虫体内寄生巴贝斯虫的生长[39]。弓形虫的感染可以激活宿主LRRCs的表达,进而调控宿主对感染的抵抗[40]。同时有6个G蛋白偶联受体GPCRs,包括Olfr456、Olfr837、Olfr600、Olfr1170、Olfr933和Olfr482的表达出现上调。GPCRs是细胞表面最大的受体家族,它们负责细胞外信号的传导,几乎调节哺乳动物生理的所有方面[41]。Olfr型的受体可以被短链脂肪酸乙酸酯和丙酸酯激活,此类受体可以介导慢性炎症反应[42]。对PRRs下游效应分子分析结果显示,IL-4和IL-6的表达呈上调趋势,这两个细胞因子是典型的Th2型免疫反应调控细胞因子,而Th2型免疫反应属于炎症抑制反应[43]。综上所述,细粒棘球绦虫原头蚴的刺激,可以使巨噬细胞中部分C型凝集素受体、G蛋白偶联受体GPCRs以及富亮氨酸重复结构域的蛋白LRRCs的表达出现上调。由此推测,上述受体可能在巨噬细胞免疫识别细粒棘球绦虫原头蚴的过程过发挥作用,但其具体调控机制尚不清楚。同时,对PRRs下游效应分子的分析结果提示,细粒棘球绦虫原头蚴刺激巨噬细胞6、24 h,细胞主要以炎症反应为主,而当细粒棘球绦虫原头蚴刺激巨噬细胞72 h,巨噬细胞的免疫反应则以炎症抑制反应为主,此结果与差异表达基因KEGG分析结果一致。
4 结论系统解析了巨噬细胞RAW264.7应对细粒棘球绦虫原头蚴刺激时其免疫相关基因的差异表达谱规律,筛选鉴定出了大量与巨噬细胞抗细粒棘球绦虫原头蚴感染相关的模式识别受体PRRs以及其下游效应分子。为进一步揭示宿主巨噬细胞与细粒棘球绦虫原头蚴免疫互作调控机制提供了理论数据,同时为囊型包虫病疫苗和药物的研发提供了新的视角。
| [1] |
SIRACUSANO A, DELUNARDO F, TEGGI A, et al. Host-parasite relationship in cystic echinococcosis: an evolving story[J]. Clin Dev Immunol, 2012, 2012: 639362. |
| [2] |
WHO. Working to overcome the global impact of neglected tropical diseases[R]. Geneva: World Health Organization, 2010.
|
| [3] |
曹得萍, 张耀刚, 姜博璠, 等. 细粒棘球蚴和多房棘球蚴感染对Balb/c小鼠淋巴细胞亚群的影响[J]. 中国人兽共患病学报, 2021, 37(5): 421-425. CAO D P, ZHANG Y G, JIANG B F, et al. The effects of hydatid cyst and alveolar hydatid infection on lymphocyte subsets in Balb/c mice[J]. Chinese Journal of Zoonoses, 2021, 37(5): 421-425. (in Chinese) |
| [4] |
余智勇, 李海, 贾斌, 等. 多浪羊MHC-DRB1基因多态性与包虫病抗性分析[J]. 畜牧兽医学报, 2007, 38(11): 1149-1153. YU Z Y, LI H, JIA B, et al. Analysis of polymorphism of MHC-DRB1 gene and resistance of Hydatidosis in Dolang sheep[J]. Acta Veterinaria et Zootechnica Sinica, 2007, 38(11): 1149-1153. DOI:10.3321/j.issn:0366-6964.2007.11.003 (in Chinese) |
| [5] |
GOTTSTEIN B, SOBOSLAY P, ORTONA E, et al. Immunology of alveolar and cystic echinococcosis (AE and CE)[J]. Adv Parasitol, 2017, 96: 1-54. |
| [6] |
INCLAN-RICO J M, SIRACUSA M C. First responders: innate immunity to helminths[J]. Trends Parasitol, 2018, 34(10): 861-880. DOI:10.1016/j.pt.2018.08.007 |
| [7] |
AKIRA S, UEMATSU S, TAKEUCHI O. Pathogen recognition and innate immunity[J]. Cell, 2006, 124(4): 783-801. DOI:10.1016/j.cell.2006.02.015 |
| [8] |
BEUTLER B A. TLRs and innate immunity[J]. Blood, 2009, 113(7): 1399-1407. DOI:10.1182/blood-2008-07-019307 |
| [9] |
JANEWAY C A J, MEDZHITOV R. Innate immune recognition[J]. Annu Rev Immunol, 2002, 20: 197-216. DOI:10.1146/annurev.immunol.20.083001.084359 |
| [10] |
REYES J L, TERRAZAS L I. The divergent roles of alternatively activated macrophages in helminthic infections[J]. Parasite Immunol, 2007, 29(12): 609-619. DOI:10.1111/j.1365-3024.2007.00973.x |
| [11] |
PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Res, 2001, 29(9): e45. DOI:10.1093/nar/29.9.e45 |
| [12] |
JANEWAY C A Jr. Approaching the asymptote?Evolution and revolution in immunology[J]. Cold Spring Harb Symp Quant Biol, 1989, 54 Pt 1: 1-13. |
| [13] |
KAPSENBERG M L. Dendritic-cell control of pathogen-driven T-cell polarization[J]. Nat Rev Immunol, 2003, 3(12): 984-993. DOI:10.1038/nri1246 |
| [14] |
GAUSE W C, WYNN T A, ALLEN J E. Type 2 immunity and wound healing: evolutionary refinement of adaptive immunity by helminths[J]. Nat Rev Immunol, 2013, 13(8): 607-614. DOI:10.1038/nri3476 |
| [15] |
KUBO M. Innate and adaptive type 2 immunity in lung allergic inflammation[J]. Immunol Rev, 2017, 278(1): 162-172. DOI:10.1111/imr.12557 |
| [16] |
GIESECK R L, WILSON M S, WYNN T A. Type 2 immunity in tissue repair and fibrosis[J]. Nat Rev Immunol, 2018, 18(1): 62-76. DOI:10.1038/nri.2017.90 |
| [17] |
GOODRIDGE H S, MARSHALL F A, ELSE K J, et al. Immunomodulation via novel use of TLR4 by the filarial nematode phosphorylcholine-containing secreted product, ES-62[J]. J Immunol, 2005, 174(1): 284-293. DOI:10.4049/jimmunol.174.1.284 |
| [18] |
THOMAS P G, CARTER M R, ATOCHINA O, et al. Maturation of dendritic cell 2 phenotype by a helminth glycan uses a toll-like receptor 4-dependent mechanism[J]. J Immunol, 2003, 171(11): 5837-5841. DOI:10.4049/jimmunol.171.11.5837 |
| [19] |
GRINGHUIS S I, KAPTEIN T M, WEVERS B A, et al. Fucose-specific DC-SIGN signalling directs T helper cell type-2 responses via IKK ε- and CYLD-dependent Bcl3 activation[J]. Nat Commun, 2014, 5: 3898. DOI:10.1038/ncomms4898 |
| [20] |
VAN DER KLEIJ D, LATZ E, BROUWERS J F H M, et al. A novel host-parasite lipid cross-talk. Schistosomal lyso-phosphatidylserine activates toll-like receptor 2 and affects immune polarization[J]. J Biol Chem, 2002, 277(50): 48122-48129. DOI:10.1074/jbc.M206941200 |
| [21] |
CORREALE J, FAREZ M. Helminth antigens modulate immune responses in cells from multiple sclerosis patients through TLR2-dependent mechanisms[J]. J Immunol, 2009, 183(9): 5999-6012. DOI:10.4049/jimmunol.0900897 |
| [22] |
YUE J C, LÓPEZ J M. Understanding MAPK signaling pathways in apoptosis[J]. Int J Mol Sci, 2020, 21(7): 2346. DOI:10.3390/ijms21072346 |
| [23] |
DAVIS R J. Signal transduction by the JNK group of MAP kinases[J]. Cell, 2000, 103(2): 239-252. DOI:10.1016/S0092-8674(00)00116-1 |
| [24] |
RAHMAN M M, MCFADDEN G. Modulation of tumor necrosis factor by microbial pathogens[J]. PLoS Pathog, 2006, 2(2): e4. DOI:10.1371/journal.ppat.0020004 |
| [25] |
HALL B S, TAM W, SEN R, et al. Cell-specific activation of nuclear factor-κB by the parasite Trypanosoma cruzi promotes resistance to intracellular infection[J]. Mol Biol Cell, 2000, 11(1): 153-160. DOI:10.1091/mbc.11.1.153 |
| [26] |
MOLESTINA R E, PAYNE T M, COPPENS I, et al. Activation of NF κB by Toxoplasma gondii correlates with increased expression of antiapoptotic genes and localization of phosphorylated IκB to the parasitophorous vacuole membrane[J]. J Cell Sci, 2003, 116(Pt 21): 4359-4371. |
| [27] |
PALMER G H, MACHADO J Jr, FERNANDEZ P, et al. Parasite-mediated nuclear factor κB regulation in lymphoproliferation caused by Theileria parva infection[J]. Proc Natl Acad Sci U S A, 1997, 94(23): 12527-12532. DOI:10.1073/pnas.94.23.12527 |
| [28] |
TACHADO S D, GEROLD P, MCCONVILLE M J, et al. Glycosylphosphatidylinositol toxin of Plasmodium induces nitric oxide synthase expression in macrophages and vascular endothelial cells by a protein tyrosine kinase-dependent and protein kinase C-dependent signaling pathway[J]. J Immunol, 1996, 156(5): 1897-1907. |
| [29] |
WU Z, NAGANO I, BOONMARS T, et al. Tumor necrosis factor receptor-mediated apoptosis in Trichinella spiralis-infected muscle cells[J]. Parasitology, 2005, 131(Pt 3): 373-381. |
| [30] |
VAN DER POL W L, VAN DE WINKEL J G. Immunology in clinical practice. X. IgG receptors: structure, function and immunotherapy[J]. Ned Tijdschr Geneeskd, 1998, 142(7): 335-340. |
| [31] |
HILBI H, KORTHOLT A. Role of the small GTPase Rap1 in signal transduction, cell dynamics and bacterial infection[J]. Small GTPases, 2019, 10(5): 336-342. DOI:10.1080/21541248.2017.1331721 |
| [32] |
PUCHAŁOWICZ K, RAĆ M E. The multifunctionality of CD36 in diabetes mellitus and its complications-update in pathogenesis, treatment and monitoring[J]. Cells, 2020, 9(8): 1877. DOI:10.3390/cells9081877 |
| [33] |
PARK Y M. CD36, a scavenger receptor implicated in atherosclerosis[J]. Exp Mol Med, 2014, 46(6): e99. DOI:10.1038/emm.2014.38 |
| [34] |
HAUSMANN L D, DE ALMEIDA B S, DE SOUZA I R, et al. Association of TNFRSF1A and IFNLR1 gene polymorphisms with the risk of developing breast cancer and clinical pathologic features[J/OL]. Biochemical Genetics, 2021, doi: 10.1007/s10528-021-10060-z.
|
| [35] |
SCHREIBER G. The molecular basis for differential type I interferon signaling[J]. J Biol Chem, 2017, 292(18): 7285-7294. DOI:10.1074/jbc.R116.774562 |
| [36] |
WANG L, ZHANG J, ZHAO X L, et al. Molecular characterization and biological effect of a C-type lectin receptor in Qihe crucian carp, Carassius auratus[J]. Dev Comp Immunol, 2021, 121: 104081. DOI:10.1016/j.dci.2021.104081 |
| [37] |
FABIAN B T, LEPENIES B, SCHARES G, et al. Expanding the known repertoire of C-type lectin receptors binding to Toxoplasma gondii oocysts using a modified high-resolution immunofluorescence assay[J]. mSphere, 2021, 6(2): e01341-20. |
| [38] |
RAULF M K, LEPENIES B, STRUBE C. Toxocara canis and Toxocara cati somatic and excretory-secretory antigens are recognised by C-type lectin receptors[J]. Pathogens, 2021, 10(3): 321. DOI:10.3390/pathogens10030321 |
| [39] |
YAO J L, XU Z M, SUN Z Y, et al. Response of leucine-rich repeat domain-containing protein in Haemaphysalis longicornis to Babesia microti infection and its ligand identification[J]. Infect Immun, 2021, 89(5): e00268-20. |
| [40] |
WANG S C, WANG Z D, GU Y, et al. Toxoplasma gondii mitogen-activated protein kinases are associated with inflammasome activation in infected mice[J]. Microbes Infect, 2016, 18(11): 696-700. DOI:10.1016/j.micinf.2016.07.004 |
| [41] |
MARZANO F, RAPACCIUOLO A, FERRARA N, et al. Targeting GRK5 for treating chronic degenerative diseases[J]. Int J Mol Sci, 2021, 22(4): 1920. DOI:10.3390/ijms22041920 |
| [42] |
KOTLO K, ANBAZHAGAN A N, PRIYAMVADA S, et al. The olfactory G protein-coupled receptor (Olfr-78/OR51E2) modulates the intestinal response to colitis[J]. Am J Physiol Cell Physiol, 2020, 318(3): C502-C513. DOI:10.1152/ajpcell.00454.2019 |
| [43] |
KÖCK J, KREHER S, LEHMANN K, et al. Nuclear factor of activated T cells regulates the expression of interleukin-4 in Th2 cells in an all-or-none fashion[J]. J Biol Chem, 2014, 289(39): 26752-26761. DOI:10.1074/jbc.M114.587865 |
(编辑 白永平)



