2. 青藏高原动物遗传资源保护与利用教育部重点实验室,成都 610041
2. Key Laboratory of Qinghai-Tibetan Plateau Animal Genetic Resource Reservation and Utilization, Chengdu 610041, China
犊牛腹泻在养殖过程中十分常见,具有高发病率和高致死率的特点,给养牛业造成巨大的经济损失。引起牛腹泻的病原体有细菌、病毒、寄生虫等[1],其中造成牛腹泻的最常见病毒有牛轮状病毒(bovine rotavirus,BRV)[2]、牛冠状病毒(bovine coronavirus,BCoV)[3]、牛病毒性腹泻黏膜病病毒(bovine viral diarrhea virus,BVDV)[4]。近几年的国内相关报道,牛纽布病毒(bovine nebovirus,BNeV)和牛诺瓦病毒(bovine norovirus,BNoV)被报道与牛腹泻疾病有关[5],二者均属于牛肠道嵌杯病毒(bovine enteric caliciviruses, BECs)[6-7]。上述5种病毒均可以造成犊牛的腹泻,并且常发生混合感染。
牛轮状病毒(BRV)是呼肠孤病毒科轮状病毒属一种双链无囊膜RNA病毒[8]。A群轮状病毒也是引起家畜感染的最主要的原因[9]。通常导致年龄小于3周龄的小牛腹泻。临床症状表现为排出水样浅黄色稀便,严重时也表现为血便并通常含有大量的黏液,成年牛一般呈隐性感染,并通过粪便将病毒排放到环境中引起群体大规模感染[10]。近年来,有研究表明,BRV能跨种间传播造成人或其他动物的感染[11-12]。牛冠状病毒(BCoV)是单链无节段的正向基因组RNA组成,属于冠状病毒科冠状病毒属[13]。BCoV主要引起1~2周龄小牛的腹泻,成年动物出血性腹泻、并伴有呼吸系统疾病,研究表明,BCoV在我国普遍存在; 也是引起犊牛及成年牛腹泻的重要病原之一[14]。牛病毒性腹泻病毒(BVDV)为单股正链RNA病毒,是瘟病毒属的成员[15],主要导致牛的发烧,腹泻,白细胞减少,产奶量减少[16]; 引起机体的免疫抑制和持续性带毒,亦会导致怀孕母牛的流产、犊牛的肠道和呼吸道的临床症状[17],病毒的传播也会造成其他动物的感染[18]。牛诺瓦病毒(BNoV)属于嵌杯病毒科,是无囊膜病毒,为线性单链正链RNA[19]。BNoV主要经粪-口传播,引起的小牛感染的临床症状主要表现为被毛凌乱、精神沉郁、严重嗜睡、急性且持续的腹泻,以及伴有吸收障碍[20-21]。牛纽布病毒(BNeV)属于嵌杯病毒科,为无囊膜的单股正链RNA病毒[22],主要引起3日龄到6月龄的小牛腹泻。其临床症状主要出现粪便颜色变化,严重时呈血便、严重腹泻和肠道损伤[23],该病毒在我国奶牛和牦牛中广泛流行; 具有独特的进化趋势[24]。以上5种病原微生物所引起犊牛腹泻在病理变化和临床症状等方面极为相似,在临床诊断中很难进行快速准确的判断。
有研究对2017—2018年山东13个地区624份牛腹泻样本进行检测,检出率分别为BRV17.70%、BCoV8.84%和BVDV34.58%[25]。2010—2011年,对北京3个地区1 650份血液样品进行了BVDV、BCoV、BRV感染抗体检测,结果显示BVDV抗体平均阳性率为48.20%;BCV抗体平均阳性率为57.20%;BRV抗体平均阳性率为52.20%[26]。对2017年11月—2018年5月采自四川、辽宁、河南、山东、陕西5个省的共计93份奶犊牛腹泻粪便样本进行检测,BNoV的检出率达到25.81% [27]。2018年8—11月采自新疆和辽宁的135份奶犊牛腹泻样本中BNeV的检出率为67.41% [28]。由上可见这5种病毒在我国广泛流行。PCR技术广泛运用在动物疫病的诊疗过程中,是一种重要的分子检测的手段[29]。国内外已报道多个关于检测这5种病毒引起牛腹泻[6, 28, 30-32]的单一PCR方法等。由于检测单一病毒的PCR方法耗时耗力且只能检测特定的病毒,存在着部分缺陷。国内外学者在此基础上建立了可以同时检测BRV和BCoV[12],BCoV和BNoV[33],BRV、BCoV和BVDV[34]等两种及以上引起牛腹泻病毒的多重PCR方法。尚无就检测本试验的5种致牛腹泻病毒的多重PCR方法的报道,本试验的目的在于建立能同时检测这5种病毒的多重PCR方法, 对疾病作出快速准确的鉴别诊断,节约实验室成本和时间。
1 材料与方法 1.1 病毒(菌)株和样本牛轮状病毒、牛冠状病毒、牛病毒性腹泻病毒、牛诺瓦病毒和牛纽布病毒的阳性样本,由本实验室保存。用于特异性验证的病毒(菌)菌株及核酸样本; 牛星状病毒(bovine astrovirus, BAstV)Swun0201、牛细小病毒(bovine parvovirus,BPV)、牛嵴病毒(bovine kobuvirus,BKV)、牛源K99大肠杆菌Swun4025、牛源都柏林沙门菌Swun3736和牛源空肠弯曲杆菌Swun1639的核酸样本由本实验室保存。
检测方法比较的样本:16份肉牛腹泻粪便样本(采自2020年9月四川省阆中1个牧场),10份奶牛腹泻样本(采自2020年12月四川省西昌市1个牧场)。由本实验室保存。
临床样本:220份采自于阿坝州的牦牛腹泻粪便样本(2019年6月四川省阿坝县和若尔盖县2个牧场共38份和采自于2020年7—8月四川省红原县、若尔盖县和阿坝县的8个牧场共182份)。所有样本-80 ℃保存。
1.2 主要试剂和仪器Trizols Reagent、Prime ScriptTM RT-PCR Kit、Premix TaqTM、DNA Marker DL2000、pMD19-T克隆载体、DH5α感受态细胞、DNA Marker均购自大连宝生物工程有限公司; Gel Extraction Kit胶回收试剂盒、质粒提取试剂盒均购自OMEGA BIO-TEK公司。凝胶成像系统Doc2000(BioRad公司,美国), 超微量核酸蛋白测定仪(NanoDrop One)。
1.3 引物的设计与合成根据NCBI上登录的BVDV、BNoV、BRVA、BNeV 4种病毒基因的保守序列, 用Primer5.0软件对4种病毒的基因保守区域各设计1对引物,参考文献[35]合成BCoV的检测引物,引物序列及相关信息见表 1。
|
|
表 1 多重PCR引物序列 Table 1 Primers of the multiplex PCR |
牛粪便样本与PBS以1∶5混匀后制成悬液,-80 ℃反复冻融3次,12 000 r·min-1离心15 min,取上清250 μL并根据TrizolTM Reagent试剂盒说明书的步骤提取样本总RNA,并按照反转录试剂盒说明书合成cDNA,反转录体系为(20 μL),采用酚-氯仿法提取细菌的DNA,-20 ℃保存备用。
1.5 单一RT-PCR的检测方法的优化为了确定单一病毒RT-PCR的反应条件,退火温度可以参考引物设计时的软件和引物合成订单,从而分别初步建立检测BCoV、BNoV、BRVA、BVDV和BNeV的单一RT-PCR,再对其反应程序中设置不同的退火温度,在51~60 ℃之间设置6个梯度和引物浓度,确定最佳退火温度和引物浓度。采用的是25 μL的反应体系:Premix TaqTM12.5 μL,cDNA 2 μL,上下游引物各1 μL,ddH2O补足至25 μL。经2%琼脂糖凝胶电泳检测扩增结果,送生物公司进行测序。
1.6 阳性质粒的制备扩增产物经琼脂糖凝胶电泳检测,将扩增出来的特异性条带进行胶回收,连接至pMD19-T载体,转化到大肠杆菌DH5α感受态细胞中,克隆加入到含氨苄青霉素的LB液体培养基中,37 ℃培养10 h,将阳性克隆送至生工生物有限公司进行测序,并将测序的结果用生物软件(BioXm)进行比对和分析,将测序正确的重组质粒作为阳性标准品。
1.7 多重RT-PCR扩增及反应条件的优化以5种病毒的阳性重组质粒DNA混合物为模板, 将5个病毒阳性质粒等量混后作为多重RT-PCR反应模板,建立25 μL的PCR反应体系; Premix TaqTM 12.5 μL,cDNA 2 μL,上下游引物各0.1~ 0.8 μL,ddH2O补足至25 μL。保持缓冲体系不变,对退火温度(退火温度在50~60 ℃之间设8个梯度)和引物浓度进行优化。
1.8 特异性试验用本试验建立的五重RT-PCR方法对“1.1”中待检病原的核酸样本进行检测, 并设立BRVA、BCoV、BVDV、BNoV和BNeV以及5种病毒混合的阳性标准对照, 以评价该方法的特异性。
1.9 重复性试验将5种阳性质粒混合作为反应模板并置于-20 ℃保存,用此方法对其进行扩增试验重复3次,每次间隔1周,评价其重复性。
1.10 敏感性试验用核酸蛋白仪测定5种病毒阳性质粒的浓度分别为BNoV 2.2 ng·μL-1、BRVA1.8 ng·μL-1、BNeV 2.2 ng·μL-1、BCoV 2.2 ng·μL-1和BVDV 2.1 ng·μL-1,进行10倍倍比稀释,分别为10-1到10-8。取混合稀释液2 μL作为模板。用本试验建立的RT-PCR方法进行检测, 确定检测下限。
1.11 与单一RT-PCR的检测符合率的比较利用本试验建立的五重RT-PCR方法对2020年采自四川阆中的16份肉牛腹泻粪便样本和西昌的10份奶牛腹泻粪便样本进行检测,检测结果与单一RT-PCR方法进行比较。最终评价多重RT-PCR方法的符合率情况。
2 结果 2.1 单一RT-PCR的优化以BRVA、BCoV、BVDV、BNoV和BNeV的cDNA作为模板,分别用相对应的PCR扩增引物进行单重PCR扩增,获得的目的片段大小均与预期结果一致(图 1)。经送生工生物公司测序,再进行blast序列比对,结果表明,各个病毒所扩增的目的片段均为所对应病毒的靶基因,基因序列的相似度为100%。
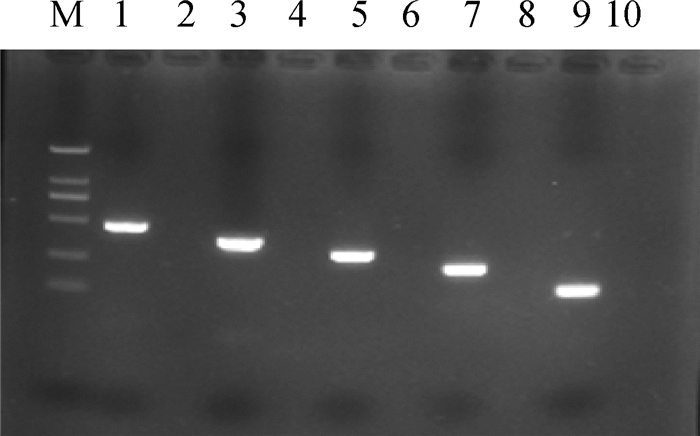
|
M. DL2000 DNA相对分子质量标准; 1. BNoV; 3. BRVA; 5. BNeV; 7. BCoV; 9. BVDV; 2、4、6、8、10. 阴性对照 M. DL2000 DNA marker; 1. BNoV; 3. BRVA; 5. BNeV; 7. BCoV; 9. BVDV; 2, 4, 6, 8, 10. Negative control 图 1 单一RT-PCR的扩增 Fig. 1 Single RT-PCR amplification |
对退火温度进行优化,确定最优的反应条件: 94 ℃预变性5 min; 94 ℃变性30 s,55.7 ℃退火35 s,72 ℃延伸45 s,共35个循环; 72 ℃延伸6 min; 16 ℃反应结束。
通过对引物浓度以及反应体系的优化,最终反应体系为Premix TaqTM12.5 μL,BCoV F/R各0.5 μL、BNoV F/R各0.4 μL、BRVA F/R各0.4 μL、BVDV F/R各0.5 μL、BNeV F/R各0.4 μL,样本DNA 2 μL,ddH2O补足至25 μL。
2.3 多重RT-PCR特异性试验所建立的五重RT-PCR方法能够扩增出五种阳性质粒的混合样本和5种病毒的阳性样本,同时对“1.1”材料中本实验室所保存其他的细菌和病毒株的阳性样本均不能扩增出目的片段(图 2)。
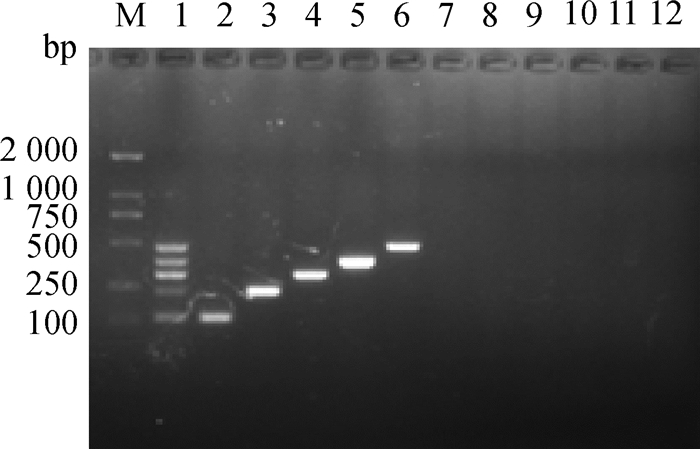
|
M. DL2000 DNA相对分子质量标准; 1. 5种阳性质粒混合; 2. BVDV; 3. BCoV; 4. BNeV; 5.BRVA; 6. BNoV; 7. BPV; 8. BAstV; 9. BKV; 10. E. coli; 11.Salmonella; 12. Campylobacter jejuni M. DL2000 DNA marker; 1. Mixture of five positive plasmids; 2. BVDV; 3.BCoV; 4. BNeV; 5. BRVA; 6. BNoV; 7. BPV; 8. BAstV; 9. BKV; 10. E. coli; 11.Salmonella; 12. Campylobacter jejuni 图 2 多重PCR特异性试验 Fig. 2 Specificity test of the multiplex PCR |
用所建立的方法重复检测阳性质粒混合模板3次,每次间隔一星期,结果均可见5条清晰的条带,表明方法稳定性良好(图略)。
2.5 多重RT-PCR敏感性测定在本试验的五重RT-PCR中,BNeV能扩增的最低检测下限为2.0×105copies·μL-1、BNoV最低检测下限1.96×105copies·μL-1,BRVA最低检测下限1.63×105copies·μL-1,BCoV最低检测下限2.0×106copies·μL-1,BVDV最低检测下限1.9×105copies·μL-1(图 3)。
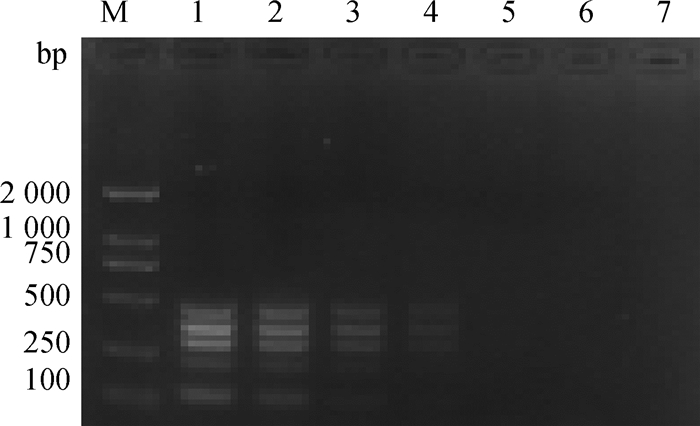
|
M. DL2000 DNA相对分子质量标准; 1. 10-1; 2. 10-2; 3. 10-3; 4. 10-4; 5. 10-5; 6. 10-6; 7. 10-7 M. DL2000 DNA marker; 1. 10-1; 2. 10-2; 3. 10-3; 4. 10-4; 5. 10-5; 6. 10-6; 7. 10-7 图 3 多重PCR敏感性试验 Fig. 3 Sensitivity tests of the multiplex PCR |
用本试验建立的五重RT-PCR方法对四川阆中16份肉牛和西昌10份奶牛的腹泻粪便样本的检测结果显示,BNeV阳性为1份,阳性率为3.8%; BVDV阳性为2份,阳性率为7.7%;BCoV阳性为8份,阳性率为30.8%。没有检测出BRVA和BNoV的阳性样本,与单一RT-PCR方法检出的阳性样本数一致且阳性符合率100%。表明本试验建立的五重RT-PCR可应用于临床检测。
2.7 临床样本的检测运用所优化并建立好的五重RT-PCR的方法对采集(2019年6月—2020年8月)阿坝州的220份牦牛腹泻粪便样本进行检测,10个牛场中BRVA牛场阳性占比9/10,BNoV牛场阳性占比3/10,BNeV牛场阳性占比4/10。对阿坝州地区的牦牛腹泻情况做出详细记录,总结其流行情况(表 3)。
|
|
表 2 与单一PCR检测结果的比较 Table 2 Comparison with single PCR detection results |
|
|
表 3 多重PCR方法对220份样本的阳性检出率 Table 3 The positive detection rate of 220 samples by multiplex PCR method |
多重PCR要求引物在同一反应条件下对单个或多个病毒的特定DNA基因序列的扩增,靶基因的选择和引物的设计成为了多重RT-PCR的两个重要的制约条件[36]。针对牛腹泻的多种病原混合感染的情况,国内外学者建立了能够同时检测出引起牛腹泻的两种或以上病原的RT-PCR方法。这其中大多数方法靶基因的选择都与单一RT-PCR相一致。其中冠状病毒的N基因、轮状病毒的VP6基因和牛病毒性腹泻病毒的5′UTR基因已经成为国内外研究者建立检测方法的首选靶基因。笔者在试验中发现,在设计冠状病毒的特异性检测引物时,国内外研究人员很多都选择N基因作为首选靶基因,复核宏病毒组技术证实为阳性的牛腹泻粪便样本时,结果几种方法均未能检出[35],追其方法的检出率和准确性有待进一步验证,遂选择本实验室已建立好的冠状病毒的检测方法。诺瓦病毒的引物设计多选择为ORF1中的RdRp基因,但BNoV在RdRp区存在着多个核苷酸发生突变[37],所以针对诺瓦病毒这种靶基因的特点,如何设计出特异性检测引物成为了非常关键的环节。轮状病毒在国内外牛腹泻样本中主要检测出的多为A型,不同品种的牛感染的轮状病毒在基因位点上也存在着少许的突变。VP6基因常常作为轮状病毒分子检测的首要靶基因,但其存在不同程度的点突变[38],所以选择更为保守的基因片段成为了提高检出率的重中之重。
笔者选择了与单一PCR检测方法同样的病毒靶基因来设计引物,运用Mega 7生物软件进行了保守基因的基本的生物信息学分析,选择了更为保守的基因片段并同时设立兼并碱基作为特异性扩增引物。笔者在设计引物的同时,严格控制退火温度之间的差距,尽量保持引物的Tm值相同或差距不大。通过对退火温度的优化,最终确定为55.7 ℃。本研究充分考虑扩增的目的条带能够在电泳图上被有效分开便于观察,各条带之间的差距大于70 bp。在2%的琼脂糖凝胶浓度时,可以观察到的图像最为清晰,引物之间没有形成二聚体结构,且有着较好的特异性、灵敏度和稳定性。证明本试验建立的五重PCR方法可用于临床病料的检测与诊断,为这5种病毒提供新的分子检测手段。
根据近几年国内的流行病学的调查资料显示,牛轮状病毒、牛冠状病毒和牛病毒性腹泻病毒是引起牦牛腹泻的3种病毒。有研究对2018年采自西藏林芝市波密县210份待检样品中分别检出BCoV的抗原阳性率为35.70%;BVDV抗体阳性率为78.60%[39]。对来源于2012年9—12月川西北阿坝州8县的1 070份牦牛血清行了抗体检测,结果显示,BVDV、BCoV和BRV抗体平均阳性率分别为44.3%、84.1%和94.4%[40]。研究结果表明这3种病毒在牦牛中普遍存在,需进一步加强该地区牦牛病毒性腹泻疾病的综合防制。对采自2017年1月—2018年7月的354个牦牛腹泻样品进行RT-PCR检测,BNeV的阳性率为22.0%[41]。此次检测结果证实牛诺瓦病毒也可造成牦牛的感染。由于以上5种病毒均可引起牦牛的肠道的炎症、腹泻、脱水等临床病理表现且常常发生混合感染,大大增加了临床诊断和病情监测的难度。
在与单一PCR进行比较的样本中,并没有检测出BRV和BNoV,其原因可能是宿主种类、地域或是管理差异带来的结果,且可能病毒在不同种类牛上的遗传演变存在着一定差异。对2019年6月—2020年8月采自于阿坝州的220份牦牛样品的检测结果显示,BRV依然是引起牦牛腹泻的主要病毒,在红原县和若尔盖县的腹泻样本中都有较高的检出率,检出率达到40.5%,说明还需要进一步加强监控轮状病毒的流行趋势,此外BNoV的阳性检出率为5.9%、BNeV的阳性检出率为4.5%。关于这两种新发病毒的检出情况还是要加强监测,由于嵌杯病毒科的靶基因RdRp基因不是很稳定,时有发生点突变,导致其检出率下降。所以应加强对BNoV和BNeV两种病毒的实时监控,即时的建立新的检测方法来做好进一步的防治措施。此次检测结果中并没有BCoV和BVDV两种病毒的检出,笔者分析其原因可能由于疫苗的接种、饲养环境的改善和更良好的科学饲养方法导致,也可能存在着5对引物间的相互干扰,导致多重RT-PCR的灵敏性上还欠缺。在五重RT-PCR的检测结果中发现,牛的腹泻往往也因为两种及以上的病毒共同感染所致,两种病毒引起的混合感染的阳性检出率为5%,3种病毒混合感染的阳性检出率为0.5%。混合感染的病毒都为牛轮状病毒和杯状病毒,究其原因还有待进一步研究。病毒的混合感染可导致更严重的临床症状及病变,更有严重的情况被治疗后导致预后不良。运用此方法可以快速准确地进行鉴别诊断,临床治疗时可以对症下药,争取了宝贵的治疗时间,且可降低多方面的损失。
4 结论首次成功建立了可以同时检测牛A群轮状病毒(BRVA)、牛冠状病毒(BCoV)、牛病毒性腹泻病毒(BVDV)、牛诺瓦病毒(BNoV)和牛纽布病毒(BNeV)的多重RT-PCR方法,可以满足对临床样本的快速诊断。本方法可充分节省时间、人力和节约诊断成本。目前阿坝州部分地区牛场引进牛群中,BRV、BCoV和BVDV仍然是引起牦牛腹泻的主要病毒,BNoV和BNeV引起的腹泻更加值得关注,并且存在着混合感染的情况,检测结果可为当地的疫情防控和生产养殖提供重要参考。
| [1] |
CHO Y L, YOON K J. An overview of calf diarrhea-infectious etiology, diagnosis, and intervention[J]. J Vet Sci, 2014, 15(1): 1-17. DOI:10.4142/jvs.2014.15.1.1 |
| [2] |
MANUJA B K, PRASAD M, MANUJA A, et al. A novel genomic constellation (G10P[J]. Virus Res, 2008, 138(1-2): 36-42. DOI:10.1016/j.virusres.2008.08.006 |
| [3] |
BOILEAU M J, KAPIL S. Bovine coronavirus associated syndromes[J]. Vet Clin North Am Food Anim Pract, 2010, 26(1): 123-146. DOI:10.1016/j.cvfa.2009.10.003 |
| [4] |
RIDPATH J F, BOLIN S R, DUBOVI E J. Segregation of bovine viral diarrhea virus into genotypes[J]. Virology, 1994, 205(1): 66-74. DOI:10.1006/viro.1994.1620 |
| [5] |
GUO Z J, HE Q F, YUE H, et al. First detection of Nebovirus and Norovirus from cattle in China[J]. Arch Virol, 2018, 163(2): 475-478. DOI:10.1007/s00705-017-3616-6 |
| [6] |
GOMEZ D E, ARROYO L G, POLJAK Z, et al. Detection of bovine coronavirus in healthy and diarrheic dairy calves[J]. J Vet Intern Med, 2017, 31(6): 1884-1891. DOI:10.1111/jvim.14811 |
| [7] |
SMILEY J R, CHANG K O, HAYES J, et al. Characterization of an enteropathogenic bovine calicivirus representing a potentially new calicivirus genus[J]. J Virol, 2002, 76(20): 10089-10098. DOI:10.1128/JVI.76.20.10089-10098.2002 |
| [8] |
SEID U, DAWO F, TESFAYE A, et al. Isolation and characterization of coronavirus and rotavirus associated with calves in central part of Oromia, Ethiopia[J/OL]. Vet Med Int, 2020, doi: 10.1155/2020/8869970.
|
| [9] |
CASTELLS M, CAFFARENA R D, CASAUX M L, et al. Phylogenetic analyses of rotavirus A from cattle in Uruguay reveal the circulation of common and uncommon genotypes and suggest interspecies transmission[J]. Pathogens, 2020, 9(7): 570. DOI:10.3390/pathogens9070570 |
| [10] |
GOMEZ D E, WEESE J S. Viral enteritis in calves[J]. Can Vet J, 2017, 58(12): 1267-1274. |
| [11] |
KOMOTO S, TACHAROENMUANG R, GUNTAPONG R, et al. Reassortment of human and animal rotavirus gene segments in emerging DS-1-Like G1P[J]. PLoS One, 2016, 11(2): e0148416. DOI:10.1371/journal.pone.0148416 |
| [12] |
ZHU W, DONG J B, HAGA T, et al. Rapid and sensitive detection of bovine coronavirus and group a bovine rotavirus from fecal samples by using one-step duplex RT-PCR assay[J]. J Vet Med Sci, 2011, 73(4): 531-534. DOI:10.1292/jvms.10-0401 |
| [13] |
CLARK M A. Bovine coronavirus[J]. Br Vet J, 1993, 149(1): 51-70. DOI:10.1016/S0007-1935(05)80210-6 |
| [14] |
姚火春, 杜念兴, 徐为燕, 等. 牛冠状病毒的血清流行病学调查[J]. 南京农业大学学报, 1990, 13(2): 117-121. YAO H C, DU N X, XU W Y, et al. Seroepizootiological survey of bovine coronavirus in cattle, human and other animals[J]. Journal of Nanjing Agricultural University, 1990, 13(2): 117-121. (in Chinese) |
| [15] |
COLLETT M S, LARSON R, BELZER S K, et al. Proteins encoded by bovine viral diarrhea virus: The genomic organization of a pestivirus[J]. Virology, 1988, 165(1): 200-208. DOI:10.1016/0042-6822(88)90673-3 |
| [16] |
BAKER J C. The clinical manifestations of bovine viral diarrhea infection[J]. Vet Clin North Am Food Anim Pract, 1995, 11(3): 425-445. DOI:10.1016/S0749-0720(15)30460-6 |
| [17] |
GAO J F, LIU M Y, MENG X R, et al. Seroprevalence of bovine viral diarrhea infection in yaks (Bos grunniens) on the Qinghai-Tibetan Plateau of China[J]. Trop Anim Health Prod, 2013, 45(3): 791-793. DOI:10.1007/s11250-012-0290-2 |
| [18] |
DENG M L, JI S K, FEI W T, et al. Prevalence study and genetic typing of bovine viral diarrhea virus (BVDV) in four bovine species in China[J]. PLoS One, 2015, 10(4): e0121718. DOI:10.1371/journal.pone.0121718 |
| [19] |
TURAN T, IŞIDAN H, ATASOY M O, et al. Detection and molecular analysis of bovine enteric norovirus and nebovirus in Turkey[J]. J Vet Res, 2018, 62(2): 129-135. DOI:10.2478/jvetres-2018-0021 |
| [20] |
DI FELICE E, MAUROY A, POZZO F D, et al. Bovine noroviruses: A missing component of calf diarrhoea diagnosis[J]. Vet J, 2016, 207: 53-62. DOI:10.1016/j.tvjl.2015.10.026 |
| [21] |
MAUROY A, SCIPIONI A, MATHIJS E, et al. Epidemiological study of bovine norovirus infection by RT-PCR and a VLP-based antibody ELISA[J]. Vet Microbiol, 2009, 137(3-4): 243-251. DOI:10.1016/j.vetmic.2009.01.031 |
| [22] |
CANDIDO M, ALENCAR A L F, ALMEIDA-QUEIROZ S R, et al. First detection and molecular characterization of Nebovirus in Brazil[J]. Epidemiol Infect, 2016, 144(9): 1876-1878. DOI:10.1017/S0950268816000029 |
| [23] |
OLIVER S L, ASOBAYIRE E, DASTJERDI A M, et al. Genomic characterization of the unclassified bovine enteric virus Newbury agent-1 (Newbury1) endorses a new genus in the family Caliciviridae[J]. Virology, 2006, 350(1): 240-250. DOI:10.1016/j.virol.2006.02.027 |
| [24] |
郭紫晶, 何琪富, 岳华, 等. 引起犊牛腹泻的Nebovirus[J]. 畜牧兽医学报, 2020, 51(3): 433-442. GUO Z J, HE Q F, YUE H, et al. Nebovirus: a diarrhea-causing virus in calves[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(3): 433-442. (in Chinese) |
| [25] |
张亮, 张云飞, 蒋仁新, 等. 2017-2018年山东省奶牛场犊牛腹泻相关病毒病原学检测[J]. 中国动物检疫, 2020, 37(6): 16-20. ZHANG L, ZHANG Y F, JIANG R X, et al. Pathogenic detection of viruses related to calf diarrhea in dairy farms in Shandong province during 2017 to 2018[J]. China Animal Health Inspection, 2020, 37(6): 16-20. (in Chinese) |
| [26] |
傅彩霞, 靳兴军, 郑瑞峰, 等. 北京地区规模化奶牛场三种病毒性腹泻病的血清学调查[J]. 动物医学进展, 2012, 33(5): 85-88. FU C X, JIN X J, ZHENG R F, et al. Serological survey of three viral diarrheal diseases in Beijing large-scale dairy cow farms[J]. Progress in Veterinary Medicine, 2012, 33(5): 85-88. DOI:10.3969/j.issn.1007-5038.2012.05.020 (in Chinese) |
| [27] |
王玥琳, 郭紫晶, 岳华, 等. 部分地区奶牛腹泻粪便样中诺如病毒的检测和演化分析[J]. 畜牧兽医学报, 2019, 50(5): 1048-1055. WANG Y L, GUO Z J, YUE H, et al. Detection and evolutionary analysis of bovine Noroviruses in diarrheic fecals of dairy calves in some areas[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(5): 1048-1055. (in Chinese) |
| [28] |
郭紫晶, 何琪富, 汤承, 等. 检测纽布病毒的Real-time RT-PCR方法的建立与应用[J]. 畜牧兽医学报, 2019, 50(4): 893-900. GUO Z J, HE Q F, TANG C, et al. Establishment and application of a real-time RT-PCR assay for detecting bovine Nebovirus[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(4): 893-900. (in Chinese) |
| [29] |
MACKAY I M. Real-time PCR in the microbiology laboratory[J]. Clin Microbiol Infect, 2004, 10(3): 190-212. DOI:10.1111/j.1198-743X.2004.00722.x |
| [30] |
BASERA S S, SINGH R, VAID N, et al. Detection of rotavirus infection in bovine calves by RNA-PAGE and RT-PCR[J]. Indian J Virol, 2010, 21(2): 144-147. DOI:10.1007/s13337-010-0017-9 |
| [31] |
MONTEIRO F L, CARGNELUTTI J F, MARTINS B, et al. Detection of bovine pestiviruses in sera of beef calves by a RT-PCR based on a newly designed set of pan-bovine pestivirus primers[J]. J Vet Diagn Invest, 2019, 31(2): 255-258. DOI:10.1177/1040638719826299 |
| [32] |
师志海, 王文佳, 兰亚莉, 等. 牛诺如病毒实时荧光定量PCR检测方法的建立及应用[J]. 畜牧兽医学报, 2020, 51(7): 1728-1736. SHI Z H, WANG W J, LAN Y L, et al. Establishment and application of a real-time PCR assay for detecting bovine Norovirus[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(7): 1728-1736. (in Chinese) |
| [33] |
王文佳, 师志海, 兰亚莉, 等. 牛诺如病毒和冠状病毒双重PCR检测方法的建立及初步应用[J]. 动物医学进展, 2019, 40(10): 6-9. WANG W J, SHI Z H, LAN Y L, et al. Establishment and preliminary application of a duplex PCR for detection of bovine Norovirus and bovine coronavirus[J]. Progress in Veterinary Medicine, 2019, 40(10): 6-9. DOI:10.3969/j.issn.1007-5038.2019.10.002 (in Chinese) |
| [34] |
林初文, 沈志强. BVDV、BCV和BRV三重RT-PCR检测方法的建立及应用[J]. 畜牧与兽医, 2013, 45(7): 61-64. LIN C W, SHEN Z Q. Establishment and application of triple RT-PCR detection methods for BVDV, BCV and BRV[J]. Animal Husbandry & Veterinary Medicine, 2013, 45(7): 61-64. (in Chinese) |
| [35] |
何琪富, 郭紫晶, 李然, 等. 牛冠状病毒RT-PCR检测方法的建立及应用[J]. 畜牧兽医学报, 2018, 49(10): 2292-2298. HE Q F, GUO Z J, LI R, et al. Establishment and application of a RT-PCR assay for detecting bovine coronavirus[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(10): 2292-2298. DOI:10.11843/j.issn.0366-6964.2018.10.026 (in Chinese) |
| [36] |
MARKOULATOS P, SIAFAKAS N, MONCANY M. Multiplex polymerase chain reaction: A practical approach[J]. J Clin Lab Anal, 2002, 16(1): 47-51. DOI:10.1002/jcla.2058 |
| [37] |
王玥琳. 牛诺瓦病毒的分子检测和基因组研究[D]. 成都: 西南民族大学, 2020. WANG Y L. Molecular detection and genomic research of bovine Norovirus[D]. Chengdu: Southwest Minzu University, 2020. (in Chinese) |
| [38] |
周芳, 岳华, 张斌, 等. 牦牛轮状病毒VP6基因序列分析及RT-PCR检测方法的建立与应用[J]. 畜牧兽医学报, 2016, 47(7): 1465-1473. ZHOU F, YUE H, ZHANG B, et al. Establishment and application of an RT-PCR assay for yak rotavirus based on the sequence analysis of yak rotavirus VP6 gene[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(7): 1465-1473. (in Chinese) |
| [39] |
赵霞玲, 牛家强, 次仁央金, 等. 牦牛腹泻病毒BVDV、BCV、BRV流行病学调查[J]. 高原农业, 2020, 4(3): 298-302. ZHAO X L, NIU J Q, CIREN Y J, et al. Epidemiological survey of yak diarrhea virus BVDV, BCV and BRV[J]. Journal of Plateau Agriculture, 2020, 4(3): 298-302. (in Chinese) |
| [40] |
何美琳, 张焕容, 王永, 等. 川西北牦牛3种病毒性腹泻病血清学调查[J]. 中国畜牧兽医, 2014, 41(3): 248-251. HE M L, ZHANG H R, WANG Y, et al. Serological survey on three viral diarrhea diseases of yaks in Northwest Sichuan province[J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(3): 248-251. (in Chinese) |
| [41] |
GUO Z J, HE Q F, ZHANG B, et al. First detection of neboviruses in yak (Bos grunniens) and identification of a novel neboviruses based on complete genome[J]. Vet Microbiol, 2019, 236: 108388. DOI:10.1016/j.vetmic.2019.108388 |
(编辑 白永平)



