2. 贵州大学动物科学学院,贵阳 550025
2. College of Animal Science, Guizhou University, Guiyang 550025, China
N-乙酰-L-半胱氨酸(N-acetyl-L-cysteine, NAC)是左旋精氨酸的天然衍生物,作为一种常见的小分子抗氧化剂,NAC易进入动物机体进行细胞代谢,可在体内脱去乙酰基生成半胱氨酸,最终合成谷胱甘肽,是机体生理代谢的重要物质。作为细胞内重要的保护剂,在降低机体细胞活性氧[1],抑制细胞自噬,维持细胞功能和细胞形态[2]等方面发挥重要作用。
Luo等[3]通过在日粮中添加0.07%NAC,发现对山羊妊娠初期胚胎的存活产生了有益的影响;杨震国等[4]研究发现,饲喂含NAC的日粮可缓解仔猪由LPS导致的免疫应激和能量的过度损耗,从而达到促生长的目的。同时,NAC可以减少白细胞在炎症组织中的浸润,改善炎症的病理特征,延缓体内形成的炎症信号[5],对提高罗非鱼的抗氧化能力、免疫能力和生长性能有显著的作用[6]。细胞层面的研究发现,培养猪卵巢颗粒细胞时添加100 μmol·L-1 NAC,对其前期贴壁生长以及细胞增殖活力都有所提升[7];同时,NAC在减弱毒素物质对细胞的损害[8]、增强动物机体免疫能力[9-10]以及抗氧化和抗纤维化[11]、改善抗营养因子对机体的不良影响[12]等方面也有不同程度的研究。可见,NAC在动物的繁殖、生长、免疫等方面都具有重要作用,具有较大的研究价值和前景。
本研究以山羊子宫内膜基质细胞(goat endometrial stromal cells, gESCs)为研究对象,在体外培养条件下给予不同浓度的NAC刺激,从细胞增殖、细胞ROS变化以及功能基因转录水平的变化方面探究NAC添加对gESCs的影响,筛选、优化适宜gESCs体外研究的培养体系,为研究NAC影响山羊繁殖机能的相关分子调控机制提供理论基础。
1 材料与方法 1.1 试验动物及样品的处理试验动物来自贵阳市山羊屠宰场,选取体况良好、无疾病的贵州黑山羊母羊,屠宰时严格按照贵州地方标准《羊屠宰操作规程》(DB22/T 2740-2017)进行,母羊屠宰后立即将其子宫组织用灭菌铝制剪刀剥离,并先后使用75%消毒酒精、生理盐水、无菌PBS(1×)反复冲洗3遍以简单去除细菌,处理后将其置于预冷的无菌PBS(1×)中保存,并于1 h内运回实验室进行细胞原代分离、培养。
1.2 主要仪器与试剂细胞培养箱(SERIES Ⅱ WATER JACKET)、酶标仪(PMT 49984)、正置荧光显微镜(RH-107C)、超微量紫外分光光度计(Mano Drop 2000, 美国)购自美国Thermo公司。细胞爬片、DMEM/F-12细胞培养基、CCK-8试剂、逆转录试剂盒、活性氧检测试剂盒(Reactive oxygen species assay kit)、N-乙酰半胱氨酸粉末、Ⅳ型胶原酶、TRIzol®Reagent试剂、DAPI试剂购自西宝生物科技有限公司(贵州);波形蛋白抗体购自博奥森生物技术有限公司(北京)。
1.2 试验方法1.2.1 山羊原代子宫内膜基质细胞的分离培养 将采集来的母羊子宫组织置于紫外消杀后的超净工作台内进行分离。首先,将子宫组织沿着中线剖开,用剪刀剔除附着的脂肪组织后,再用无菌PBS液漂洗多次,至组织样表面泛白,将其转移至新的培养皿中,用剪刀剪碎成糜烂状后转移至50 mL灭菌离心管内加入适量Ⅳ型胶原酶进行37 ℃、3 h封口消化,每20 min轻微摇晃1次,将消化后的悬液体进行200目的细胞筛过滤,收集的滤液于1 500 r·min-1离心10 min,除去上清,再加入10 mL细胞完全培养基进行600 r·min-1离心5 min,取上清8 mL于细胞培养瓶中进行培养,待细胞初次贴壁时进行换液,之后每2 d对细胞进行1次换液。待山羊子宫内膜基质细胞贴壁生长汇合至95%左右时,胰酶消化进行细胞的传代培养试验。
1.2.2 山羊原代子宫内膜基质细胞的鉴定 采用间接免疫荧光法对山羊子宫内膜基质细胞进行鉴定,参考文献[13]。依据子宫内膜基质细胞表面的波形蛋白受体,用相应抗体对其进行间接染色。将原代细胞经0.25%胰蛋白酶消化后分别置于2个细胞鉴定培养皿中继续培养,待其汇合至培养皿的70%时,弃去培养基并用PBS(1×)进行洗涤、4%多聚甲醛固定1.5 h、5% BSA封闭、加入波形蛋白抗体过夜孵育(16 ℃),孵育后回收一抗,依次加入二抗、SABC-Cy3、DAPI进行孵育,孵育后用PBS(1×)反复洗涤细胞,在避光条件下用倒置荧光显微镜观察细胞。
1.2.3 NAC浓度梯度的添加及配置 精确称取0.163 2 g N-乙酰半胱氨酸粉末于100 mL容量瓶中,用DMEM/F-12细胞完全培养基逐步定容至100 mL,即得到浓度为10 mmol·L-1的NAC细胞培养基,再用10 mmol·L-1的培养基依次稀释成100、200、400 μmol·L-1的梯度NAC培养基,4 ℃避光保存备用。分别用NAC浓度梯度培养基培养细胞。
1.2.4 实时荧光定量PCR引物的设计与合成 用Primer Premier 5.0软件设计细胞周期及增殖相关基因CyclinA1(登录号:XM_0180 56659.1)、CyclinD2(登录号:XM_005680985.3)、CyclinE(登录号:XM_018062248.1)、PCNA(登录号:XM_005688167.3)以及山羊繁殖性状相关基因TGF-β1 (登录号:NM_001314142.1)、TGF-β3(登录号:XM_005686141.3)的实时荧光定量PCR引物并交由生工生物工程技术(上海)股份有限公司合成引物,其中β-actin为内参基因,引物序列详见表 1。
|
|
表 1 实时荧光定量引物详情 Table 1 Real-time PCR primer details |
1.2.5 山羊子宫内膜基质细胞总RNA提取及cDNA合成 按照TRIzol®Reagent试剂说明书提取不同浓度NAC培养24 h后的山羊子宫内膜基质细胞总RNA,使用超微量分光光度测定仪测定组织总RNA浓度和纯度,观察光密度比值(D260 nm/D280 nm)以及图像是否合理,将峰图单一、曲线平滑、D260 nm/D280 nm比值在1.8~2.0区间内的组织总RNA于-80 ℃冰箱中保存,用于后续逆转录试验。
1.3.6 cDNA第一链的合成 采用GenStar的StarScript Ⅱ First-strand cDNA试剂盒将提取的组织总RNA逆转录合成cDNA第一链。逆转录体系为20 μL,其中包括RNA模板1 μL、50 μmol·L-1、Oligo (dT) Primer 1 μL、DEPC-ddH2O 7 μL、2× Reaction mix 10 μL、StarScript Ⅱ RT mix 1 μL。PCR反应条件为42 ℃孵育30~50 min,85 ℃孵育5 min,产物标记后于-20 ℃冰箱保存备用。
1.2.7 实时荧光定量PCR法测定相关因子的表达水平 逆转录结束后,以cDNA第一链为模板结合相关引物进行实时荧光定量PCR反应,反应预混液体系为20 μL,其中上、下游引物(10 μmoL·L-1) 各0.6 μL,cDNA模板1 μL,2× RealStar Green Fast Mixture 10 μL,ddH2O补充至20 μL,反应程序为95 ℃ 2 min、在40个循环下进行95 ℃ 15 s、退火(各基因最佳退火温度见表 1)30 s、72 ℃ 30 s,之后添加机器自带的熔解曲线分析以获取扩增曲线和熔解曲线。反应设置3个生物性与技术性重复并设置不加cDNA模板的阴性对照。反应结束后使用2-ΔΔCt使用计算相对表达水平。
1.2.8 CCK-8法测定NAC对细胞增殖活力的影响 利用CCK-8细胞增殖检测试剂盒对不同浓度梯度NAC培养的山羊子宫内膜基质细胞在不同时间段进行增殖检测。将山羊子宫内膜基质细胞接种在96孔板内,5×103个·孔-1,每孔重复6次,37 ℃,5% CO2培养24 h,吸除原有培养基,更换100、200、400 μmol·L-1 NAC培养基分别培养12、24、48、72 h,每孔加入10 μL的CCK-8,细胞培养箱中孵育3 h后分别测定进行450 nm处的吸光值。
1.2.9 NAC对细胞内活性氧含量变化的影响 用无菌1×PBS缓冲液按照1∶1 000比例将DCFH-DA探针原液进行稀释备用,待NAC刺激细胞24 h后用PBS洗涤细胞2~3次,避光条件下加入稀释好的DCFH-DA探针,放置细胞培养箱孵育20 min,洗去未进入细胞的探针,放置在荧光显微镜下观察并拍照,采用Image J对图片荧光平均强度进行计算分析。
1.3 数据统计与分析试验数据表示为“平均值±标准误”,使用SPSS19.0软件包进行单因素方差分析(one-way ANOVA)与多重比较分析。两组之间比较使用独立样本T检验,分别以P<0.01、P<0.05为差异极显著或显著。
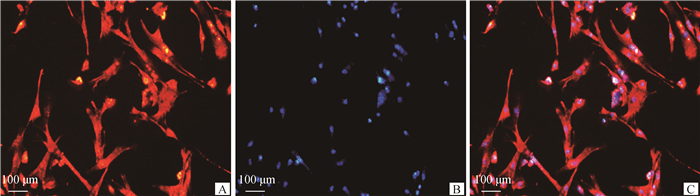
2 结果 2.1 山羊子宫内膜基质细胞的鉴定间接免疫荧光鉴定山羊子宫内膜基质细胞结果如图 1所示,波形蛋白(Vimentin)抗体与细胞质发生特异性结合,Vimentin特异性受体标记阳性细胞呈红色(图 1A),所有细胞核在DAPI的染色下呈蓝色(图 1B),且A和B能完全重合(图 1C),表明分离得到的山羊子宫内膜基质细胞纯度为100%。
|
A.Vimentin特异性受体标的记阳性细胞;B. DAPI核染;C. Merge图 A. Vimentin specific receptor labeled positive cells; B. DAPI nuclear staining; C. Merge diagram 图 1 山羊子宫内膜基质细胞的鉴定 Fig. 1 Identification of gESCs |
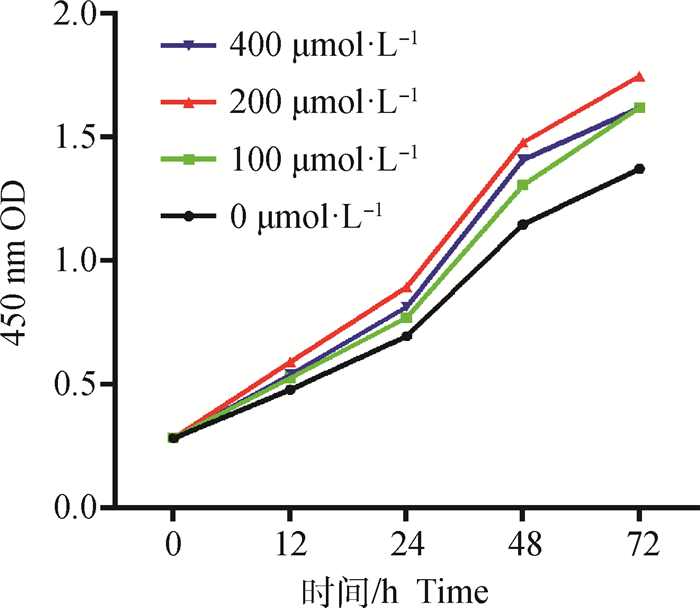
结果显示:不同浓度NAC添加对山羊子宫内膜基质细胞的体外培养有不同程度的促增殖作用,其中以200 μmol·L-1的NAC浓度促增殖作用最为显著,见图 2。
|
图 2 不同浓度NAC对山羊子宫内膜基质细胞增殖的影响 Fig. 2 The effect of different concentrations of NAC on the proliferation of gESCs |
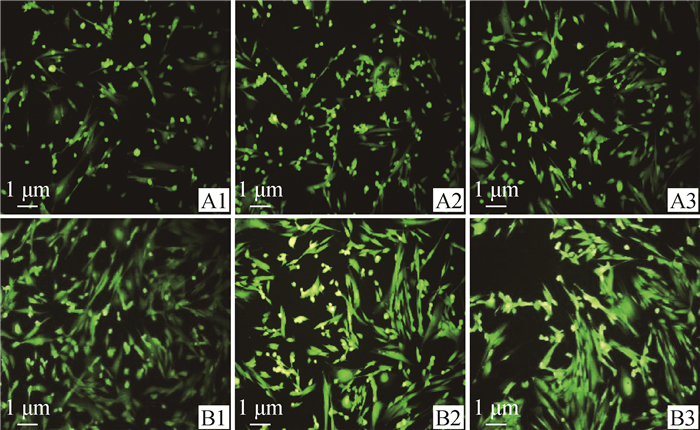
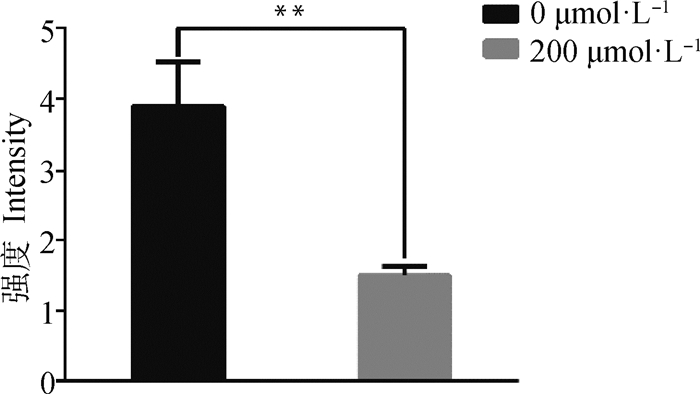
利用DCFH-DA荧光探针活性氧检测试剂盒对NAC刺激培养24 h后的山羊子宫内膜基质细胞进行活性氧的测定,结果如图 3所示,荧光显微镜观察发现:200 μmol·L-1 NAC组的活性氧荧光强度与空白组存在明显差异,通过Image J软件分析计算两组间的平均荧光强度Mean值及标准差所知,NAC刺激后的细胞荧光强度极显著低于空白对照组的细胞荧光强度(P<0.01,图 4),推测添加NAC能够降低细胞活性氧的含量,从而延缓细胞衰老。
|
A1、A2、A3和B1、B2、B3分别表示空白组和200 μmol·L-1组的3个重复 A1, A2, A3 and B1, B2, B3 represent three replicates of the blank group and 200 μmol·L-1 group, respectively 图 3 显微镜下观察山羊子宫内膜基质细胞ROS变化 Fig. 3 Observation of ROS changes in gESCs under microscope |
|
图 4 山羊子宫内膜基质细胞ROS荧光强度变化 Fig. 4 Changes in ROS fluorescence intensity of gESCs |
PCR法对相应的荧光引物进行扩增验证,结果如图 5:扩增的条带均与预测片段大小一致,证明各基因荧光定量引物特异性良好,可用于下一步荧光定量试验。
|
M表示DL2000 marker, 1~3表示PCR产物大小 M means DL2000 marker, 1-3 means PCR product size 图 5 NAC对山羊子宫内膜基质细胞Cyclin A1(A)、Cyclin D2(B)、CyclinE(C)、PCNA(D)表达的影响 Fig. 5 Effect of NAC on the expression of Cyclin A1(A), Cyclin D2(B), CyclinE(C), PCNA(D) genes in gESCs |
RT-qPCR检测结果如图所示:200 μmol·L-1 NAC添加培养的山羊子宫内膜基质细胞能够极显著提高细胞周期相关因子Cyclin A1(图 6A)和Cyclin E(图 6C)基因的表达(P<0.01),并极显著降低Cyclin D2(图 6B)基因的表达(P<0.01);同时极显著提高了增殖相关因子PCNA(图 6D)的mRNA表达水平(P<0.01)。
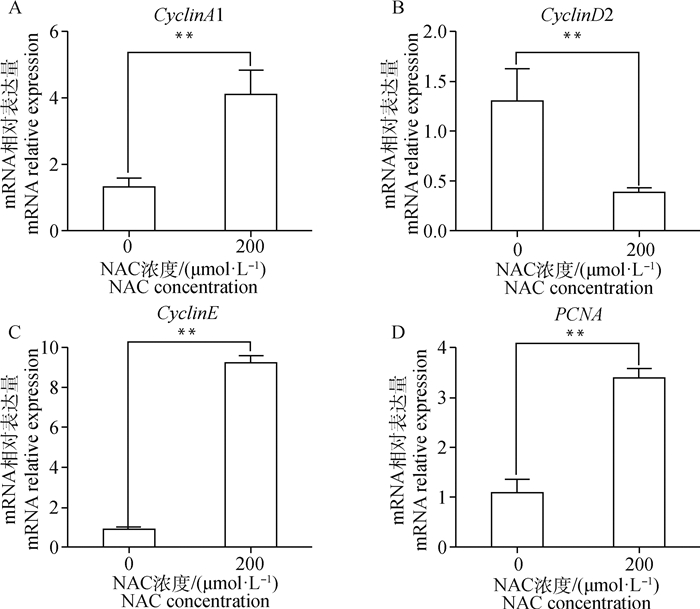
|
图 6 山羊子宫内膜基质细胞周期、增殖因子mRNA表达水平 Fig. 6 The mRNA expression levels of cell cycle and proliferation-related factors in gESCs |
PCR法对相应的荧光引物进行扩增验证,结果如图 7:扩增的条带均与预测片段大小一致,证明各基因荧光定量引物特异性良好,可用于下一步荧光定量试验。
|
M表示DL2000 marker, 1~2表示PCR产物大小 M means DL2000 marker, 1-2 means PCR product size 图 7 NAC对山羊子宫内膜基质细胞TGF-β1(A)、TGF-β3(B)基因mRNA表达的影响 Fig. 7 Effect of NAC on mRNA expression of TGF-β1(A) and TGF-β3(B) genes in gESCs |
由图 8可知,200 μmol·L-1的NAC添加较空白组极显著降低了山羊子宫内膜基质细胞中TGF-β1基因的表达(P<0.01);显著降低了TGF-β3基因的mRNA表达(P<0.05)。
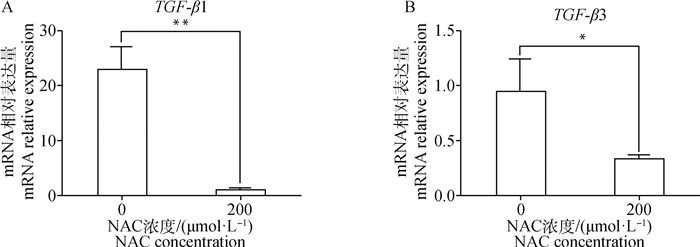
|
图 8 山羊子宫内膜基质细胞TGF-β1、TGF-β3基因表达谱分析结果 Fig. 8 Analysis results of gene expression profile of TGF-β1, TGF-β3 in gESCs |
子宫作为雌性动物孕育新生命的场所,在物种繁衍中具有重要的功能[14]。其分子调控是影响母体妊娠早期功能性胚泡附植、发育及体内胎儿正常生长的重要因素,当出现异常的调控或受到外界不良因素的刺激时,会造成胎儿发育不良、发育迟缓、流产等诸多问题,因此,对子宫的分子调控机制研究必不可少[15]。子宫内膜基质细胞是子宫固有膜上一类星形的细胞,在对母体子宫内进行胚胎附植以及正常妊娠等生理过程都发挥了积极的作用[16]。本研究通过间接免疫荧光技术证实山羊子宫内膜基质细胞培养成功,为进一步探究其功能奠定基础。NAC作为一类抗氧化的物质,可通过促进还原型谷胱甘肽(GSH)生物合成,清除ROS而达到抗氧化、抗炎症的功能[17]。研究发现,NAC对PM2.5介导的人支气管上皮细胞的凋亡和自噬有明显的抑制作用,从而减少细胞的损伤,证明了NAC在细胞层面积极的作用[18]。本研究发现,在培养基中添加不同浓度的NAC对山羊子宫内膜基质细胞的增殖均具有促进作用,这证实了NAC在细胞层面的积极作用。
为进一步探究NAC对山羊子宫内膜基质细胞的影响机制,本研究发现,NAC刺激细胞后,促进了细胞中PCNA、CyclinA1、CyclinE基因的表达,抑制了CyclinD2基因的表达,细胞核抗原PCNA作为细胞增殖标记物,对细胞的增殖水平起正向调控[19];而Cyclin A1、CyclinE、CyclinD2均为细胞内细胞周期蛋白因子,对细胞的生物学行为具有重要调控作用[20],而NAC刺激能改变这些因子的表达, 提示NAC可能通过调控细胞因子的表达水平来调控细胞的增殖。此外,本试验还发现NAC可以降低细胞中的活性氧浓度,从而达到延缓细胞衰老的作用,同时验证了本研究中NAC促进细胞增殖的作用,活性氧在机体内承担着第二信使的功能,在体内的信号传导和内分泌系统的调控下,ROS与脂质、蛋白质和核酸等分子发生化学反应引起多种生理变化,调控细胞内外氧化还原平衡相关的基因表达,进而调节细胞功能[21]。有研究表明,NAC可减轻LPS诱导的感染性休克小鼠肺损伤的严重程度,使肺组织中抗氧化酶水平升高,而氧化应激产物和炎症介质水平降低[22]。NAC能够抑制IL-1β诱导的氧化应激介导的软骨细胞基质降解,同时对骨关节炎具有潜在的治疗价值[23]。日粮NAC可以改善中华绒螯蟹的生长性能和存活率,0.1%NAC可以有效减轻由T-2毒素诱导的氧化应激,免疫抑制和细胞凋亡[24]。对山羊卵泡颗粒细胞的研究发现,NAC的添加可显著抵制由甲氧氯诱导的颗粒细胞凋亡引起的DNA损伤的增加,通过降低细胞ROS产生信号转导途径,从而防止甲氧氯诱导的颗粒细胞凋亡和卵泡闭锁[25-26]。这些研究均证实,NAC对细胞生物学行为的促进作用,与本研究发现NAC对山羊子宫内膜基质细胞中的积极作用相符。
转化生长因子β(transforming growth factor β,TGFβ)是一种分泌性、炎症性细胞因子,存在于细胞过程(包括增殖,分化,迁移和存活)以及生理过程(包括胚胎发育,血管生成和伤口愈合),此外,还可通过激活多个细胞内途径而调控细胞的分化、增殖过程,在组织动态平衡中起着至关重要的作用[27]。TGF-β1是TGFβs其中一个亚型,可参与调节生物体内多种生物学功能,研究表明,TGF-β1异常表达可引起机体的疾病的发生,并能够将细胞阻滞在G0/G1期[28]。TGF-β3同样具有广泛的生物学效应,TGF-β3对生殖系统的调控机制是目前研究的前沿与热点,刘彧等[29]研究发现,高浓度TGF-β3因子可以促进黑色素细胞突起形成,引起黑色素细胞形态学的变化。生殖方面,热应激导致猪睾丸TGF-β3表达升高,下调血睾屏障紧密连接蛋白Claudin-11的表达,导致正常的精子发生受阻,进而影响精子发生和精液品质[30]。为研究NAC对山羊繁殖性能的影响,本试验发现,NAC刺激细胞后,子宫内膜基质细胞中TGF-β1、TGF-β3基因的表达水平显著降低,说明NAC可能通过调控细胞中TGF-β1、TGF-β3基因的表达而间接影响山羊的繁殖性能。
4 结论在体外培养条件下,200 μmol·L-1 NAC能够促进山羊子宫内膜基质细胞的增殖,降低细胞的活性氧,延缓细胞衰老,降低TGF-β1、TGF-β3基因的表达水平。
| [1] |
文艺, 杨强震, 李思思, 等. NAC抑制镉离子诱导的小鼠精子DLD酪氨酸磷酸化作用[J]. 上海交通大学学报: 农业科学版, 2019, 37(2): 37-46. WEN Y, YANG Q Z, LI S S, et al. N-acetyl-L-cysteine inhibits tyrosine phosphorylation of dihydrolipoamide dehydrogenase induced by cadmium in mouse spermatozoa[J]. Journal of Shanghai Jiaotong University: Agricultural Science, 2019, 37(2): 37-46. DOI:10.3969/J.ISSN.1671-9964.2019.02.007 (in Chinese) |
| [2] |
钱韦昊, 李绍波, 路会侠. N-乙酰-L-半胱氨酸对子宫内膜异位症自噬及活性氧的影响[J]. 中国临床药理学杂志, 2019, 35(18): 2125-2127. QIAN W H, LI S B, LU H X. Effect of N-acetyl-L-cysteine on autophagy and reactive oxygen species in endometriosis[J]. The Chinese Journal of Clinical Pharmacology, 2019, 35(18): 2125-2127. (in Chinese) |
| [3] |
LUO J H, AO Z, DUAN Z Q, et al. Effects of N-acetylcysteine on the reproductive performance, oxidative stress and RNA sequencing of Nubian goats[J]. Vet Med Sci, 2021, 7(1): 156-163. DOI:10.1002/vms3.338 |
| [4] |
杨震国, 张伟, 侯永清, 等. N-乙酰半胱氨酸对脂多糖刺激仔猪免疫应激和能量状况的影响[J]. 畜牧兽医学报, 2012, 43(4): 564-571. YANG Z G, ZHANG W, HOU Y Q, et al. Effects of N-acetylcysteine on immunological stress and energy status of piglets chronically challenged with lipopolysaccharide[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(4): 564-571. (in Chinese) |
| [5] |
GAO X, LAMPRAKI E M, SARWAH A K, et al. N-acetylcysteine(NAC)ameliorates Epstein-Barr virus latent membrane protein 1 induced chronic inflammation[J]. PLoS One, 2017, 12(12): e0189167. DOI:10.1371/journal.pone.0189167 |
| [6] |
XIE S W, ZHOU W W, TIAN L X, et al. Effect of N-acetylcysteine and glycine supplementation on growth performance, glutathione synthesis, anti-oxidative and immune ability of Nile tilapia, Oreochromis niloticus[J]. Fish Shellfish Immunol, 2016, 55: 233-241. DOI:10.1016/j.fsi.2016.05.033 |
| [7] |
郭晓飞, 张金龙, 李义海, 等. 添加N-乙酰半胱氨酸对猪卵巢颗粒细胞体外培养的影响[J]. 黑龙江畜牧兽医, 2020(12): 59-62. GUO X F, ZHANG J L, LI Y H, et al. Effects of N-acetylcysteine on porcine ovarian granulosa cell culture in vitro[J]. Heilongjiang Animal Science and Veterinary Medicine, 2020(12): 59-62. (in Chinese) |
| [8] |
BHARDWAJ J K, SARAF P, KUMARI P, et al. N-Acetyl-cysteine mediated inhibition of spermatogonial cells apoptosis against malathion exposure in testicular tissue[J]. J Biochem Mol Toxicol, 2018, 32(4): e22046. DOI:10.1002/jbt.22046 |
| [9] |
ZAFARULLAH M, LI W Q, SYLVESTER J, et al. Molecular mechanisms of N-acetylcysteine actions[J]. Cell Mol Life Sci, 60(1): 6-20. DOI:10.1007/s000180300001 |
| [10] |
周冬梅, 孔灵菲. N-乙酰半胱氨酸对哮喘小鼠气道上皮细胞自噬水平的影响[J]. 中国医科大学学报, 2018, 47(7): 626-630. ZHOU D M, KONG L F. Effect of N-acetylcysteine on autophagy in airway epithelial cells in asthmatic mice[J]. Journal of China Medical University, 2018, 47(7): 626-630. (in Chinese) |
| [11] |
MA M, WU C J, ZHANG P, et al. N-acetylcysteine maintains penile length and erectile function in bilateral cavernous nerve crush rat model by reducing penile fibrosis[J]. Asian J Androl, 2021, 23(2): 215-221. DOI:10.4103/aja.aja_17_20 |
| [12] |
WANG C L, PAN J Y, WANG X D, et al. N-acetylcysteine provides protection against the toxicity of dietary T-2 toxin in juvenile Chinese mitten crab (Eriocheir sinensis)[J]. Aquaculture, 2021, 538: 736531. DOI:10.1016/j.aquaculture.2021.736531 |
| [13] |
韦仕南. NCG对山羊妊娠前期受胎率的影响及机制研究[D]. 贵阳: 贵州大学, 2020. WEI S N. Study on the effect and mechanism of NCG on the pregnancy rate of goats[D]. Guiyang: Guizhou University, 2020. (in Chinese) |
| [14] |
盛宏霞, 吴庆侠, 靳亚平, 等. 山羊子宫内膜基质细胞永生化研究[J]. 畜牧兽医学报, 2009, 40(6): 818-823. SHENG H X, WU Q X, JIN Y P, et al. Immortalization of goat endometrial stromal cells by telomerase reverse transcriptase transfection[J]. Acta Veterinaria et Zootechnica Sinicae, 2009, 40(6): 818-823. DOI:10.3321/j.issn:0366-6964.2009.06.006 (in Chinese) |
| [15] |
赵乐, 杨海丽, 李佳璐, 等. TETs与细胞程序性死亡相关基因在山羊妊娠早期输卵管及子宫角的表达[J]. 中国农业科学, 2021, 54(4): 845-854. ZHAO L, YANG H L, LI J L, et al. Expression patterns of TETs and programmed cell death related genes in oviduct and uterus of early pregnancy goats[J]. Scientia Agricultura Sinica, 2021, 54(4): 845-854. (in Chinese) |
| [16] |
王宗捷, 张瑞雪, 刘守勤, 等. 玉米赤霉烯酮诱导山羊子宫内膜基质细胞凋亡的研究[J]. 畜牧兽医学报, 2021, 52(2): 535-542. WANG Z J, ZHANG R X, LIU S Q, et al. The apoptotic effect of zearalenone on goat endometrial stromal cells[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(2): 535-542. (in Chinese) |
| [17] |
JARIYAMANA N, CHUVEERA P, DEWI A, et al. Effects of N-acetyl cysteine on mitochondrial ROS, mitochondrial dynamics, and inflammation on lipopolysaccharide-treated human apical papilla cells[J]. Clin Oral Invest, 2021, 25(6): 3919-3928. DOI:10.1007/s00784-020-03721-7 |
| [18] |
郭淼, 闫鹏, 韩国鑫, 等. N-乙酰半胱氨酸对PM2.5致支气管上皮细胞损伤的保护作用体外实验[J]. 解放军医学院学报, 2021, 42(1): 99-103. GUO M, YAN P, HAN G X, et al. Protective effect of N-acetylcysteine on PM2.5-induced injury of bronchial epithelial cells in vitro[J]. Academic Journal of Chinese PLA Medical School, 2021, 42(1): 99-103. DOI:10.3969/j.issn.2095-5227.2021.01.021 (in Chinese) |
| [19] |
STRZALKA W, ZIEMIENOWICZ A. Proliferating cell nuclear antigen (PCNA): a key factor in DNA replication and cell cycle regulation[J]. Ann Bot, 2011, 107(7): 1127-1140. DOI:10.1093/aob/mcq243 |
| [20] |
周志楠, 陈祥, 张艳, 等. CTSD对黔北麻羊卵泡颗粒细胞的调控机制及功能分析[J]. 畜牧兽医学报, 2021, 52(5): 1278-1292. ZHOU Z N, CHEN X, ZHANG Y, et al. Regulatory mechanism and functional analysis of CTSD on follicular granulosa cells of Qianbei ma goat[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(5): 1278-1292. (in Chinese) |
| [21] |
张祥, 李向南, 刘瑞花, 等. AAPH引起小鼠早期胚胎发育阻滞中线粒体相关机能研究[J]. 农业生物技术学报, 2017, 25(1): 11-20. ZHANG X, LI X N, LIU R H, et al. Study on the role of AAPH in the mitochondria related functions of early embryonic development block in mice (Mus musculus)[J]. Journal of Agricultural Biotechnology, 2017, 25(1): 11-20. (in Chinese) |
| [22] |
黄晓军, 陈茜圆, 任卓超, 等. N-乙酰半胱氨酸对感染性休克小鼠肺损伤保护作用的研究[J]. 浙江医学, 2021, 43(3): 260-262, 267. HUANG X J, CHEN X Y, REN Z C, et al. Protective effect of N-acetylcysteine on lung injury in septic shock mice[J]. Zhejiang Medicine, 2021, 43(3): 260-262, 267. (in Chinese) |
| [23] |
张卫华, 张建业, 叶恒, 等. N-乙酰半胱氨酸对软骨细胞基质降解和骨关节炎的作用研究[J]. 实用骨科杂志, 2021, 27(2): 137-142. ZHANG W H, ZHANG J Y, YE H, et al. Effect of N-acetylcysteine on chondrocyte matrix degradation and its effect on osteoarthritis[J]. Journal of Practical Orthopaedics, 2021, 27(2): 137-142. (in Chinese) |
| [24] |
WANG H Y, LI C C, PENG M, et al. N-acetylcysteine improves intestinal function and attenuates intestinal autophagy in piglets challenged with β-conglycinin[J]. Sci Rep, 2021, 11(1): 1261. DOI:10.1038/s41598-021-80994-2 |
| [25] |
BHARDWAJ J K, SARAF P. N-acetyl cysteine-mediated effective attenuation of methoxychlor-induced granulosa cell apoptosis by counteracting reactive oxygen species generation in caprine ovary[J]. Environ Toxicol, 2017, 32(1): 156-166. DOI:10.1002/tox.22221 |
| [26] |
BHARDWAJ J K, SARAF P. N-acetyl-l-cysteine mediated regulation of DNA fragmentation, an apoptotic event, against methoxy chlor-toxicity in the Granulosa cells of ovarian antral follicles[J]. Mutat Res Genet Toxicol Environ Mutagen, 2020, 858-860: 503222. DOI:10.1016/j.mrgentox.2020.503222 |
| [27] |
GORDON K J, BLOBE G C. Role of transforming growth factor-β superfamily signaling pathways in human disease[J]. Biochim Biophys Acta Mol Basis Dis, 2008, 1782(4): 197-228. DOI:10.1016/j.bbadis.2008.01.006 |
| [28] |
MASSAGUÉ J. How cells read TGF-β signals[J]. Nat Rev Mol Cell Biol, 2000, 1(3): 169-178. DOI:10.1038/35043051 |
| [29] |
刘彧, 石占全, 姬凯元, 等. TGF-β3对体外培养的羊驼黑色素细胞的影响[J]. 畜牧兽医学报, 2015, 46(5): 746-751. LIU Y, SHI Z Q, JI K Y, et al. Effect of TGF-β3 on in vitro cultured alpaca melanocytes[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(5): 746-751. (in Chinese) |
| [30] |
张禛, 范小瑞, 席华明, 等. 热应激对性成熟猪睾丸TGF-β3和Claudin-11蛋白表达的影响[J]. 畜牧兽医学报, 2016, 47(10): 2136-2142. ZHANG Z, FAN X R, XI H M, et al. Effect of heat stress on the expression of TGF-β3 and claudin-11 protein in mature boar testis[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(10): 2136-2142. DOI:10.11843/j.issn.0366-6964.2016.10.023 (in Chinese) |
编辑 范子娟



