伪中间葡萄球菌(Staphylococcus pseudintermedius)是一种2005年由Devriese等[1]命名的凝固酶阳性葡萄球菌,在此之前归为中间型葡萄球菌(Staphylococcus intermedius)[2]。伪中间葡萄球菌是一种共生菌,最常定植于健康犬的肛周和鼻腔[3];同时,也是一种致病菌,可引发脓皮病、外耳道炎、术后创口感染、尿路感染以及其他部位感染[4-8]。由于人与宠物之间的密切接触,该菌也可在人体定植并引发疾病,目前已有多篇关于人感染伪中间葡萄球菌的报道[9-11],因此伪中间葡萄球菌对人类健康和公共卫生也具有一定的威胁[12]。
随着抗生素滥用现象日益严重,继耐甲氧西林金黄色葡萄球菌(MRSA)之后,耐甲氧西林伪中间葡萄球菌(MRSP)感染已成为兽医领域中严重威胁动物健康的新兴问题[3, 13],且MRSP被认为是葡萄球菌中耐药基因的重要“储存库”。因此,调查伪中间葡萄球菌的流行特征至关重要。目前国内兽医临床中关于伪中间葡萄球菌的报道较为少见,国外的相关研究主要聚焦于MRSP,因此,关于甲氧西林敏感伪中间葡萄球菌(MSSP)的研究在国内外均少见。本研究针对国内部分地区犬源伪中间葡萄球菌(包括MRSP和MSSP)临床分离株的耐药性和分子流行特征进行调查,以了解国内伪中间葡萄球菌的感染现状,为指导临床监测和合理用药提供依据。
1 材料与方法 1.1 样本采集和细菌分离2017年11月—2019年4月,共收集601份送检至中国农业大学动物医院检验科和第三方检测机构的犬源临床样本,接种于5%绵羊血琼脂平板、麦康凯琼脂平板和甘露醇氯化钠琼脂平板中,37 ℃恒温培养24 h,观察菌落形态特征,初步筛选出葡萄球菌。
1.2 细菌鉴定使用Magen HiPure Bacterial DNA试剂盒提取制备细菌DNA模板,贮存于-20 ℃备用。使用16S rDNA基因通用引物进行PCR扩增,将扩增产物进行测序,并将所获序列在NCBI网站上进行BLAST比对,鉴定细菌种属(相似性>99%)。
1.3 药物敏感性试验依据美国临床和实验室标准协会(CLSI)标准,选用10类共14种抗生素。苯唑西林、青霉素、万古霉素、克林霉素、阿米卡星、庆大霉素、利福平、多西环素、氯霉素和阿奇霉素购自中国食品药品检定研究院;氟苯尼考、恩诺沙星和环丙沙星购自北京索莱宝科技有限公司;利奈唑胺购自上海源叶生物科技有限公司。采用琼脂稀释法进行药物敏感性试验,测定最小抑菌浓度(MIC)。质控菌株为金黄色葡萄球菌ATCC 29213。药敏结果判定标准参照CLSI VET08和CLSI 2018 M100。对3类及3类以上药物产生耐药定义为多重耐药(MDR)[14]。
1.4 全基因组测序将“1.2”中提取的细菌DNA模板送至安诺优达公司进行文库构建及全基因组测序(Illumina HiSeq X Ten平台)。所获取的全基因组序列使用Unicycler v0.3.0进行拼接,并与伪中间葡萄球菌MLST数据库进行比对,获得各菌株多位点序列分型(ST),未知ST型由MLST数据库管理者(vincent.perreten@vbi.unibe.ch)分配ST编号;与ResFinder 2.1和SCCmecFinder v.1.2(www.genomicepidemiology.org)数据库进行比对,获得各菌株耐药基因和SCCmec分型,携带mecA基因的伪中间葡萄球菌即为MRSP[15]。使用Harvest软件包中Parsnp工具对本研究中的所有MRSP和MSSP基因组进行核心基因组进化树构建,并使用iTOL(www.itol.embl.de)进行标记和可视化。
1.5 统计分析采用R 4.0.2软件进行χ2检验和Fisher精确检验,以P<0.05为差异显著。
2 结果 2.1 伪中间葡萄球菌分离鉴定经甘露醇氯化钠琼脂培养基筛选葡萄球菌,可见平板中生长呈灰白色、表面湿润、光滑和突起的中等圆形菌落(图 1)。使用16S rDNA通用引物进行PCR扩增,获得目的条带为1 465 bp的PCR产物(图 2)。将PCR产物测序拼接后,在NCBI数据库中进行BLAST比对,与伪中间葡萄球菌的序列相似性达99%~ 100%。
|
图 1 葡萄球菌在甘露醇氯化钠培养上的生长形态 Fig. 1 Growth morphology of Staphylococcus on Mannitol Salt Agar |
|
1~7.PCR产物;8. 阴性对照; M. DNA相对分子质量标准 1-7. PCR products; 8. Negative control; M. DNA marker 图 2 16S rDNA PCR扩增结果 Fig. 2 PCR amplification results of 16S rDNA |
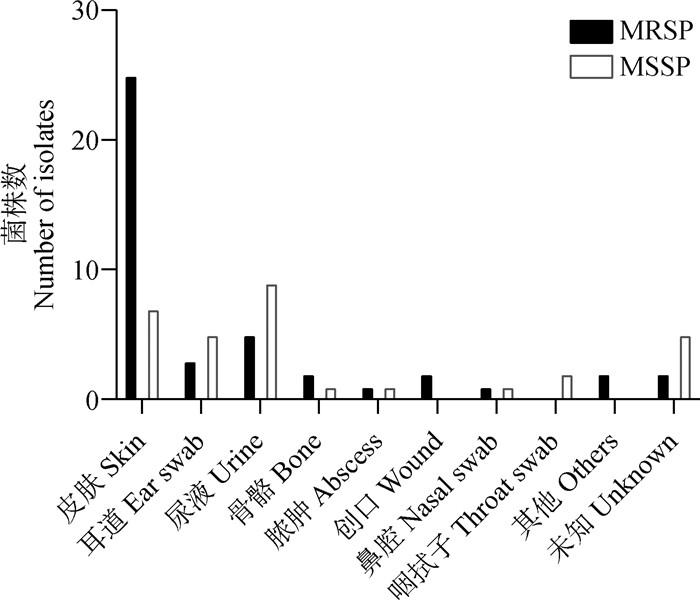
本研究共采集601份犬源性临床样本,分离鉴定获得75株伪中间葡萄球菌,其中42株MRSP(56%,n=42),33株MSSP(44%,n=33)。伪中间葡萄球菌的分离率为12.5%(n=75),MRSP的分离率为7.0%(n=42),MSSP的分离率为5.5%(n=33)。菌株来源见图 3,包括皮肤(42.67%,n=32)、耳道(10.67%,n=8)、尿液(18.67%,n=14)、骨骼(4%,n=3)、鼻腔(2.67%,n=2)、脓肿(2.67%,n=2)、咽拭子(2.67%,n=2)、创口(2.67%,n=2)和其他部位(4%,n=3),7株(9.33%)来源未知。样本来源覆盖18个地区,包括广东省(n=24)、辽宁省(n=9)、上海市(n=7)、天津市(n=7)、湖南省(n=5)、重庆市(n=3)、浙江省(n=3)、河南省(n=3)、江苏省(n=3)、山东省(n=2)、四川省(n=2)、福建省(n=1)、河北省(n=1)、湖北省(n=1)、江西省(n=1)、内蒙古自治区(n=1)、宁夏回族自治区(n=1)和安徽省(n=1)。
|
图 3 不同感染部位分离伪中间葡萄球菌的数量 Fig. 3 Number of Staphylococcus pseudintermedius isolated from different infection sites |
75株伪中间葡萄球菌分离自74只临床就诊的患犬,患犬的性别分布:雌性30只,雄性42只,2只性别未知;年龄分布:2 ~180月龄(中位值:36月龄);品种分布:贵宾犬(n=9)、斗牛犬(n=7)、阿拉斯加犬(n=5)、金毛寻回猎犬(n=5)、混种犬(n=5)、雪纳瑞犬(n=4)、萨摩耶犬(n=3)、德国牧羊犬(n=3)、柴犬(n=3)、巴哥犬(n=2)和拉布拉多寻回猎犬(n=2),其他品种各1只(包括博美犬、秋田犬、比格犬、边境牧羊犬、牛头、恶霸犬、吉娃娃、哈士奇、古代牧羊犬、蝴蝶犬、比特犬、西施犬、藏獒和约克夏),12只患犬品种未知。经统计学分析,在品种和性别方面,MRSP和MSSP之间无显著差异(P>0.05);在菌株来源方面,MRSP和MSSP之间存在显著差异(P < 0.05)。
2.3 耐药表型75株伪中间葡萄球菌对青霉素、阿奇霉素、克林霉素、多西环素、环丙沙星、恩诺沙星、苯唑西林和氯霉素高度耐药,耐药率介于49.3%~89.3%;对氟苯尼考和庆大霉素较敏感;对利奈唑胺、万古霉素、阿米卡星和利福平敏感(表 1)。75株伪中间葡
|
|
表 1 75株伪中间葡萄球菌对14种抗菌药物的耐药率 Table 1 Antimicrobial resistance rates of 75 Staphylococcus pseudintermedius isolates |
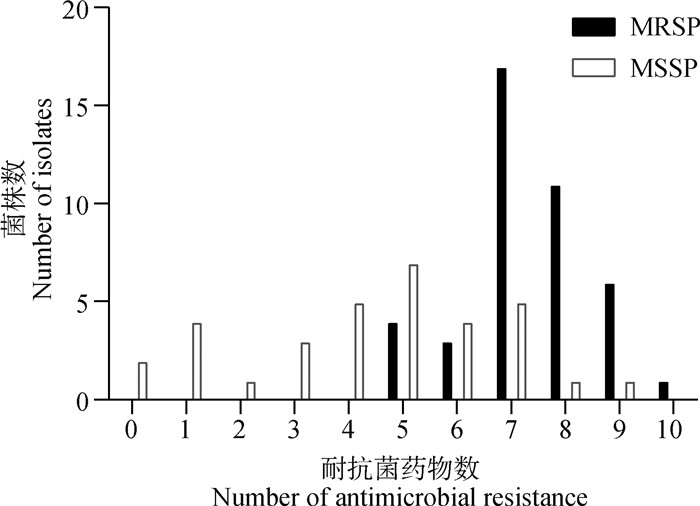
萄球菌的多重耐药率高达90.7%(68/75)。MRSP针对7种抗菌药物的耐药率与MSSP相比差异显著(P < 0.05)(表 1)。MRSP对青霉素、克林霉素和阿奇霉素的耐药率高达100%(42/42);对苯唑西林、环丙沙星、恩诺沙星和多西环素的耐药率均达到80%以上。42株MRSP均具有多重耐药性,至少对5种以上受试药物耐药,多重耐药率高达100%(42/42)(图 4)。33株MSSP中,2株对所有受试药物均敏感,26株至少对3种以上受试药物耐药,多重耐药率为78.8%(26/33)。MRSP与MSSP的多重耐药率之间存在显著差异(P < 0.05)。
|
图 4 伪中间葡萄球菌中多药耐药菌株分布 Fig. 4 Number of antimicrobial resistance distribution of Staphylococcus pseudintermedius isolates from dogs |
WGS分析结果显示,75株伪中间葡萄球菌共携带19种耐药基因(表 2)。其中,blaZ和aac(6′)-aph(2″)检出率最高,均为92.0%(69/75);其次为erm(B)、tet(M)、dfrG、aph(3′)-Ⅲ、ant(6)-Ia和mecA。ant(9)-Ia、erm(A)、fosB和lnu(G)各检出1株,未检出erm(C)。在42株MRSP中,blaZ和erm(B)检出率高达100%,与耐药表型完全相符;aac(6′)-aph(2″)的检出率为100%,但庆大霉素耐药率仅为7.1%。7株含有对截短侧耳素类-林可胺类-链阳菌素A类耐药的多药耐药基因lsa(E)。MRSP中8种耐药基因的检出率与MSSP之间存在显著差异(P < 0.05)(表 2)。
|
|
表 2 75株伪中间葡萄球菌耐药基因检出率 Table 2 Frequency of the antimicrobial resistance gene for 75 Staphylococcus pseudintermedius isolates |
75株伪中间葡萄球菌中,共发现70种ST型,54种为新ST型,无优势ST型。MRSP中存在38种ST型,MSSP中存在33种ST型。对75株伪中间葡萄球菌进行SNP分析,并建立系统发育进化树(图 5),结果可见所有菌株彼此的亲缘关系并不紧密。

|
图 5 76株伪中间葡萄球菌的系统发育进化树(含标准菌株ED99) Fig. 5 Core genome-based phylogenetic analysis of 75 dog isolates and the reference isolate (ED99) |
42株MRSP中,葡萄球菌染色体基因盒(SCCmec)V型23株,占54.7%;SCCmec Ⅲ型2株,占4.8%;SCCmec IV型2株,占4.8%;15株未分型,占35.7%。
3 讨论本研究中,伪中间葡萄球菌和MRSP的分离率分别为12.5%和7.0%,均低于国内相关的报道[6, 16]。2007年,Sasaki等[17]报道日本犬MRSP的分离率为29.8%。2020年,韩国和德国报道伪中间葡萄球菌的分离率分别为68%[18]和39.6%[19]。本研究中,56%伪中间葡萄球菌为MRSP,高于Feng等(42.7%)[16]和Wang等(44.0%)[6]之前的报道,但低于日本的相关报道(66.5%)[20]。在美国和欧洲,MRSP在伪中间葡萄球菌中的占比相对较低,介于2.5%~33.0%[21-24]。本研究显示伪中间葡萄球菌分离株主要来源于皮肤、尿液和耳道,与国外的研究具有一致性[21-22]。因采样部位、物种、试验设计、地域分布和动物健康状态的影响,不同研究之间的结果会有所不同,但是国内MRSP的高流行率必须予以重视。
Lee和Yang[18]报道MRSP的多重耐药率是MSSP的2倍~3倍,而在本研究中MRSP的多重耐药率是100%,MSSP的多重耐药率是78.8%,这表明MSSP中存在的多重耐药现象,这一结果与关珊[25]关于北京地区宠物犬外伤感染中分离到的伪中间葡萄球菌的耐药性一致,提示临床兽医在使用抗生素之前应尽量先采样进行细菌培养药敏试验,以更为合理地使用抗生素。所有菌株均对青霉素呈现高度耐药,因此不建议将青霉素作为伪中间葡萄球菌感染的常规用药。2020年,Haenni等[26]关于欧洲MSSP的研究发现,MSSP通常对四环素类、大环内酯类和氨基糖苷类耐药,这与本研究结果一致。值得注意的是,Wang等[6]的报道中发现所有MRSP均对氟苯尼考敏感,周传铎等[27]的研究也与该研究结果一致,但本研究中发现MRSP和MSSP中均存在氟苯尼考耐药现象。
本研究中,42株伪中间葡萄球菌携带mecA,同时所有MRSP均携带耐药基因blaZ、aac(6′)-aph(2″) 和erm(B)。耐药基因blaZ和erm(B)的检出率高于国内相关研究[6, 16]。42株MRSP中,5株未表现出苯唑西林耐药,耐药表型和耐药基因不一致的情况还需要进一步研究[28]。在7种耐药基因[ant(6)-Ia、aph(3′)-Ⅲ、lnu(B)、tet(K)、lsa(E)、cat(pC221)和fexA]的检出率方面,MRSP和MSSP之间未存在显著差异,提示MSSP中也存在严重的基因转移。
国外的一项回顾性综述中[29]指出,MRSP的优势ST型是ST71,随后依次是ST45、ST258、ST261、ST112、ST265、ST68、ST169和ST181。2012年,Wang等[6]报道ST71是中国北部地区的优势ST型;Feng等[16]报道ST4、ST5和ST95是华南地区的优势ST型。在本研究中,MRSP和MSSP中均未发现优势ST型,说明国内部分地区犬源伪中间葡萄球菌具有较大的遗传多样性和个体差异性。国内外的文献报道显示在我国华南地区[16]、韩国[18]和美国[30],MRSP主要为SCCmec V型,与本研究的结果一致。
4 结论从国内18个地区分离到的75株犬源伪中间葡萄球菌中存在严重的多重耐药现象,尤其是MSSP的耐药现状不容忽视;耐药基因分布广泛,且检出率高;ST型复杂多样,发现大量的新ST型,且无优势ST型,提示MRSP和MSSP中均存在较大的遗传多样性。因此,加强宠物临床细菌耐药性监测,规范诊疗程序,推动抗生素的合理使用至关重要。
| [1] |
DEVRIESE L A, VANCANNEYT M, BAELE M, et al. Staphylococcus pseudintermedius sp. nov., a coagulase-positive species from animals[J]. Int J Syst Evol Microbiol, 2005, 55(Pt 4): 1569-1873. |
| [2] |
NISA S, BERCKER C, MIDWINTER A C, et al. Combining MALDI-TOF and genomics in the study of methicillin resistant and multidrug resistant Staphylococcus pseudintermedius in New Zealand[J]. Sci Rep, 2019, 9(1): 1271. DOI:10.1038/s41598-018-37503-9 |
| [3] |
VAN DUIJKEREN E, CATRY B, GREKO C, et al. Review on methicillin-resistant Staphylococcus pseudintermedius[J]. J Antimicrob Chemother, 2011, 66(12): 2705-2714. DOI:10.1093/jac/dkr367 |
| [4] |
CABASSU J, MOISSONNIER P. Surgical treatment of a vertebral fracture associated with a haematogenous osteomyelitis in a dog[J]. Vet Comp Orthop Traumatol, 2007, 20(3): 227-230. DOI:10.1160/VCOT-06-11-0089 |
| [5] |
FITZGERALD J R. The Staphylococcus intermedius group of bacterial pathogens: species re-classification, pathogenesis and the emergence of meticillin resistance[J]. Vet Dermatol, 2009, 20(5-6): 490-495. DOI:10.1111/j.1365-3164.2009.00828.x |
| [6] |
WANG Y, YANG J, LOGUE C M, et al. Methicillin-resistant Staphylococcus pseudintermedius isolated from canine pyoderma in North China[J]. J Appl Microbiol, 2012, 112(4): 623-630. DOI:10.1111/j.1365-2672.2012.05233.x |
| [7] |
WEESE J S, VAN DUIJKEREN E. Methicillin-resistant Staphylococcus aureus and Staphylococcus pseudintermedius in veterinary medicine[J]. Vet Microbiol, 2010, 140(3-4): 418-429. DOI:10.1016/j.vetmic.2009.01.039 |
| [8] |
VIDELA R, SOLYMAN S M, BRAHMBHATT A, et al. Clonal complexes and antimicrobial susceptibility profiles of Staphylococcus pseudintermedius isolates from Dogs in the United States[J]. Microb Drug Resist, 2018, 24(1): 83-88. DOI:10.1089/mdr.2016.0250 |
| [9] |
POMBA C, RANTALA M, GREKO C, et al. Public health risk of antimicrobial resistance transfer from companion animals[J]. J Antimicrob Chemother, 2017, 72(4): 957-968. |
| [10] |
GAGETTI P, ERRECALDE L, WATTAM A R, et al. Characterization of the first mecA-positive multidrug-resistant Staphylococcus pseudintermedius isolated from an argentinian patient[J]. Microb Drug Resist, 2020, 26(7): 717-721. DOI:10.1089/mdr.2019.0308 |
| [11] |
LOZANO C, REZUSTA A, FERRER I, et al. Staphylococcus pseudintermedius human infection cases in spain: dog-to-human transmission[J]. Vector Borne Zoonotic Dis, 2017, 17(4): 268-270. DOI:10.1089/vbz.2016.2048 |
| [12] |
MCCARTHY A J, HARRISON E M, STANCZAK-MROZEK K, et al. Genomic insights into the rapid emergence and evolution of MDR in Staphylococcus pseudintermedius[J]. J Antimicrob Chemother, 2015, 70(4): 997-1007. |
| [13] |
MORRIS D O, LOEFFLER A, DAVIS M F, et al. Recommendations for approaches to meticillin-resistant staphylococcal infections of small animals: diagnosis, therapeutic considerations and preventative measures: Clinical consensus guidelines of the world association for veterinary dermatology[J]. Vet Dermatol, 2017, 28(3): 304-369. DOI:10.1111/vde.12444 |
| [14] |
MAGIORAKOS A P, SRINIVASAN A, CAREY R B, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance[J]. Clin Microbiol Infect, 2012, 18(3): 268-281. DOI:10.1111/j.1469-0691.2011.03570.x |
| [15] |
CLSI 2020 Performance standards for antimicrobial disk and dilution susceptibility tests for bacteria isolated from animals[S]. Approved Standard, CLSI Document M100 30th Ed.
|
| [16] |
FENG Y Y, TIAN W, LIN D C, et al. Prevalence and characterization of methicillin-resistant Staphylococcus pseudintermedius in pets from South China[J]. Vet Microbiol, 2012, 160(3-4): 517-524. DOI:10.1016/j.vetmic.2012.06.015 |
| [17] |
SASAKI T, KIKUCHI K, TANAKA Y, et al. Methicillin-resistant Staphylococcus pseudintermedius in a veterinary teaching hospital[J]. J Clin Microbiol, 2007, 45(4): 1118-1125. DOI:10.1128/JCM.02193-06 |
| [18] |
LEE G Y, YANG S J. Comparative assessment of genotypic and phenotypic correlates of Staphylococcus pseudintermedius strains isolated from dogs with otitis externa and healthy dogs[J]. Com Immunol Microbiol Infect Dis, 2020, 70: 101376. DOI:10.1016/j.cimid.2019.101376 |
| [19] |
SOIMALA T, LUBKE-BECKER A, HANKE D, et al. Molecular and phenotypic characterization of methicillin-resistant Staphylococcus pseudintermedius from ocular surfaces of dogs and cats suffering from ophthalmological diseases[J]. Vet Microbiol, 2020, 244: 108687. DOI:10.1016/j.vetmic.2020.108687 |
| [20] |
KAWAKAMI T, SHIBATA S, MURAYAMA N, et al. Antimicrobial susceptibility and methicillin resistance in Staphylococcus pseudintermedius and Staphylococcus schleiferi subsp. coagulans isolated from dogs with pyoderma in Japan[J]. J Vet Med Sci, 2010, 72(12): 1615-1619. DOI:10.1292/jvms.10-0172 |
| [21] |
COUTO N, MONCHIQUE C, BELAS A, et al. Trends and molecular mechanisms of antimicrobial resistance in clinical staphylococci isolated from companion animals over a 16 year period[J]. J Antimicrob Chemother, 2016, 71(6): 1479-1487. DOI:10.1093/jac/dkw029 |
| [22] |
GRÖNTHAL T, EKLUND M, THOMSON K, et al. Antimicrobial resistance in Staphylococcus pseudintermedius and the molecular epidemiology of methicillin-resistant S. pseudintermedius in small animals in Finland[J]. J Antimicrob Chemother, 2017, 72(4): 1021-1030. |
| [23] |
LITTLE S V, BRYAN L K, HILLHOUSE A E, et al. Characterization of agr groups of Staphylococcus pseudintermedius isolates from dogs in texas[J]. mSphere, 2019, 4(2): e00033-19. |
| [24] |
MENANDRO M L, DOTTO G, MONDIN A, et al. Prevalence and characterization of methicillin-resistant Staphylococcus pseudintermedius from symptomatic companion animals in Northern Italy: Clonal diversity and novel sequence types[J]. Comp Immunol Microbiol Infect Dis, 2019, 66: 101331. DOI:10.1016/j.cimid.2019.101331 |
| [25] |
关珊. 北京地区宠物外伤感染菌群特征及伪中间型葡萄球菌耐药性研究[D]. 北京: 中国农业大学, 2020: 49-50. Guan S. Investigation on characteristics of infected wound flora in pet dogs in Beijing and antimicrobial susceptibility of Staphylococcus pseudintermedius[D]. Beijing: China Agricultural University, 2020: 49-50. |
| [26] |
HAENNI M, EL GARCH F, MIOSSEC C, et al. High genetic diversity among methicillin-susceptible Staphylococcus pseudintermedius in dogs in Europe[J]. J Glob Antimicrob Resist, 2020, 21: 57-59. DOI:10.1016/j.jgar.2020.02.016 |
| [27] |
周传铎, 赵然, 金艺鹏, 等. 北京地区警犬皮肤伪中间型葡萄球菌药敏试验及耐药基因筛查[J]. 中国兽医杂志, 2016, 52(11): 100-103. ZHOU C D, ZHAO R, JIN Y P, et al. Antibacterial sensitive test and drug-resistant genetic screening for Staphylococcus pseudintermedius from the skins of police dogs in Beijing Area[J]. Chinese Journal of Veterinary Medicine, 2016, 52(11): 100-103. (in Chinese) |
| [28] |
WEGENER A, BROENS E M, ZOMER A, et al. Comparative genomics of phenotypic antimicrobial resistances in methicillin-resistant Staphylococcus pseudintermedius of canine origin[J]. Vet Microbiol, 2018, 225: 125-131. DOI:10.1016/j.vetmic.2018.09.013 |
| [29] |
SANROS T P D, DAMBORG P, MOODLEY A, et al. Systematic review on global epidemiology of methicillin-resistant Staphylococcus pseudintermedius: Inference of population structure from multilocus sequence typing data[J]. Front Microbiol, 2016, 7: 1599. |
| [30] |
SMITH J T, AMADOR S, MCGONAGLE C J, et al. Population genomics of Staphylococcus pseudintermedius in companion animals in the United States[J]. Commun Biol, 2020, 3(1): 282. DOI:10.1038/s42003-020-1009-y |
(编辑 白永平)



