2. 北京大学, 北京 100871
2. Peking University, Beijing 100871, China
白头翁汤是《伤寒论》清热解毒类方剂中的代表方剂,具有凉血止痢之效[1]。目前研究表明,白头翁汤具有较好的抗菌抗炎作用[2-3],可通过降低IL-8、ICAM-1水平调节肠道组织炎症以治疗大鼠大肠杆菌性腹泻,并与抗生素治疗相比可明显保护肠道菌群的种类及丰度,在治疗动物细菌性疾病方面具有较好的应用前景[4]。内毒素(LPS)是由革兰阴性菌产生的一种强致病性毒素,可引起机体强烈的炎症反应,导致内毒素血症[5],常被用作刺激因子调控IL-6、IL-1β等相关炎性因子的表达,构建炎症模型[6-7]。LPS-TLR4的信号通路转导途径是目前常见的LPS刺激途径,LPS主要通过Toll样受体4(Toll-like receptor 4, TLR4)识别宿主细胞并激活天然免疫系统[8]。LPS与TLR4结合后TLR4产生构象变化激活下游信号通路,使得下游的肿瘤坏死因子受体相关因子6(TNF receptor associated factor 6, TRAF6)活化,引起ERK、JNK和p38的MAPK信号转导而导致炎性因子的释放,引发病理变化[9]。实验室前期研究表明,白头翁汤具有良好的抗毒素药理作用,可通过抑制炎症反应,降低LPS诱导的大鼠肠黏膜微血管内皮细胞(rat microvascular endothelial cells, RIMVECs)损伤,保护微血管内皮细胞,从而激活跨内皮中性粒细胞(PMNs)溶菌酶,增强PMNs杀菌能力,发挥抗菌作用[10-13]。但其中具体作用机制尚不明确,因此本研究以RIMVECs细胞为模式细胞,利用RT-PCR、Western blot等方法检测白头翁汤对LPS诱导的RIMVECs的TLR4、TRAF6、P-ERK基因及蛋白表达的影响;以ERK1/2信号通路特异性阻断剂PD98059作用后探究对下游炎性因子的影响,从而研究白头翁汤的抗炎机制,为抗炎中药的开发奠定试验基础,为抗炎策略提供参考。
1 材料与方法 1.1 主要试剂白头翁(批号:801001104)、黄连(批号:18121402)、黄柏(批号:18052601)、秦皮(批号:180713001)购自北京同仁堂药店,DMEM高糖培养基、D-Hank’s干粉、胎牛血清、双抗、胰蛋白酶均购自GiBco公司,L-谷氨酰胺、二甲基亚砜、LPS、Ⅱ型胶原酶购自Sigma公司,超纯RNA提取试剂盒、cDNA第一链合成试剂盒、UltraSYBR Mixture (WithROX)、DNase1、5×RNA Loading Buffer购自北京康为世纪生物科技有限公司,TRAF-6、TLR4、Erk1+Erk2抗体购自Abcam公司,羊抗兔IgG二抗、BCA蛋白浓度测定试剂盒购自碧云天生物技术公司,大鼠IL-6、IL-8、IL-β、TNF-α ELISA试剂盒购自上海酶联生物科技有限公司,PD98059购自MCE公司。
1.2 主要仪器奥林巴斯倒置荧光显微镜(日本Olympus公司,型号:IX71),CO2培养箱(日本Sanyo公司,型号:MCO-17AC)PCR仪(美国ABI公司,型号:2720),实时荧光定量PCR系统(德国Roche公司,型号:LightCycler® 480II),垂直电泳转印系统(美国Bio-rad | Biorad,型号:PROTEAN Tetra+ Trans-Blot),凝胶成像仪(上海天能,型号:Tanon-5200),多功能酶标仪(美国Bio tek,型号:SYNERGY4)。
1.3 试验材料原代培养的1~3日龄SD大鼠肠黏膜微血管内皮细胞,经纯化、鉴定、可稳定传代后用于本试验。称取黄连15 g、黄柏10 g、秦皮20 g、白头翁20 g按兽药典[14]中方法制备白头翁汤水煎液,然后浓缩生药浓度至1 g·mL-1,0.22 μm滤膜过滤后置于4 ℃冰箱保存备用[13]。
1.4 细胞的分组与处理将RIMVECs细胞分为空白对照组、LPS组和白头翁汤组。待细胞长至80%~90%汇合状态时,各组进行如下处理:对照组,加入维持培养基(2% DMEM)作用细胞28 h;LPS组,加入10 μg·mL-1的LPS作用于细胞4 h后使用2% DMEM作用24 h;白头翁汤组,LPS作用4 h后使用20 μg·mL-1白头翁汤作用细胞24 h。涉及PD98059(ERK1/2抑制剂)处理的细胞分组中,PD98059组使用20 μmol·L-1 PD98059预处理细胞2 h后加入10 μg·mL-1的LPS作用细胞4 h,使用2% DMEM作用细胞24 h,其余各组在上述分组处理基础上使用2% DMEM预处理细胞2 h。
1.5 RT-PCR检测基因转录使用总RNA提取试剂盒提取RIMVECs细胞总RNA,并反转录为cDNA,反应体系共20 μL,加入1.2 μL Primer mix及总RNA 3 μg(6~7 μL),70 ℃孵育5 min,立即冰浴5 min,随后短暂离心将管壁上的溶液离心至管底。继续向以上反应管中加入以下试剂:4 μL 5×RT Buffer,2 μL 0.1 mol·L-1 DTT,0.75 μL 10 mmol·L-1 dNTP Each,0.2 μL HiFi-MMLV Enzyme Mix,加H2O至20 μL。轻轻混匀, 42 ℃孵育45 min,85 ℃保温5 min。用荧光定量PCR仪,采用2-△△Ct法进行数据的相对定量分析。取Roche 384孔板,分别编号,按如下反应体系进行: 2×UltraSYBR Mixture 12.5 μL,PCR Forward Primer(10 μmol·L-1)0.5 μL,PCR Reverse Primer(10 μmol·L-1) 0.5 μL,DNA模板2 μL,加入灭菌蒸馏水至25 μL,程序为95 ℃预变性3 min,40个循环(95 ℃ 12 s,62 ℃ 40 s)。其中根据GenBank中TLR4、TRAF6基因序列,采用Primer Premier 5.0设计1对特异引物(表 1),由北京基谱生物科技有限公司合成。根据GenBank中MAPK3基因序列,采用Primer Premier 5.0设计1对特异引物(表 1),由苏州吉玛基因有限公司合成。
|
|
表 1 GAPDH、TLR4、TRAF6、ERK基因引物 Table 1 The gene primers of GAPDH, TLR4, TRAF6 and ERK |
使用RIPA裂解缓冲液提取细胞的总蛋白并按照碧云天BCA蛋白浓度测定试剂盒测定蛋白浓度。根据BCA的结果将每组样品使用裂解液统一至相同浓度后按4∶1的比例加入5×SDS-PAGE上样缓冲液,充分混合均匀后,于100 ℃条件下煮沸8 min, 使蛋白充分变性。按电泳时的上样量合理分装,-80 ℃保存。8% SDS-PAGE检测TLR4、TRAF6、P-ERK,使用GAPDH校正,所有蛋白条带灰度值均使用Image J软件进行分析。
1.7 ELISA检测细胞炎性因子收集各组细胞培养上清液,根据试剂盒说明书要求使用ELISA试剂盒检测IL-6、IL-8、IL-1β、TNF-α含量。
1.8 数据处理与分析数据使用GraphPad Prism 8.0(GraphPad软件)进行多组间的单因素方差分析处理。数据表示为“平均值±标准差(x±s)”。P值< 0.05被认为差异具有统计学意义(*.P < 0.05,**.P < 0.01,***.P < 0.001)。
2 结果 2.1 白头翁汤对LPS作用的RIMVECs中TLR4、TRAF6及ERK基因表达的影响为了探究白头翁汤是否通过TLR4-ERK1/2信号通路的级联作用产生抗炎效应,检测TLR4、TRAF6及ERK mRNA的转录情况,结果显示,与空白组相比,LPS组TLR4、TRAF6的基因相对表达量显著升高(P < 0.01,P < 0.001),ERK的基因相对表达量有升高趋势但无显著变化(P>0.05)。与LPS刺激组相比,白头翁汤组TLR4、TRAF6、ERK的基因相对表达量降低,差异显著(P < 0.001,P < 0.001,P < 0.01),结果见图 1。

|
图 1 白头翁汤对LPS作用的RIMVECs TLR4、TRAF6 及 ERK mRNA表达的影响 Fig. 1 Effect of Pulsatilla decoction on the relative expression of RIMVECs TLR4, TRAF6 and ERK genes induced by LPS |
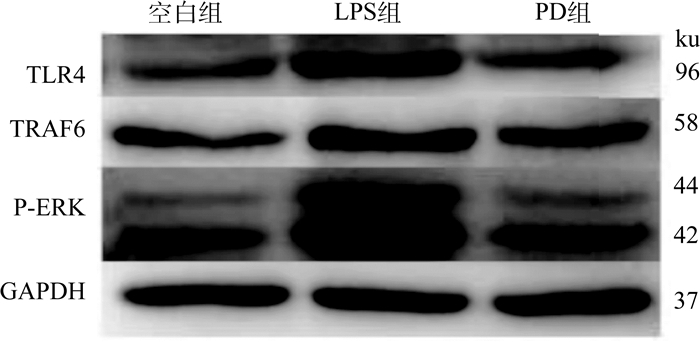
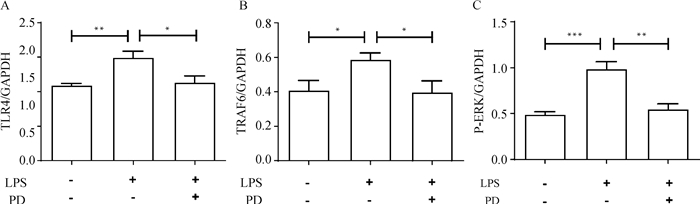
白头翁汤能从基因的转录水平较好地抑制RIMVECs TLR4及TRAF6、ERK的表达,为了进一步探究白头翁汤能否抑制到蛋白表达,采用Western blot法从蛋白水平研究白头翁汤的抗炎作用机制。图 2、3结果表明,LPS组和空白对照组相比TLR4、TRAF6、P-ERK的相对表达量升高,差异显著(P < 0.01,P < 0.05,P < 0.001),白头翁汤组和LPS组相比,TLR4、TRAF6、P-ERK的相对表达量降低,差异显著(P < 0.05,P < 0.05,P < 0.01)。
|
图 2 白头翁汤对LPS作用的RIMVECs TLR4、TRAF6、P-ERK蛋白表达的影响 Fig. 2 Effect of Pulsatilla decoction on the expression of TLR4, TRAF6 and P-ERK protein in RIMVECs stimulated by LPS |
|
A. TLR4灰度值分析;B. TRAF6灰度值分析;C. P-ERK灰度值分析 A. Gray value analysis of TLR4; B. Gray value analysis of TRAF6; C. Gray value analysis of P-ERK 图 3 TLR4、TRAF6、P-ERK相对表达量灰度值分析 Fig. 3 Gray value analysis of relative expression of TLR4, TRAF6 and P-ERK |
由图 4、5可知,与空白对照组相比,LPS组P-ERK水平显著增高(P < 0.01),白头翁汤组显著降低了LPS所诱导的RIMVECs P-ERK水平(P < 0.05),与上述结果一致。抑制剂组与LPS组相比,P-ERK的蛋白表达量显著降低(P < 0.05),并且白头翁汤组与抑制剂组相比作用效果无显著差异。

|
图 4 P-ERK蛋白表达情况 Fig. 4 Expression of P-ERK |

|
图 5 P-ERK相对表达量灰度值分析 Fig. 5 Gray value analysis of relative expression of P-ERK |
由图 6可知,与空白对照组相比,LPS作用后,RIMVECs的IL-6、IL-8、IL-1β、TNF-α表达显著升高(P < 0.01,P < 0.01,P < 0.05,P < 0.01),而与LPS组相比,白头翁汤组IL-6、IL-8、IL-1β、TNF-α表达显著降低(P < 0.05,P < 0.001,P < 0.05,P < 0.05)。同时抑制剂组与LPS组相比其下游炎性因子IL-6、IL-8、IL-1β、TNF-α的分泌显著降低(P < 0.05,P < 0.001,P < 0.05,P < 0.01)。白头翁汤组与抑制剂组相比其下游炎性因子IL-6、IL-8、IL-1β、TNF-α的分泌无显著性差异。

|
图 6 PD98059作用后白头翁汤对LPS作用的RIMVECs IL-6、IL-8、IL-1β、TNF-α表达的影响 Fig. 6 Effects of Pulsatilla decoction on the expression of IL-6, IL-8, IL-1β and TNF-α in RIMVECs induced by LPS after PD98059 treatment |
微血管内皮细胞(MVECs)是机体重要的保护屏障,其在维持机体内环境稳态、抗炎等方面都具有重要作用[15]。MVECs在细菌病的发生过程中有着十分重要的作用,是多种细菌毒素的靶标[16-17]。致病因子会首先识别MVECs膜上的特异性受体并与之结合来破坏MVECs的屏障作用[18],进而引发炎症反应[19]。其中,LPS是细菌所产生的重要毒力因子,在细菌性疾病发生过程中起重要作用,研究表明,其主要通过损伤MVECs发挥致病作用[20]。尤青海等[21]研究发现LPS可通过PI3K/Akt信号通路诱导RACK1及rac1表达造成大鼠肺微血管内皮细胞损伤导致弥漫性肺间质及肺泡水肿。在研究Apelin-13对LPS诱导大鼠肺微血管内皮细胞炎性因子表达的影响时发现,LPS还可通过干预ROS-NF-κB信号通路诱导炎性因子的表达并最终损害内皮细胞功能[22]。在脑微血管内皮细胞中,秦劭晨等[23]发现,LPS处理可升高脑微血管内皮细胞TNF-α、CCL20、IL-8 mRNA表达量,诱导炎性因子分泌增加最终导致脑小血管疾病。由此可见保护微血管内皮细胞对于治疗LPS所致的机体损伤具有重要意义。而研究发现中药对MVECs具有多种调节作用,包括改变血管的通透性、促进细胞的增殖、减少炎症的分泌等[24-25]。白头翁汤主要成分为皂苷类:白头翁皂苷A、B、B4;生物碱类:小檗碱及药根碱;柠檬苦素类:黄柏内酯;香豆素类:秦皮甲素、秦皮乙素及葡萄糖苷[4]。前期研究表明,其在抑制LPS所致的大鼠肺微血管内皮细胞损伤、治疗肠道炎症方面具有良好的效果。节阳华等[26]研究发现,白头翁汤可通过阻断JAK2/STAT3通路的转导,改善结直肠癌中炎性微环境从而达到抗肿瘤的效果。在溃疡性结肠炎治疗中,白头翁汤可通过调节肠道免疫系统如维持Th17/Treg的平衡、增加miR-19a的表达等,调节NF-κB mRNA的水平、黏附分子水平及影响TGF-β1/Smad3信号通路等途径发挥显著抗炎作用[27]。
因此,本试验以RIMVECs细胞为材料,探究白头翁汤是否通过抑制TLR4-ERK1/2信号通路而发挥抗炎作用。炎症Toll样受体(TLR)4属于TLR受体家族,可诱导对入侵病原体的炎症反应,是参与介导LPS诱导跨膜信号转导和细胞激活的受体,广泛分布于内皮细胞等多种免疫细胞中,在机体免疫过程中具有重要作用[28]。TLR4激活后会引起一系列的下游蛋白的反应,包括引起TRAF6活化、ERK1/2的磷酸化等。ERK1/2是MAPK成员之一,许多文献都表明ERK1/2在控制炎症方面发挥重要作用,其持续的激活可引起炎症细胞因子不断产生,和其上游的MAPKK及MAPKKK共同作用,导致级联“瀑布”效应。严宁等[29]研究发现,抑制ERK1/2信号通路后可缓解心肌缺血再灌注大鼠所出现的炎症损伤。在幽门螺杆菌所致的大鼠肠黏膜炎性反应中,田华等[30]研究发现抑制ERK通路可减轻胃炎大鼠胃黏膜的炎性反应。在非酒精性脂肪肝病中,廖媛等[31]研究发现下调TLR4、ERK1/2基因及蛋白表达,可抑制炎症反应,减轻肝脏炎症。
前期实验室研究表明20 μg·mL-1的白头翁汤对细胞无毒性[13]。笔者发现20 μg·mL-1的白头翁汤处理可以显著降低LPS诱导的TLR4、TRAF6、ERK1/2基因及蛋白的表达。随后使用ERK1/2信号通路上的特异性抑制剂PD98059,观察白头翁汤与抑制剂在抑制P-ERK蛋白表达及LPS所诱导的RIMVECs炎性因子IL-6、IL-8、IL-1β、TNF-α分泌情况的作用效果差异。PD98059可通过特异性抑制其上游蛋白激酶MEK从而阻断ERK1/2信号通路的激活[32],其被广泛应用于癌症的研究中[33-34]。抑制剂PD98059抑制了LPS所引起的ERK1/2磷酸化及其下游炎性因子的分泌。表明ERK信号通路是LPS诱导炎性因子分泌,损伤RIMVECs细胞的主要靶点之一。白头翁汤在抑制ERK1/2磷酸化水平上与抑制剂组相当,并可显著降低LPS所诱导的炎性因子IL-6、IL-8、IL-1β、TNF-α含量的高表达,且白头翁汤下调炎性因子表达的效果与ERK1/2抑制剂相似,无统计学差异。这提示EKR1/2可能是白头翁汤抑制炎症反应保护RIMVECs的主要靶点之一。本试验从细胞水平证实了白头翁汤可抑制LPS刺激RIMVECs所引起的IL-6、IL-8、IL-1β、TNF-α的高表达,并通过PD98059阻断试验,初步认为其机制可能与白头翁汤抑制ERK1/2信号通路有关,ERK1/2信号通路可能是白头翁汤作用的主要靶位之一。以上说明,白头翁汤可通过抑制TLR4-ERK1/2信号通路,降低LPS所引起的细胞炎性反应,从而达到保护机体的目的。此外由于LPS激活胞内信号转导,可引起多条信号通路间的级联反应,且白头翁汤多成分、多靶点,除了抑制LPS激活ERK1/2通路外,是否还作用于其他胞内通路,都需进一步的试验进行研究探讨。
4 结论白头翁汤通过抑制TLR4-ERK1/2信号通路上TLR4、TRAF6、ERK基因及蛋白的表达抑制LPS所诱导的RIMVECs炎性反应,发挥抗炎作用。
| [1] |
金燊懿, 毕凌, 焦丽静, 等. 白头翁汤化学成分及药理作用研究进展[J]. 上海中医药杂志, 2019, 53(3): 109–111.
JIN S Y, BI L, JIAO L J, et al. Research progress in chemical constituents and pharmacological effects of Pulsatilla decoction[J]. Shanghai Journal of Traditional Chinese Medicine, 2019, 53(3): 109–111. (in Chinese) |
| [2] |
邹志强, 刘晏灼, 于如娟, 等. 白头翁汤药理作用研究进展[J]. 山东畜牧兽医, 2020, 41(1): 63–65.
ZOU Z Q, LIU Y Z, YU R J, et al. Research progress on pharmacological action of Pulsatilla decoction[J]. Shandong Journal of Animal Science and Veterinary Medicine, 2020, 41(1): 63–65. DOI: 10.3969/j.issn.1007-1733.2020.01.036 (in Chinese) |
| [3] |
王丽, 陶兴宝, 欧阳净, 等. 白头翁汤对痢疾杆菌的体外抑菌作用研究[J]. 中医药信息, 2020, 37(5): 49–53.
WANG L, TAO X B, OUYANG J, et al. Bacteriostasis in vitro effect of baitouweng decoction on shigella dysenteriae[J]. Information on Traditional Chinese Medicine, 2020, 37(5): 49–53. (in Chinese) |
| [4] | LIU X Y, HE S W, LI Q Y, et al. Comparison of the gut microbiota between Pulsatilla decoction and levofloxacin hydrochloride therapy on Escherichia coli infection[J]. Front Cell Infect Microbiol, 2020, 10: 319. DOI: 10.3389/fcimb.2020.00319 |
| [5] |
张晓音, 吴旻, 李雨萌, 等. 脂多糖的效应及其机理研究进展[J]. 动物医学进展, 2015, 36(12): 133–136.
ZHANG X Y, WU M, LI Y M, et al. Progress on Effects and mechanisms of lipopolysaccharides[J]. Progress in Veterinary Medicine, 2015, 36(12): 133–136. DOI: 10.3969/j.issn.1007-5038.2015.12.028 (in Chinese) |
| [6] | YUAN H X, FENG X E, LIU E L, et al. 5, 2'-dibromo-2, 4', 5'-trihydroxydiphenylmethanone attenuates LPS-induced inflammation and ROS production in EA. hy926 cells via HMBOX1 induction[J]. J Cell Mol Med, 2019, 23(1): 453–463. DOI: 10.1111/jcmm.13948 |
| [7] | ZHONG M, ZHANG X, SHI X M, et al. Halofuginone inhibits LPS-induced attachment of monocytes to HUVECs[J]. Int Immunopharmacol, 2020, 87: 106753. DOI: 10.1016/j.intimp.2020.106753 |
| [8] | SIVAK K V, STOSMAN K I, RASSOKHA T A, et al. The effect of TLR4 blockade on some indicators of systemic inflammatory response to Proteus mirabilis LPS in rats[J]. Bull Exp Biol Med, 2020, 169(6): 795–797. DOI: 10.1007/s10517-020-04981-9 |
| [9] | PARK B S, LEE J O. Recognition of lipopolysaccharide pattern by TLR4 complexes[J]. Exp Mol Med, 2013, 45(12): e66. DOI: 10.1038/emm.2013.97 |
| [10] |
胡屹屹, 穆祥, 胡元亮. 白头翁汤及其主要成分对LPS诱导内皮细胞分泌NO、E-selectin和IL-8的影响[J]. 畜牧兽医学报, 2012, 43(1): 145–151.
HU Y Y, MU X, HU Y L. Effects of pulsatillae decoction and its main ingredients on LPS-induced NO, E-selectin and IL-8 secretion of endothelial cells[J]. Acta Veterinaria et Zootechnica Sinica, 2012, 43(1): 145–151. (in Chinese) |
| [11] |
胡屹屹, 穆祥, 胡元亮. 白头翁汤对内毒素诱导血管内皮细胞基因表达谱的影响[J]. 畜牧兽医学报, 2013, 44(10): 1675–1684.
HU Y Y, MU X, HU Y L. Effects of pulsatillae decoction on gene expression of LPS-induced endothelial cell[J]. Acta Veterinaria et Zootechnica Sinica, 2013, 44(10): 1675–1684. DOI: 10.11843/j.issn.0366-6964.2013.10.023 (in Chinese) |
| [12] |
刘晓晔, 张涛, 董虹, 等. 白头翁汤对大鼠跨内皮迁移的中性粒细胞溶菌酶的影响[J]. 畜牧兽医学报, 2014, 45(1): 142–146.
LIU X Y, ZHANG T, DONG H, et al. Effects of Pulsatilla decoction on the lysozyme of transendothelial migration of polymorph nuclear neutrophils in rat[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(1): 142–146. (in Chinese) |
| [13] |
王明明, 杨舒, 董虹, 等. 白头翁汤通过保护微血管内皮细胞的完整性及PMNs迁移杀菌功能的影响[J]. 畜牧兽医学报, 2016, 47(4): 836–843.
WANG M M, YANG S, DONG H, et al. Pulsatillae decoction improves the bactericidal capacity of neutrophils by protection of integrity of microvascular endothelial cells[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(4): 836–843. (in Chinese) |
| [14] |
中国兽药典委员会.
中华人民共和国兽药典-二部[M]. 北京: 化学工业出版社, 2010: 590-591.
Committee of Chinese Veterinary Pharmacopoeia. Veterinary pharmacopoeia of the people's republic of China (Volume Ⅱ)[M]. Beijing: Chemical Industry Press, 2010: 590-591. (in Chinese) |
| [15] |
武果桃, 牛国庆. MVECs抗炎症感染作用及应用前景[J]. 养猪, 2019(2): 94–96.
WU G T, NIU G Q. The regulation role in anti inflammation of microvascular endothelial cells[J]. Swine Production, 2019(2): 94–96. DOI: 10.3969/j.issn.1002-1957.2019.02.033 (in Chinese) |
| [16] | LEGROS N, POHLENTZ G, STEIL D, et al. Shiga toxin-glycosphingolipid interaction: status quo of research with focus on primary human brain and kidney endothelial cells[J]. Int J Med Microbiol, 2018, 308(8): 1073–1084. DOI: 10.1016/j.ijmm.2018.09.003 |
| [17] | HUANG J, KELLY C P, BAKIRTZI K, et al. Clostridium difficile toxins induce VEGF-A and vascular permeability to promote disease pathogenesis[J]. Nat Microbiol, 2019, 4(2): 269–279. DOI: 10.1038/s41564-018-0300-x |
| [18] | KONRAD F M, WITTE E, VOLLMER I, et al. Adenosine receptor A2b on hematopoietic cells mediates LPS-induced migration of PMNs into the lung interstitium[J]. Am J Physiol Lung Cell MolPhysiol, 2012, 303(5): L425–L438. DOI: 10.1152/ajplung.00387.2011 |
| [19] |
陈燕燕, 欧希龙. 中性粒细胞影响炎症反应的受控因素及与机体损伤关系[J]. 东南大学学报: 医学版, 2013, 32(4): 511–514.
CHEN Y Y, OU X L. The controlled factors of neutrophils affecting inflammatory response and their relationship with body injury[J]. Journal of Southeast University: Medical Science Edition, 2013, 32(4): 511–514. DOI: 10.3969/j.issn.1671-6264.2013.04.028 (in Chinese) |
| [20] | MALDONADO R F, SÁ-CORREIA I, VALVANO M A. Lipopolysaccharide modification in Gram-negative bacteria during chronic infection[J]. FEMS Microbiol Rev, 2016, 40(4): 480–493. DOI: 10.1093/femsre/fuw007 |
| [21] |
尤青海, 王巾枚, 孙耕耘, 等. PI3K/Akt信号通路参与LPS诱导大鼠肺微血管内皮细胞表达RACK1及rac1[J]. 安徽医科大学学报, 2020, 55(1): 41–45.
YOU Q H, WANG J M, SUN G Y, et al. The PI3K/Akt signaling pathway involved in the expression of RACK1 and rac1 in the rat pulmonary microvascular endothelial cells induced by lipopolysaccharide[J]. Acta Universitatis Medicinalis Anhui, 2020, 55(1): 41–45. (in Chinese) |
| [22] |
刘焕龙, 陈天鹏, 苏素文, 等. Apelin-13对脂多糖诱导大鼠肺微血管内皮细胞炎性因子表达的影响及机制研究[J]. 中国临床药理学杂志, 2020, 36(2): 142–145.
LIU H L, CHEN T P, SU S W, et al. Effects of Apelin-13 on the level of inflammatory factors induced by LPS in rat PMVECs and the mechanisms[J]. The Chinese Journal of Clinical Pharmacology, 2020, 36(2): 142–145. (in Chinese) |
| [23] |
秦劭晨, 王爱梅, 张晋岳, 等. 槲皮素对脂多糖诱导人脑微血管内皮细胞的作用机制[J]. 湖南师范大学自然科学学报, 2019, 42(6): 38–45.
QIN S C, WANG A M, ZHANG J Y, et al. Effect of quercetinon human brain microvascular endothelial cells induced by lipopolysaccharide[J]. Journal of Natural Science of Hunan Normal University, 2019, 42(6): 38–45. (in Chinese) |
| [24] |
康春燕, 李婷, 邹琳, 等. 红景天苷抑制模拟微重力诱导的肺微血管内皮细胞凋亡[J]. 南方医科大学学报, 2011, 31(4): 649–652.
KANG C Y, LI T, ZOU L, et al. Salidroside inhibits clinorotation-induced apoptosis in pulmonary microvascular endothelial cells[J]. Journal of Southern Medical University, 2011, 31(4): 649–652. (in Chinese) |
| [25] | HU G, WANG J J, HONG D, et al. Effects of aqueous extracts of Taraxacum Officinale on expression of tumor necrosis factor-alpha and intracellular adhesion molecule 1 in LPS-stimulated RMMVECs[J]. BMC Complement Altern Med, 2017, 17(1): 38. DOI: 10.1186/s12906-016-1520-3 |
| [26] |
节阳华, 杨晓蓓, 陈卫东. 白头翁汤对结直肠癌小鼠炎性微环境的影响[J]. 广州中医药大学学报, 2020, 37(12): 2406–2412.
JIE Y H, YANG X B, CHEN W D. Effects of baitouweng decoction on inflammatory microenvironment in mice with colorectal cancer[J]. Journal of Guangzhou University of Traditional Chinese Medicine, 2020, 37(12): 2406–2412. (in Chinese) |
| [27] |
李盼盼, 李东阳, 李毅. 白头翁汤治疗溃疡性结肠炎作用机制研究进展[J]. 现代中医药, 2019, 39(6): 130–133.
LI P P, LI D Y, LI Y. Research progress of baitouweng decoction on the treatment of ulcerative colitis[J]. Modern Traditional Chinese Medicine, 2019, 39(6): 130–133. (in Chinese) |
| [28] | CIESIELSKA A, MATYJEK M, KWIATKOWSKA K. TLR4 and CD14 trafficking and its influence on LPS-induced pro-inflammatory signaling[J]. Cell Mol Life Sci, 2021, 78(4): 1233–1261. DOI: 10.1007/s00018-020-03656-y |
| [29] |
严宁, 杨春霞, 马娟, 等. β-谷甾醇对大鼠心肌缺血再灌注损伤和ERK1/2信号通路的影响[J]. 心血管病学进展, 2020, 41(3): 321–325.
YAN N, YANG C X, MA J, et al. Effects of β-sitosterolon myocardial ischemia-reperfusion injury and ERK1/2 signaling pathway in rats[J]. Advances in Cardiovascular Diseases, 2020, 41(3): 321–325. (in Chinese) |
| [30] |
田华, 黄毓娟. 蒲公英多糖对幽门螺杆菌相关性胃炎大鼠胃黏膜炎性反应及MAPK/ERK通路的影响[J]. 现代中西医结合杂志, 2019, 28(35): 3877–3880.
TIAN H, HUANG Y J. Effect of dandelion polysaccharide on gastric mucosal inflammatory response and MAPK/ERK pathway in rats with Helicobacter pylori-associated gastritis[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2019, 28(35): 3877–3880. DOI: 10.3969/j.issn.1008-8849.2019.35.001 (in Chinese) |
| [31] |
廖媛, 池晓玲, 杨以琳, 等. 脂必泰对非酒精性脂肪肝病大鼠肝组织ERK和TLR4表达的影响[J]. 中药药理与临床, 2019, 35(6): 130–134.
LIAO Y, CHI X L, YANG Y L, et al. Effects of zhibitai on the expressions of ERK and TLRs in liver tissues of NAFLD rats[J]. Pharmacology and Clinics of Chinese Materia Medica, 2019, 35(6): 130–134. (in Chinese) |
| [32] | LI Y P, YANG Q. Effect of PD98059 on chemotherapy in patients with colorectal cancer through ERK1/2 pathway[J]. J Buon, 2019, 24(5): 1837–1844. |
| [33] | HOU L, HOU X F, WANG L J, et al. PD98059 impairs the cisplatin-resistance of ovarian cancer cells by suppressing ERK pathway and epithelial mesenchymal transition process[J]. Cancer Biomark, 2017, 21(1): 187–194. DOI: 10.3233/CBM-170644 |
| [34] |
杨扬, 夏冬琴, 王维. 抑制剂PD98059阻断MAPK/ERK信号通路对结直肠癌细胞增殖抑制和凋亡促进作用的研究[J]. 结直肠肛门外科, 2019, 25(6): 657–661, 667.
YANG Y, XIA D Q, WANG W. Effects of inhibitor PD98059 blocking MAPK/ERK pathway on inhibiting proliferation and promoting apoptosis of colorectal cancer cells[J]. Journal of Colorectal & Anal Surgery, 2019, 25(6): 657–661, 667. (in Chinese) |



