2. 北京农学院动物科学技术学院 奶牛营养学北京市重点实验室, 北京 102206
2. Key Laboratory of Dairy Nutrition in Beijing, Animal Sciences and Technology College, Beijing University of Agriculture, Beijing 102206, China
奶牛乳房炎始终是制约全球乳品行业发展最重要的疾病之一。据估计,奶牛乳房炎造成的经济损失占奶牛场常见生产疾病直接总成本的38%[1]。因乳房炎造成的泌乳量及乳品质下降、繁殖力减退、死淘率升高及治疗成本增加等一系列损失更是对奶牛养殖业的惨重打击[1]。目前,抗生素干预仍然是生产实际中用于临床乳房炎(clinical mastitis, CM)治疗的主要措施,广泛使用抗生素治疗可能会增加抗生素耐药菌株的风险,从而对人类健康产生影响。而亚临床乳房炎(subclinical mastitis, SCM),在生产中通常不采取有效的治疗措施[1-2]。尽管没有肉眼可见的炎症症状,SCM的发生已经导致了乳成分的改变[3]。一直以来,乳房炎主要的致病因素被认为是来自外界环境中的致病菌入侵并感染乳腺[1]。然而,近来的研究表明,造成乳房感染的微生物存在着内源途径,即胃肠道菌群对乳房炎同样有着重要的调控作用,这种调控作用可能包括对炎症的引发和缓解[4-5]。
胃肠道菌群已被越来越多的研究证明在非肠组织炎症疾病中发挥着重要作用。可能的机制包括对有限营养物质的直接竞争、参与宿主代谢、免疫系统发育及对抗病原体入侵等[6-7]。有研究发现,胃肠道菌群结构与乳房炎发病之间存在一定的关联性[5, 8-9]。肠道菌群紊乱可诱发乳房炎[5]。反过来,乳房炎患病期间,奶牛瘤胃和粪便中与炎症相关的微生物丰度和促炎代谢产物水平显著增加,而有益共生菌丰度明显下降[8-9]。这种关联性可能基于微生物的“肠-乳腺”内源途径,其具体机制仍需深入研究[4]。基于此,通过调控胃肠道菌群或可实现对乳房炎的缓解。目前的研究表明,饮食结构[10]、胃肠道菌群代谢产物(如SCFAs)[11]、益生菌[12]及肠道共生菌[6]等,对肠外组织(如乳腺)菌群及机体的免疫稳态具有一定的调节作用。本文从奶牛乳房炎的致病因素、胃肠道菌群与乳房炎的关联性及其对乳房炎调控的可能机制等方面进行综述,为奶牛乳房炎的发病机理及生产中的有效防治措施提供一定的参考。
1 奶牛乳房炎 1.1 影响奶牛乳房炎发病的因素奶牛乳房炎的发病原因复杂,尚缺乏明确、系统的致病机制。目前,病原微生物入侵导致乳腺内持续感染[13]和固有免疫反应不足导致易感性增强[14]被认为是奶牛乳房炎发病的主要因素。典型的乳房炎致病菌被分为“传染性”和“环境性”[1]。先前的研究认为,传染性病原体(主要包括金黄色葡萄球菌、停乳链球菌和无乳链球菌等)对宿主具有更高的适应性,因此,能够持续存在于乳腺内并引发SCM。SCM因其潜伏期长、隐蔽性高等特点,在实际生产中的发病率(占乳房炎发病率的90%~95%)远高于CM [15]。同时,这些存在于SCM奶牛中的传染性病原体通常会在挤奶时或挤奶前后在牛群之间传播[3, 15]。相比之下,环境性病原体(主要是大肠杆菌)不适宜在宿主内生存,它们通过入侵、繁殖,引起宿主的免疫反应,然后迅速被机体固有免疫消灭[16]。然而,近来的研究表明,即使在一些管理良好的牧场中,也难以控制环境性病原菌引起的乳房炎,甚至可能出现更高的发病率[17]。一项调查研究显示,在177个牛场的乳房炎发病群体中,80%是由环境性病原菌(主要是大肠杆菌)引起的[18]。
乳房炎的严重程度被认为受到固有免疫反应速度的影响,特别是多形核粒细胞(polymorphonu-clear neutrophils, PMNs)向乳腺的迁移速度[19]。乳中的体细胞是乳腺免疫的关键部分,对保护乳腺内感染至关重要。通常来讲,乳房炎的典型表现为感染乳区的牛奶体细胞数(somatic cell counts, SCCs)显著升高。SCCs较高的奶牛可能会持续感染传染性病原体,因此容易引起复发性乳房炎[1, 8]。然而,有调查研究表明,环乳房炎易感性的增加与低奶缸SCC(somatic cell count in bulk milk, BMSCC)有关(平均BMSCC < 150 000个细胞·mL-1)[20]。Green等[21]也发现,大肠杆菌感染诱发的乳房炎在低BMSCC的牛群中更常见。Goli等[22]用大肠杆菌接种12头奶牛诱导乳房炎,结果发现,血液和牛奶中PMNs数较低的奶牛在乳腺内攻毒时募集细胞速度也较慢,炎症程度也随即加重。以上这些数据表明,奶牛SCC可能会呈现一种“U型”分布,过低(SCC < 100 000个细胞·mL-1)或过高(SCC > 500 000个细胞·mL-1)的SCC都有更高的复发性乳房炎的发病率,这可能分别是由于免疫反应不足或天生对感染的易感性高所致[20]。
1.2 乳房炎对奶牛代谢及免疫水平的影响先前的研究认为,奶牛乳房炎是致病菌入侵乳房导致的局部感染[15]。然而,随着研究的深入,越来越多的证据表明,乳房炎,特别是SCM可能是由全身感染或炎症引起的。反过来,乳房炎可能导致全身性炎症的发生也被认为是合理的[23]。奶牛乳房炎发病期间,上皮细胞间紧密连接的打开,使得血浆中的炎性细胞因子,如IL-8、IL-1和TNF-α等渗入到牛奶中,进而可能损害犊牛肠道[23]。此外,乳房炎发病期间,牛奶中的Na/K比值升高。牛奶Na/K比值与奶牛血浆急性期蛋白显著相关[24]。此外,有研究证实,乳房炎发病期间,奶牛机体代谢异常[25]。Sundekilde等[26]研究发现,乳房炎奶牛牛奶中乳酸、异亮氨酸和β-羟基丁酸的含量增加,而乳糖、马尿酸和富马酸含量降低。一方面,乳糖浓度的下降趋势被发现可能与参与乳糖合成的乳糖合酶的调节亚基和α-乳清蛋白的下调有关;另一方面,乳糖浓度的降低可能是为了维持牛奶的渗透压,以补偿血液成分。此外,乳房炎期间,牛奶中乳酸浓度的增加可能与牛奶中高细菌载量有关,因为乳酸是细菌代谢的最终产物,但也可能是由于宿主厌氧代谢增加所致[25-26]。Thomas等[27]对乳房链球菌感染引起的奶牛乳房炎发病期间的代谢产物变化的研究中发现,大部分碳水化合物和核苷酸代谢产物在感染后81 h呈下降趋势,而脂类代谢产物(如前列腺素F2α(PGF2α)和类花生四烯酸等)和二肽、三肽及四肽在同一时间点呈上升趋势。PGF2α是急性炎症过程中的重要介质,已有研究证实,其在乳腺炎期间被上调。而这些多肽的增加可能是由于蛋白酶降解乳蛋白导致的。此外,由具有炎症调节作用的法尼醇X受体(farnesol X receptor, FXR)介导抗菌活性物质——胆汁酸,在奶牛乳房炎期间的含量显著降低。FXR主要通过抑制NF-κB靶标的表达而发挥抗炎作用,这表明,乳房炎的发生抑制了机体的免疫调节活性[27]。
除了检测到乳腺内蛋白及代谢水平的异常,乳房炎发病期间,奶牛血液中氨基酸(amino acids, AA)代谢和蛋白质生物合成也被证实发生了多种变化。Dervishi等[28]利用GC-MS代谢组学技术发现,奶牛乳房炎发病期间,血清中包括Val、Leu和Ile在内的所有支链氨基酸(branched chain amino acid, BCAA)和淀粉样蛋白A的浓度升高。BCAA参与免疫细胞对蛋白质合成的调节和细胞因子的释放。血清中BCAA水平上升表明机体代谢不良。在感染期间,免疫系统对AA和蛋白质等底物的需求显著增加。全身性炎症反应刺激蛋白质分解代谢以及肌肉蛋白质中AA的释放,为抗体、细胞因子、急性期蛋白质和免疫系统相关蛋白质的合成提供了底物,这可能是导致血清AA浓度增加的部分原因[3, 28]。综上,奶牛乳房内感染期间,不仅出现乳房局部的炎症反应,机体AA、蛋白质、脂类等其他代谢及免疫水平均会受到不利影响。
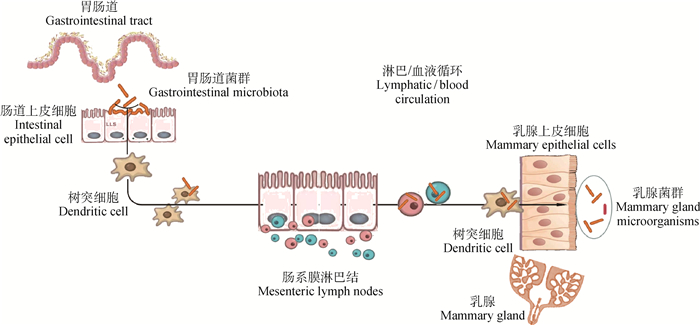
2 胃肠道菌群与乳房炎的关联性 2.1 微生物在胃肠道与乳腺之间的“传递”奶牛瘤胃及肠道中寄居的数量庞大、种类繁多的微生物群是奶牛营养物质消化、能量代谢及免疫反应的主要参与者。近来的研究表明,肠道菌群与非肠组织(包括乳腺)炎症有关[6]。其中一种可能机制是活菌可通过完整的肠道黏膜转移至非肠组织,即细菌易位[4]。一项研究观察到,怀孕和哺乳期小鼠细菌易位(从肠道跨越肠系膜淋巴结最后到达乳腺)频率增加[29]。类似于人类和小鼠中的报道,细菌从肠道迁移到乳腺的机制也被证明发生在奶牛身上。Young等[30]研究了来自同一头健康奶牛的牛奶(使用无菌导管,通过滴管延伸装置收集无菌牛奶样本)、血液及粪便样本的微生物组成及多样性,结果发现,这3种样本中均存在瘤胃球菌属、消化链球菌属和双歧杆菌属。该研究人员据此推测,这些细菌可能是通过循环白细胞从肠道转移到乳腺的。研究表明,来自胃肠道的某些细菌可以通过涉及单核免疫细胞(主要是吞噬细胞)机制进行转移,通过内源性细胞途径(细菌性肠-乳途径)迁移到乳腺[31]。这些单核吞噬细胞主要来自外周血,且具有向树突细胞(dendritic cell, DC)分化的能力,其出现在肠道相关的淋巴组织(gut-associated lymphoid tissues, GALTs),捕获肠道菌群,然后将这些微生物成分运到乳腺(图 1)。GALTs中的淋巴细胞回到乳腺,形成一个“肠-乳腺轴”,并形成“共同的黏膜系统”。在该系统中,肠道与非肠组织(乳腺)的黏膜部位通过免疫细胞的迁移而连接[31]。过去的研究认为,细菌易位通常发生在病理条件下,因此,主要研究致病菌在机体内的传播[4]。事实上,已经有人提出,肠道菌群易位到肠外组织也可发挥有益作用,因为它可能与免疫调节有关[30-31]。总之,内源性“肠道-乳腺通路”的存在为奶牛胃肠道与乳房之间的联系提供了一定的支持。
2.2 肠道菌群对乳房炎的影响胃肠道菌群的一个主要功能是保护胃肠道免受外源性病原体和机体内潜在有害微生物的定植。一旦正常微生物群落被破坏就会增加病原体感染,有害病原体过度生长和炎症疾病的风险。因此,宿主免疫系统和肠道微生物群之间的复杂互作是肠道稳态所必需的[4]。近来有研究发现,肠道菌群紊乱可能引发奶牛乳房炎[5]。该研究将乳房炎奶牛的粪菌移植到无菌小鼠肠道后引发小鼠乳房炎症状,以及血清、脾和结肠的炎症。而移植健康奶牛粪菌,则无此作用。因此,肠道菌群失调可能是引发乳房炎的病因之一。为进一步探究奶牛肠道菌群与乳房炎之间的关系,Ma等[5]对比了健康与乳房炎奶牛粪便菌群及代谢物的差异。结果显示,与健康奶牛相比,乳房炎奶牛粪便中厌氧棒杆菌、多尔氏菌属、毛螺菌科及罗氏菌属等产乙酸和丁酸的菌的丰度显著减少,而颤螺旋菌属丰度显著增加。代谢组结果显示,乳房炎奶牛的肠道中与维生素B相关的代谢途径(包括硫辛酸代谢,维生素B6和硫胺素代谢等)受到明显抑制。维生素B作为许多生化反应的辅助因子可能具有抑制炎症的作用。此外,肠道中其他受抑制的代谢途径(包括赖氨酸生物合成、脂肪酸生物合成,嘌呤和嘧啶代谢及硒代谢等)可能与肠黏膜保护有关。据此推测,乳房炎发病可能与肠道菌群中维生素B代谢紊乱及肠黏膜保护功能受损有关,其机制需要进一步研究[5]。Zhong等[32]研究发现,与低乳SCC(SCC < 200 000个细胞·mL-1)相比,高乳SCC(550 000 < SCC < 1 000 000个细胞·mL-1) 奶牛瘤胃中琥珀酸弧菌科和丁酸弧菌属丰度显著降低,而放线菌门和未分类梭菌科丰度显著增加。Wang等[9]研究表明,与乳房健康的奶牛相比,乳房炎奶牛瘤胃微生物α-多样性显著降低。其中,CM奶牛瘤胃中,与口腔和肠道炎症相关的毛螺菌科、莫拉克斯氏菌属和奈瑟氏菌科的相对丰度随着促炎代谢产物白三烯B4的含量增加显著增加;而SCM奶牛瘤胃中,瘤胃梭菌属和肠杆菌属丰度增加,同时伴随着六亚甲基四胺、5-甲基糠醛和甲氧基蜂毒毒素等与炎症相关代谢物丰度的增加;与健康组相比,SCM和CM组中普雷沃氏菌属_1、双歧杆菌属及2-苯基丁酸的丰度的显著降低。上述研究表明,奶牛乳房炎患病期间,瘤胃与后肠道菌群及其代谢产物(主要与炎症和免疫应答相关)较健康奶牛发生了显著变化。胃肠道菌群与奶牛乳房炎相关性的可能机制主要涉及免疫调节[5, 9, 32]。
在人类乳腺癌的研究中同样发现,微生物从肠道向乳腺组织的易位会导致全身炎症指数的增加,部分原因涉及到胃肠道微生物群及其代谢产物与免疫系统的互作[33]。另有一项研究指出,一些肠道有益共生菌能够参与集体免疫细胞的生成。CD8+ T细胞是可以根除乳腺肿瘤细胞最有效的免疫细胞。胃肠道共生菌中属于变形菌门的鞘氨醇单胞菌能够参与效应CD8+ T细胞(也称为杀伤性T细胞)的成熟。而在乳房炎症发病过程中,鞘氨醇单胞菌的这种能力下降,导致CD8+抗肿瘤细胞毒性T细胞的构建受到阻碍[34]。此外,在人类及小鼠中的研究数据表明,肠道共生菌失调与乳腺组织相关疾病(乳腺炎或乳腺癌)关联性的可能机制还包括雌激素代谢、胰岛素抵抗及血脂异常等[35-36]。
由此可见,外源致病菌入侵感染很可能不是奶牛乳房炎的唯一致病因素,胃肠道菌群完全有可能通过“肠道-乳腺”内源途径进入乳腺。因此,胃肠道菌群紊乱同样会引发奶牛乳房炎。此外,乳房炎奶牛与健康奶牛胃肠道菌群及代谢产物之间存在显著差异。发现的这些可能机制涉及胃肠道菌群与机体免疫系统的互作。
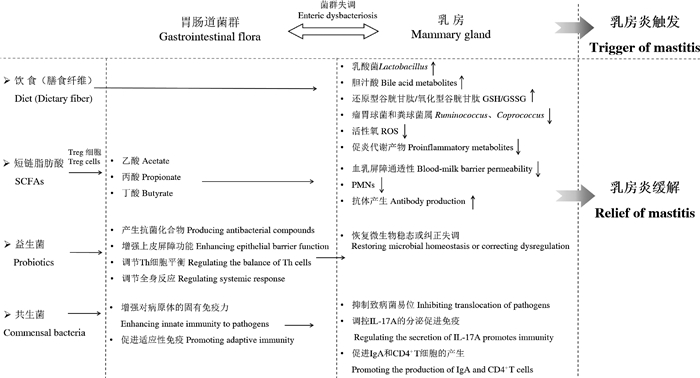
3 胃肠道菌群对乳房炎的调控微生物从肠道转运到乳腺的可能性为通过调控肠道菌群实现对乳房炎的缓解这一科学假设提供了一定的理论依据。研究表明,摄入的益生菌能够通过血液进入乳腺,可以用来对抗与乳房炎发病有关的病原微生物[12]。微生物群对宿主的主要贡献包括碳水化合物的消化和发酵、维生素的生产、GALTs的发育、肠道特异性免疫反应的极化和病原体定植的预防[6]。反过来,由共生菌群诱导的肠道免疫反应同样能够调节肠道微生物群的组成[37]。最近的研究表明,饮食、肠道菌群结构及其代谢产物(如SCFAs)、益生菌和肠道共生菌等均能对乳房健康状态起到重要的调控作用[6, 10-12](图 2)。
|
Treg:调节性T细胞;PMNs: 多形核白细胞 Treg: regulatory T cells; PMNs: polymorphonuclear leukocytes 图 2 胃肠道菌群对乳房炎触发和缓解的调控[6, 10-12] Fig. 2 The trigger and relief of gastrointestinal microbiota to mastitis[6, 10-12] |
食物的类型、质量和来源是塑造肠道菌群组成、影响其结构功能以及与宿主互作的主要因素。近来的一项研究表明,饮食在决定乳腺菌群结构及其代谢产物方面具有至关重要的作用[10]。该研究采用猴子作为试验动物模型,将其随机分为2组,分别接受高膳食纤维和高脂饮食模式,饲养31个月,采集血浆和乳腺组织,对其微生物及代谢产物进行分析。结果表明,食用高脂或高膳食纤维饮食均可以影响乳腺微生物群组成和代谢产物。与高脂饮食喂养的猴子相比,高膳食纤维饮食显著增加了乳腺中乳酸菌属丰度、乳房胆汁酸代谢产物(包括结合型胆汁酸如甘氨胆酸(GCA)、鹅去氧胆酸(CDCA)及牛磺胆酸(TCA)等)水平及还原型谷胱甘肽(GSH)与氧化型谷胱甘肽(GSSG)的比值,而乳腺组织中瘤胃球菌属和粪球菌属丰度、活性氧和促炎代谢产物水平显著下降。相反,高脂饮食喂养的猴子的乳腺组织中瘤胃球菌属、毛螺菌科、颤螺旋菌属和粪球菌属的丰度明显增加[10]。一项调查良性与恶性乳腺肿瘤患者乳腺组织微生物群的研究指出,与良性病变组织相比,恶性乳腺肿瘤的乳腺组织中乳酸杆菌菌属数量显著减少[38]。据报道,乳中乳酸杆菌属数量的减少,可直接导致乳中SCCs的升高,即乳中的乳酸杆菌属有维持乳腺健康和抵抗乳房感染的功效[5]。Jiménez等[39]发现,每天口服乳酸菌的哺乳期妇女的母乳中乳酸杆菌属数量增加,这表明,饮食可以直接影响乳腺微生物群。Shively等[10]研究同样发现,在高膳食饮食喂养的猴子粪便中乳酸杆菌属丰度增加,瘤胃球菌属及粪球菌属的丰度减少。这表明,饮食对肠道和乳腺组织之间存在一些共同调控的微生物群。此外,膳食纤维摄入导致乳腺中胆汁酸代谢物的升高可能增加FXR的活化,这将减少局部雌激素合成,增加乳腺癌细胞凋亡[40]。高膳食纤维饮食减少了乳腺组织中的氧化应激和促炎代谢物,这与具有清除活性氧功能的代谢产物的增加和促炎性氧化脂质产物的减少有关,这表明,高膳食纤维饮食对微生物介导的代谢产物的调节可能会影响乳腺局部的氧化应激[10]。在一项人类的研究中发现,与高脂饮食模式相比,高膳食纤维饮食的女性患亚型乳腺癌的风险更低[41]。膳食纤维发酵促进肠道益生菌的增殖,这些有益共生菌或可通过内吞作用抵达乳腺,抑制致病菌的繁殖,同时也可提高宿主对致病菌的抵抗能力[5, 10]。但其具体机制仍需进一步探究。膳食纤维对乳腺菌群的影响表明,饮食结构对乳腺健康状态可能起到直接的调控作用。
然而,与单胃动物不同,瘤胃是奶牛等反刍动物体内最大的微生物聚集地。瘤胃中容纳的数百万种微生物对奶牛营养物质消化和机体免疫能力起决定性的作用。同时,瘤胃也是奶牛胃肠道中产生SCFAs的主要部位[42]。对于奶牛而言,饲料类型同样能够影响乳房炎的发病。研究表明,奶牛饲料中精料比例过高会导致瘤胃内促炎代谢产物,如生物胺及细菌内毒素脂多糖(lipopolysaccharide,LPS)等浓度增加,进而通过瘤胃壁进入血液,再透过血乳屏障进入乳腺,从而引发乳房炎[43]。因此,通过调控奶牛饲料类型可能也是预防或缓解乳房炎发生的有效途径之一。
3.2 短链脂肪酸对乳房炎的调控肠道菌群发酵纤维产生的SCFAs可通过调节性T细胞(regulatory T cells, Treg)的影响而具有抗炎和免疫调节作用,Treg是维持机体免疫耐受、保持免疫稳态的重要因素[6, 11]。近来的研究表明,肠道菌群对乳腺健康状态调控的另一个关键因素是由SCFAs介导的[44-45]。Hu等[46]比较正常小鼠和肠道菌群失调小鼠(抗生素处理)在金黄色葡萄球菌诱导乳房炎后的生理变化,结果表明,与正常小鼠相比,肠道菌群失调小鼠的血乳屏障通透性增加,乳房炎加重。与此同时,肠道菌群丰富度和多样性降低,且粪便中SCFAs(乙酸、丙酸、丁酸、异丁酸、异戊酸、戊酸)含量显著下降。该研究表明,肠道菌群对金黄色葡萄球菌性乳房炎的保护作用可能是通过调节血乳屏障的通透性来实现的,而这种调控作用的关键可能与SCFAs有关[46]。丙酸和丁酸在宿主对细菌和真菌感染的易感性中起着重要作用[47-48]。研究表明,丙酸可以通过调节血液屏障来预防脂多糖诱导的乳房炎[49]。丁酸可调节小肠细胞生长和分化,是诱导血乳屏障紧密连接蛋白表达重要的营养物质[50]。这些发现表明,SCFAs可能参与了血乳屏障的形成。
与Hu等[46]研究结果类似,Wang等[9]研究发现,与健康奶牛相比,乳房炎奶牛瘤胃中乙酸、丙酸和丁酸浓度显著降低,部分原因可能与乳房炎患病期间采食量下降有关。SCFAs可提高乙酰辅酶A并调节代谢传感器,以促进氧化磷酸化、醣酵解及脂肪酸合成。因此,SCFAs不仅是机体代谢的能量底物,也是支持抗体产生的能量和组件。SCFAs产量降低导致机体在稳态和病原体特异性抗体反应方面均存在缺陷,进而对病原体更为易感[51]。因此,直接或间接补充SCFAs或可实现对乳房炎的缓解。Hu等[46]在乳房炎小鼠腹腔中注射丙酸钠和丁酸钠后发现,血液和乳腺中的丙酸和丁酸水平均升高,血乳屏障通透性降低,乳房炎的严重程度减轻。上述研究表明,SCFAs对乳房炎的调控作用可能是通过支持抗体产生,降低对致病菌的易感性,或通过抑制促炎免疫反应、维持血乳屏障通透性来实现的[9, 44, 49]。
3.3 口服益生菌对乳房炎的调控口服益生菌的主要作用靶点是消化道和肠道微生物群。这些活性的、代谢活跃的益生菌与肠道微生物相互作用,通过恢复微生物稳态或纠正失调来发挥其有益作用[12]。有几项试验研究了口服益生菌对乳房炎影响。Even[52]研究表明,从奶牛乳腺细菌中分离出的乳酸菌用来预防或治疗奶牛乳房炎。Ma等[5]将乳房炎奶牛的粪菌移植给无菌小鼠后引发小鼠乳房炎症,补充干酪乳杆菌后,可减轻炎症症状。de Leblanc等[53]研究了瑞士乳杆菌R389发酵乳对乳房局部炎症存在时免疫应答的调节能力。结果表明,使用L. helveticus R389发酵乳喂养乳房炎小鼠后,小鼠血清和乳腺细胞中IL-10升高,IL-6水平降低,炎症受到明显抑制。
有研究基于16S rRNA基因特征的基础上,提出奶牛乳房炎是由微生物失调引起的,即乳腺中有益共生菌群与引起乳房炎的病原菌之间的不平衡。使用口服途径的基本原理是益生菌通过DC或巨噬细胞,沿“肠-乳腺轴”从肠腔转移到乳腺。益生菌应用于乳房炎的可能机制包括以下几种:1)对肠道微生物群组成和活性的调节,通过代谢物或细菌素产生直接拮抗,或通过竞争营养物质产生竞争排斥。益生菌可产生多种抗菌化合物,如乳酸、SCFAs、过氧化氢、一氧化氮和细菌素等,这些都可能抑制致病菌[54]。2)增强上皮屏障功能。益生菌是肠道屏障功能和完整性的重要介质。益生菌可能以不同的方式对肠道上皮细胞起到有益的作用:①通过提高紧密连接的完整性。黏液层可以限制细菌的移动和与上皮细胞的接触,维持上皮细胞表面分泌的IgA和抗菌肽的有效浓度,并可能作为一些微生物群的黏附或营养的底物;②通过刺激生产抗菌肽的上皮细胞,尤其是潘氏(Paneth)细胞[55]。3)与肠道上皮细胞的相互作用发挥免疫调节作用。益生菌通过与单核细胞、巨噬细胞和DC的相互作用及先天免疫反应,调节辅助性T(T helper, Th)细胞的平衡,从而影响适应性免疫应答。此外,益生菌能够诱导免疫调节,主要通过抑制炎症途径(NF-κB或组胺依赖性途径);或调控上皮相关T细胞,例如产生作用于上皮细胞IL-17的Th17细胞;或通过调节Treg细胞以抑制促炎性信号[56]。4)对全身反应的调节,例如通过内分泌调节或通过信号介导的中枢神经系统[12]。
尽管临床研究表明,口服益生菌可以作为预防和控制乳房炎发展、增强宿主免疫系统的调节剂,但其临床效果仍然存在一部分争议。需要更多的临床试验或前瞻性研究来验证益生菌在乳房炎预防和治疗中的效果,并揭示免疫系统机制。
3.4 肠道共生菌对乳腺组织的保护肠道共生菌对非肠组织(包括乳腺)发挥保护作用的可能机制还包括促进黏膜屏障功能、增强对病原体的固有免疫力及促进适应性免疫等[6]。研究表明,肠道菌群可以通过代谢产物的产生增强上皮屏障功能。例如,双歧杆菌产生的SCFAs(特别是乙酸)作用于肠上皮细胞可抑制大肠杆菌O157:H7产生的志贺毒素的易位[57]。此外,肠道共生菌还可以通过调控IL-17A的分泌来促进免疫[58]。细胞因子IL-17A已被证明在宿主不同上皮部位对细菌和真菌感染的防御中发挥关键作用。Porcherie等[58]通过小鼠乳腺炎模型研究发现,IL-17A参与了乳腺对大肠杆菌感染的防御。利用大肠杆菌诱导小鼠乳房炎后,细菌负荷迅速增加,引发白细胞大量涌入乳腺组织,并增加了IL-6、IL-22、TNF-α和IL-10的浓度。嗜中性粒细胞是第一个向乳腺组织强烈迁移的细胞。而IL-17A产生增加的最主要的贡献者是嗜中性粒细胞,乳房炎感染期间,肠道共生菌可通过激活视黄酸相关的孤儿受体γ(RORγt)信号诱导嗜中性粒细胞产生IL-17A,从而使细菌数量和IL-10产生显著减少[6, 58]。以上结果表明,共生菌通过刺激嗜中性粒细胞产生IL-17A是乳腺组织对大肠杆菌免疫的一个重要效应。如上所述,细菌易位可能诱发乳房炎,这通常与病原体感染和上皮屏障的破坏有关[5, 54]。然而,研究表明,肠道共生细菌能够诱导适应性免疫反应(包括IgA的产生和CD4+ T细胞的产生),这可能有助于防止由致病菌易位而引起的间接损害,并可能通过其他免疫机制对病原体起到清除作用[59]。此外,肠道共生菌诱导肠道Toll样受体(Toll-like receptors, TLR)依赖的DC激活,可抑制肠外组织感染[60]。最近有研究报道,肠道共生细菌可能提供组织特异性防御机制,即宿主皮肤细菌能够对存在于组织局部的病原菌感染提供保护[61]。然而,肠道共生菌对乳腺组织感染是否能够提供类似的防御机制尚不清楚,仍需开展深入研究。
4 小结与展望乳房炎在生产实际中对奶牛机体健康状态、生产性能及繁殖能力造成的损害极为严重。除了外源致病菌入侵感染外,瘤胃及肠道菌群结构紊乱同样能够引发乳房炎。此外,乳房炎发病期间,奶牛瘤胃和肠道菌群及其代谢产物同样发生了显著改变。其机制可能与微生物的“肠道-乳腺”内源途径有关。目前,胃肠道菌群对乳房炎调控的可能机制涉及饮食、肠道菌群代谢产物(如SCFAs)、益生菌及肠道共生菌对肠外组织免疫功能的调控等,然而,其具体作用机制尚不十分明确,需要开展更为深入的研究。
胃肠道菌群在全身性(系统性)炎症疾病中的角色日益凸显,然而,其在乳腺组织相关疾病(如乳腺炎及乳腺癌)中的研究目前主要集中在人和小鼠上,有关奶牛乳房炎的报道极为有限。鉴于奶牛与单胃动物在消化道结构上的明显差异,未来的研究需要进一步明确奶牛乳房炎发病与瘤胃内环境之间存在的相关性及其机制,这对于乳房炎的改善及调控具有关键的指导意义。此外,基于当前的研究基础,进一步探究通过营养调控等手段改善奶牛瘤胃及肠道内环境是否有助于预防和缓解乳房炎的发病,这对于奶牛生产具有实际意义。
| [1] | BOCHNIARZ M, SZCZUBIAŁ M, BRODZKI P, et al. Serum amyloid A as an marker of cow's mastitis caused by Streptococcus sp.[J]. Comp Immunol Microbiol Infect Dis, 2020, 72: 101498. DOI: 10.1016/j.cimid.2020.101498 |
| [2] | DOEHRING C, SUNDRUM A. The informative value of an overview on antibiotic consumption, treatment efficacy and cost of clinical mastitis at farm level[J]. Prev Vet Med, 2019, 165: 63–70. DOI: 10.1016/j.prevetmed.2019.02.004 |
| [3] | ZHANG L, BOEREN S, VAN HOOIJDONK A C M, et al. A proteomic perspective on the changes in milk proteins due to high somatic cell count[J]. J Dairy Sci, 2015, 98(8): 5339–5351. DOI: 10.3168/jds.2014-9279 |
| [4] | ADDIS M F, TANCA A, UZZAU S, et al. The bovine milk microbiota: insights and perspectives from -omics studies[J]. Mol Biosyst, 2016, 12(8): 2359–2372. DOI: 10.1039/C6MB00217J |
| [5] | MA C, SUN Z, ZENG B, et al. Cow-to-mouse fecal transplantations suggest intestinal microbiome as one cause of mastitis[J]. Microbiome, 2018, 6(1): 200–217. DOI: 10.1186/s40168-018-0578-1 |
| [6] | KAMADA N, SEO S U, CHEN G Y, et al. Role of the gut microbiota in immunity and inflammatory disease[J]. Nat Rev Immunol, 2013, 13(5): 321–335. DOI: 10.1038/nri3430 |
| [7] | HONDA K, LITTMAN D R. The microbiome in infectious disease and inflammation[J]. Annu Rev Immunol, 2012, 30: 759–795. DOI: 10.1146/annurev-immunol-020711-074937 |
| [8] | ZHONG Y F, XUE M Y, LIU J X. Composition of rumen bacterial community in dairy cows with different levels of somatic cell counts[J]. Front Microbiol, 2018, 9: 3217. DOI: 10.3389/fmicb.2018.03217 |
| [9] | WANG Y, NAN X M, ZHAO Y G, et al. Rumen microbiome structure and metabolites activity in dairy cows with clinical and subclinical mastitis[J]. J Anim Sci Biotechnol, 2021, 12(1): 36. DOI: 10.1186/s40104-020-00543-1 |
| [10] | SHIVELY C A, REGISTER T C, APPT S E, et al. Consumption of mediterranean versus western diet leads to distinct mammary gland microbiome populations[J]. Cell Rep, 2018, 25(1): 47–56. DOI: 10.1016/j.celrep.2018.08.078 |
| [11] | RICHARDS J L, YAP Y A, MCLEOD K H, et al. Dietary metabolites and the gut microbiota: an alternative approach to control inflammatory and autoimmune diseases[J]. Clin Transl Immunol, 2016, 5(5): e82. DOI: 10.1038/cti.2016.29 |
| [12] | RAINARD P, FOUCRAS G. A critical appraisal of probiotics for mastitis control[J]. Front Vet Sci, 2018, 5: 251. DOI: 10.3389/fvets.2018.00251 |
| [13] | BUITENHUIS B, RØNTVED C M, EDWARDS S M, et al. In depth analysis of genes and pathways of the mammary gland involved in the pathogenesis of bovine Escherichia coli-mastitis[J]. BMC Genomics, 2011, 12(1): 130. DOI: 10.1186/1471-2164-12-130 |
| [14] | LEITE R F, BACCILI C C, DA COSTA E SILVA C P, et al. Passive immunity transfer in calves fed with colostrum from dams with subclinical mastitis[J/OL]. Arq Inst Biol, 2017, 84[2021-05-11]. http://dx.doi.org/10.1590/1808-1657000022015. |
| [15] | GAO J, BARKEMA H W, ZHANG L M, et al. Incidence of clinical mastitis and distribution of pathogens on large Chinese dairy farms[J]. J Dairy Sci, 2017, 100(6): 4797–4806. DOI: 10.3168/jds.2016-12334 |
| [16] | KLAAS I C, ZADOKS R N. An update on environmental mastitis: Challenging perceptions[J]. Transbound Emerg Dis, 2018, 65(S1): 166–185. |
| [17] | SOOPENG K, HARUN D, MAT-AMIN M, et al. Enhanced virgin coconut oil (EVCO) as natural postmilking teat germicide to control environmental mastitis pathogens[J]. Int J Biostechnol Well Ind, 2016, 5(4): 128–134. |
| [18] | PAUDYAL S, MELENDEZ P, MANRIQUEZ D, et al. Use of milk electrical conductivity for the differentiation of mastitis causing pathogens in Holstein cows[J]. Animal, 2019, 14(3): 588–596. |
| [19] | MOLINARI P C C, BLAGITZ M G, LIBERA A M M P D, et al. Intracellular reactive oxygen species production and phagocytosis of Staphylococcus aureus by milk neutrophils as tool to diagnose mastitis and identify susceptible dairy cows[J]. Pesq Vet Bras, 2018, 38(4): 659–664. DOI: 10.1590/1678-5150-pvb-4704 |
| [20] | RAINARD P, FOUCRAS G, BOICHARD D, et al. Invited review: Low milk somatic cell count and susceptibility to mastitis[J]. J Dairy Sci, 2018, 101(8): 6703–6714. DOI: 10.3168/jds.2018-14593 |
| [21] | GREEN M, GREEN L, CRIPPS P. Low bulk milk SCC and toxic mastitis[J]. Vet Rec, 1996, 138(18): 452. |
| [22] | GOLI M, EZZATPANAH H, GHAVAMI M, et al. The effect of multiplex-PCR-assessed major pathogens causing subclinical mastitis on somatic cell profiles[J]. Trop Anim Health Product, 2012, 44(7): 1673–1680. DOI: 10.1007/s11250-012-0123-3 |
| [23] | WANG L J, CHEN Y, LIU W H, et al. Changes of cytokines in serum and whey of dairy cows with subclinical mastitis[J]. J Northeast Agr Univ: English Ed, 2020, 27(3): 65–71. |
| [24] | CHARJAN-KU P Y, MANGLE N S, KALOREY D R, et al. Changes in milk pH and the levels of Na and K in whey associated with udder health status of cow[J]. Indian Vet J, 2000, 77(12): 1066–1068. |
| [25] | SARDARE S S, GUBBAWAR S G, DHURVE N G, et al. Quality assessment of cow milk affected by subclinical mastitis[J]. Pharma Innov J, 2017, 6(11): 75–77. |
| [26] | SUNDEKILDE U K, POULSEN N A, LARSEN L B, et al. Nuclear magnetic resonance metabonomics reveals strong association between milk metabolites and somatic cell count in bovine milk[J]. J Dairy Sci, 2013, 96(1): 290–299. DOI: 10.3168/jds.2012-5819 |
| [27] | THOMAS F C, MUDALIAR M, TASSI R, et al. Mastitomics, the integrated omics of bovine milk in an experimental model of Streptococcus uberis mastitis: 3.Untargeted metabolomics[J]. Mol BioSyst, 2016, 12(9): 2762–2769. DOI: 10.1039/C6MB00289G |
| [28] | DERVISHI E, ZHANG G S, DUNN S M, et al. GC-MS metabolomics identifies metabolite alterations that precede subclinical mastitis in the blood of transition dairy cows[J]. J Proteome Res, 2017, 16(2): 433–446. DOI: 10.1021/acs.jproteome.6b00538 |
| [29] | DONNET-HUGHES A, PEREZ P F, DORÉ J, et al. Potential role of the intestinal microbiota of the mother in neonatal immune education[J]. Proc Nutr Soc, 2010, 69(3): 407–415. DOI: 10.1017/S0029665110001898 |
| [30] | YOUNG W, HINE B C, WALLACE O A M, et al. Transfer of intestinal bacterial components to mammary secretions in the cow[J]. PeerJ, 2015, 3: e888. DOI: 10.7717/peerj.888 |
| [31] | RODRÍGUEZ J M. The origin of human milk bacteria: is there a bacterial entero-mammary pathway during late pregnancy and lactation?[J]. Adv Nutr, 2014, 5(6): 779–784. DOI: 10.3945/an.114.007229 |
| [32] | ZHONG Y F, XUE M Y, LIU J X. Composition of rumen bacterial community in dairy cows with different levels of somatic cell counts[J]. Front Microbiol, 2018, 9: 3217–3227. DOI: 10.3389/fmicb.2018.03217 |
| [33] | FENG Z P, XIN H Y, ZHANG Z W, et al. Gut microbiota homeostasis restoration may become a novel therapy for breast cancer[J]. Investigat New Drugs, 2021, 39(3): 871–878. DOI: 10.1007/s10637-021-01063-z |
| [34] | YANG J Q, TAN Q W, FU Q Y, et al. Gastrointestinal microbiome and breast cancer: correlations, mechanisms and potential clinical implications[J]. Breast Cancer, 2017, 24(2): 220–228. DOI: 10.1007/s12282-016-0734-z |
| [35] | GUNTER M J, XIE X H, XUE X N, et al. Breast cancer risk in metabolically healthy but overweight postmenopausal women[J]. Cancer Res, 2015, 75(2): 270–274. DOI: 10.1158/0008-5472.CAN-14-2317 |
| [36] | MARGOLIS K L, RODABOUGH R J, THOMSON C A, et al. Prospective study of leukocyte count as a predictor of incident breast, colorectal, endometrial, and lung cancer and mortality in postmenopausal women[J]. Arch Intern Med, 2007, 167(17): 1837–1844. DOI: 10.1001/archinte.167.17.1837 |
| [37] | CLARKE T B, DAVIS K M, LYSENKO E S, et al. Recognition of peptidoglycan from the microbiota by Nod1 enhances systemic innate immunity[J]. Nat Med, 2010, 16(2): 228–231. DOI: 10.1038/nm.2087 |
| [38] | HIEKEN T J, CHEN J, HOSKIN T L, et al. The microbiome of aseptically collected human breast tissue in benign and malignant disease[J]. Sci Rep, 2016, 6: 30751. DOI: 10.1038/srep30751 |
| [39] | JIMÉNEZ E, FERNÁNDEZ L, MALDONADO A, et al. Oral administration of Lactobacillus strains isolated from breast milk as an alternative for the treatment of infectious mastitis during lactation[J]. Appl Environ Microb, 2008, 74(15): 4650–4655. DOI: 10.1128/AEM.02599-07 |
| [40] | SWALES K E, KORBONITS M, CARPENTER R, et al. The farnesoid X receptor is expressed in breast cancer and regulates apoptosis and aromatase expression[J]. Cancer Res, 2006, 66(20): 10120–10126. DOI: 10.1158/0008-5472.CAN-06-2399 |
| [41] | CASTELLÓ A, POLLÁN M, BUIJSSE B, et al. Spanish mediterranean diet and other dietary patterns and breast cancer risk: case-control EpiGEICAM study[J]. British J Cancer, 2014, 111(7): 1454–1462. DOI: 10.1038/bjc.2014.434 |
| [42] | ASCHENBACH J R, PENNER G B, STUMPFF F, et al. Ruminant nutrition symposium: role of fermentation acid absorption in the regulation of ruminal pH[J]. J Anim Sci, 2011, 89(4): 1092–1107. DOI: 10.2527/jas.2010-3301 |
| [43] |
刘小倩, 刘颖, 荣超, 等. ACE2在奶牛乳腺中的表达定位及其抗炎性损伤作用的研究[J]. 畜牧兽医学报, 2017, 48(3): 552–560.
LIU X Q, LIU Y, RONG C, et al. Expression localization of angiotensin converting enzyme 2 (ACE 2) in dairy cow mammary gland and its anti-inflammation effect[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(3): 552–560. (in Chinese) |
| [44] | BOLLRATH J, POWRIE F. Immunology.Feed your tregs more fiber[J]. Science, 2013, 341(6145): 463–464. DOI: 10.1126/science.1242674 |
| [45] | FURUSAWA Y, OBATA Y, FUKUDA S, et al. Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells[J]. Nature, 2013, 504(7480): 446–450. DOI: 10.1038/nature12721 |
| [46] | HU X Y, GUO J, ZHAO C J, et al. The gut microbiota contributes to the development of Staphylococcus aureus-induced mastitis in mice[J]. ISME J, 2020, 14(7): 1897–1910. DOI: 10.1038/s41396-020-0651-1 |
| [47] | CIARLO E, HEINONEN T, HERDERSCHEE J, et al. Impact of the microbial derived short chain fatty acid propionate on host susceptibility to bacterial and fungal infections in vivo[J]. Sci Rep, 2016, 6(1): 37944. DOI: 10.1038/srep37944 |
| [48] | LASITSCHKA F, GIESE T, PAPARELLA M, et al. Human monocytes downregulate innate response receptors following exposure to the microbial metabolite n-butyrate[J]. Immun Inflamm Dis, 2017, 5(4): 480–492. DOI: 10.1002/iid3.184 |
| [49] | WANG J J, WEI Z K, ZHANG X, et al. Propionate protects against lipopolysaccharide-induced mastitis in mice by restoring blood-milk barrier disruption and suppressing inflammatory response[J]. Front Immunol, 2017, 8: 1108. DOI: 10.3389/fimmu.2017.01108 |
| [50] | WANG J J, WEI Z K, ZHANG X W, et al. Butyrate protects against disruption of the blood-milk barrier and moderates inflammatory responses in a model of mastitis induced by lipopolysaccharide[J]. Brit J Pharmacol, 2017, 174(21): 3811–3822. DOI: 10.1111/bph.13976 |
| [51] | KIM M, QIE Y Q, PARK J, et al. Gut microbial metabolites fuel host antibody responses[J]. Cell Host Microbe, 2016, 20(2): 202–214. DOI: 10.1016/j.chom.2016.07.001 |
| [52] | EVEN S. Mastitis prevention with mammary probiotics[J]. Dairy Global, 2017, 3(2): 20–21. |
| [53] | DE LEBLANC A D M, MATAR C, LEBLANC N, et al. Effects of milk fermented by Lactobacillus helveticus R389 on a murine breast cancer model[J]. Breast Cancer Res, 2005, 7(4): R477–R486. DOI: 10.1186/bcr1032 |
| [54] | SANDERS M E, BENSON A, LEBEER S, et al. Shared mechanisms among probiotic taxa: implications for general probiotic claims[J]. Curr Opin Biotechnol, 2018, 49: 207–216. DOI: 10.1016/j.copbio.2017.09.007 |
| [55] | OHLAND C L, MACNAUGHTON W K. Probiotic bacteria and intestinal epithelial barrier function[J]. Am J Physiol Gastronintest Liver Physiol, 2010, 298(6): G807–G819. DOI: 10.1152/ajpgi.00243.2009 |
| [56] | KLAENHAMMER T R, KLEEREBEZEM M, KOPP M V, et al. The impact of probiotics and prebiotics on the immune system[J]. Nat Rev Immunol, 2012, 12(10): 728–734. DOI: 10.1038/nri3312 |
| [57] | FUKUDA S, TOH H, HASE K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate[J]. Nature, 2011, 469(7331): 543–547. DOI: 10.1038/nature09646 |
| [58] | PORCHERIE A, GILBERT F B, GERMON P, et al. IL-17A is an important effector of the immune response of the mammary gland to Escherichia coli infection[J]. J Immunol, 2015, 196(2): 803–812. |
| [59] | SORINI C, CARDOSO R F, GAGLIANI N, et al. Commensal bacteria-specific CD4+ T Cell responses in health and disease[J]. Front Immunol, 2018, 9: 2667. DOI: 10.3389/fimmu.2018.02667 |
| [60] | YIU J H C, DORWEILER B, WOO C W. Interaction between gut microbiota and toll-like receptor: from immunity to metabolism[J]. J Mol Med (Berl), 2017, 95(1): 13–20. DOI: 10.1007/s00109-016-1474-4 |
| [61] | NAIK S, BOULADOUX N, WILHELM C, et al. Compartmentalized control of skin immunity by resident commensals[J]. Science, 2012, 337(6098): 1115–1119. DOI: 10.1126/science.1225152 |