2. 广汉市农业农村局, 德阳 618300
2. Guanghan Agricultural and Rural Bureau, Deyang 618300, China
鸭甲肝病毒(duck hepatitis A virus, DHAV)是引起雏鸭一种急性、高度接触性、高致死性传染病的病原[1]。我国是水禽养殖大国,近年来我国多省出现DHAV的疫情,给养鸭业造成了巨大的损失[2-5]。根据基因序列特征和遗传进化分析可将DHAV分为3个血清型,分别是血清1型(DHAV-1)、2型(DHAV-2)和3型(DHAV-3)[6-8]。2012年以前,我国大陆地区流行的DHAV主要是DHAV-1,2013年以后DHAV-3逐渐取代DHAV-1成为优势流行毒株,在所有流行毒株中3型DHAV占比57.1%[9],且常常与DHAV-1混合感染[10],流行毒株的改变给防控带来了困难。DHAV-2主要在中国台湾省发生,未在大陆地区流行过。鸭甲型肝炎防控以免疫防治为主,随着不同血清型DHAV的流行趋势的变化,疫苗的研究也向两种血清型的二价疫苗方向发展[1, 11-13],并且已有批准的产品上市[14]。但是由于免疫失败、免疫抑制以及母源抗体水平低等原因[15-16],常常导致雏鸭的发病。所以传统的鸭肝炎卵黄抗体仍然很受养殖企业和养殖户的欢迎,针对DHAV-1和DHAV-3双价卵黄抗体的研究也越来越多[17-18],并且有双价卵黄抗体获批上市[19]。卵黄抗体虽然具有很好的临床预防和治疗效果,但是如果出现多血清型或者基因型混合感染往往会导致预防和治疗失败,造成损失。如果制备卵黄抗体的抗原所诱导的中和性抗体含量少,在产品效价低的情况下,也可能造成预防和治疗的效果不理想。因此,对于鸭甲型肝炎的防控需要转变策略和思路。广谱中和单克隆抗体是可以中和不同毒株或者不同亚型的抗体,其广谱性能够在一定程度上解决混合感染导致的治疗性抗体失去效果的问题,一些病毒的广谱中和抗体被证明有较好的交叉保护效力[20-22]。其高效性大大提高治疗性抗体的中和作用,提高治疗效果。鉴于我国鸭甲肝病毒多血清型混合感染的情况[9-10],研制DHAV的广谱中和单克隆抗体对于该病的防控具有重要意义。
VP1蛋白是DHAV的外膜蛋白,是病毒变异发生的主要区域,但是VP1蛋白中又存在相对保守的区域,这些区域是该病毒的优势抗原区[11, 23]。研究发现DHAV-1和DHAV-3 VP1基因之间的核苷酸序列(67.8%~72.0%)和氨基酸序列(67.6%~ 77.7%)都有一定的相似性,DHAV-3 VP1抗原可以与DHAV-1的阳性血清发生交叉反应[24-25],因此DHAV-1和DHAV-3 VP1基因间可能存在相同的抗原决定簇。也有研究报道VP1基因中可能存在适合作为中和抗体和受体结合的靶点[26],可用于广谱中和单克隆抗体研制。
本研究针对DHAV-1和DHAV-3 VP1共同抗原表位,制备与DHAV-1和DHAV-3发生交叉反应的单克隆抗体,并采用Real-time RT-PCR方法测定抗体对病毒增殖的抑制率、鸭胚中和试验和雏鸭预防保护试验鉴定单抗的中和活性,旨在筛选出具有广谱中和活性的单克隆抗体,用于1型和3型DHAV感染的高效预防和治疗。可达到一针防两型和一针治两型的效果,具有很大的应用前景,而其所识别的抗原表位也可为进一步研制鸭肝炎的广谱卵黄抗体及治疗性疫苗奠定基础。
1 材料与方法 1.1 材料1.1.1 病毒株及血清 DHAV-1(SMU3522)、DHAV-3(SMU3523)、新城疫病毒(NDV, SMU2185)和鸭瘟病毒(DPV, SMU2491)均由西南民族大学动物医学实验室冻干保存,经蔗糖密度梯度离心纯化后使用;禽流感病毒灭活抗原(AIV,H7 N7),购自哈尔滨维科生物技术开发有限公司。DHAV-1、DHAV-3、NDV、DPV、AIV鼠抗阳性血清均由本实验室制备并保存。鼠阴性血清,自行采集后分离血清。
1.1.2 实验动物与细胞株 6周龄BALB/c雌性小鼠(SPF级),体重20 g±2 g,购自成都达硕生物科技有限公司;SP2/0小鼠骨髓瘤细胞和杂交瘤细胞株由西南民族大学动物医学实验室保存;12日龄鸭受精卵(SPF级),购自中国农业科学院哈尔滨兽医研究所;1日龄健康雏鸭,购自成都克里莫育种有限公司。
1.1.3 主要试剂 小鼠McAb亚类鉴定用ELISA试剂盒购自北京奥拓免疫技术有限公司;双功能交联剂SMPH和羊抗鼠IgG-HRP由Thermo公司生产;改良型R/MINI-1640培养基和胎牛血清由Gibco公司生产;钥孔血蓝蛋白(KLH)载体蛋白和弗氏佐剂购自Sigma公司;ELISA包被板由Corning公司生产;Dotblot显色液试剂盒由Roche公司生产;硝酸纤维素膜由GE公司生产;总核酸提取试剂盒购自洛阳莱普生物生科技公司;反转录试剂盒和TB Green Ⅱ均购自大连宝生物公司;其他试剂为国产分析纯。
1.2 方法1.2.1 抗原表位肽的设计合成和偶联 通过软件比对本实验室分离到的DHAV-1和DHAV-3流行毒株的VP1基因序列以及GenBank中的序列,筛选出DHAV-1和DHAV-3 VP1蛋白共有的氨基酸序列的区域,设计DHAV-1和DHAV-3共同的特异性抗原表位。设计的表位肽长度为14肽,设计原则避开信号肽、跨膜区、特殊结构、疏水区以及半胱氨酸含量多的区域。通过NCBI网站上的BLAST工具确定抗原位点的保守性后,送上海生工生物有限公司进行合成。在肽段的C-端添加半胱氨酸残基,按照双功能交联剂SMPH说明书的操作方法,将合成肽C-端上半胱氨酸残基与KLH载体蛋白偶联,作为小鼠免疫的抗原备用。同时,将合成肽与牛血清白蛋白(BSA)载体偶联,作为检测抗原备用。
1.2.2 动物免疫 将设计的抗原肽制备的抗原混合为两组,1~6号为1组,7~12号为1组,然后分别与弗氏完全佐剂和不完全佐剂乳化后腹腔皮下注射免疫3只BALB/c小鼠,每次免疫100 μg·只-1,每2周免疫1次,共免疫5次。5免后小鼠眼底静脉采血,采用间接ELISA方法检测小鼠血清的效价,抗原肽抗原包被10 ng·孔-1,用5%脱脂乳PBST封闭2 h,小鼠血清1∶4 000起始,4倍倍比稀释,一抗37 ℃孵育1 h,羊抗鼠IgG酶标二抗稀释度为1∶5 000,37 ℃孵育45 min;加显色液37 ℃显色15 min,加入终止液后读取OD450nm吸光值,经过方法的优化,OD450nm值大于0.25对应的血清稀释度判断为小鼠血清效价。选择抗血清效价大于1∶8 000的小鼠脾,用于杂交瘤细胞的制备。
1.2.3 阳性杂交瘤细胞的筛选与克隆 取血清效价大于1∶8 000的免疫小鼠脾细胞与SP2/0骨髓瘤细胞按照参考文献[27]的方法进行融合,融合后培养良好的细胞,抽取上清液用“1.2.2”的间接ELISA方法检测,一抗稀释度为1∶1 000,羊抗鼠IgG酶标二抗稀释度为1∶5 000。将检测结果为阳性且只有单个细胞的细胞孔细胞进行亚克隆,经过3次同样操作克隆化,直至所有克隆化细胞孔ELISA检测阳性率为100%,获得杂交瘤细胞株。
1.2.4 小鼠腹水的制备及效价测定 取1×106个·mL-1的阳性杂交瘤细胞腹腔注射BALB/c雌性小鼠制备腹水,用Dot blot方法检测小鼠腹水抗体的效价。将BSA偶联的多肽蛋白点到硝酸纤维素膜上(每个点2 μL),分别含有25.00、5.00、1.00、0.25、0.05、0.01 ng偶联的多肽,5%脱脂乳/TBS-T 37 ℃封闭1 h。用1∶1 000稀释的腹水37 ℃孵育1 h,TBS-T洗3次,1∶5 000的羊抗鼠IgG酶标二抗37 ℃孵育45 min,TBST洗涤3次。最后加入ECL试剂,加封保鲜膜,在暗室曝光X-ray胶片显影。当抗体的灵敏度小于0.25 ng时,抗体效价视为合格。
1.2.5 腹水中单抗交叉反应活性的鉴定 交叉反应活性的鉴定采用本实验室已建立的DHAV-1和DHAV-3的ELISA方法进行,用按文献[28]的方法纯化的DHAV-1和DHAV-3病毒液包被ELISA板,包被浓度为4 μg·mL-1,100 μL·孔-1,37 ℃包被2 h,3% BSA 37 ℃封闭1 h,McAb (一抗)做3个稀释度,分别为1∶500、1∶5 000、1∶50 000,一抗(小鼠腹水抗体)孵育时间为1 h,羊抗鼠IgG酶标二抗稀释度为1∶10 000,二抗孵育时间为0.5 h,最后显色,ELISA吸光值高于阳性血清的吸光值判为有交叉反应,测定12株McAb对DHAV-1和DHAV-3的交叉反应性。
1.2.6 McAb特异性鉴定 McAb特异性鉴定分别按照本实验室已建立的DPV、NDV和AIV的间接ELISA方法进行,分别用纯化的DPV、NDV和AIV包被ELISA板,5% BSA作为封闭液,37 ℃封闭的时间分别1、2和1 h,一抗(小鼠腹水抗体)的稀释度分别为1∶1 000、1∶1 000和1∶1 500,孵育时间均为1 h,羊抗鼠IgG酶标二抗的稀释度分别1∶7 000、1∶10 000和1∶8 000,孵育时间均为0.5 h,操作步骤参照ELISA的常规操作步骤进行。
1.2.7 McAb体亚型鉴定 按照北京奥拓免疫技术有限公司的小鼠McAb亚类鉴定ELISA试剂盒说明书进行McAb亚型的鉴定。
1.2.8 McAb对DHAV-1和DHAV-3抑制率的测定 取用0.45 μm滤器过滤的McAb 100 μL分别与等体积200ELD50的DHAV-1(ELD50:10-7.5·0.2 mL-1)和DHAV-3(ELD50:10-6.5·0.2 mL-1) 混匀;同时用100 μL PBS缓冲液分别与等体积200 ELD50的DHAV-1和DHAV-3混匀,作为病毒对照组。37 ℃孵育1 h后,待测的各个McAb分别尿囊腔接种20枚12日龄鸭胚(0.2 mL·枚-1),其中McAb与DHAV-1接种5枚,McAb与DHAV-3接种5枚,PBS与DHAV-1接种5枚,PBS与DHAV-3接种5枚。然后每天观察3次,弃去24 h内死亡的鸭胚,收集24~84 h内死亡鸭胚,接种84 h后将存活鸭胚置4 ℃冰箱过夜,收集各组所有鸭胚肝提取RNA,按照Prime ScriptTMRT试剂盒的说明书的方法反转录合成cDNA,以cDNA为模板,采用Real-time RT-PCR方法[29-30]分别扩增DHAV-1、DHAV-3,以鸭β-actin作为内参基因[10],利用2-△△Ct法进行相对定量分析,比较各组鸭胚肝中病毒荷载量,计算McAb对病毒繁殖的抑制效率。
1.2.9 McAb中和效价的测定 取用0.45 μm滤器过滤的McAb,用PBS倍比稀释为2-1、2-2、2-3、2-4、2-5共5个梯度,分别与等体积的200ELD50DHAV-1和DHAV-3病毒液混和,37 ℃孵育1 h后,接种于12日龄的SPF鸭胚尿囊腔,每个浓度梯度接种5枚胚(0.2 mL·枚-1),接种后的鸭胚放回37 ℃孵化箱中继续孵化,每天观察3次,弃去24 h内死亡的鸭胚,记录24~120 h内死亡和存活的鸭胚数量,根据Reed-Muench公式计算得出每株McAb分别对DHAV-1和DHAV-3的中和效价。
1.2.10 McAb对DHAV-1和DHAV-3的攻毒保护率测定 根据McAb对DHAV增殖的抑制率和McAb对DHAV中和效价,选出对DHAV中和效果最好的几株McAb,评价各株McAb对DHAV感染的预防效果。将1日龄雏鸭按照随机分10个组(10只·组-1),分别为试验1~8组和对照1~2组。试验1~4组分别腿部肌内注射C1、C4、C7、C16 McAb(1 mL·只-1,对DHAV-1病毒的琼扩效价为1∶256),试验5~8组分别腿部肌内注射各个McAb(1 mL·只-1,对DHAV-3病毒的琼扩效价为1∶256),对照1~2组注射等量PBS。注射McAb后24 h,试验1~4组和对照1组注射DHAV-1病毒(100 LD50·只-1),试验5~8组和对照2组注射DHAV-3病毒(100 LD50·只-1)。攻毒后继续饲养,每天观察3次,记录雏鸭的健康状况和每组死亡雏鸭的数量,剖检死亡雏鸭观察病变情况,连续观察8 d,并对每株McAb保护效果进行统计分析,计算各McAb的保护率。
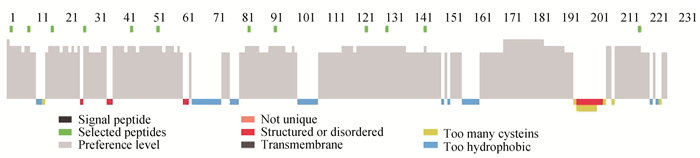
2 结果 2.1 设计合成的抗原肽DHAV-1和DHAV-3的VP1蛋白共有的氨基酸序列的区域为238个氨基酸,用SEALTM软件设计的表位分析图如图 1,绿色小方块代表设计表位的位置,避开了信号肽、跨膜区、特殊结构、疏水区以及半胱氨酸含量多的区域,同时又是DHAV-1和DHAV-3共有的氨基酸区域,设计合成12条长度为14 aa的肽段,见表 1。
|
图 1 DHAV-1和DHAV-3 VP1蛋白共有表位氨基酸序列的分析结果 Fig. 1 Epitope analysis of VP1 amino acid sequences shared by DHAV-1 and DHAV-3 |
|
|
表 1 共有抗原表位的信息 Table 1 Information of shared epitope |
杂交瘤细胞经3次亚细胞克隆纯化和间接ELISA方法筛选,共得到12株杂交瘤细胞,分别为C1、C2、C3、C4、C5、C7、C9、C10、C12、C13、C14、C16。
2.3 小鼠腹水效价用Dot blot方法检测小鼠腹水效价,12株杂交瘤细胞制备的小鼠腹水中抗体Dot blot检测的灵敏度均小于或等于0.25 ng(表 2),说明抗体效价水平能满足后续筛选之用。
|
|
表 2 斑点印迹检测McAb的效价 Table 2 Dot blot titers of McAb |
间接ELISA结果显示,12株杂交瘤细胞制备的抗体中,有6株可以同时和DHAV-1和DHAV-3病毒发生特异性反应,ELISA的OD450 nm吸光值均显著大于DHAV-1和DHAV-3的阳性血清(P≤0.05),编号分别是C1、C4、C7、C12、C13、C16,见表 3,可用于后续试验。它们的亚型分别为IgG1、IgG2b、IgG2a、IgG2b、IgG2b、IgG2a。
|
|
表 3 McAb交叉反应性鉴定结果(OD450 nm值,x±s,n=3) Table 3 Results of McAb cross-reactivity identification (OD450 nm value, x±s, n=3) |
6株杂交瘤细胞的抗体分别与DPV、AIV和NDV抗原进行ELISA反应,结果显示,C1、C4、C7、C12、C13和C16 OD值均分别显著小于NDV、AIV和DPV阳性血清的OD值(P≤0.05),与NDV、AIV和DPV阴性血清的OD值接近,见表 4。按照实验室已建立的DPV、NDV和AIV的ELISA方法的判断标准进行评价,说明这6株McAb不与NDV、AIV和DPV的抗原发生反应,特异性较好。
|
|
表 4 McAb特异性鉴定结果(OD450nm值,x±s,n=3) Table 4 Specific identification of the McAb (OD450nm value, x±s, n=3) |
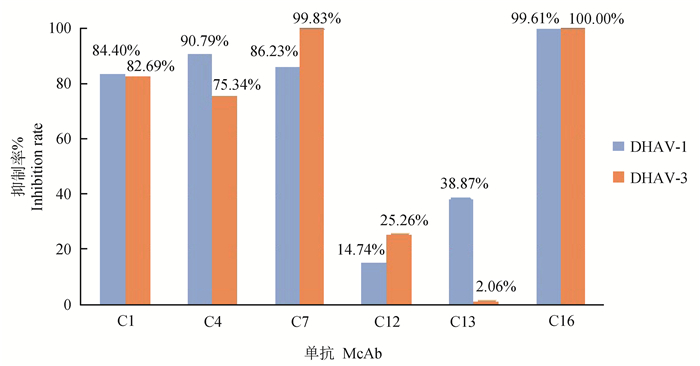
2.6.1 McAb对DHAV-1增殖的影响 对各组鸭胚肝中DHAV-1病毒的定量检测结果及相对定量处理数据见表 5。从表 5可见,6株McAb C1、C4、C7、C12、C13和C16株对DHAV-1的增殖均有不同程度的抑制作用,抑制率分别为84.40%、90.79%、86.23%、14.74%、38.87%、和99.61%;其中C1、C4、C7和C16株对DHAV-1抑制率大于50%,表明上述4株McAb对DHAV-1在鸭胚中的复制均具有显著的抑制作用。McAb C4和C16对DHAV-1的抑制率分别达到90.79%和99.61%,为所有McAb中效果最佳。
|
|
表 5 6株单克隆抗体对DHAV-1和DHAV-3增殖的抑制情况 Table 5 Inhibition of DHAV-1 and DHAV-3 proliferation by 6 strains of monoclonal antibodies |
2.6.2 McAb对DHAV-3增殖的影响 对各组鸭胚肝中DHAV-3病毒的定量检测结果及相对定量处理数据见表 5。从表 5可见,C1、C4、C7、C12、C13和C16株对DHAV-3增殖的抑制率分别为82.69%、75.34%、99.83%、25.26%、2.06%和100%;6株中C1、C4、C7、C16对DHAV-3抑制作用高于50%,其中C7、C16的抑制率分别高达99.83%和100%。
2.6.3 McAb对DHAV-1和DHAV-3的交叉中和活性 对上述6株McAb对DHAV-1和DHAV-3的抑制情况分析发现,C1、C4、C7、C16株对两种血清型的DHAV在鸭胚中的复制都具有很强的抑制作用,说明这4株McAb对DHAV-3和DHAV-1具有良好交叉中和作用,其中C12有微弱的交叉中和活性,而C13则几乎没有交叉保护活性,如图 2。
|
图 2 6株单克隆抗体对DHAV-1和DHAV-3增殖的抑制情况 Fig. 2 Inhibition of DHAV-1 and DHAV-3 proliferation by 6 strains of monoclonal antibodies |
McAb中和效价测定结果显示,C7对DHAV-1和DHAV-3的中和效价是所有McAb中最高的,分别是1∶10和1∶11;C16对两种血清型毒株的中和效价均为1∶9;C1对DHAV-1和DHAV-3的中和效价分别为1∶3和1∶5;C4对DHAV-1和DHAV-3的中和效价均为1∶3;C12、C13对DHAV-1和DHAV-3均无中和效价。
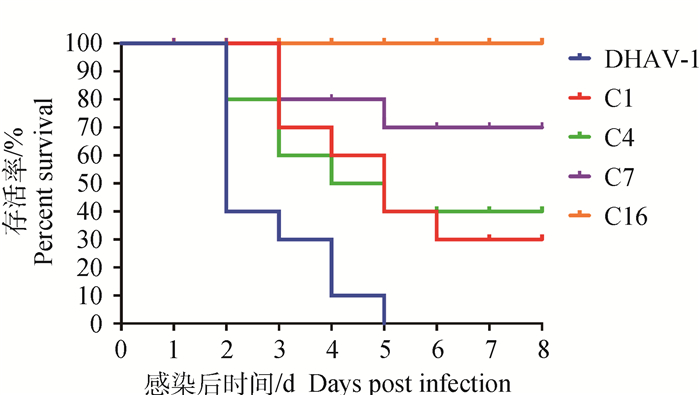
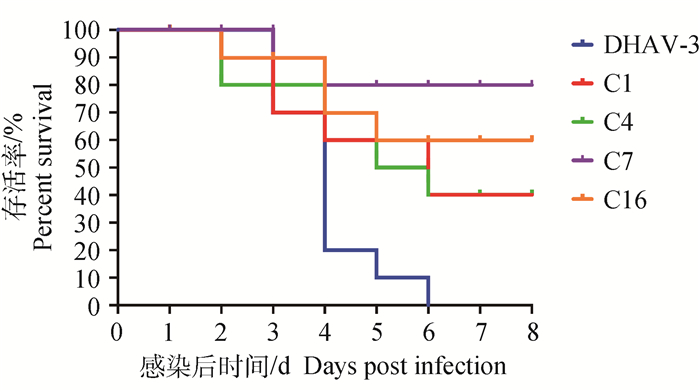
2.8 McAb攻毒保护率统计试验中各组雏鸭的死亡数,分别计算4株McAb对DHAV的攻毒保护率,结果如图 3、4。从图中可以看出C7和C16对两种血清型病毒感染雏鸭都具有良好的保护作用,C7对DHAV-1和DHAV-3病毒保护率分别为70%、80%,C16对DHAV-1病毒的保护率达到100%,对DHAV-3病毒的保护率为60%。而C1和C4对DHAV-1和DHAV-3病毒保护率相对较低,分别为30% & 40%、40% & 40%,但仍然具有一定的保护力。病毒对照组(DHAV-1和DHAV-3)的雏鸭全部死亡,死亡率为100%,死亡雏鸭均表现出典型鸭肝炎的临床症状和剖检变化。
|
图 3 DHAV-1攻毒组雏鸭生存曲线 Fig. 3 Duck survival curve of DHAV-1 virus challenge group |
|
图 4 DHAV-3攻毒组雏鸭生存曲线 Fig. 4 Duck survival curve of DHAV-3 virus challenge group |
McAb可以与病毒发生中和反应,降低病毒对动物机体组织破坏,减少动物体内病毒数量,可以有效地提升疾病治愈率[31]。McAb在动物疫病的防控和治疗中应用广泛,同时也可作为新型检测方法和治疗手段开发的基础,此外McAb在病毒结构的分析、中和表位的鉴定、免疫学诊断以及抗病毒治疗方面也发挥着重要的作用[1]。关于DHAV的McAb研究方面也有诸多进展,李晓军等[32]用纯化的DHAV-1型病毒作为抗原免疫小鼠后得到了10株McAb,其中有6株McAb与DHAV-1和3型的DHAV的病毒都能产生交叉反应。夏琳琳[33]用DHAV-3的全病毒为抗原制备的McAb与DHAV-1也能发生特异性的反应,但是反应效果较3型的弱。张瑞华等[24]使用DHV VP1蛋白制备的McAb 4F8对DHAV-1和DHAV-3都有微弱的中和作用。上述研究表明,DHAV-1和DHAV-3病毒间确实存在共有抗原表位,这为开发具有交叉中和活性McAb的研究奠定了理论基础。
本研究综合考虑信号肽、跨膜区、特殊结构、疏水区、胱氨酸含量多的区域以及抗原位点的保守性和种属特异性等因素来设计筛选特异性的抗原表位,显著提高了抗原位点选择的准确性。将与KLH载体蛋白偶联的抗原多肽片段作为免疫原,用常规McAb制备技术共获得了12株杂交瘤细胞株,并大量制备相应的抗体腹水,经间接ELISA检测,证明其中6株细胞的抗体可以同时识别DHAV- 1和DHAV-3病毒,为特异性McAb。中和试验显示其中4株McAb具有广谱中和活性。攻毒保护试验确定了C7和C16 2株McAb对DHAV-1和DHAV-3交叉中和效果最佳。筛选到其中6株细胞产生的抗体同时识别DHAV- 1和DHAV- 3病毒,而另外6株与两个亚型病毒都不反应,出现这样的结果的可能原因是筛选单克隆细胞株时ELISA包被的抗原是抗原表位肽,而进行交叉反应性试验时ELISA包被抗原是全病毒,不发生反应的6株杂交瘤细胞所识别的抗原表位肽在全病毒中可能被包裹在内部或者具有空间结构,所以产生的抗体不与全病毒发生反应。本研究筛选到的12株杂交瘤细胞所对应的抗原表位虽然未公布,但是对12株杂交瘤细胞所对应7个抗原表位进行分析发现,C7和C16 2株单抗所针对的表位相同,但产生的中和活性却有差异,C7对DHAV-1、DHAV-3病毒保护率分别为70%、80%,C16分别为100%和60%。导致中和活性差异的原因很多,其中抗体的亚型便是其一,但是本研究的亚型鉴定发现,C7和C16的亚型相同,均为IgG2a,因此排除这方面原因。还有研究证实,蛋白质的序列或结构特征在一定程度上影响着抗原表位生物学特性[34-35],而且受到蛋白质二级结构的影响较大。范卫国等[36]研究发现DHAV VP1结构蛋白的二级结构较为复杂,含有较多的β片层结构和转角结构,有多个区域为B细胞优势表位。黄良宗等[37]表明DHAV VP1蛋白C端第132~137、177~186、209~219区段有较好的亲水性、表面可及性和较高的抗原指数,并且在二级结构上含有易形成抗原表位的无规则卷曲和β-转角,可能是VP1蛋白的B细胞抗原优势表位。C7和C16所识别的抗原表位相同,表位序列包括132~137区段,有较多而复杂的二级结构,所以可能是所识别的二级空间结构的差异导致了保护率的不同。
国内分别针对DHAV-1和DHAV-3制备的McAb有很多研究报道[32, 38-40],本研究通过比对DHAV-1和DHAV-3多个流行毒株的VP1蛋白基因序列,找到DHAV两个血清型病毒共有的保守的序列,然后设计抗原表位多肽作为抗原制备了McAb,与只针对一个血清型的McAb相比,可以同时中和两血清型的不同毒株,具有广谱中和活性。张瑞华等[24]、汪铭书等[41]研制出同时识别DHAV-1和DHAV-3的McAb。但是这些研究都只证明了McAb可以同时与DHAV-1和DHAV-3发生交叉反应,汪铭书等没有检测McAb对两个血清型病毒的中和活性,张瑞华等研制的McAb对DHAV-1和DHAV-3只有微弱的中和作用。因此推断他们研制的McAb针对的表位只有识别功能而没有中和活性,比较适于检测方法的研究,不能应用于防控或治疗。而本研究通过测定McAb对两种血清型病毒增殖的抑制率、中和效价以及攻毒保护效力,证实所筛选的McAb对两种血清型病毒具有很好的中和活性,可以用于DHAV的防控和治疗,具有很好的应用前景。
中和活性很好的C7和C16两株McAb所对应的抗原表位的序列是已知的(已测未公布),可以人工合成后使用,能大大降低生产成本。该抗原表位可作为免疫原研制亚单位疫苗,用于免疫预防。还可以用于制备广谱中和活性的卵黄抗体,制备的卵黄抗体不仅可以预防DHAV两种血清型病毒的感染,而且具有更高的防治效力,从而为我国鸭病毒性肝炎的预防和治疗产品的开发提供新思路。McAb虽然具有很好的治疗和预防效果,但是生产成本高昂,用于临床生产价格过高,不利于推广使用。同时抗原表位肽属于小分子物质,免疫原性比较差,所以不管是作为亚单位疫苗还是作为制备广谱中和活性的卵黄抗体的抗原都有局限性。因此本研究的后续工作是,第一,McAb鸭源化的研究。第二,提高抗原表位肽的免疫原性的研究。
4 结论成功研制出对1型和3型DHAV具有交叉中和活性的McAb 4株,其中2株对病毒的感染具有良好的预防效果,可用于1型和3型DHAV感染的高效预防和治疗,具有很好的应用前景,同时也为DHA的防控提供了新思路。
| [1] | KANG M, ROH J H, JANG H K. Protective efficacy of a bivalent live attenuated vaccine against duck hepatitis A virus types 1 and 3 in ducklings[J]. Vet Microbiol, 2018, 214: 108–112. DOI: 10.1016/j.vetmic.2017.12.018 |
| [2] | GAN Y J, HUANG C H, WANG X Z, et al. Epidemiological investigation of duck hepatitis A virus (DHAV) isolated from Sichuan basin by RT-PCR disclose the existence of mixed infection and the feasibility of DHAV-A Evolved from C80 strain[J]. Pak Vet J, 2014, 34(3): 356–360. |
| [3] |
徐倩, 陈琳琳, 张瑞华, 等. 鸭甲肝病毒3型2012年山东分离株VP1基因的序列分析[J]. 病毒学报, 2013, 29(5): 522–528.
XU Q, CHEN L L, ZHANG R H, et al. Sequence analysis of VP1 gene of the duck hepatitis a virus type 3 strains isolated from Shandong province of China in 2012[J]. Chinese Journal of Virology, 2013, 29(5): 522–528. (in Chinese) |
| [4] |
何冉娅, 于淼, 张玉玲, 等. 2007~2009年华南地区鸭肝炎病毒流行病学调查及分离株的VP1基因变异分析[J]. 中国动物传染病学报, 2010, 18(1): 7–17.
HE R Y, YU M, ZHANG Y L, et al. Epidemiological investigation and genetic variation in VP1 gene of duck hepatitis virus isolates from in Southwestern China in 2007-2009[J]. Chinese Journal of Animal Infectious Diseases, 2010, 18(1): 7–17. DOI: 10.3969/j.issn.1674-6422.2010.01.002 (in Chinese) |
| [5] | ZHANG R, XIA L, CHEN J, et al. Molecular epidemiology and genetic diversity of duck hepatitis A virus type 3 in Shandong province of China, 2012-2014[J]. Acta Virol, 2017, 61(4): 463–472. DOI: 10.4149/av_2017_409 |
| [6] | FU Y, PAN M, WANG X Y, et al. Molecular detection and typing of duck hepatitis A virus directly from clinical specimens[J]. Vet Microbiol, 2008, 131(3-4): 247–257. DOI: 10.1016/j.vetmic.2008.03.011 |
| [7] | WANG L Y, PAN M, FU Y, et al. Classification of duck hepatitis virus into three genotypes based on molecular evolutionary analysis[J]. Virus Genes, 2008, 37(1): 52–59. DOI: 10.1007/s11262-008-0233-1 |
| [8] |
皮晋魁, 张焕容, 汤承, 等. 14株基因C型鸭甲肝病毒分离株的VP1基因变异及其编码蛋白的抗原表位分析[J]. 中国兽医科学, 2012, 42(3): 243–252.
PI J K, ZHANG H R, TANG C, et al. Genetic heterogeneity in VP1 gene and VP1 protein antigenic epitope of 14 strains of genotype C duck hepatitis A virus[J]. Chinese Veterinary Science, 2012, 42(3): 243–252. (in Chinese) |
| [9] | WEN X, ZHU D, CHENG A, et al. Molecular epidemiology of duck hepatitis a virus types 1 and 3 in China, 2010-2015[J]. Transbound Emerg Dis, 2018, 65(1): 10–15. DOI: 10.1111/tbed.12741 |
| [10] |
马静, 汤承, 岳华. 雏鸭混合感染基因A型和基因C型鸭甲肝病毒研究[J]. 西南民族大学学报: 自然科学版, 2014, 40(2): 192–195.
MA J, TANG C, YUE H. Diagnosis of simultaneously infection of duck hepatitis A virus genotype A and duck hepatitis A virus genotype C in duckling[J]. Journal of Southwest University for Nationalities: Natural Science Edition, 2014, 40(2): 192–195. DOI: 10.3969/j.issn.1003-4271.2014.02.06 (in Chinese) |
| [11] |
郑文卿, 宋敏训, 李建亮, 等. 表达1型和3型鸭甲型肝炎病毒VP1基因重组新城疫病毒的构建及其免疫原性[J]. 中国兽医学报, 2017, 37(9): 1641–1647.
ZHENG W Q, SONG M X, LI J L, et al. Generation and evaluation of recombinant Newcastle disease viruses (NDV) expressing VP1 gene of duck hepatitis A viruses (DHAV) type 1 and 3[J]. Chinese Journal of Veterinary Science, 2017, 37(9): 1641–1647. (in Chinese) |
| [12] |
银凤桂, 李晶, 张爽, 等. 鸭病毒性肝炎二价灭活疫苗(DHAV-SH和DHAV-FS株)的制备和评价[J]. 生物工程学报, 2015, 31(11): 1579–1588.
YIN F G, LI J, ZHANG S, et al. Development and evaluation of an inactivated bivalent vaccine against duck viral hepatitis[J]. Chinese Journal of Biotechnology, 2015, 31(11): 1579–1588. (in Chinese) |
| [13] |
王继练, 张焕容, 王栋. 基因A型和C型鸭甲型肝炎病毒卵黄抗体的研制及应用[J]. 动物医学进展, 2016, 37(9): 43–48.
WANG J L, ZHANG H R, WANG D. Development and application of egg yolk antibodies against hepatitis a virus genotypes A and C[J]. Progress in Veterinary Medicine, 2016, 37(9): 43–48. DOI: 10.3969/j.issn.1007-5038.2016.09.010 (in Chinese) |
| [14] |
张金强, 刘海涛, 杨傲冰, 等. 鸭病毒性肝炎二价(YB3株+GD株)灭活疫苗对鸭肝流行毒株的攻毒保护试验[J]. 山东畜牧兽医, 2018, 39(4): 6–7.
ZHANG J Q, LIU H T, YANG A B, et al. Challenge test of an inactivated bivalent vaccine (Strain YB3 and GD)against duck viral hepatitis[J]. Shandong Journal of Animal Science and Veterinary Medicine, 2018, 39(4): 6–7. DOI: 10.3969/j.issn.1007-1733.2018.04.004 (in Chinese) |
| [15] | ZHANG X L, CAO C, LIU Y, et al. Comparative liver transcriptome analysis in ducklings infected with duck hepatitis A virus 3 (DHAV-3) at 12 and 48 hours post-infection through RNA-seq[J]. Vet Res, 2018, 49(1): 52. DOI: 10.1186/s13567-018-0545-7 |
| [16] | XIE J Y, WANG M S, CHENG A C, et al. Cytokine storms are primarily responsible for the rapid death of ducklings infected with duck hepatitis A virus type 1[J]. Sci Rep, 2018, 8(1): 6596. DOI: 10.1038/s41598-018-24729-w |
| [17] |
卢荣辉, 刘小龙, 肖隆华, 等. 鸭甲型病毒性肝炎最新研究进展[J]. 福建农业学报, 2017, 32(3): 336–341.
LU R H, LIU X L, XIAO L H, et al. The latest research progress of duck hepatitis a virus[J]. Fujian Journal of Agricultural Sciences, 2017, 32(3): 336–341. (in Chinese) |
| [18] |
徐保娟, 宫晓, 郭伟伟, 等. 鸭病毒性肝炎二价精制卵黄抗体的制备方法: 中国, CN102827275A[P]. 2012-12-19.
XU B J, GONG X, GUO W W, et al. Method for preparing duck virus hepatitis divalent refined egg yolk antibody: CN, CN102827275A[P]. 2012-12-19. (in Chinese) |
| [19] |
宋扬, 李建华, 藏玉婷, 等. 鸭病毒性肝炎二价(1型+3型)卵黄抗体(JS株+SD株)被动免疫持续期研究[J]. 中国动物保健, 2016, 18(9): 77–79.
SONG Y, LI J H, ZANG Y T, et al. The passive immunity duration research of duck viral hepatitis bivalent (Type1+Type3) yolk antibody (strain JS+strain SD)[J]. China Animal Health, 2016, 18(9): 77–79. (in Chinese) |
| [20] |
陈雪晴, 祁贤, 焦永军. 甲型流感病毒广谱中和抗体研究进展[J]. 江苏预防医学, 2007, 28(2): 169–172.
CHEN X Q, QI X, JIAO Y J. Research progress of broadly neutralizing antibodies against influenza A virus[J]. Jiangsu Journal of Preventive Medicine, 2007, 28(2): 169–172. (in Chinese) |
| [21] |
张婷, 陈雪, 刘洪洋, 等. HPV31型L2保守中和表位可诱发广谱中和抗体[J]. 基础医学与临床, 2017, 37(11): 1552–1556.
ZHANG T, CHEN X, LIU H Y, et al. Conservative epitope of human papillomavirus type 31 L2 can induce broad-spectrum neutralizing antibodies[J]. Basic & Clinical Medicine, 2017, 37(11): 1552–1556. DOI: 10.3969/j.issn.1001-6325.2017.11.011 (in Chinese) |
| [22] |
邹森, 张岱, 胡园园, 等. HIV-1广谱中和活性感染者假病毒的中和表型分析[J]. 中国热带医学, 2017, 17(7): 646–649, 674.
ZOU S, ZHANG D, HU Y Y, et al. Neutralization phenotype of the Env-pseudoviruses from an HIV-1 infected individual with broadly neutralizing activity[J]. China Tropical Medicine, 2017, 17(7): 646–649, 674. (in Chinese) |
| [23] |
崔嘉琦, 张雪莲, 刘悦, 等. DHAV-3 VP1蛋白优势抗原区的初步鉴定[J]. 黑龙江畜牧兽医, 2017(17): 53–57.
CUI J Q, ZHANG X L, LIU Y, et al. The initial identification of dominant epitope region of DHAV-3 VP1[J]. Heilongjiang Animal Science and Veterinary Medicine, 2017(17): 53–57. (in Chinese) |
| [24] | ZHANG R H, ZHOU G M, XIN Y H, et al. Identification of a conserved neutralizing linear B-cell epitope in the VP1 proteins of duck hepatitis A virus type 1 and 3[J]. Vet Microbiol, 2015, 180(3-4): 196–204. DOI: 10.1016/j.vetmic.2015.09.008 |
| [25] |
杨发龙, 张焕容, 程方明, 等. 基于基因C型鸭甲肝病毒VP1重组蛋白的鸭甲肝病毒抗体ELISA检测方法的建立[J]. 畜牧兽医学报, 2014, 45(7): 1148–1153.
YANG F L, ZHANG H R, CHENG F M, et al. Development of an indirect ELISA for detecting antibodies against genotype A and C duck hepatitis a virus based on recombinant VP1 protein[J]. Acta Veterinaria et Zootechnica Sinica, 2014, 45(7): 1148–1153. (in Chinese) |
| [26] | LI X J, ZHAO R, LIN W, et al. Evidence of VP1 of duck hepatitis A type 1 virus as a target of neutralizing antibodies and involving receptor-binding activity[J]. Virus Res, 2017, 227: 240–244. DOI: 10.1016/j.virusres.2016.10.018 |
| [27] | NELSON P N, REYNOLDS G M, WALDRON E E, et al. Monoclonal antibodies[J]. Mol Pathol, 2000, 53(3): 111–117. DOI: 10.1136/mp.53.3.111 |
| [28] |
何美琳, 张焕容, 程方明, 等. 基因C型鸭甲肝病毒竞争ELISA抗体检测方法的建立[J]. 中国预防兽医学报, 2015, 37(3): 211–215.
HE M L, ZHANG H R, CHENG F M, et al. Development of a competitive ELISA for detecting antibodies against genotype C duck hepatitis A virus based on the monoclonal antibody[J]. Chinese Journal of Preventive Veterinary Medicine, 2015, 37(3): 211–215. DOI: 10.3969/j.issn.1008-0589.2015.03.12 (in Chinese) |
| [29] | HUANG Q X, YUE H, ZHANG B, et al. Development of a real-time quantitative PCR for detecting Duck hepatitis A virus genotype C[J]. J Clin Microbiol, 2012, 50(10): 3318–3323. DOI: 10.1128/JCM.01080-12 |
| [30] |
陈玉环. Ⅰ型与新Ⅰ型鸭肝炎病毒分离鉴定及实时荧光定量RT-PCR方法的建立[D]. 哈尔滨: 东北农业大学, 2003.
CHEN Y H. Identities and establishment of real-time FQ-PCR of DHV-IA and DHV-IC[D]. Harbin: Northeast Agricultural University, 2003. (in Chinese) |
| [31] |
张琳琳. 杂交瘤技术制备单克隆抗体研究进展[J]. 生物学教学, 2016, 41(8): 2–4.
ZHANG L L. Research progress of monoclonal antibody preparation by hybridoma technique[J]. Biology Teaching, 2016, 41(8): 2–4. (in Chinese) |
| [32] |
李晓军, 张婷婷, 孟凡依, 等. 抗Ⅰ型鸭肝炎病毒单克隆抗体的制备及其生物学特性鉴定[J]. 中国预防兽医学报, 2011, 33(6): 487–489.
LI X J, ZHANG T T, MENG F Y, et al. Preparation of monoclonal antibodies against DHV-1 and their identification of biological characters[J]. Chinese Journal of Preventive Veterinary Medicine, 2011, 33(6): 487–489. (in Chinese) |
| [33] |
夏琳琳. DHAV-3山东分离株P1基因序列分析及单克隆抗体的制备[D]. 泰安: 山东农业大学, 2015.
XIA L L. Sequence analysis of P1 gene of DHAV-3 strains isolated from Shandong province and preparation of monoclonal antibody for SD1101[D]. Taian: Shandong Agricultural University, 2015. (in Chinese) |
| [34] | BJÖRKLUND H V, HIGMAN K H, KURATH G. The glycoprotein genes and gene junctions of the fish rhabdoviruses spring viremia of carp virus and hirame rhabdovirus: analysis of relationships with other rhabdoviruses[J]. Virus Res, 1996, 42(1-2): 65–80. DOI: 10.1016/0168-1702(96)01300-7 |
| [35] | LI D, PAN L, XIE Y M, et al. Prediction and identification-based prediction of Chinese hepatitis C viral-specific cytotoxic T lymphocyte epitopes[J]. J Med Virol, 2011, 83(8): 1315–1320. DOI: 10.1002/jmv.22053 |
| [36] |
范卫国, 杜佳慧, 曹瑞兵, 等. 新型鸭肝炎病毒GD1株VP1结构蛋白的基因分析及B细胞抗原表位预测[J]. 畜牧与兽医, 2011, 43(1): 65–68.
FAN W G, DU J H, CAO R B, et al. Gene analysis and B cell epitope prediction of VP1 structural protein of a novel duck hepatitis virus strain GD1[J]. Animal Husbandry & Veterinary Medicine, 2011, 43(1): 65–68. (in Chinese) |
| [37] |
黄良宗, 刘鳗仪, 王淑敏, 等. 鸭肝炎病毒VP1蛋白B细胞抗原表位预测及变异分析[J]. 中国家禽, 2011, 33(20): 27–30.
HUANG L Z, LIU M Y, WANG S M, et al. B cell epitopes prediction and variations of duck hepatitis virus VP1 protein[J]. China Poultry, 2011, 33(20): 27–30. (in Chinese) |
| [38] |
提金凤, 李志杰, 王海燕, 等. Ⅰ型鸭肝炎病毒VP1蛋白单克隆抗体的研制[J]. 中国动物传染病学报, 2012, 20(3): 7–11.
TI J F, LI Z J, WANG H Y, et al. Production and characterization of monoclonal antibodies against VP1 proteinof Ⅰ type duck hepatitis virus[J]. Chinese Journal of Animal Infectious Diseases, 2012, 20(3): 7–11. DOI: 10.3969/j.issn.1674-6422.2012.03.002 (in Chinese) |
| [39] |
杨萍萍, 宋敏训, 艾武, 等. 鸭肝炎病毒单克隆抗体的研制[J]. 中国预防兽医学报, 2006, 28(2): 212–216.
YANG P P, SONG M X, AI W, et al. Preparation and identification of monoclonal antibodies against duck hepatitis virus[J]. Chinese Journal of Preventive Veterinary Medicine, 2006, 28(2): 212–216. DOI: 10.3969/j.issn.1008-0589.2006.02.024 (in Chinese) |
| [40] |
潘朋朋, 文力正, 单振振, 等. 鸭肝炎病毒单克隆抗体的制备[J]. 中国农学通报, 2011, 27(1): 415–418.
PAN P P, WEN L Z, SHAN Z Z, et al. Preparation of monoclonal antibody against duck hepatitis virus[J]. Chinese Agricultural Science Bulletin, 2011, 27(1): 415–418. (in Chinese) |
| [41] |
汪铭书, 程安春, 杨旸. 同时识别1型和3型鸭甲型肝炎病毒的单克隆抗体及其杂交瘤细胞株和应用: 中国, CN106811444A[P]. 2017-06-09.
WANG M S, CHENG A C, YANG Y. Monoclonal antibody capable of simultaneously recognizing duck hepatitis A virus 1 and duck hepatitis A virus 3, and hybridoma cell strain and application thereof: CN, CN106811444A[P]. 2017-06-09. (in Chinese) |



