2. 中牧实业股份有限公司, 北京 100095;
3. 生物饲料添加剂北京市重点实验室, 北京 100193
2. China Animal Husbandry Industry Co. Ltd., Beijing 100095, China;
3. Beijing Key Laboratory of Biological Feed Additive, Beijing 100193, China
赖氨酸是猪日粮中的第一限制性氨基酸,赖氨酸的需要量是按照日粮配方中特定的百分比表示。以5~10 kg的断奶仔猪为例,赖氨酸的需要量与猪的品种、断奶日龄、日粮类型和养殖条件等因素有关。在适宜范围内,赖氨酸水平的提高可以促进其他氨基酸的吸收和利用,提高猪的日增重和饲料转化效率,从而改善猪的生长性能[1-2]。当赖氨酸缺乏时,机体自身蛋白质降解,蛋白质和肌肉组织沉积减少[3]。
氨基酸只有在被肠道吸收后才能被肠外组织所利用[4],这是畜禽利用日粮蛋白质的重要步骤。研究表明,小肠上皮细胞的增殖与凋亡是维持细胞正常生理活动的重要部分,对发挥肠道的正常功能非常重要。哺乳动物的肠道上皮细胞也是体内增殖与凋亡最快的细胞,平均4~5 d更新一次,此过程需要诸多的营养物质。氨基酸可促进细胞增殖、细胞凋亡、细胞迁移,并维持肠道屏障等功能[5-7]。有研究表明,谷氨酰胺、精氨酸、亮氨酸和谷氨酸可以加快肠道上皮细胞蛋白质的周转,从而促进细胞的增殖[8]。同时,氨基酸还可参与相关转运载体的调控,如日粮添加赖氨酸可显著提高肉鸡肠道中b0, +和y+氨基酸转运载体的表达[9],也可显著上调育肥猪回肠中氨基酸和小肽的表达。此外,单独增加葡萄糖或氨基酸的浓度也会促进成纤维细胞的增殖[10]。
目前,国内外关于赖氨酸过量添加以及营养调控相关机制的研究较少。本研究旨在进一步探究在低蛋白质玉米-豆粕型日粮与体外培养细胞的培养基中添加过量的赖氨酸,对断奶仔猪生长性能、器官指数、腹泻率、血液学指标、肠道上皮细胞增殖等指标的影响,并探究其原因,为调整饲料配方中赖氨酸等氨基酸的添加量提供试验依据。
1 材料与方法 1.1 试验动物、日粮与细胞动物饲养试验在国家饲料工程技术研究中心丰宁动物试验基地进行。试验选取144头28 d断奶的杜×长×大三元杂交仔猪,初始体重为(8.39±0.02) kg,随机分为4组,每组6个重复,每个重复6头仔猪(3头阉公猪和3头母猪)。各组仔猪分别饲喂含有不同赖氨酸(1.3%、2.6%、3.9%和5.2%)的玉米-豆粕型日粮。除赖氨酸水平外,所有日粮的其他营养成分基本维持在相同水平。根据NRC(2012)中规定的体重在7~11 kg和11~25 kg仔猪的营养需要量进行配制。
仔猪自由采食和饮水,记录每日饲养情况和腹泻情况。饲养28 d后结束试验,并对所有断奶仔猪进行称重。
试验基础日粮组成和营养成分见表 1。本试验所用赖氨酸为98%赖氨酸盐酸盐,其L-赖氨酸含量≥78%。
|
|
表 1 试验日粮组成及营养水平 Table 1 Ingredient composition and nutrient levels of the diets |
本试验使用的细胞是猪小肠上皮细胞(IPEC-J2),培养基是添加10%胎牛血清、1%胰岛素-转铁蛋白-亚硒酸钠和5 μg·L-1表皮生长因子的DMEM/F12完全培养基。将IPEC-J2细胞接种于培养皿中,置于37 ℃、5% CO2条件下培养,用细胞计数仪计数,使细胞个数在104个·孔-1左右时进行后续试验。
1.2 动物屠宰和样品采集在试验结束时(28 d),从每栏中挑选1头体重接近该栏平均值的断奶仔猪。空腹12 h后,用抗凝真空采血管和非抗凝真空采血管从仔猪前腔静脉采集血液样品分别用于血常规、血生化和血清氨基酸等指标分析。非抗凝釆血管采集的血液样品在4 ℃下,以3 500 r·min-1离心10 min分离血清,分装后置于-80 ℃保存。所有仔猪采取电击放血法屠宰,取十二指肠、空肠和回肠组织[11],用磷酸缓冲盐溶液冲洗食糜后,将肠段浸没于4%多聚甲醛溶液中,用于后续的肠道形态和病理分析。
1.3 测定指标及方法 1.3.1 动物试验指标测定1.3.1.1 日粮组分 日粮的干物质、粗蛋白质、总磷、钙、常用氨基酸分别根据中华人民共和国国家标准GB/T 6435—2014[12]、GB/T 6432—2018[13]、GB/T 6437—2018[14]、GB/T 6436—2018[15]、GB/T18246—2019[16]和GB/T15399—2018[17]相应方法进行测定。
1.3.1.2 生长性能及腹泻率 记录并计算0~14 d、15~28 d和0~28 d每栏仔猪的平均日采食量、平均日增重和耗料增重比。每天观察并记录每头猪的粪便情况,并计算0~14 d、15~28 d和0~28 d断奶仔猪的腹泻率,腹泻率=试验期内该栏仔猪腹泻的总头次/(该栏猪头数×试验天数)×100%[18]。
1.3.1.3 器官指数 屠宰后,取仔猪的心、肝、脾、肺和肾等器官称重,并计算器官指数。器官指数=器官重/体重×100%。
1.3.1.4 血液生理生化指标 取仔猪的血液样品,抗凝真空采血管采集的血液用多功能全自动血常规分析仪(MindrayBC-2800,深圳,中国),分析红细胞计数(red blood cell,RBC)、血红蛋白(haemoglobin,HGB)、红细胞比积(hematokrit,HCT)、平均红细胞体积(mean corpuscular volume,MCV)与平均红细胞血红蛋白含量(mean corpuscular hemoglobin,MCH)等血常规指标。
非抗凝真空采血管采集的血液样品,分离血清,测定生化参数[19]和氨基酸等指标。经全自动生化分析仪(Hitachi 7020,Hitachi High-Technologies Corporation,日本),测定血清中的总蛋白(total protein,TP)、白蛋白(albumin,ALB)、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)等生化指标。将0.5 mL血清置于离心试管中,加入1.5 mL磺基水杨酸(4%),振荡摇匀,冰浴20 min。再加入氢氧化锂,充分振荡摇匀,并吸取2 mL置于专用离心管中,4 ℃条件下11 000×g离心30 min,取上清液经0.22 μm滤膜过滤,采用氨基酸分析仪(S-433D氨基酸分析仪,赛卡姆公司,德国),通过锂离子交换色谱柱与茚三酮在130 ℃的环境下进行衍生反应,测定游离氨基酸浓度。免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白M(immunoglobulin M,IgM)及免疫球蛋白G(immunoglobulin G,IgG)采用比色法,按照试剂盒(北京华英生物技术研究所,中国)说明书,使用全自动生化仪(日立7160型,日立集团,日本)进行测定。钙(calcium,Ca)、钾(kalium,K)、钠(sodium, Na)和氯(chlorine,Cl)等无机离子测定采用离子电极法,按照Beckman试剂盒说明书,使用(贝克曼DXC800,美国贝克曼库尔特公司,美国)设备进行测定。类胰岛素生长因子-Ⅰ(insulin-like growth factor-Ⅰ,IGF-Ⅰ)、胰岛素(insulin,INS)、胰高血糖素(glucagon,GLU)等激素指标,按照试剂盒(北京华英生物技术研究所,中国)说明书,使用全自动放免计数仪(r-911型,中国科技大学实业总公司,中国)进行测定。
1.3.1.5 肠道形态 取4%多聚甲醛固定后的十二指肠、空肠和回肠组织,包埋后切为4 μm的切片置于载玻片上,进行苏木精-伊红染色操作。每个样品至少做3张切片,每个切片选取10个完整而典型的绒毛视野,利用Olympus BX 51显微镜(深圳,中国)观察小肠形态。通过放大40 × 10倍数,对绒毛高度和隐窝深度进行测量,并计算两者的比值。统计并记录每100个肠上皮细胞中杯状细胞的数目。
1.3.1.6 组织病理学 取经4%多聚甲醛固定后的肝、肾组织,用石蜡包埋后,经过修块、脱水和包埋等程序后切片,切片制作方法同“1.3.1.5”,用苏木精-伊红染色,晾干,在显微镜下进行组织病理观察与分析,并拍摄代表性的样本。
1.3.2 细胞处理及指标测定1.3.2.1 不同赖氨酸浓度对IPEC-J2细胞增殖的影响 以DMEM/F12培养基中已含有的赖氨酸浓度0.5 mmol·L-1为对照,将IPEC-J2细胞分别加入1、2、4或8 mmol·L-1的赖氨酸,共5个处理,每个处理10个重复,处理24 h后,通过CCK-8试剂盒测定细胞的增殖情况。
1.3.2.2 氨基酸平衡对细胞增殖的影响 以DMEM/F12培养基中原有的赖氨酸浓度为0.5 mmol·L-1为基础,按照DMEM/F12培养基中氨基酸的组分及浓度比例(表 2),配制如下处理液:处理1:0.5 mmol·L-1赖氨酸;处理2:2.0 mmol·L-1赖氨酸(4倍浓度);处理3:2.0 mmol·L-1赖氨酸+ 其他必需氨基酸(1~9,4倍浓度);处理4:2.0 mmol·L-1赖氨酸+ 其他必需氨基酸+ 条件性必需氨基酸(1~15,4倍浓度);处理5:2.0 mmol·L-1赖氨酸+ 所有的氨基酸(1~21,4倍浓度)。将IPEC-J2细胞处理24 h,每个处理10个重复,用CCK-8试剂盒测定细胞增殖情况。
|
|
表 2 氨基酸的组分及浓度 Table 2 Composition and concentration of amino acids |
1.3.2.3 碱性氨基酸平衡对细胞增殖情况的影响 以DMEM/F12培养基中原有的赖氨酸浓度0.5 mmol·L-1为基础,以NRC(2012)中仔猪营养需要的碱性氨基酸比例关系,将IPEC-J2细胞分别加入以下5个处理。处理1:0.5 mmol·L-1赖氨酸;处理2:2.0 mmol·L-1赖氨酸;处理3:2.0 mmol·L-1赖氨酸+ 0.91 mmol·L-1精氨酸;处理4:2.0 mmol·L-1赖氨酸+ 0.69 mmol·L-1组氨酸;处理5:2.0 mmol·L-1赖氨酸+ 0.91 mmol·L-1精氨酸+ 0.69 mmol·L-1组氨酸。每个处理10个重复,处理24及48 h后,用CCK-8试剂盒测定细胞增殖情况。
1.4 统计方法采用SAS 8.1的GLM模型中的ANOVA程序进行数据统计分析,通过线性和二次效应评估。若不同处理间存在显著差异,则进一步采用Duncan’s多重比较法进行检验。以平均值和SEM来表示统计结果。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果 2.1 日粮添加不同水平的赖氨酸对断奶仔猪生长性能、器官指数和腹泻率的影响由表 3可见,增加SID Lys的剂量显著降低了断奶仔猪各阶段的ADFI和ADG (P<0.05),提高了F/G (P<0.05),并呈线性关系(P<0.05)。在1~14、15~28和1~28 d三个阶段,1.3%、2.6%、3.9%和5.2% SID Lys添加组之间ADG均显著降低(P<0.05)。在试验的任何阶段,1.3%和2.6% SID Lys添加组的F/G以及3.9%和5.2% SID Lys添加组的ADFI均无显著差异(P>0.05)。当日粮中添加高剂量的SID Lys时,断奶仔猪的生长性能受到显著影响(P<0.05)。日粮SID Lys含量的提高,对断奶仔猪的器官指数和腹泻率无显著影响(P>0.05)。
|
|
表 3 日粮添加不同水平赖氨酸对断奶仔猪生长性能的影响 Table 3 Effect of dietary Lys levels on growth performance of weaned piglets |
从表 4可知,日粮SID Lys含量的提高显著降低了MCV和MCH(P<0.05),并呈线性关系(P<0.05),而对其他的血液常规指标无显著影响。除Cl-外,日粮SID Lys含量对断奶仔猪的血清生化、免疫指标、无机离子和生长激素指标无显著影响(P>0.05)。
|
|
表 4 日粮添加不同水平赖氨酸对断奶仔猪血液常规指标的影响 Table 4 Effect of dietary Lys levels on haematological parameters in weaned piglets |
由表 5可知,随着日粮中SID Lys含量的提高,显著影响了血清中赖氨酸、组氨酸、亮氨酸、色氨酸、苯丙氨酸、丙氨酸、天冬氨酸、酪氨酸和鸟氨酸的水平,其中对必需氨基酸中赖氨酸、亮氨酸、色氨酸和苯丙氨酸的影响还呈线性和二次关系(P<0.05)。2.6%的SID Lys添加组与对照组相比,其血清中赖氨酸、亮氨酸、色氨酸、苯丙氨酸等必需氨基酸与非必需氨基酸中酪氨酸、鸟氨酸的含量差异显著(P<0.05);而2.6%SID Lys日粮添加组与3.9%、5.2%组相比,以上氨基酸的含量基本差异不显著(P>0.05)。
|
|
表 5 日粮添加不同水平赖氨酸对断奶仔猪血清游离氨基酸的影响 Table 5 Effect of dietary Lys levels on serum amino acid concentrations in weaned piglets |
如表 6所示,十二指肠的肠道形态指标不受日粮中Lys的影响(P>0.05)。随着日粮中SID Lys含量的提高,空肠的绒毛高度显著降低(P<0.05),且呈线性关系(P<0.05),其中1.3%和2.6%的SID Lys添加组之间、3.9%和5.2%的SID Lys添加组间差异不显著(P>0.05)。在回肠中,隐窝深度和杯状细胞个数受SID Lys含量的显著影响(P<0.05)。
|
|
表 6 日粮添加不同水平赖氨酸对断奶仔猪肠道形态的影响 Table 6 Effect of dietary Lys levels on intestinal morphology in weaned piglets |
对断奶仔猪组织病理学检测(图略),发现肝组织部分出现空泡和淋巴细胞灶等,肾组织部分出现少数肾球囊轻度扩张或髓质的间质轻度水肿,但组间差异不显著(P>0.05)。
2.6 不同浓度的赖氨酸对IPEC-J2细胞增殖的影响本试验观察了不同浓度的赖氨酸对IPEC-J2细胞增殖的影响,结果如图 1所示。在DMEM/F12培养基中额外添加赖氨酸时,会对IPEC-J2细胞增殖产生不利影响,当赖氨酸添加量为1 mmol·L-1,IPEC-J2增殖水平降低,当赖氨酸大于2 mmol·L-1时,IPEC-J2的细胞增殖水平显著下降(P<0.05),当增加到8 mmol·L-1时,细胞增殖数目降低了26.24%。
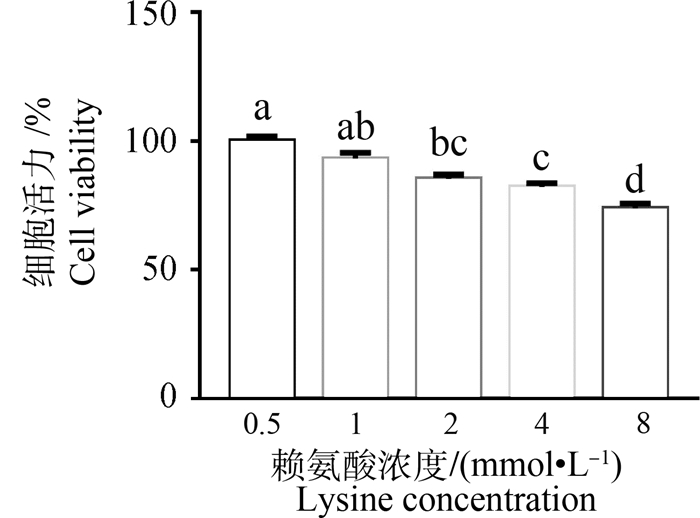
|
不同字母表示差异显著(P<0.05),n=6。下同 Values with different letters are significantly different (P < 0.05), n=6. The same as below 图 1 不同浓度的赖氨酸对IPEC-J2细胞增殖的影响 Fig. 1 Effects of different concentrations of lysine on the cell viability of IPEC-J2 cells |
根据DMEM/F12培养基中的氨基酸配比模式,观察了过量氨基酸对IPEC-J2细胞的影响,结果如图 2所示。当IPEC-J2中加入2 mmol·L-1的赖氨酸时,细胞活力显著降低(P<0.05);将其他的必需氨基酸浓度提高到相同倍数时,细胞活力有升高的趋势;将必需氨基酸和条件性必需氨基酸浓度,以及非必需氨基酸同时提高到相同倍数时,细胞活力又显著降低(P<0.05)。
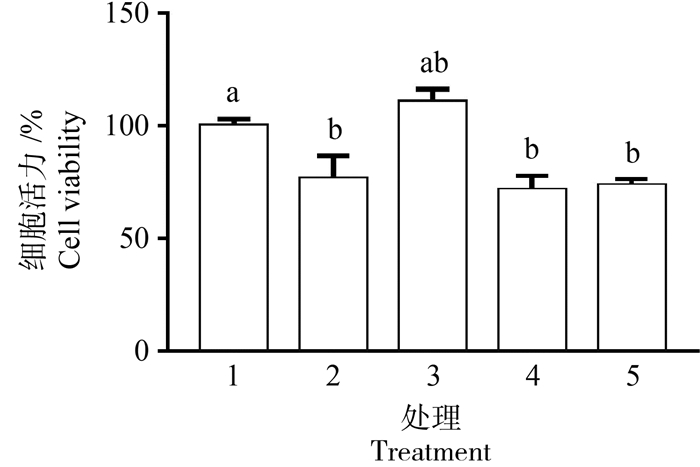
|
1.0.5 mmol·L-1 Lysine;2.2.0 mmol·L-1 Lysine(4倍浓度);3.2.0 mmol·L-1 Lysine +其他必需氨基酸(表 2中1~9,4倍浓度);4.2.0 mmol·L-1 Lysine + 其他必需氨基酸+ 条件性必需氨基酸(表 2中1~15,4倍浓度);5.2.0 mmol·L-1 Lysine + 所有的氨基酸(表 2中1~21,4倍浓度) 1. 0.5 mmol·L-1 Lysine group; 2. 2.0 mmol·L-1 Lysine group (4×); 3. 2.0 mmol·L-1 Lysine + EAA(1-9 in table 2, 4×); 4. 2.0 mmol·L-1 Lysine + EAA + CEAA (1-15 in table 2, 4×); 5. 2.0 mmol·L-1 Lysine + AA (1-21 in table 2, 4×) 图 2 氨基酸平衡对IPEC-J2细胞增殖的影响 Fig. 2 Effects of amino acid balance on the cell viability of IPEC-J2 Cells |
根据猪营养需要的氨基酸平衡模式,观察了过量碱性氨基酸(赖氨酸、精氨酸与组氨酸)对IPEC-J2细胞的影响,结果如图 3所示。当IPEC-J2细胞处理24 h时(图 3A),添加2.0 mmol·L-1 Lysine的处理组比添加0.5 mmol·L-1 Lysine的对照组,细胞活力显著下降(P<0.05);当在处理液中按照相应的比例提高精氨酸、组氨酸以及同时提高这两种氨基酸时,细胞活力降低,但与对照组相比无显著差异(P>0.05)。当IPEC-J2细胞处理48 h时(图 3B),2 mmol·L-1 Lysine的处理组以及相应提高精氨酸、组氨酸的处理组,细胞活力均显著低于对照组(P<0.05)。
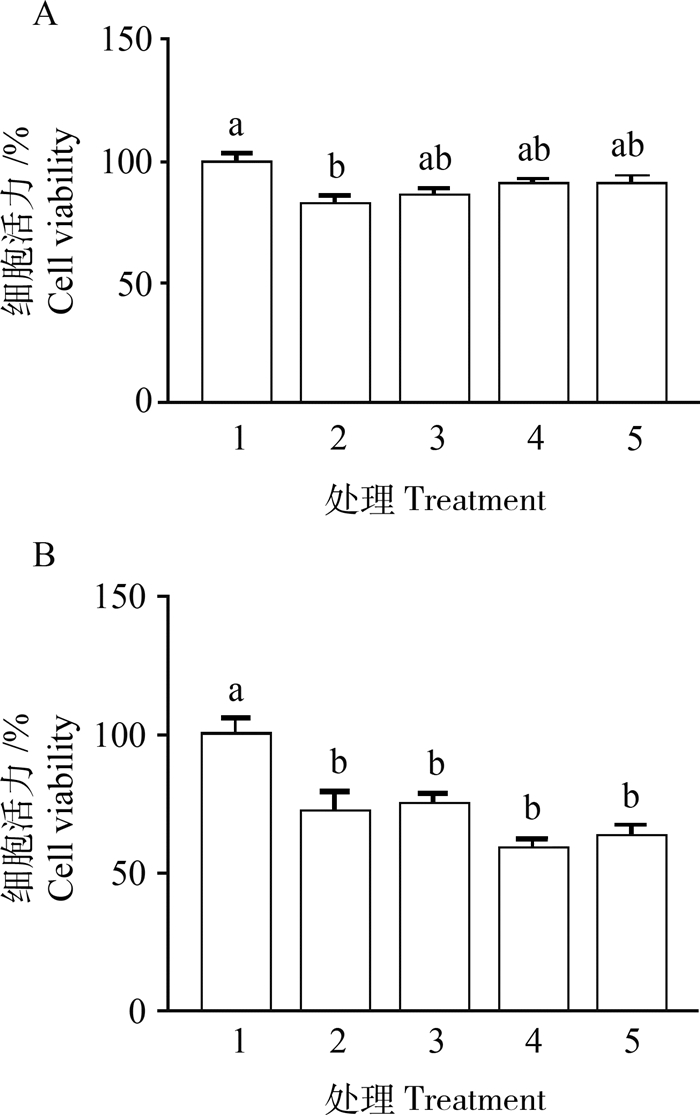
|
A. IPEC-J2细胞处理24 h;B.IPEC-J2细胞处理48 h. 1.0.5 mmol·L-1 Lysine;2.2.0 mmol·L-1 Lysine;3.2.0 mmol·L-1 Lysine + 0.91 mmol·L-1 Arginine; 4.2.0 mmol·L-1 Lysine + 0.69 mmol·L-1 Histidine;5.2.0 mmol·L-1 Lysine + 0.91 mmol·L-1 Arginine + 0.69 mmol·L-1 Histidine A. IPEC-J2 cells treated for 24 h; B. IPEC-J2 cells treated for 48 h. 1. 0.5 mmol·L-1 Lysine group; 2. 2.0 mmol·L-1 Lysine group; 3. 2.0 mmol·L-1 Lysine + 0.91 mmol·L-1 Arginine; 4.2.0 mmol·L-1 Lysine + 0.69 mmol·L-1 Histidine; 5. 2.0 mmol·L-1 Lysine + 0.91 mmol·L-1Arginine + 0.69 mmol·L-1 Histidine 图 3 碱性氨基酸平衡对IPEC-J2细胞增殖的影响 Fig. 3 Effects of alkaline amino acid balance on the cell viability of IPEC-J2 Cells |
随着氨基酸工业化生产的实现,合成氨基酸开始被广泛用于猪日粮的配制中,以满足猪对氨基酸的需要。有研究表明,在日粮中增加0.1%~0.2%的合成氨基酸可有效节约日粮粗蛋白质至少2%,而降低日粮粗蛋白质水平将最小化必需氨基酸的部分,保证氨基酸营养处于更好状态。Hahn和Baker[20]的研究结果显示,断奶仔猪在饲喂16%粗蛋白质并补充0.2%赖氨酸的日粮后,营养物质排出量最少。李德发等[21]报道,赖氨酸含量为1.25%的日粮与赖氨酸含量为1.15%的日粮相比,能够显著提高5~7周龄仔猪的平均日增重,改善氮存留量、氮表观消化率和净利用率。谯仕彦等[22]研究发现,将日粮赖氨酸含量由1.21%提高到1.41%能够改善仔猪生长性能和日粮氮利用效率,提高氨基酸用于合成蛋白质的效率。谢建兵等[23]以ADG为考察指标进行研究表明,断奶仔猪日粮中总赖氨酸最适宜的水平为1.45%。本试验中,随着日粮中赖氨酸添加量的升高,仔猪在断奶后28 d的生长性能下降,这说明当SID Lys提高到现有需要量的2倍时,对断奶仔猪的生长产生了不利影响,以SID Lys水平为1.3%的处理最佳。这与在仔猪中,3~4倍的赖氨酸推荐量(1.15%)降低了采食量与体重的报道[24]一致。
赖氨酸水平不同时,猪对其他氨基酸的需要量也会有所差别。当赖氨酸含量达到一定水平后,赖氨酸的利用率会随着赖氨酸水平的提高而降低。在理想蛋白质模型和低氮日粮限制性氨基酸平衡模式研究中[25],其他氨基酸与赖氨酸之间存在一定的比例。而在本试验中,其他氨基酸水平并未随着SID Lys水平的提高而提高,仔猪不仅无法利用更多的赖氨酸,反而因为需要动用额外的能量来完成赖氨酸的转化,引起了能量的相对不足,导致了仔猪生产性能指标的下降[26]。
3.2 日粮添加不同水平的赖氨酸对断奶仔猪器官指数、腹泻率、组织病理学的影响动物器官指数可以被看作是机体机能状况的反映,作为一个重要的生物学指标对理论实践和生产都具有重要意义[27]。本试验在测定器官指数和肝、肾组织病理时,未发现显著性差异,说明过量赖氨酸(5.2% SID Lys)的添加对器官指数和肝肾并无不良影响。本试验在保证蛋白质水平一致的情况下,随着SID Lys的升高,降低了豆粕的使用比例,而大豆中的抗营养因子是引起断奶仔猪腹泻的主要原因之一,因此,本试验全期各处理组仔猪的腹泻发生率较低。
3.3 日粮添加不同水平赖氨酸对断奶仔猪血液指标的影响在评价动物个体或群体的健康状态和免疫性能时,通常将血液常规作为重要指标[28]。其中,红细胞负责运输氧和二氧化碳,其功能主要依赖于红细胞内的血红蛋白含量。本试验中,随着日粮中SID Lys的升高,MCV和MCH显著降低,说明高赖氨酸添加组的断奶仔猪中肝造血功能减弱。在血清生化指标中,AST和ALT通常被视为肝功能的可靠标记物[29],其水平升高表明肝细胞渗透性增加、肝细胞受损乃至坏死。在本试验中,AST和ALT含量差异不显著,说明过量赖氨酸对仔猪的肝细胞未造成损伤,这与肝组织切片的结果一致。UN、T-BIL和CREA都是评价动物肾功能的指标[11]。本试验中,SUN、T-BIL与CREA差异均不显著,说明过量赖氨酸未对断奶仔猪的肾功能造成影响,这与肾组织切片结果一致。
随着日粮中SID Lys的升高,断奶仔猪血清赖氨酸含量显著升高,而精氨酸含量不受影响,这进一步说明赖氨酸和精氨酸不存在拮抗作用,这与Southern和Baker[30]的研究结果一致。有研究表明,如果日粮中的非必需氨基酸总量较少,不能满足动物机体需求,动物机体将开启一系列转氨反应,自行合成非必需氨基酸[31]。因此,饲料中赖氨酸的升高和饲料中必需氨基酸比例的不同,造成了机体氨基酸水平的变化,从而引起了组氨酸、亮氨酸、色氨酸与苯丙氨酸等必需氨基酸以及丙氨酸、天冬氨酸、酪氨酸与鸟氨酸等非必需氨基酸的变化。
3.4 日粮添加不同水平的赖氨酸对断奶仔猪肠道形态的影响氨基酸和小肽主要通过小肠进行吸收,而营养物质的消化和吸收明显受到肠绒毛高度和隐窝深度的影响[32-33]。在本试验中,过高的赖氨酸水平会减少空肠的绒毛高度和回肠的隐窝深度,这与之前仔猪饲喂赖氨酸缺乏日粮的试验结论相似[34],也与施寿荣等[35]在肉鸡上的研究结果相似,说明赖氨酸的不足与过量都会影响动物对营养物质的消化与吸收。
3.5 过量赖氨酸对猪肠道上皮细胞增殖的影响作为一种未完全分化的肠道细胞,IPEC-J2是从初生仔猪的空肠上皮组织中分离出来的[36],其保持了多种肠道细胞的特征。本试验采用IPEC-J2细胞系作为体外模型,研究过量赖氨酸对仔猪肠道吸收的影响。
本试验中,当加入的赖氨酸浓度高于2.0 mmol·L-1时,IPEC-J2的细胞活性显著降低。张海环[37]的研究表明,对于IPEC细胞,细胞增殖情况随着赖氨酸的浓度(0、0.5、1.5、4.5和13.5 mmol·L-1) 出现先升高后降低的变化,在1.5 mmol·L-1时细胞活力最高,但与0.5 mmol·L-1差异不显著,这与本试验的结果基本一致。张海环[37]的研究还证明,当赖氨酸浓度达到1.5 mmol·L-1时,CAT-1, b0, +AT和y+LAT1基因表达量最高,并且这一数值极显著高于其他赖氨酸浓度组。其中原因也许是这一数值较为适中,既不像在0.5 mmol·L-1时由于赖氨酸浓度过低无法引起调控对象的变化,也不至于在4.5 mmol·L-1以上时由于赖氨酸浓度过大从而对细胞的生长造成不利影响。适当提高赖氨酸和葡萄糖的含量有助于增加赖氨酸转运载体b0, +AT和y+LAT1的表达[38]。由于赖氨酸本身具有一定的碱性,当赖氨酸浓度过高时,培养基的酸碱程度也会被相应改变,进而影响细胞正常生理活动。同时,当赖氨酸的浓度为1.5 mmol·L-1时,由哺乳动物雷帕霉素靶蛋白(mTOR)信号通路参与调控的蛋白质合成值可能达到最大[36],而mTOR不仅是细胞生长调节的重要蛋白质,还在蛋白质合成中发挥重要的作用。因此,当赖氨酸浓度过高时,会影响细胞增殖与蛋白质的合成。
本研究中,当赖氨酸浓度为2.0 mmol·L-1时,同时提高其他必需氨基酸的浓度,尽管与0.5 mmol·L-1浓度组差异不显著,但IPEC-J2的细胞增殖情况得到了一定的改善,说明氨基酸平衡会影响细胞的增殖。有研究表明,赖氨酸/蛋氨酸配比模式会对奶牛乳腺上皮细胞增殖与酪蛋白合成产生较为显著的影响[39],在猪的小肠上皮细胞和骨骼肌细胞中必需氨基酸会通过mTORC1信号通路影响细胞的增殖和蛋白质生物合成[40-41],添加最优浓度配比的组氨酸、赖氨酸、蛋氨酸和亮氨酸会通过增加激活mTOR信号通路信号蛋白质的磷酸化,从而促进酪蛋白合成相关基因的表达[42]。
本研究中,在2.0 mmol·L-1浓度处理的IPEC-J2细胞中,按照猪对碱性氨基酸需要量的比例补充精氨酸和组氨酸时,随着处理时间的增加,细胞活力降低,当细胞处理24 h时,补充其他碱性氨基酸的处理组的细胞活性与2.0 mmol·L-1赖氨酸浓度组相比有提高的趋势,这符合氨基酸平衡模式的要求。有研究表明,0.3 mmol·L-1是上皮细胞增殖与蛋白质转化适宜的精氨酸浓度[7],本试验中添加的精氨酸为0.91 mmol·L-1,显然已过量,所以细胞的生长受到不利影响。这一过程可能与过量的半胱氨酸通过激活内质网应激和丝裂原活化蛋白激酶(MAPK)信号通路来引起细胞坏死[43]的原理相似。
4 结论本研究显示,在玉米-豆粕型日粮中添加过多的赖氨酸对断奶仔猪的生长产生了负面作用。饲喂添加1.3% SID Lys的日粮时,断奶仔猪的生长性能最优。SID Lys添加量为2.6%、3.9%与5.2%时,断奶仔猪的生长性能下降,部分血常规指标、血清游离氨基酸指标和肠道形态均受到不利影响。在IPEC-J2细胞体外试验显示,大于2.0 mmol·L-1的赖氨酸对IPEC-J2细胞活力具有抑制作用。综上,在实际应用中,应充分考虑氨基酸之间的平衡作用。
| [1] | ROY N, LAPIERRE H, BERNIER J F. Whole-body protein metabolism and plasma profiles of amino acids and hormones in growing barrows fed diets adequate or deficient in Lysine[J]. Can J Anim Sci, 2000, 80(4): 585–595. DOI: 10.4141/A98-057 |
| [2] | REN J B, ZHAO G Y, LI Y X, et al. Influence of dietary Lysine level on whole-body protein turnover, plasma IGF-Ⅰ, GH and insulin concentration in growing pigs[J]. Livest Sci, 2007, 110(1-2): 126–132. DOI: 10.1016/j.livsci.2006.10.009 |
| [3] |
罗钧秋, 陈代文. 赖氨酸对蛋白质代谢的影响及其可能调控机制[J]. 饲料工业, 2006, 27(16): 40–43.
LUO J Q, CHEN D W. Effect of lysine on protein metabolize and its possibility mechanism of regulation and control[J]. Feed Industry, 2006, 27(16): 40–43. DOI: 10.3969/j.issn.1001-991X.2006.16.013 (in Chinese) |
| [4] | BAKER D H. Advances in protein-amino acid nutrition of poultry[J]. Amino Acids, 2009, 37(1): 29–41. DOI: 10.1007/s00726-008-0198-3 |
| [5] | FAURE M, MOËNNOZ D, MONTIGON F, et al. Dietary threonine restriction specifically reduces intestinal mucin synthesis in rats[J]. J Nutr, 2005, 135(3): 486–491. DOI: 10.1093/jn/135.3.486 |
| [6] | RHOADS J M, WU G Y. Glutamine, arginine, and leucine signaling in the intestine[J]. Amino Acids, 2009, 37(1): 111–122. DOI: 10.1007/s00726-008-0225-4 |
| [7] | TAN B, YIN Y L, KONG X F, et al. L-arginine stimulates proliferation and prevents endotoxin-induced death of intestinal cells[J]. Amino Acids, 2010, 38(4): 1227–1235. DOI: 10.1007/s00726-009-0334-8 |
| [8] | WU G Y. Functional amino acids in growth, reproduction, and health[J]. Adv Nutr, 2010, 1(1): 31–37. DOI: 10.3945/an.110.1008 |
| [9] | TORRAS-LLORT M, SORIANO-GARCÍA J F, FERRER R, et al. Effect of a Lysine-enriched diet on L-Lysine transport by the brush-border membrane of the chicken jejunum[J]. Am J Physiol, 1998, 274(1): R69–R75. |
| [10] |
宋娇. 葡萄糖和氨基酸通过mTORC1信号通路影响小鼠皮肤成纤维细胞生长[D]. 重庆: 重庆医科大学, 2013.
SONG J. Glucose and leucine through the mTORC1 signal pathway affect the fibroblasts growth[D]. Chongqing: Chongqing Medical University, 2013. (in Chinese) |
| [11] |
夏添. 不同锌源调控断奶仔猪腹泻机理的研究[D]. 北京: 中国农业大学, 2017.
XIA T. Study on different zinc sources in modulating mechanisms of reducing incidence of diarrhea of weaned piglets[D]. Beijing: China Agricultural University, 2017. (in Chinese) |
| [12] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 6435-2014饲料中水分的测定[S]. 北京: 中国标准出版社, 2015.
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration. GB/T 6435-2014 Determination of moisture in feedstuffs[S]. Beijing: Standards Press of China, 2015. (in Chinese) |
| [13] |
国家市场监督管理总局, 国家标准化管理委员会. GB/T 6432-2018饲料中粗蛋白的测定凯氏定氮法[S]. 北京: 中国标准出版社, 2018.
State Administration for Market Regulation, Standardization Administration. GB/T 6432-2018. Determination of crude protein in feeds-Kjeldahl method[S]. Beijing: Standards Press of China, 2018. (in Chinese) |
| [14] |
国家市场监督管理总局, 国家标准化管理委员会. GB/T 6437-2018饲料中总磷的测定分光光度法[S]. 北京: 中国标准出版社, 2018.
State Administration for Market Regulation, Standardization Administration. GB/T 6437-2018 Determination of phosphorus in feeds-Spectrophotometry[S]. Beijing: Standards Press of China, 2018. (in Chinese) |
| [15] |
国家市场监督管理总局, 中国国家标准化管理委员会. GB/T 6436-2018饲料中钙的测定[S]. 北京: 中国标准出版社, 2018.
State Administration for Market Regulation, Standardization Administration. GB/T 6436-2018 Determination of calcium in feeds[S]. Beijing: Standards Press of China, 2018. (in Chinese) |
| [16] |
中华人民共和国国家市场监督管理总局, 中国国家标准化管理委员会. GB/T 18246-2019饲料中氨基酸的测定[S]. 北京: 中国标准出版社, 2019.
State Administration for Market Regulation, Standardization Administration. GB/T 18246-2019 Determination of amino acids in feeds[S]. Beijing: Standards Press of China, 2019. (in Chinese) |
| [17] | 国家市场监督管理总局, 国家标准化管理委员会. GB/T 15399-2018饲料中含硫氨基酸的测定离子交换色谱法[J]. 北京: 中国标准出版社, 2018. |
| [18] |
方晨, 郭飞, 胡瑞举, 等. 杂交组合断奶仔猪腹泻与FUT1基因遗传变异的关联分析[J]. 畜牧兽医学报, 2021, 52(3): 610–619.
FANG C, GUO F, HU R J, et al. Analysis of correlation between diarrhea and genetic variation of FUT1 gene in weaned piglets of hybrid combination[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(3): 610–619. (in Chinese) |
| [19] |
张振宇, 梁春年, 姚喜喜, 等. 日粮不同营养水平对牦牛生产性能、屠宰指标和血清生化指标的影响[J]. 畜牧兽医学报, 2021, 52(1): 135–143.
ZHANG Z Y, LIANG C N, YAO X X, et al. Effects of different nutrition levels of diets on production performance, slaughter indexes and serum biochemical indexes of yak[J]. Acta Veterinaria et Zootechnica Sinica, 2021, 52(1): 135–143. (in Chinese) |
| [20] | HAHN J D, BAKER D H. Optimum ratio to lysine of threonine, tryptophan, and sulfur amino acids for finishing swine[J]. J Anim Sci, 1995, 73(2): 482–489. DOI: 10.2527/1995.732482x |
| [21] |
李德发, 顾宏伟, 谯仕彦, 等. 日粮赖氨酸水平对生长肥育猪氮代谢的影响[J]. 中国饲料, 1992(5): 15–17.
LI D F, GU H W, QIAO S Y, et al. Effects of dietary lysine level on nitrogen metabolism of growing finishing pigs[J]. China Feed, 1992(5): 15–17. (in Chinese) |
| [22] |
谯仕彦, 李德发, 张国龙, 等. 增加日粮赖氨酸对断奶仔猪生长、氮存留和血浆游离氨基酸含量的影响[J]. 中国畜牧杂志, 1996, 32(3): 3–6.
QIAO S Y, LI D F, ZHANG G L, et al. Effect of increased dietary lysine level on performance N retention and plasma amino acid profiles in weanling pigs[J]. Chinese Journal of Animal Science, 1996, 32(3): 3–6. (in Chinese) |
| [23] |
谢建兵, LEEH C, 段红伟, 等. 饲粮不同赖氨酸水平对早期断奶仔猪生产性能的影响[J]. 饲料工业, 2010, 31(20): 5–7.
XIE J B, LEE H C, DUAN H W, et al. Effects of different dietary lysine levels on performance of early-weaned piglets[J]. Feed Industry, 2010, 31(20): 5–7. (in Chinese) |
| [24] | EDMONDS M S, BAKER D H. Failure of excess dietary lysine to antagonize arginine in young pigs[J]. J Nutr, 1987, 117(8): 1396–1401. DOI: 10.1093/jn/117.8.1396 |
| [25] |
马文锋. 猪肥育后期低氮日粮限制性氨基酸平衡模式的研究[D]. 北京: 中国农业大学, 2015.
MA W F. Study on the limiting amino acid pattern for late finishing pigs fed protein reduced diet[D]. Beijing: China Agricultural University, 2015. (in Chinese) |
| [26] |
袁中彪, 李俊波, 杨飞来, 等. 不同赖氨酸水平饲粮对断奶仔猪生长性能和营养物质消化率的影响[J]. 养猪, 2008(6): 3–4.
YUAN Z B, LI J B, YANG F L, et al. Effect of the level of lysine on growth performances and nutrients digestibility in weaned piglets[J]. Swine Production, 2008(6): 3–4. (in Chinese) |
| [27] |
封飞飞, 方伟, 王淑楠, 等. 茶树油对育肥猪生长性能、器官指数、胴体性状和肉品质的影响[J]. 动物营养学报, 2017, 29(10): 3620–3626.
FENG F F, FANG W, WANG S N, et al. Effects of tea tree oil on growth performance, organ indexes, carcass characteristics and meat quality of finishing pigs[J]. Chinese Journal of Animal Nutrition, 2017, 29(10): 3620–3626. (in Chinese) |
| [28] | CHEN C Y, YANG B, ZENG Z J, et al. Genetic dissection of blood lipid traits by integrating genome-wide association study and gene expression profiling in a porcine model[J]. BMC Genomics, 2013, 14(1): 848. DOI: 10.1186/1471-2164-14-848 |
| [29] | ADARAMOYE O A, ADESANOYE O A, ADEWUMI O M, et al. Studies on the toxicological effect of nevirapine, an antiretroviral drug, on the liver, kidney and testis of male Wistar rats[J]. Hum Exp Toxicol, 2012, 31(7): 676–685. |
| [30] | SOUTHERN L L, BAKER D H. Performance and concentration of amino acids in plasma and urine of young pigs fed diets with excesses of either arginine or lysine[J]. J Anim Sci, 1982, 55(4): 857–866. |
| [31] |
伍国耀, 武振龙, 戴兆来, 等. 猪对"非必需氨基酸"的营养需要[J]. 饲料工业, 2013, 34(16): 60–64.
WU G Y, WU Z L, DAI Z L, et al. Nutritional requirements for "non-essential amino acids" in pigs[J]. Feed Industry, 2013, 34(16): 60–64. (in Chinese) |
| [32] | KELLY D, SMYTH J A, MCCRACKEN K J. Digestive development of the early-weaned pig: 1. Effect of continuous nutrient supply on the development of the digestive tract and on changes in digestive enzyme activity during the first week post-weaning[J]. Br J Nutr, 1991, 65(2): 169–180. |
| [33] | PLUSKE J R, THOMPSON M J, ATWOOD C S, et al. Maintenance of villus height and crypt depth, and enhancement of disaccharide digestion and monosaccharide absorption, in piglets fed on cows' whole milk after weaning[J]. Br J Nutr, 1996, 76(3): 409–422. |
| [34] | HE L Q, YANG H S, HOU Y Q, et al. Effects of dietary L-lysine intake on the intestinal mucosa and expression of CAT genes in weaned piglets[J]. Amino Acids, 2013, 45(2): 383–391. DOI: 10.1007/s00726-013-1514-0 |
| [35] |
施寿荣, 刘勇强, 张珊, 等. 赖氨酸和其他必需氨基酸对1~18日龄中速型黄羽肉鸡生长性能、血清生化指标、器官指数和肠道组织形态的影响[J]. 动物营养学报, 2021, 33(2): 779–791.
SHI S R, LIU Y Q, ZHANG S, et al. Effects of lysine and other essential amino acids on growth performance, serum biochemical indexes, organ indexes and intestinal morphology of medium-speed yellow-feather broilers during 1 to 18 days of age[J]. Chinese Journal of Animal Nutrition, 2021, 33(2): 779–791. (in Chinese) |
| [36] | SCHIERACK P, NORDHOFF M, POLLMANN M, et al. Characterization of a porcine intestinal epithelial cell line for in vitro studies of microbial pathogenesis in swine[J]. Histochem Cell Biol, 2006, 125(3): 293–305. DOI: 10.1007/s00418-005-0067-z |
| [37] |
张海环. 猪小肠赖氨酸转运体对氮源的响应规律及mTOR信号通路的调控研究[D]. 长春: 吉林农业大学, 2016.
ZHANG H H. Study on lysine transports response law by different types of protein in the small intestines of weaned piglets and mTOR signaling pathway regulation in IEPC cells[D]. Changchun: Jilin Agricultural University, 2016. (in Chinese) |
| [38] |
姜廷波. 葡萄糖和赖氨酸水平对仔猪小肠上皮细胞赖氨酸吸收、转运的影响[D]. 长春: 吉林农业大学, 2017.
JIANG Y B. Effects of glucose and lysine levels on the lysine absorption and transportation in intestinal epithelial cells of piglets[D]. Changchun: Jilin Agricultural University, 2017. (in Chinese) |
| [39] |
王芳. 赖氨酸蛋氨酸配比模式和葡萄糖水平影响酪蛋白合成关键基因表达[D]. 北京: 中国农业科学院, 2015.
WANG F. Lysine/methionine pattern and glucose level regulate the expression of genes related to casein synthesis[D]. Beijing: Chinese Academy of Agricultural Sciences, 2015. (in Chinese) |
| [40] | WANG X, QIAO S Y, YIN Y L, et al. A deficiency or excess of dietary threonine reduces protein synthesis in jejunum and skeletal muscle of young pigs[J]. J Nutr, 2007, 137(6): 1442–1446. |
| [41] | WANG H, JI Y, WU G Y, et al. L-tryptophan activates mammalian target of rapamycin and enhances expression of tight junction proteins in intestinal porcine epithelial cells[J]. J Nutr, 2015, 145(6): 1156–1162. |
| [42] |
高海娜, 郑楠, 胡菡, 等. 必需氨基酸通过哺乳动物雷帕霉素靶蛋白信号通路调控乳蛋白合成的研究进展[J]. 动物营养学报, 2014, 26(9): 2451–2456.
GAO H N, ZHENG N, HU H, et al. Research progress on the regulation of milk protein synthesis by essential amino acids through mammalian target of rapamycin signaling pathway[J]. Chinese Journal of Animal Nutrition, 2014, 26(9): 2451–2456. (in Chinese) |
| [43] | JI Y, WU Z L, DAI Z L, et al. Excessive L-cysteine induces vacuole-like cell death by activating endoplasmic reticulum stress and mitogen-activated protein kinase signaling in intestinal porcine epithelial cells[J]. Amino Acids, 2016, 48(1): 149–156. |



