2. 山东省德州市陵城区畜牧兽医服务中心, 德州 253500
2. Shandong Dezhou Lingcheng District Animal Husbandry and Veterinary Service Center, Dezhou 253500, China
蛋壳具有抵抗外力破坏和抵御微生物侵害的作用[1-2],蛋壳品质是衡量蛋鸡经济性状的重要指标[3]。集约化生产中,蛋壳品质问题日益凸显[4],并且在产蛋后期蛋壳品质下降等问题越发严峻[5]。这类问题在需要进行人工输精的种鸡生产中尤为突出。蛋壳品质下降不仅影响食品质量安全,也给蛋鸡养殖和种蛋孵化产业造成了巨大的经济损失。因此,改善蛋壳品质, 尤其是改善产蛋后期种鸡的蛋壳品质对于家禽产业高效发展尤为重要。
蛋鸡日龄是决定蛋壳品质的关键因素之一。蛋壳钙化形成的过程是在输卵管壳腺部进行的,此过程受雌激素的调控[6]。然而,老年母鸡普遍存在雌激素水平下降的现象。此外,氧化应激是造成机体衰老和功能减退的主要原因之一[7]。研究表明,氧化应激不仅会抑制钙离子在肠道内的吸收[8],还会阻碍钙在壳腺部中的转运[9]。壳腺部钙离子的吸收和转运对蛋壳的形成和品质起决定性作用[10-11]。目前,关于提升蛋壳品质的研究主要集中在营养调控[12-13]和饲养管理[6]等方面,而有关黄酮类物质对壳腺部作用机制的研究鲜有报道。
山楂是一种多年生木本植物,广泛分布于亚洲、欧洲和美洲。山楂叶已被用于治疗心血管和脂肪肝疾病[14]。山楂叶黄酮类化合物是从山楂叶中提取的,具有抗高血压、抗炎、清除自由基和抗菌等生物学功能[15-16]。据报道,灌胃山楂叶黄酮类物质可以通过激活Nrf2/HO-1信号通路来提高非酒精性肝炎大鼠的抗氧化能力[17]。Shi等[16]研究表明,多囊卵巢综合征的大鼠口服山楂叶黄酮(HF)后可显著提高机体的雌激素水平和抗氧化能力。因此,本研究拟从抗氧化和钙转运角度探究HF对种鸡蛋壳品质调控的机制。
1 材料与方法 1.1 试验设计与饲养管理山楂叶黄酮由南通经纬生物科技有限公司提供,纯度80%(牡荆素鼠李糖苷48%、牡荆素葡萄糖苷12%、牡荆素8%、金丝桃苷6%等)。选择体重和产蛋率相近的60周龄健康种母鸡(栖岭草鸡)270只,随机分为3组,每组6个重复,每个重复15只。对照组饲喂玉米-豆粕型基础饲粮(CON);低、高剂量试验组分别在基础饲粮中添加30(LHF)和60 mg·kg-1(HHF)的HF。基础饲粮参照NRC(1994)和我国《鸡饲养标准》(NY/T 33—2004),组成和营养水平见表 1。
|
|
表 1 基础日粮成分和营养水平 Table 1 Composition and nutrient levels of basic diets |
动物试验在常州土山种鸡场进行。采用半开放式鸡舍阶梯式笼养, 每笼(47 cm×37 cm×47 cm) 3只鸡,连续5笼为1个重复,每组6个重复均匀分布在鸡舍内。预饲期为2周,期间统一饲喂对照组基础日粮,根据生产性能进行适当调整后,进行为期8周的正式试验。自然光照加人工补光, 光照时间为16 h·d-1、温度保持在18~25 ℃,纵向负压通风。每天定时(06:00)饲喂1次,限饲113 g·d-1,自由饮水;每天15:00按照标准程序由指定的专业人员统一进行人工输精,其他饲养管理程序与正常生产保持一致。
1.2 测定指标与方法1.2.1 样品采集 在试验的第8周末,每个重复随机选择1只蛋鸡静脉采血,3 000 r·min-1离心10 min获得血清,-80 ℃保存。采集输卵管壳腺部,称重,取中心部位样品固定在4%的多聚甲醛中,另取部分样品置于液氮中速冻。
1.2.2 蛋品质检测 试验的第8周末,每个重复随机选取3枚鸡蛋(n=6)。使用蛋品质分析仪(DET-6000, NABEL, 日本)对蛋重、蛋黄颜色和哈氏单位进行测量,用蛋壳压力计(Robotmation, 日本)测定蛋壳的强度,用千分尺测量蛋壳的上、中、下三部分的厚度。
1.2.3 血液指标测定 使用南京建成商品试剂盒测定血清中的钙(C004-2-1)、磷(C006-1-1)含量和碱性磷酸酶(A059-2-2)的活性,试验步骤严格按照说明书进行操作。
1.2.4 壳腺组织学观察与测定 参照文献[18]对壳腺样本进行处理后,使用切片机进行切片(4 μm),烘干的切片用二甲苯脱蜡,浸入分级稀释的乙醇中再水化,并用苏木精和伊红(HE)染色。使用显微镜(Olympus Optical, 北京)进行观察和拍照。参照Jiang等[19]的方法测定壳腺绒毛长度、上皮高度和腺体密度。
1.2.5 TUNEL检测细胞凋亡 采用末端脱氧核苷酸转移酶介导的去氧尿苷三磷酸镍末端标记法(TUNEL)检测壳腺的细胞凋亡。整个试验使用TUNEL BrightRed凋亡检测试剂盒(A113, Vazyme Biotech, 南京),按照说明书进行操作。使用lsm900共焦激光扫描显微镜(Carl Zeiss, Oberkochen, 德国)获得荧光图片。最后,使用Image-pro Plus测定凋亡细胞的比率。
1.2.6 壳腺部抗氧化水平检测 称取0.2 g壳腺部,用2 mL冰冻PBS匀浆,4 ℃,12 000 g离心10 min,收集上清液,测定抗氧化状态。用BCA蛋白测定试剂盒(P0010, Beyotime Biotechnology, 上海)测定上清液的蛋白含量。采用抗氧化试剂盒(S0051、S0056、S0121和S0131, Beyotime Biotechnology,上海)检测壳腺部过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)活性、总抗氧化能力(T-AOC)和丙二醛(MDA)含量。
1.2.7 蛋白质免疫印迹法检测蛋白表达 参照Jiang等[20]的方法,其中,KEAP1、HO-1、NFκB、p-NFκB、Bcl2、Bax和PCNA为1∶1 000稀释,Nrf2为1∶1 500稀释,β-actin、HRP羊抗兔IgG和HRP羊抗鼠IgG均为1∶5 000稀释。利用FuJI Film(LAS4000)对目的条带进行拍照,通过Image J软件对目的条带进行灰度分析。
1.2.8 壳腺部相关基因表达测定 采用Trizol(TaKaRa, 大连)法提取壳腺部组织RNA。测定其完整性、浓度和纯度后,使用反转录试剂盒(Vazyme, 南京)合成cDNA,保存于-20 ℃备用。使用ChamQTM SYBR qPCR Master Mix (Vazyme, 南京),在实时PCR仪(QuantStudio 7 Flex, Thermo, 美国)中按照说明书进行一步实时RT-PCR。根据目的基因和内参基因GAPDH阈值循环(CT),采用2-△△CT法计算样品中目的基因mRNA的相对表达量。引物由上海生工生物工程股份有限公司合成,序列见表 2。
|
|
表 2 引物序列信息 Table 2 Primers information for real-time PCR |
运用SPSS 20.0软件进行单因素方差分析(One-way-ANOVA),结果以“平均值±标准误(Mean±SEM)”表示,以P<0.05表示差异显著。
2 结果 2.1 山楂叶黄酮对壳腺重量及蛋品质的影响为了探究HF对蛋品质的影响,本研究对蛋品质进行了测定。由表 3可见,与CON组相比,日粮中添加HF可以显著提高蛋壳的强度(P<0.05)和厚度(P<0.05),蛋壳强度分别提高了18.7%和16.9%,蛋壳厚度分别提高了10%和13.3%。然而,HF处理组与CON组相比,壳腺重(P=0.108)和壳腺相对重(P=0.078)有上升的趋势,但没有显著性差异。
|
|
表 3 日粮山楂叶黄酮对蛋品质和器官指数的影响 Table 3 Effects of dietary HF on the egg quality and organ index |
由表 4可知,与CON组相比,HHF处理组血清钙含量显著升高(P<0.05);LHF组与CON和HHF组之间没有显著性差异(P>0.05);CON组Ca2+ ATP酶活性显著低于LHF和HHF组(P<0.05)。
|
|
表 4 日粮山楂叶黄酮对血清钙、磷含量及碱性磷酸酶活性的影响 Table 4 Effect of dietary HF on serum Ca, P content and ALP activity |
为了观察HF对产蛋后期母鸡壳腺部形态学的影响,本研究对母鸡的壳腺部组织切片进行了HE染色,同时对壳腺部上皮高度、绒毛长度和腺体密度进行了统计(图 1)。结果表明,与CON组相比,LHF和HHF组的绒毛长度和腺体密度显著提高(P<0.05),上皮高度没有显著性差异。
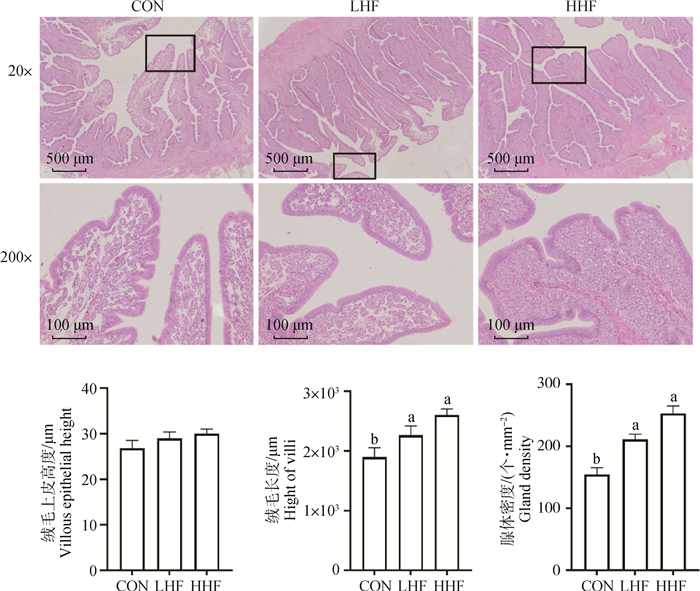
|
数据均以“平均值±标准误”表示(n=6),柱上标不同小写字母(a, b)表示差异显著(P<0.05),下图同 Data are presented as "mean value±SEM" (n=6). Without the same mark (a, b) on the column represent statistically significant differences (P < 0.05), the same as in the following figures 图 1 日粮山楂叶黄酮对壳腺组织形态学的影响 Fig. 1 Effects of dietary HF on the histomorphology of the shell gland |
为了评估HF对壳腺部细胞凋亡的影响进行了TUNEL试验(图 2)。结果显示,LHF和HHF处理组凋亡指数显著低于CON组(P < 0.05)。

|
图 2 日粮山楂叶黄酮对壳腺部细胞凋亡的影响 Fig. 2 Effects of dietary HF on apoptosis of the shell gland |
MDA含量、GSH-Px和T-AOC的活性能够综合评估壳腺部组织的抗氧化状态。结果显示,与CON组相比,LHF和HHF处理组MDA含量显著降低(P<0.05,图 3a);HHF处理组GSH-Px活性显著升高(P<0.05,图 3b)。
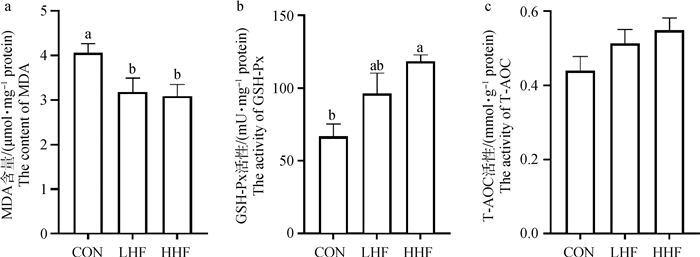
|
图 3 日粮山楂叶黄酮对壳腺部组织抗氧化酶活性的影响 Fig. 3 Effects of dietary HF on the oxidative status of shell glands |
为了测定HF对壳腺部抗氧化和凋亡相关蛋白表达的影响,本研究通过蛋白质免疫印迹法检测了KEAP1、Nfr2、HO-1、NFκB、p-NFκB、Bcl2、Bax和PCNA的相对表达(图 4)。结果表明,HHF组壳腺部的KEAP1、p-NFκB /NFκB和Bax/Bcl2蛋白相对表达水平显著低于CON组(P<0.05);与CON组相比,HHF组Nrf2、HO-1和PCNA蛋白的相对表达量显著提高(P<0.05)。LHF组Nrf2蛋白的表达水平显著低于HHF组(P<0.05),但与CON组无显著性差异。

|
图 4 日粮山楂叶黄酮对壳腺部蛋白表达的影响 Fig. 4 Effects of dietary HF supplementation on the protein expression in shell glands |
由图 5可知,与CON组相比,HHF和LHF组的CaBP-D28K、OPN和OC-116基因mRNA相对表达水平显著上调(P<0.05,图 5a、b、d);CON和HF处理组之间PMCA1b基因表达量无显著性差异(图 5c)。
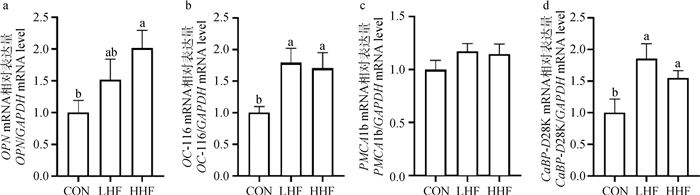
|
图 5 日粮山楂叶黄酮对壳腺部基因表达的影响 Fig. 5 Effects of dietary HF supplementation on the gene expression in shell glands |
蛋壳的品质不仅决定了种鸡的孵化性能,还与商品蛋鸡的鲜蛋产量、经济效益等密切相关。在产蛋后期,随着产蛋日龄的增加蛋壳品质通常会下降。如何改善种鸡产蛋后期的蛋白品质越来越受到人们的关注。近年来,有学者发现,黄酮类物质可以提高禽类产蛋后期蛋壳的品质[21-23]。以往的研究表明,雌激素水平和钙吸收、代谢能力下降是导致产蛋后期蛋壳品质下降的主要原因[24]。本课题组前期研究发现,HF可以显著提高产蛋后期种母鸡血清中雌激素的水平。这与Shi等[16]研究发现的灌胃多发性卵巢综合征(PCOS)大鼠山楂叶黄酮能够提高血清雌激素水平结果一致。此外,Arjmandi等[25]指出,雌激素可以通过雌激素受体途径促进肠道对钙的吸收,这可能是HHF处理组血清钙含量显著提高的原因之一。因此,本研究认为,山楂叶黄酮通过提高产蛋后期种母鸡的雌激素水平,提高血清钙含量,进而改善蛋壳品质。
蛋鸡体内的钙代谢异常活跃,钙的转运离不开钙转运体[6]。CaBP-D28K是鸡体内唯一的钙结合蛋白,参与钙离子的转运[26];骨桥蛋白(OPN)在壳腺中合成和分泌,是蛋壳基质的主要磷酸化蛋白之一,在蛋壳钙化过程中起到重要作用[27];蛋壳基质蛋白(OC-116)则与蛋壳厚度、弹性模量及蛋形指数有着密切的关系[28]。本研究发现,日粮中添加HF上调了CaBP-D28K、OPN和OC-116基因的表达。此外,Ca2+ATP酶是调节钙离子转运的关键酶[29]。本研究中,Ca2+ATP酶的活性增强表明,添加HF可以增加壳腺中钙离子的转运。因此,山楂叶黄酮可以通过提高钙离子转运酶的活性,上调钙离子转运和基质蛋白基因的表达来提高蛋壳品质。
氧化应激会阻碍钙离子在壳腺部的转运,进而降低蛋壳品质[8]。MDA和GSH-Px是反映机体抗氧化能力的重要指标,MDA是膜脂过氧化的最终的产物之一;GSH-Px是机体内一种重要的过氧化物分解酶。在大鼠肝炎模型中,山楂叶提取物可以降低肝组织匀浆液中MDA含量,提高GSH-Px的活性[30]。与先前的研究结果一致,日粮中添加HF提高了产蛋后期种母鸡壳腺部的抗氧化能力。核转录相关因子Nrf2是调节抗氧化应激的重要转录因子。正常情况下,特异性的受体KEAP1与细胞质中Nrf2结合,抑制其行使功能。但在氧化应激的条件下,KEAP1与Nrf2解离,活化的Nrf2可启动多种抗氧化酶基因的表达,并在细胞核内启动由抗氧化反应元件(ARE)调控的HO-1的表达,从而缓解氧化反应引起的细胞损伤。有研究表明,给非酒精性肝炎大鼠灌胃HF可通过调节Nrf2/HO-1信号通路来提高肝的抗氧化能力[17]。在本试验中,与CON组相比,HHF处理组壳腺组织的KEAP1蛋白表达下调,HO-1和Nrf2蛋白表达上调。因此,日粮中添加HF后能够促进Nrf2的活化和释放,进一步启动ARE调控的Ⅱ期解毒酶和抗氧化酶等下游蛋白的表达。相应地,日粮中添加60 mg·kg-1的HF显著增强了壳腺中GSH-Px酶的活性。总之,日粮中添加HF可以通过激活产蛋后期种母鸡壳腺部Nrf2/HO-1信号通路,发挥其抗氧化作用,来提高产蛋后期种母鸡的蛋壳品质。
输卵管壳腺部是蛋壳形成的部位,对蛋壳品质起决定性作用[31]。研究表明,壳腺中的腺体在蛋壳形成过程中的主要作用是分泌钙离子和色素[32],壳腺腺体的减少将会直接影响钙离子转运,降低蛋壳品质[33]。本研究通过组织学观察到产蛋后期种母鸡出现壳腺绒毛变短和腺体排列混乱、密度降低的现象,日粮中添加HF能明显改善这些问题。这与前面提及的HF能够提高壳腺部钙转运和抗氧化能力的结果相一致。因此,本研究认为,日粮中添加山楂叶黄酮能够通过改善壳腺组织形态来提高蛋壳品质。
活性氧引起的氧化应激是机体衰老和功能减退的主要原因[7]。有学者发现,氧化应激可以导致细胞过度损伤和凋亡[34],细胞凋亡率可以反映氧化应激的程度[35],此外,细胞的损伤和凋亡往往伴随着炎症反应[36],本研究发现,与HF处理组相比,CON组种母鸡壳腺部细胞凋亡率和Bax/Bcl2、p-NFκB /NFκB蛋白表达量显著增加,日粮中添加60 mg·kg-1的HF降低了壳腺细胞的凋亡指数,下调了Bax/Bcl2、p-NFκB /NFκB蛋白的表达。这与HF在治疗心脏衰竭方面表现出抗凋亡和抗炎的作用效果相一致[37]。HF的抗凋亡作用也更好地解释了HHF组壳腺腺体密度和绒毛长度的增加。
4 结论日粮中添加HF通过激活壳腺部Nrf2/HO-1信号通路增强抗氧化能力,增强钙离子转运能力,改善壳腺部组织形态,抑制细胞凋亡,从而改善种鸡蛋壳品质。并且60 mg·kg-1 HF的添加水平具有较好效果。
| [1] | CHEN X, LI X Z, GUO Y Y, et al. Impact of cuticle quality and eggshell thickness on egg antibacterial efficiency[J]. Poult Sci, 2019, 98(2): 940–948. DOI: 10.3382/ps/pey369 |
| [2] |
谭光辉, 吴磊, 李杰章, 等. 三穗鸭ITPR2基因组织表达、功能预测及其SNPs对蛋壳品质的影响[J]. 农业生物技术学报, 2020, 28(4): 720–730.
TAN G H, WU L, LI J Z, et al. Tissue expression, function prediction of ITPR2 Gene and effects of its SNPs on eggshell quality in Sansui Duck (Anas platyrhyncha domestica)[J]. Journal of Agricultural Biotechnology, 2020, 28(4): 720–730. (in Chinese) |
| [3] |
张倚剑, 胡艳, 梁明振, 等. 改善产蛋后期鸡蛋蛋壳质量研究进展[J]. 动物营养学报, 2021, 33(2): 686–697.
ZHANG Y J, HU Y, LIANG M Z, et al. Research progress on improving eggshell quality in late laying period[J]. Chinese Journal of Animal Nutrition, 2021, 33(2): 686–697. DOI: 10.3969/j.issn.1006-267x.2021.02.010 (in Chinese) |
| [4] |
崔闯飞, 王晶, 齐广海, 等. 枯草芽孢杆菌对产蛋后期蛋鸡生产性能和蛋壳品质的影响[J]. 动物营养学报, 2018, 30(4): 1481–1488.
CUI C F, WANG J, QI G H, et al. Effects of Bacillus subtilis on performance and eggshell quality of laying hens during later period of laying[J]. Chinese Journal of Animal Nutrition, 2018, 30(4): 1481–1488. DOI: 10.3969/j.issn.1006-267x.2018.04.032 (in Chinese) |
| [5] |
王晶, 马玲玲, 冯嘉, 等. 微量元素调控鸡蛋蛋壳品质的研究进展[J]. 动物营养学报, 2019, 31(5): 1961–1969.
WANG J, MA L L, FENG J, et al. Advances in modulation of trace minerals on eggshell quality[J]. Chinese Journal of Animal Nutrition, 2019, 31(5): 1961–1969. DOI: 10.3969/j.issn.1006-267x.2019.05.001 (in Chinese) |
| [6] |
巩翔. 光周期对蛋鸡蛋壳质量及钙转运体的影响[D]. 泰安: 山东农业大学, 2019.
GONG X. Effect of light regime on eggshell quality and calcium transporters of laying hens[D]. Tai'an: Shandong Agricultural University, 2019. (in Chinese) |
| [7] | CHHUNCHHA B, KUBO E, SINGH P, et al. Sumoylation-deficient Prdx6 repairs aberrant Sumoylation-mediated Sp1 dysregulation-dependent Prdx6 repression and cell injury in aging and oxidative stress[J]. Aging (Albany NY), 2018, 10(9): 2284–2315. |
| [8] | DE BARBOZA G D, GUIZZARDI S, MOINE L, et al. Oxidative stress, antioxidants and intestinal calcium absorption[J]. World J Gastroenterol, 2017, 23(16): 2841–2853. DOI: 10.3748/wjg.v23.i16.2841 |
| [9] | BAR A, VAX E, STRIEM S. Relationships between calbindin (Mr 28, 000) and calcium transport by the eggshell gland[J]. Comp Biochem Physiol Part A: Comp Physiol, 1992, 101(4): 845–848. DOI: 10.1016/0300-9629(92)90367-Y |
| [10] | BAR A, HURWITZ S. Vitamin D metabolism and calbindin (calcium-binding protein) in aged laying hens[J]. J Nutr, 1987, 117(10): 1775–1779. DOI: 10.1093/jn/117.10.1775 |
| [11] | RODRIGUEZ-NAVARRO A, KALIN O, NYS Y, et al. Influence of the microstructure on the shell strength of eggs laid by hens of different ages[J]. Br Poult Sci, 2002, 43(3): 395–403. DOI: 10.1080/00071660120103675 |
| [12] |
秦红, 王帅, 陈昱筱, 等. 维生素C和黄芪多糖对热应激蛋鸡蛋品质及肠道健康的影响[J]. 中国粮油学报, 2019, 34(9): 88–95.
QIN H, WANG S, CHEN Y X, et al. Effects of vitamin C and astragalus polysaccharides on egg quality and intestinal health of laying hens under heat stress[J]. Journal of the Chinese Cereals and Oils Association, 2019, 34(9): 88–95. (in Chinese) |
| [13] |
张继良, 毕英佐, CHIUH, 等. 活性维生素D3及锌、锰复合物改善蛋壳质量研究[J]. 广东饲料, 2019, 28(3): 23–24.
ZHANG J L, BI Y Z, CHIU H, et al. Study on improvement of eggshell quality by active vitamin D3 and zinc and manganese complexes[J]. Guangdong Feed, 2019, 28(3): 23–24. (in Chinese) |
| [14] | YIN J J, QU J G, ZHANG W J, et al. Tissue distribution comparison between healthy and fatty liver rats after oral administration of hawthorn leaf extract[J]. Biomed Chromatogr, 2014, 28(5): 637–647. DOI: 10.1002/bmc.3082 |
| [15] | FU J H, ZHENG Y Q, LI P, et al. Hawthorn leaves flavonoids decreases inflammation related to acute myocardial ischemia/reperfusion in anesthetized dogs[J]. Chin J Integr Med, 2013, 19(8): 582–588. DOI: 10.1007/s11655-012-1250-4 |
| [16] | SHI Y H, KONG X, YIN H M, et al. Effect of hawthorn leaf flavonoids in dehydroepiandrosterone-induced polycystic ovary syndrome in rats[J]. Pathobiology, 2019, 86(2-3): 102–110. DOI: 10.1159/000493895 |
| [17] | QI L N, JIANG J L, ZHANG J F, et al. Curcumin protects human trophoblast HTR8/SVneo cells from H2O2-induced oxidative stress by activating Nrf2 signaling pathway[J]. Antioxidants (Basel), 2020, 9(2): 121. DOI: 10.3390/antiox9020121 |
| [18] | SHI Z C, LV Z P, HU C H, et al. Oral exposure to genistein during conception and lactation period affects the testicular development of male offspring mice[J]. Animals (Basel), 2020, 10(3): 377. |
| [19] | JIANG J L, QI L N, DAI H J, et al. Dietary stevioside supplementation improves laying performance and eggshell quality through increasing estrogen synthesis, calcium level and antioxidant capacity of reproductive organs in aged breeder hens[J]. Anim Feed Sci Technol, 2020, 269: 114682. DOI: 10.1016/j.anifeedsci.2020.114682 |
| [20] | JIANG J L, QI L N, LV Z P, et al. Dietary stevioside supplementation alleviates lipopolysaccharide-induced intestinal mucosal damage through anti-inflammatory and antioxidant effects in broiler chickens[J]. Antioxidants (Basel), 2019, 8(12): 575. DOI: 10.3390/antiox8120575 |
| [21] | YUAN Z H, ZHANG K Y, DING X M, et al. Effect of tea polyphenols on production performance, egg quality, and hepatic antioxidant status of laying hens in vanadium-containing diets[J]. Poult Sci, 2016, 95(7): 1709–1717. DOI: 10.3382/ps/pew097 |
| [22] | SAHIN N, ONDERCI M, BALCI T A, et al. The effect of soy isoflavones on egg quality and bone mineralisation during the late laying period of quail[J]. Br Poult Sci, 2007, 48(3): 363–369. DOI: 10.1080/00071660701341971 |
| [23] | LV Z P, YAN S J, LI G, et al. Genistein improves the reproductive performance and bone status of breeder hens during the late egg-laying period[J]. Poult Sci, 2019, 98(12): 7022–7029. DOI: 10.3382/ps/pez367 |
| [24] | JIANG M J, ZHAO J P, JIAO H C, et al. Dietary supplementation with sodium bicarbonate improves calcium absorption and eggshell quality of laying hens during peak production[J]. Br Poult Sci, 2015, 56(6): 740–747. DOI: 10.1080/00071668.2015.1113499 |
| [25] | ARJMANDI B H, SALIH M A, HERBERT D C, et al. Evidence for estrogen receptor-linked calcium transport in the intestine[J]. Bone Miner, 1993, 21(1): 63–74. DOI: 10.1016/S0169-6009(08)80121-3 |
| [26] | WASSERMAN R H, SMITH C A, SMITH C M, et al. Immunohistochemical localization of a calcium pump and calbindin-D28k in the oviduct of the laying hen[J]. Histochemistry, 1991, 96(5): 413–418. DOI: 10.1007/BF00315999 |
| [27] | CHEN W, ZHAO F, TIAN Z M, et al. Dietary calcium deficiency in laying ducks impairs eggshell quality by suppressing shell biomineralization[J]. J Exp Biol, 2015, 218(Pt 20): 3336–3343. |
| [28] | DUNN I C, JOSEPH N T, BAIN M, et al. Polymorphisms in eggshell organic matrix genes are associated with eggshell quality measurements in pedigree Rhode Island Red hens[J]. Anim Genet, 2009, 40(1): 110–114. DOI: 10.1111/j.1365-2052.2008.01794.x |
| [29] | BUBLITZ M, MUSGAARD M, POULSEN H, et al. Ion pathways in the sarcoplasmic reticulum Ca2+-ATPase[J]. J Biol Chem, 2013, 288(15): 10759–10765. DOI: 10.1074/jbc.R112.436550 |
| [30] | MECHERI A, BENABDERRAHMANE W, AMRANI A, et al. Hepatoprotective effects of algerian Crataegus oxyacantha leaves[J]. Recent Pat Food Nutr Agric, 2019, 10(1): 70–75. DOI: 10.2174/2212798410666180730095456 |
| [31] | ZHU M K, LI H Y, MIAO L P, et al. Dietary cadmium chloride impairs shell biomineralization by disrupting the metabolism of the eggshell gland in laying hens[J]. J Anim Sci, 2020, 98(2): skaa025. DOI: 10.1093/jas/skaa025 |
| [32] | NⅡ T, ISOBE N, YOSHIMURA Y. Effects of avian infectious bronchitis virus antigen on eggshell formation and immunoreaction in hen oviduct[J]. Theriogenology, 2014, 81(8): 1129–1138. DOI: 10.1016/j.theriogenology.2014.02.002 |
| [33] | YIGIT F, DAGLIOGLU S. Histological changes in the uterus of the hens after embryonic exposure to bisphenol A and diethylstilbestrol[J]. Protoplasma, 2010, 247(1-2): 57–63. DOI: 10.1007/s00709-010-0140-x |
| [34] | THIRUPATHI A, PINHO R A, CHANG Y Z. Physical exercise: an inducer of positive oxidative stress in skeletal muscle aging[J]. Life Sci, 2020, 252: 117630. DOI: 10.1016/j.lfs.2020.117630 |
| [35] | SARVESTANI N N, FIROUZI S S, FALAK R, et al. Phosphodiesterase 4 and 7 inhibitors produce protective effects against high glucose-induced neurotoxicity in PC12 cells via modulation of the oxidative stress, apoptosis and inflammation pathways[J]. Metab Brain Dis, 2018, 33(4): 1293–1306. DOI: 10.1007/s11011-018-0241-3 |
| [36] | TSAI W C, YU T Y, CHANG G J, et al. Platelet-Rich plasma releasate promotes regeneration and decreases inflammation and apoptosis of injured skeletal muscle[J]. Am J Sports Med, 2018, 46(8): 1980–1986. DOI: 10.1177/0363546518771076 |
| [37] | HOLUBARSCH C J F, COLUCCI W S, EHA J. Benefit-risk assessment of crataegus extract WS 1442:an evidence-based review[J]. Am J Cardiovasc Drugs, 2018, 18(1): 25–36. DOI: 10.1007/s40256-017-0249-9 |



