哺乳动物支持细胞的增殖在出生后可以分为两个阶段,即出生期前后和青春期前,幼年睾丸最初的增长比生物体慢,之后随着青春期的临近其增长速度比生物体快。睾丸在这一时期的变化包括曲细精管直径的增大、间质空间的缩小以及曲细精管长度的增大,但这些发育变化并不一定是以相同的速度发生[1-2],牛支持细胞数量呈线性增加,表明在牛体内不存在分离为两个不同的出生后波的现象,这推翻了哺乳动物(实验室小鼠和大鼠除外) 产后支持细胞增殖存在两个阶段的理论[3]。而公羊与牛相似,支持细胞的数量在出生后表现出相似的线性增长[4]。由于睾丸支持细胞在青春期前停止分裂,此后支持细胞群体变得稳定,且支持细胞只能支持有限数量的生殖细胞,故雄性哺乳动物在青春期前建立的支持细胞数量决定了最终性成熟后的睾丸大小和精子数量[5]。因此,影响支持细胞发育和增殖能力的因素也可能对成年动物睾丸功能产生重要影响。
体内多种激素会影响睾丸支持细胞的增殖。其中关于促卵泡素、甲状腺激素和睾酮等激素可刺激睾丸支持细胞增殖的报道居多。例如,促卵泡素(follicle stimulating hormone,FSH)在精子细胞代谢和精子形成中起重要作用,被认为是睾丸支持细胞分裂的主要有丝分裂因子[6-8];而且,外源性的FSH给药能够增加精子发生速率,有利于治愈男性不育症[9]。甲状腺激素受体在睾丸发育过程中高度表达,但在成年睾丸中不表达,它可以延长睾丸支持细胞有丝分裂时间,诱导睾丸支持细胞的早期成熟,从而改变成年动物睾丸支持细胞的总数[10-12]。睾酮是由睾丸中的间质细胞产生的,可以与雄激素受体结合,调节睾丸支持细胞的合成和分泌[13-14]。这些研究都说明,睾丸支持细胞的增殖受到了体内多种激素的调控。
骨形态发生蛋白4(bone morphogenetic protein,BMP4)是转化生长因子-β(transforming growth factor-β,TGF-β)家族的成员,在两性繁殖方面起着重要的作用,其表达与卵细胞的活力和功能、精子质量和胚胎发育有关。研究表明,BMP4突变型雄性小鼠不育,存在生殖细胞退化、精子计数低、精子质量差等问题[15]。在雌性哺乳动物中,BMP4促进催乳素细胞的产生,并与Smad(Sma and Mad homologue)-雌激素受体(estrogen receptor,ER)相互作用以促进泌乳素的产生,其作用机制表现为BMP4抑制ER的转录活性,进而减弱SMAD信号的表达[16-17]。DNA结合抑制剂(Id)属于碱性螺旋-环-螺旋因子的内源性负调节剂,可通过防止异二聚体与DNA结合来抑制细胞分化,促进增殖,促进胚胎干细胞的自我更新和再生[18-20]。Id家族成员的DNA结合抑制剂2(Id2)是BMP目标基因中最重要的成员,作为BMP4的下游基因参与BMP4诱导的细胞功能改变[21]。本研究着重于BMP4-Id2信号轴,探讨其在睾丸支持细胞中的作用。
1 材料与方法 1.1 试验动物和细胞试验动物选自西南大学动物科学技术学院试验羊场的健康大足黑山羊,4组山羊分别为0、1、2和3月龄,每组选择3只公山羊。所有试验均得到西南大学动物实验伦理委员会的批准。
山羊麻醉后,立即用消毒的外科手术设备收集睾丸组织,酒精消毒,将它们放入含有双抗的生理盐水中,立即送回实验室进行细胞培养。使用十字法切开睾丸的白膜以及附睾,以暴露睾丸中间的实质组织,并将其放入新的无菌培养皿中,切成约1 mm×1 mm× 1 mm的组织块,使其均匀。两步酶法消化匀浆,将含有DMEM/F12的混合物通过80目和400目细胞筛过滤到烧杯中,以获得单细胞悬液,将其以1 300 r·min-1离心5 min获得细胞沉淀。最后,向细胞沉淀物中添加适量的胎血培养基,移液混合,添加到细胞培养瓶,在显微镜下观察细胞密度。调整到烧瓶底部的约60%,并标记每个细胞培养瓶。置于37 ℃和5%CO2的细胞培养箱中。在2、12、18和24 h后更换培养基,以去除未附着的精原细胞、基质细胞和杂质细胞。
1.2 BMP4下游靶基因的预测本课题组前期对大足黑山羊睾丸组织进行转录组测序,其结果的准确性已经过检验[22]。通过转录组分析发现,BMP4与BMPRⅠ结合,使SMAD4参与磷酸化SMAD1、SMAD5、SMAD8,并最终调控Id家族基因,从而影响DNA的复制。通过初步的试验研究发现,山羊睾丸支持细胞中Id1和Id3基因的表达水平极低。因此,本试验选择Id2基因作为研究对象。
1.3 贴壁细胞总RNA提取和反转录根据制造商的说明,使用RNAiso试剂(TaKaRa,中国)从细胞中提取总RNA。使用型号Nanodrop1000分光光度计(中国)测定RNA浓度和纯度。研究中仅考虑吸光度比A260/A280为1.8~2.0的样品。根据PrimeScriptTM RT reagent Kit with gDNA Eraser说明书的要求首先去除基因组DNA,之后进行反转录反应。
1.4 山羊睾丸支持细胞总蛋白提取和Western blotting根据制造商的说明,使用动物总蛋白提取试剂盒(Sangon Biotech,中国)提取山羊睾丸支持细胞的总蛋白,BCA法测量蛋白水平。通过电泳、转印、封闭、一抗孵育、二抗孵育、DAB显影等步骤测定对应抗体的相对表达量水平。
1.5 引物设计和实时荧光定量PCR所有基因扩增引物均使用NCBI(https://www.ncbi.nlm.nih.gov/)设计(表 1),委托重庆擎科生物有限公司合成。TB GreenⓇ Premix Ex TaqTM II荧光定量PCR的反应体系为15 μL:TB GreenTM Premix Ex TaqTM II 7.5 μL,Forward primer 0.3 μL,Reverse primer 0.3 μL,cDNA 0.6 μL,RNase Free H2O 6.3 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,循环40次;63.5 ℃检测信号,熔解曲线根据引物不同设置为65~95 ℃每0.5 ℃读取一次Ct值。
|
|
表 1 研究中使用的PCR引物序列 Table 1 Sequences of PCR primers used in the study |
用于过表达的质粒载体是pReceiver-07-Expression Clone(图 1),使用的标签抗体是血凝素(HA)。

|
图 1 pReceiver-07-Expression Clone过表达载体 Fig. 1 pReceiver-07-Expression Clone overexpression vector |
BMP4干扰片段:BMP4(goat)-si-1: GAGCCAUGCUAGUUUGAUAtt;BMP4(goat)-si-2:GCAGGGCUUUCAUCGUAUAtt;BMP4(goat)-si-3:GCCCGGAAGAAGAAUAAGA tt。Id2干扰片段:Id2(goat)-si-1:GCCUGCUGUACAACA-UGAAtt;Id2(goat)-si-2:GGCUUCUGAAUU-CCCUUCUtt;Id2(goat)-si-3:GCAAGAUGGAA-AUCCUGCAtt。
1.7 睾丸支持细胞免疫荧光鉴定将单细胞悬浮液加入放有细胞爬片的12孔板中,在37 ℃、5% CO2培养箱中培养24 h后,用无菌的PBS冲洗3次。4%的多聚甲醛进行固定,0.5%Triton X-100溶液进行细胞通透,柠檬酸钠抗原修复液修复抗原,5% 的BSA溶液封闭后,孵育一抗(Rabbit Anti-WT1,Rabbit Anti-PCNA)、二抗(山羊抗兔IgG),再用DAPI进行核染,DAB对相关蛋白进行显色。
1.8 统计分析所有qPCR数据均表示为“平均值±SEM”,用2-ΔΔCT法测定基因的相对表达水平。使用SPSS 19.0软件单因素方差One-Way ANOVA分析对多个数据进行比较,使用独立t检验对两组数据进行比较分析。每个选择鉴定的基因均进行3个生物学重复以及3次技术重复。
2 结果 2.1 睾丸支持细胞鉴定WT1蛋白(wilms tumor protein-1)在睾丸支持细胞中特异性表达,而在睾丸其他细胞中不表达,因此WT1蛋白表达可作为鉴定睾丸支持细胞的标准[23]。培养细胞的DAPI核染色和WT1蛋白的AlexaFluor647红色荧光标记显示,几乎100%的细胞核被染成红色,表明大多数培养细胞是睾丸支持细胞,可用于后续试验(图 2)。
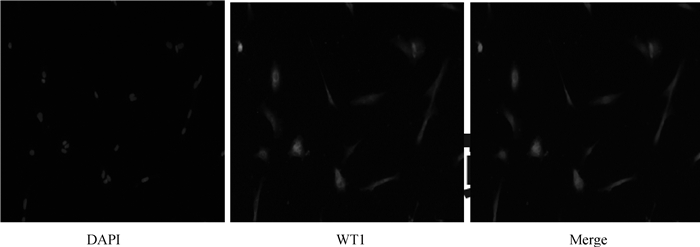
|
图 2 睾丸支持细胞的免疫荧光鉴定(100×) Fig. 2 Immunofluorescence identification of testicular sertoli cells(100×) |
为筛选出睾丸支持细胞中BMP4表达最高的时期,使用qPCR来检测BMP4在0、1、2和3月龄时期睾丸支持细胞中的表达。发现0~3月龄的睾丸支持细胞中都存在BMP4表达,并且BMP4在2月龄组的表达量极显著高于0、1月龄组(P < 0.01,图 3)。因此,使用2月龄的睾丸支持细胞进行后续试验。
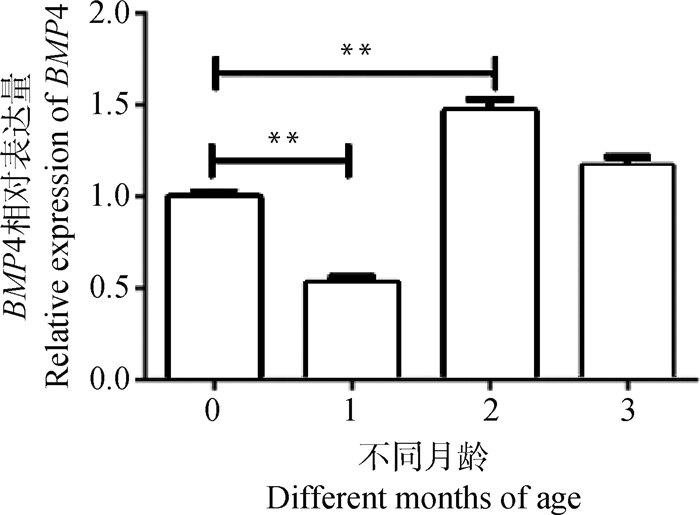
|
*. P < 0.05,**. P < 0.01。下同 *. P < 0.05, **. P < 0.01. The same as below 图 3 BMP4在不同月龄睾丸支持细胞中的表达 Fig. 3 The expression of BMP4 in testicular sertoli cells at different months of age |
细胞复苏后接种到96孔板,按分组向不同的孔中加入不同浓度的BMP4。具体分组设置为对照组、50、100、150和200 ng·mL-1组(每组4个重复孔)。放入细胞培养箱分别培养24、48、72 h。CCK8法检测细胞的活性,结果发现,24 h后细胞增殖无明显变化,48、72 h后细胞随BMP4浓度的增加其增殖活力也增加。其中200 ng·mL-1的BMP4处理组与对照组相比,其增殖能力最强(P < 0.05,图 4)。

|
图 4 不同浓度BMP4对睾丸支持细胞增殖的影响 Fig. 4 The effect of BMP4 with different concentrations on the proliferation of testicular sertoli cells |
为深入了解BMP4表达水平对睾丸支持细胞的影响,本研究用RT-PCR检测干扰片段对BMP4表达的影响。结果表明,阴性对照(NC)对BMP4基因表达无显著影响(P>0.05),而3对干扰片段对BMP4基因表达均有一定的干扰作用,干扰效率分别为67.85%、73.44%和64.05%(P<0.01,图 5A),其中,BMP4 siRNA2具有最高的干扰效率,被选作后续试验的干扰片段。利用CCK8法检测细胞的活性,结果表明,与NC组相比,siRNA2组的细胞活力分别在24和48 h后下降了21%和34%(P < 0.05),并在72 h后恢复,NC和siRNA组之间无显著差异(P>0.05,图 5B)。在睾丸支持细胞中,BMP4干扰后,试验组中PCNA的表达极显著降低(P<0.01,图 5C),表明BMP4干扰后细胞的增殖能力受到限制。测量细胞增殖指数表明,与NC组相比,BMP4干扰组的增殖水平显著降低(P < 0.05,图 5D),进一步说明BMP4干扰后细胞的增殖能力受到限制。
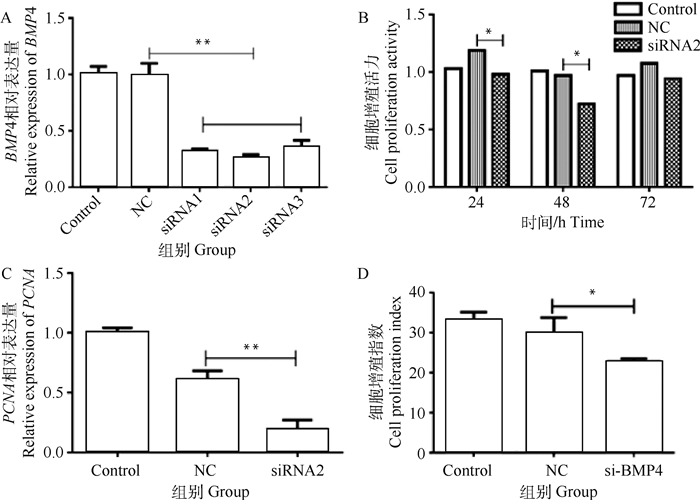
|
A. siRNA干扰后BMP4的相对表达;B. siRNA2干扰后细胞增殖活性水平;C. siRNA2干扰后PCNA的相对表达水平;D. BMP4干扰后的细胞增殖指数 A. The relative expression of BMP4 after siRNA interference; B. The level of cell proliferation activity after siRNA2 interference; C. The relative expression level of PCNA after siRNA2 interference; D. The cell proliferation index after BMP4 interference 图 5 BMP4干扰效果检测 Fig. 5 BMP4 interference effect detection |
为验证BMP4对Id2的作用,本研究敲低了BMP4或使其过表达。敲低BMP4后,试验组其下游靶基因Id2的mRNA水平较NC组降低,但无显著差异(P>0.05,图 6A),因此没有对其进行后续试验。BMP4过表达后,试验组BMP4的表达水平极显著高于NC组和对照组(P < 0.01, 图 6B)。使用HA标签确定了BMP4过表达后Id2的蛋白水平,并使用qPCR检测了Id2的mRNA表达。结果显示,BMP4过表达后,不仅其自身表达增加,而且其靶基因Id2也显著增加,并且过表达组中Id2的表达比NC组高1.25倍,差异有统计学意义(P < 0.01,图 6C、D、E)。这些结果表明,BMP4对Id2有正向的调节作用。
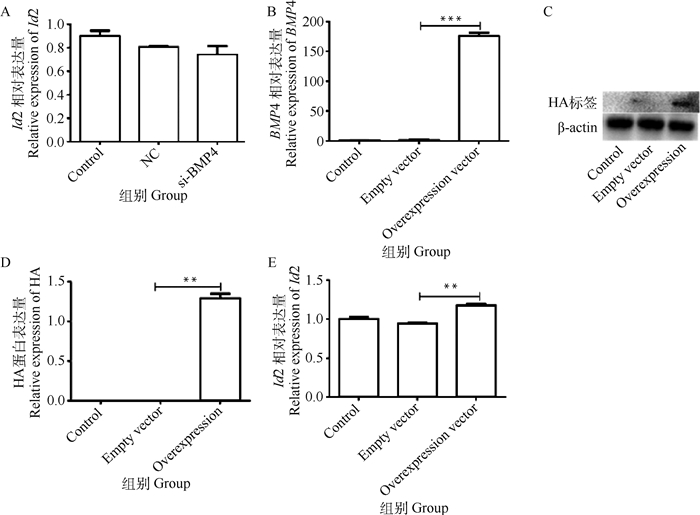
|
A. BMP4干扰后下游基因Id2的相对表达;B. 质粒转染后BMP4的相对表达水平;C、D.质粒转染后HA蛋白的相对水平;E.质粒转染后的Id2的相对水平 A. The relative expression of the downstream gene Id2 after BMP4 interference; B. The relative expression level of BMP4 after plasmid transfection; C, D. The relative level of HA protein after plasmid transfection; E. The relative expression level of Id2 after plasmid transfection 图 6 BMP4敲低/过表达对Id2的影响 Fig. 6 The effect of BMP4 knockdown/overexpression on Id2 |
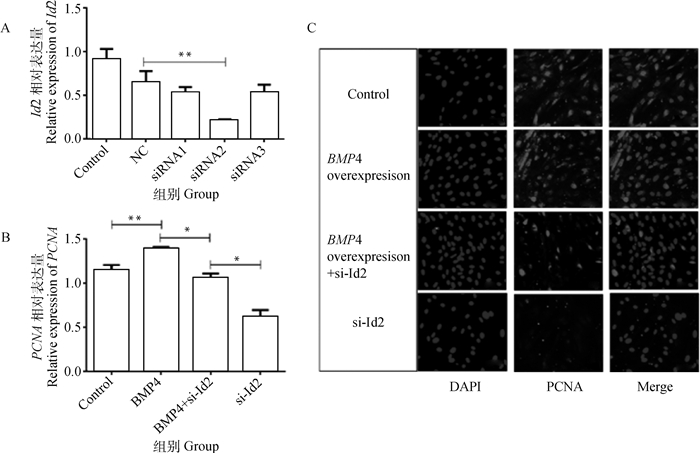
为筛选出对Id2干扰效果最佳的siRNA,将3个干扰片段分别转染睾丸支持细胞。转染24 h后,Id2-siRNA2的干扰效率最高,为77.72%(P < 0.01,图 7A)。因此,选择Id2-siRNA2进行后续研究。为验证Id2干扰对睾丸支持细胞增殖基因表达的影响,首先过表达BMP4,然后将Id2干扰片段转染24 h,最后提取总RNA,利用细胞免疫荧光检测PCNA的表达。对荧光定量结果分析表明,单独过表达BMP4后,PCNA的表达较对照组极显著增加(P < 0.01)。BMP4过表达再转染Id2干扰片段后,PCNA的表达与对照组差异无统计学意义(P>0.05),单独干扰Id2组PCNA的表达水平与对照组相比差异显著(P<0.05,图 7B、C)。
|
A. siRNNA干扰后睾丸支持细胞中Id2表达;B. BMP4过表达、Id2干扰、BMP4过表达+Id2干扰后睾丸支持细胞中PCNA表达;C. BMP4过表达、Id2干扰、BMP4过表达+Id2干扰后睾丸支持细胞中PCNA蛋白表达(200×) A. The expression of Id2 in testicular sertoli cells after siRNA interference; B. The PCNA expression in testicular sertoli cells after BMP4 overexpression, Id2 interference, BMP4 overexpression + Id2 interference; C. The PCNA protein expression in testicular sertoli cells after BMP4 overexpression, Id2 interference, BMP4 overexpression + Id2 interference(200×) 图 7 干扰Id2对睾丸支持细胞增殖的影响 Fig. 7 The effect of interfering Id2 on the proliferation of testicular sertoli cells |
BMP4对两性的生殖功能都有重要影响,其表达会影响精子的健康、卵细胞的活力和功能以及正常的胚胎发育[24]。本试验首先筛选出了BMP4在大足黑山羊睾丸支持细胞中作用的最佳年龄。BMP4的表达在2月龄组最高,这可能与大足黑山羊的生殖发育阶段有关,2月龄正处于青春期前期,睾丸的发育处于旺盛阶段,睾丸体积增大,支持细胞也处于大幅度增长状态[25]。基于这种推测,本研究探讨了BMP4浓度对睾丸支持细胞生长活力的影响,发现睾丸支持细胞的增殖能力随着BMP4浓度的增加而增加,这种状态与细胞接触异质后的生长趋势相一致。同样,Hai等[26]发现,BMP4能使人睾丸支持细胞的生长呈剂量依赖性。随后,为验证此结果,本研究构建了3条siRNA干扰片段,经过荧光检测证实,siRNA能够被有效地转入到睾丸支持细胞内,且siRNA2干扰效率最高,可以作为BMP4的干扰靶点。
Id的生理功能主要是抑制细胞分化和促进细胞增殖。Yang等[27]表明,Id蛋白是人肺动脉平滑肌细胞中BMP信号转导的关键下游效应子,Fei等[28]发现,在小鼠胚胎干细胞中,Id基因的启动子区域有SMAD的结合位点,进一步表明BMP /SMAD途径可以通过Id基因起作用。在本研究中,干扰BMP4后,睾丸支持细胞中Id2表达水平无明显变化;而在BMP4过表达后,睾丸支持细胞中Id2的表达水平显著上升,表明在睾丸支持细胞中BMP4能够正向调控Id2。相对过表达BMP4再干扰Id2试验组,干扰Id2的试验组中PCNA基因以及蛋白的表达水平显著降低(P < 0.05),这说明BMP4可以通过Id2影响支持细胞的增殖。这与Hua等[29]发现的BMP4通过Id2蛋白促进胰腺祖细胞增殖的结果是相似的。但过表达BMP4再干扰Id2的试验组PCNA表达水平与对照组差异不显著,而只干扰Id2试验组显著低于对照组,说明BMP4可能不仅仅通过Id2这一基因对睾丸支持细胞起作用,如作为BMPs主要调控通路的SMAD通路很有可能在其中起着重要作用[30-31]。这些结果与Carlomagno等[32]对小鼠精原干细胞的发现是相似的。但是,Id2下游是否存在调控睾丸支持细胞生长的基因需要进一步研究。
4 结论本研究结果显示,山羊睾丸支持细胞的增殖活力在一定范围内与BMP4的浓度呈正相关;且BMP4能够正向调控Id2的表达,并通过促进Id2的表达进而促进支持细胞的增殖。
| [1] | AHMAD N, UMAIR S, SHAHAB M, et al. Testicular development and establishment of spermatogenesis in Nili-Ravi buffalo bulls[J]. Theriogenology, 2010, 73(1): 20–25. DOI: 10.1016/j.theriogenology.2009.06.034 |
| [2] | MOURA A A, SOUZA C E A, ERICKSON B H. Early prepubertal testis criteria, seminiferous epithelium and hormone concentrations as related to testicular development in beef bulls[J]. Anim Reprod Sci, 2011, 124(1-2): 39–47. DOI: 10.1016/j.anireprosci.2011.01.016 |
| [3] | FRANCÇA L R, SILVA V A, CHIARINI-GARCIA H, et al. Cell proliferation and hormonal changes during postnatal development of the testis in the pig[J]. Biol Reprod, 2000, 63(6): 1629–1636. DOI: 10.1095/biolreprod63.6.1629 |
| [4] | HERRERA-ALARCÓN J, VILLAGÓMEZ-AMEZCUA E, GONZÁLEZ-PADILLA E, et al. Stereological study of postnatal testicular develop-ment in Blackbelly sheep[J]. Theriogenology, 2007, 68(4): 582–591. DOI: 10.1016/j.theriogenology.2007.01.020 |
| [5] | RUSSELL L D, PETERSON R N. Determination of the elongate spermatid-sertoli cell ratio in various mammals[J]. J Reprod Fert, 1984, 70(2): 635–641. DOI: 10.1530/jrf.0.0700635 |
| [6] | ODUWOLE O O, PELTOKETO P, HUHTANIEMI I T. Role of follicle-stimulating hormone in spermatogenesis[J]. Front Endocrinol (Lausanne), 2018, 9: 763. DOI: 10.3389/fendo.2018.00763 |
| [7] | CRESPO D, LEMOS M S, ZHANG Y T, et al. PGE2 inhibits spermatogonia differentiation in zebrafish: interaction with FSH and an androgen[J]. J Endocrinol, 2020, 244(1): 163–175. DOI: 10.1530/JOE-19-0309 |
| [8] | SCHULZ R W, DE FRANÇA L R, LAREYRE J J, et al. Spermatogenesis in fish[J]. Gen Comp Endocrinol, 2010, 165(3): 390–411. DOI: 10.1016/j.ygcen.2009.02.013 |
| [9] | SANTI D, CRÉPIEUX P, REITER E, et al. Follicle-stimulating hormone (FSH) action on spermatogenesis: a focus on physiological and therapeutic roles[J]. J Clin Med, 2020, 9(4): 1014. DOI: 10.3390/jcm9041014 |
| [10] | CAROSA E, LENZI A, JANNINI E A. Thyroid hormone receptors and ligands, tissue distribution and sexual behavior[J]. Mol Cell Endocrinol, 2018, 467: 49–59. DOI: 10.1016/j.mce.2017.11.006 |
| [11] | FIGUEIREDO A F A, WNUK N T, TAVARES A O, et al. Prepubertal PTU treatment in rat increases Sertoli cell number and sperm production[J]. Reproduction, 2019, 158(2): 199–209. |
| [12] | HATEF A, UNNIAPPAN S. Metabolic hormones and the regulation of spermatogenesis in fishes[J]. Theriogenology, 2019, 134: 121–128. DOI: 10.1016/j.theriogenology.2019.05.021 |
| [13] | BERGER T. Testicular estradiol and the pattern of Sertoli cell proliferation in prepuberal bulls[J]. Theriogenology, 2019, 136: 60–65. DOI: 10.1016/j.theriogenology.2019.06.031 |
| [14] | BHATTACHARYA I, BASU S, PRADHAN B P, et al. Testosterone augments FSH signaling by upregulating the expression and activity of FSH-Receptor in Pubertal Primate Sertoli cells[J]. Mol Cell Endocrinol, 2019, 482: 70–80. DOI: 10.1016/j.mce.2018.12.012 |
| [15] | HU J, CHEN Y X, WANG D, et al. Developmental expression and function of Bmp4 in spermatogenesis and in maintaining epididymal integrity[J]. Dev Biol, 2004, 276(1): 158–171. DOI: 10.1016/j.ydbio.2004.08.034 |
| [16] | GIACOMINI D, PÁEZ-PEREDA M, STALLA J, et al. Molecular interaction of BMP-4, TGF-β, and estrogens in lactotrophs: impact on the PRL promoter[J]. Mol Endocrinol, 2009, 23(7): 1102–1114. DOI: 10.1210/me.2008-0425 |
| [17] | MIYOSHI T, OTSUKA F, OTANI H, et al. Involvement of bone morphogenetic protein-4 in GH regulation by octreotide and bromocriptine in rat pituitary GH3 cells[J]. J Endocrinol, 2008, 197(1): 159–169. DOI: 10.1677/JOE-07-0549 |
| [18] | PATEL D, MORTON D J, CAREY J, et al. Inhibitor of differentiation 4 (ID4): from development to cancer[J]. Biochim Biophys Acta Rev Cancer, 2015, 1855(1): 92–103. DOI: 10.1016/j.bbcan.2014.12.002 |
| [19] | LING F, KANG B, SUN X H. Chapter Five-Id proteins: small molecules, mighty regulators[J]. Curr Top Dev Biol, 2014, 110: 189–216. |
| [20] | YING Q L, NICHOLS J, CHAMBERS I, et al. BMP induction of Id proteins suppresses differentiation and sustains embryonic stem cell self-renewal in collaboration with STAT3[J]. Cell, 2003, 115(3): 281–292. DOI: 10.1016/S0092-8674(03)00847-X |
| [21] | SMADJA D M, BIÈCHE I, SILVESTRE J S, et al. Bone morphogenetic proteins 2 and 4 are selectively expressed by late outgrowth endothelial progenitor cells and promote neoangiogenesis[J]. Arterioscl Throm Vas Biol, 2008, 28(12): 2137–2143. DOI: 10.1161/ATVBAHA.108.168815 |
| [22] | ZHAO Z Q, QIAO L, DAI Z N, et al. LncNONO-AS regulates AR expression by mediating NONO[J]. Theriogenology, 2020, 145: 198–206. DOI: 10.1016/j.theriogenology.2019.10.025 |
| [23] | GAO F, MAITI S, ALAM N, et al. The Wilms tumor gene, Wt1, is required for Sox9 expression and maintenance of tubular architecture in the developing testis[J]. Proc Natl Acad Sci U S A, 2006, 103(32): 11987–11992. DOI: 10.1073/pnas.0600994103 |
| [24] | BORGES L, IACOVINO M, KOYANO-NAKAGAWA N, et al. Expression levels of endoglin distinctively identify hematopoietic and endothelial progeny at different stages of yolk sac hematopoiesis[J]. Stem Cells, 2013, 31(9): 1893–1901. DOI: 10.1002/stem.1434 |
| [25] | MÄKELÄ J A, KOSKENNIEMI J J, VIRTANEN H E, et al. Testis development[J]. Endocr Rev, 2019, 40(4): 857–905. DOI: 10.1210/er.2018-00140 |
| [26] | HAI Y N, SUN M, NIU M H, et al. BMP4 promotes human Sertoli cell proliferation via Smad1/5 and ID2/3 pathway and its abnormality is associated with azoospermia[J]. Discov Med, 2015, 19(105): 311–325. |
| [27] | YANG J, LI X H, LI Y, et al. Id proteins are critical downstream effectors of BMP signaling in human pulmonary arterial smooth muscle cells[J]. Am J Physiol Lung Cell Mol Physiol, 2013, 305(4): L312–L321. DOI: 10.1152/ajplung.00054.2013 |
| [28] | FEI T, XIA K, LI Z W, et al. Genome-wide mapping of SMAD target genes reveals the role of BMP signaling in embryonic stem cell fate determination[J]. Genome Res, 2010, 20(1): 36–44. DOI: 10.1101/gr.092114.109 |
| [29] | HUA H, ZHANG Y Q, DABERNAT S, et al. BMP4 regulates pancreatic progenitor cell expansion through Id2[J]. J Biol Chem, 2006, 281(19): 13574–13580. DOI: 10.1074/jbc.M600526200 |
| [30] | WANG W, WANG L, LI X X, et al. Effect of interrupted endogenous BMP/Smad signaling on growth and steroidogenesis of porcine granulosa cells[J]. J Zhejiang Univ Sci-B(Biomed & Biotechnol), 2010, 11(9): 719–727. |
| [31] | YU D L, ZHANG L, WANG H J, et al. A potential role for SMAD9 in goose follicular selection through regulation of mRNA levels of luteinizing hormone receptor[J]. Theriogenology, 2019, 135: 204–212. DOI: 10.1016/j.theriogenology.2018.11.022 |
| [32] | CARLOMAGNO G, VAN BRAGT M P A, KORVER C M, et al. BMP4-induced differentiation of a rat spermatogonial stem cell line causes changes in its cell adhesion properties[J]. Biol Reprod, 2010, 83(5): 742–749. DOI: 10.1095/biolreprod.110.085456 |



