2. 沧州职业技术学院畜牧兽医系, 沧州 061001
2. Department of Animal Husbandry and Veterinary, Cangzhou Vocational and Technical College, Cangzhou 061001, China
纳米材料是一种人工制造或自然形成的、粒径在1~100 nm的微型颗粒;其中,乳胶体、陶瓷颗粒、金属颗粒、碳颗粒、聚合物及生物分子等均可作为纳米材料。由于纳米微粒的独特结构状态,使其产生了表面效应、小尺寸效应、量子尺寸效应等,故纳米材料具有许多特殊功能。目前,纳米材料已广泛应用于医学、药学、生物检测、光学以及国防等领域[1]。自然条件下,生物能够合成各种各样的纳米颗粒,如外泌体、脂蛋白、铁蛋白、小热休克蛋白与病毒样颗粒等,这些纳米颗粒与细胞膜作用强,极易进入细胞内,易被化学和生物学修饰或改造[1-3]。将纳米技术与生物医学、药学相结合而制成的纳米制剂和纳米药物具有更好的药代动力学、高效性、生物相容性、安全性和靶向性等优势,在生物医药领域开发应用前景十分广阔[4]。
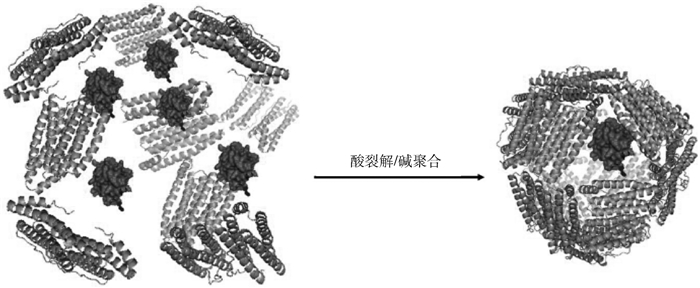
铁蛋白(ferritin)由法国科学家Laufberger(1937)[5]首次发现,Lawson等[6]明确了铁蛋白的晶体结构。除酵母外,铁蛋白广泛存在于动物、高等植物、细菌、真菌以及古细菌中,具有储存铁、调节铁离子代谢和维持机体内铁元素平衡及保护细胞组分等功能[7]。哺乳动物的几乎所有组织中均有铁蛋白,尤其是在肝和脾内含量最高[7-8]。在细胞内外均存在铁蛋白,胞内铁蛋白主要分布于细胞质、细胞核和线粒体中,胞外铁蛋白则主要存在于如血清、滑膜液和脑脊液等液体中[7-9]。铁蛋白是由一定数目的亚基以对称方式组成一个空心结构,内部为铁和磷酸盐分子构成的内核,具有直径小(外径9~32 nm)、耐热(85 ℃)、耐变性剂以及蛋白亚基解体(pH 2.66~3.4)后可重新恢复(pH 7.0)原结构等独特的理化性质[10-13]。近年来,通过对铁蛋白进行化学修饰和基因工程改造而搭建的铁蛋白纳米载体平台,为诊断制剂、疫苗递送和靶向治疗等的研究提供了重要支撑。本文重点综述了铁蛋白的结构、生物学功能及其在诊断、疫苗研究和药物递送等方面的研究进展,以期为基于铁蛋白纳米颗粒的检测制剂、疫苗和药物载体的研究提供参考。
1 铁蛋白的结构与生物学功能根据蛋白组成和结构的不同,铁蛋白可分为经典铁蛋白(ferritin, Ftn)和细菌特有铁蛋白。Ftn是铁蛋白家族的典型成员,见于真核生物、古细菌和细菌中,是迄今发现的分布最广泛的一种铁蛋白[11]。细菌特有铁蛋白主要有Bfr(bacterioferritin)、Dps(DNA binding protein from starved cells)和Encftn(encapsulin ferritin)3种;其中,Bfr存在于细菌中,结构上与Ftn相似,但有明显差异;Dps发现于细菌和古生菌,是一种可以与DNA结合的铁蛋白;Encftn是在细菌中发现的直径最大的一种铁蛋白[7, 14-15]。
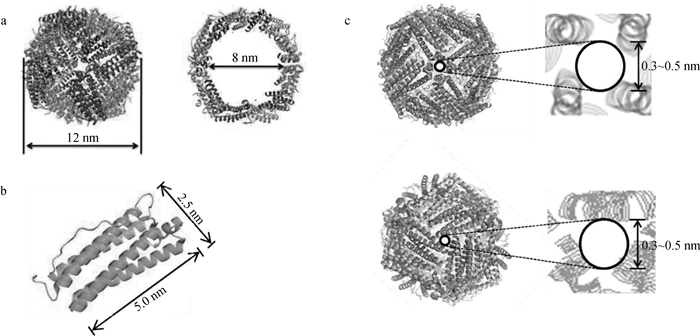
1.1 经典铁蛋白经典铁蛋白Ftn由24个亚基组成,外径约为12 nm,内径8 nm,为一对称型中空球状结构,其相对分子质量为450 ~ 480 ku。Ftn的亚基为长5 nm、宽2.5 nm的圆柱形,每个亚基由5~6个α螺旋组成[16](图 1a、1b)。天然的铁蛋白含有铁核(主要成分是5Fe2O3·9H2O),每个铁蛋白的中心空腔能够存储大约4 500个铁原子,不含铁核的铁蛋白称为脱铁铁蛋白(apoferritin)[7]。
|
a. 铁蛋白;b. 亚基; c. 离子通道 a. Ferritin; b. Subunit; c. Ion channels 图 1 铁蛋白的结构示意图[7, 16, 20] Fig. 1 The structural sketch of ferritin[7, 16, 20] |
通常情况下,Ftn球状结构的内表面富含谷氨酸和天冬氨酸等酸性残基,其等电点为5.0~6.0,致使铁蛋白内表面的负电荷密度很高[17]。研究表明,铁蛋白的24个亚基组成正八面体结构,其亚基之间连接可形成一定的通道,每个Ftn分子具有8个3倍通道和6个4倍通道,其孔径为0.3~0.5 nm(图 1c)。在这些通道以及Ftn内部均带负电荷,此特征使金属离子和带正电荷的有机小分子可以扩散到腔内[16, 18-19]。
虽然从古细菌到高等真核生物Ftn的结构具有高度保守性,但在不同生物体内或者同种生物的不同组织器官内,铁蛋白的亚基组成及亚基数目不同。铁蛋白亚基包括:重链(H-chain,21 ku)和轻链(L-chain,19 ku)[20],其中H链和L链按一定比例组装成的铁蛋白分子为多聚物,而由相同亚基(H链或L链)组装成的铁蛋白分子为均聚物。在植物和细菌中,大部分的Ftn是由相同亚基自主装而成的均聚物,少数是由不同H链和L链组成的多聚物。哺乳动物的铁蛋白是由H链和L链共同组装成的多聚物,且不同组织中铁蛋白的H链和L链的比例也不尽相同,如人的心脏中铁蛋白H链含量较高,人肺和马脾中L链含量较高,这是由于哺乳动物不同器官和组织对铁离子代谢功能或者铁存储功能的需求不同所致[8, 21]。在昆虫体内,Ftn由两种亚基(命名为HCH和LCH)以固定比例(H12∶L12)组装而成,敲除其中任何一种亚基基因都会使其胚胎致死[22]。
在不同的铁蛋白亚基中,H链亚基含有高度保守的“亚铁氧化酶”氧化位点,具有结合和氧化亚铁离子的功能[7],并直接参与机体对氧化损伤的保护作用[23]。而铁蛋白L链亚基具有电子转移活性,可以通过铁蛋白壳层的电子受体和供体使铁氧化过程中释放的电子穿过铁蛋白笼,提高铁的周转速度。Ftn特有的中空结构以及灵活的离子通道,使其在不同物质的递送方面具有广泛的应用潜力。
1.2 细菌特有铁蛋白细菌铁蛋白Bfr的结构和直径与Ftn相似,大多数是由24个H链亚基组成的均聚物,少数细菌的Bfr是由H链和L链两种亚基组成的多聚物,如铜绿假单胞菌(Pesudomonas aeruginosa)、恶臭假单胞菌(P. putida)和蓝藻(cyanobacterium Synechocystis)中的铁蛋白[24-25]。与经典铁蛋白Ftn不同的是,在Bfr的每两个亚基之间有一个血红素基团,而经典铁蛋白Ftn的亚基之间没有[11]。Bfr具有储存铁、参与保护细胞免受氧化还原应激和维持细胞稳态的功能,但其的储铁功能主要是通过与血红素结合的形式而实现的[26]。
Dps是由12个相同亚基组成的外径约9 nm、内径4.5 nm的四面体对称的壳状结构。由于Dps体积小,在其中心空腔仅能够存储500个左右的铁原子。除了能存储铁原子之外,Dps的主要功能是防止有害的芬顿反应(fenton reaction),保护DNA免受铁诱导的氧化损伤[27-28]。
Encftn是细菌铁蛋白中最大的一种,直径有24和32 nm两种,蛋白分子呈二十面体,分别由60和180个相同的亚基组成[10, 29]。Encftn最多能够存储大约30 000个铁原子[10],这些铁原子可能以不均匀的形式聚集成为多个直径5~6 nm的铁微粒(iron granules),它们加在一起所包含的铁原子量大约是单个Ftn的10倍[30]。但Encftn的亚基内不含有铁氧化酶中心和铁原子,因此,Encftn只能依靠装载其他铁蛋白或组装不完整的铁蛋白(half-ferritin)分子来实现铁的储存或者转化功能[30-32]。
2 铁蛋白的应用 2.1 在疾病诊断方面铁蛋白的独特结构使其可作为纳米容器装载具有不同功能的物质,从而提高或改善生物医学检测技术的应用效果。铁蛋白装载的物质主要包括纳米荧光材料、磁性纳米颗粒和过渡金属离子[33-35],用于肿瘤靶向荧光检测、核磁共振成像和生化检测等方面。
2.1.1 肿瘤靶向荧光检测 铁蛋白的H链能够与细胞表面转铁蛋白受体1(transferritin receptor 1,TfR1)特异性结合,而肿瘤细胞过度表达TfR1[36],该特性使铁蛋白在成像检测方面具有很大的应用潜力。已有试验表明,用异硫氰酸荧光素(FITC)或Cy5.5标记铁蛋白H链制成的纳米颗粒可染色肿瘤细胞,区分癌细胞与正常细胞,检测敏感性达98%[37-38],但铁蛋白与不同肿瘤细胞的结合能力有差异。此外,铁蛋白还可以延长荧光染料的体内发光时间,如装载荧光染料吲哚箐绿(indocyanine green,ICG)的铁蛋白H链纳米粒(HFN-ICG),在小鼠活体肿瘤荧光成像检测时,ICG在体内的保留时间延长,在给药6 h后仍可观察到较强的荧光信号[33]。上述研究表明,基于铁蛋白纳米颗粒的荧光检测试剂不仅可以实现靶向性和精准性诊断的目的,而且具有高敏感性及检测长效性的特点。
2.1.2 核磁共振成像检测 目前,氧化铁磁性纳米颗粒(magnetic nanoparticles,MNP)作为T1造影剂和T2造影剂已广泛应用于核磁共振成像(magnetic resonance imaging,MRI)检测中,但是需要对MNP进行复杂的修饰才能具备高效率的组织靶向性和良好的生物相容性等特点,并且MNP具有一定的细胞毒性[39-40]。而装载MNP的磁性铁蛋白(magnetoferritin,MFt)具有蛋白质壳层,可以避免上述缺点,在溶液中容易分散,不相互作用,生物相容性好,成像效果显著优于造影剂,更适用于活体MRI[41-43]。Radoul等(2016)[44]将人H链铁蛋白的C末端与磁小体蛋白Mms6连接后转染小鼠胶质瘤C6细胞,发现该嵌合磁性铁蛋白可提高核磁共振的检测极限。可见,装载MNP的铁蛋白纳米颗粒可以实现组织靶向性、降低细胞毒性、提高成像准确性与检测极限的目标。
2.1.3 生化检测 一般铁蛋白的H链亚基具有铁氧化酶中心,因此铁蛋白本身即是一种纳米酶。以铁蛋白为基础,通过不同方法装载过渡金属离子,获得的人工纳米酶可表现出不同的类酶活性[34],具有良好的生物相容性和稳定性,同时铁蛋白外壳能够有效抵抗高温、变性剂以及生物体内致酶失活的大分子物质的作用[34]。人工纳米酶活性与铁蛋白装载金属离子的量成正比,双金属纳米酶的活性高于单一金属的纳米酶,这可能与两种金属离子(如Fe和Pt)存在协同效应有关[45-46]。目前,利用铁蛋白合成的人工纳米酶主要包括类铁氧化酶、类过氧化酶、类氧化酶和类超氧化物歧化酶等(表 1)[37, 45-55]。这些人工纳米酶可用于调节体内铁的动态平衡、疾病诊断和治疗,还可以用于清除细胞内活性氧和冷冻保存剂。
|
|
表 1 基于铁蛋白的人工纳米酶 Table 1 Artificial nanoenzyme based on ferritin |
应用基因工程手段对铁蛋白的不同亚基进行改造或修饰,将抗原蛋白引入铁蛋白表面,同时不影响铁蛋白各亚基之间的自主装性能。该特点使铁蛋白作为纳米递送系统在纳米疫苗(nanoparticle vaccines)研发和抗原递呈研究等方面突显竞争潜力[3]。研究发现,幽门螺杆菌(Helicobacter pylori,HP)铁蛋白亚基与H1N1流感病毒血凝素(hemagglutinin,HA)的融合蛋白纳米颗粒(HA-Ftn)能够诱导小鼠和雪貂产生高于普通疫苗10倍以上的中和抗体,并且中和抗体作用范围广(可中和同亚型的不同毒株)[56];HP-Ftn与EB病毒(Epstein-Barr virus,EBV)表面糖蛋白(gp350)的融合纳米颗粒刺激小鼠和灵长类动物产生的特异性中和抗体水平比单纯gp350糖蛋白诱导的抗体水平高10~100倍[57]。另外,铁蛋白的H链和L链可分别与不同抗原基因(如不同流感病毒毒株的HA亚基和人类免疫缺陷病毒包膜蛋白Env)重组,制备含有两种不同抗原的重组铁蛋白纳米颗粒,这些重组纳米颗粒均能刺激小鼠产生针对相应病毒的中和抗体[58],这为后期多价铁蛋白纳米疫苗的开发提供了理论依据。
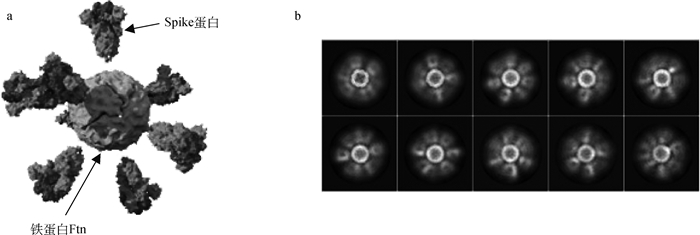
近来,Powell等[59]体外表达的HP-Ftn与新冠肺炎病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2) S蛋白的融合蛋白纳米颗粒(S-Ftn)(图 2)诱导小鼠产生的血清中和抗体水平比20名新冠肺炎恢复期血浆捐献者高2倍。此外,基于铁蛋白的丙型肝炎病毒(HCV)[60]、人轮状病毒[61]、呼吸道合胞病毒(RSV)[62]和疏螺旋体[63]等的纳米颗粒,均能诱导动物产生高水平的特异性抗体(表 2)。抗原蛋白在铁蛋白亚基上的插入位点及抗原分子量的大小会影响疫苗的免疫效果,如当肠病毒71的VP1蛋白呈现在铁蛋白外部时,诱导小鼠产生的抗体滴度较高;抗原肽分子越大,免疫效果越好;当抗原设计在铁蛋白环区(loop zone)时,免疫效果最好,保护率最高[64]。
|
图 2 铁蛋白和SARS-CoV-2病毒S蛋白重组蛋白的模拟结构(a)和电镜图像(b)[59] Fig. 2 The simulated structure (a) and electron microscope image (b) of ferritin and SARS-COV-2 virus S protein[59] |
|
|
表 2 以铁蛋白为抗原递送系统的疫苗研究 Table 2 Research on vaccines using ferritin as antigen delivery system |
有关铁蛋白纳米疫苗能够诱导高水平且持久免疫应答的机制研究发现,铁蛋白纳米疫苗颗粒可在免疫小鼠的淋巴结内沉积,刺激特异性B淋巴细胞成熟,但在免疫猕猴时却未发现该效果,对此需要进一步深入探究[65]。Wang等[66]发现铁蛋白-乙肝病毒(HBV)表面抗原preS1纳米颗粒能同时主动靶向淋巴结中的常驻SIGNR1+巨噬细胞和SIGNR1+树突状细胞,分别促进B细胞和Tfh细胞的活化应答,该机制可能是诱导机体持久产生高水平抗体的主要原因,并且该研究认为铁蛋白纳米疫苗的免疫增强效果可能还与铁蛋白能重复展示目的抗原有关。另有研究表明,铁蛋白可通过激活TLR4/NF-κB途径刺激骨髓树突状细胞成熟,进而促进T细胞增殖分化为辅助性Th1和Th2细胞,增强机体的免疫反应[67]。上述研究表明,铁蛋白纳米疫苗可以同时刺激B细胞和T细胞活化,诱导完整的免疫应答反应;铁蛋白本身不仅可以作为非病毒型疫苗运输载体,而且其本身还具有免疫增强效果。
2.3 在药物递送系统方面2.3.1 化学药物递送系统 铁蛋白作为递送系统装载化学药物,可以有效避免药物在体内被快速清除,延长药物的半衰期,减少药物用量,同时也可以实现靶向给药,提高细胞摄取药物的效果。Macone等[68]利用人H铁蛋白特异性识别CD71的功能,将H铁蛋白部分序列嵌合在古细菌铁蛋白基因中,在大肠杆菌中表达出“人源化古生铁蛋白(HumFt)”,然后装载细胞色素C(图 3),从而将细胞色素C成功传递给急性早幼粒细胞白血病(APL) NB4细胞系,诱导细胞凋亡。包封于铁蛋白中的阿霉素(Dox)对胃癌、肝癌、乳腺癌及黑色素瘤的疗效显著提高,同时其对正常细胞的毒性降低[69-72]。铁蛋白药物载体在跨越血脑屏障(blood brain barrier,BBB)治疗肿瘤的研究中备受关注。Fan等[73]和Liu等[74]分别证实装载Dox和紫杉醇(PTX)的铁蛋白对小鼠大脑原位胶质瘤有特异性杀伤功能,且对其他器官无明显毒性。另外,根据临床需要,通过对铁蛋白进行修饰可获得对某些细胞的靶向功能,如在体外试验中发现,将肿瘤细胞的特异性单克隆抗体共价引入铁蛋白表面制成的抗体-药物偶联物对黑色素瘤细胞的靶向性比无单抗引入偶联物的靶向性高出25倍[75];用低分子量的聚乙二醇(polyethylene glycol,PEG)处理的铁蛋白可以快速穿过肺支气管黏液层,当恶性肺癌小鼠吸入PEG处理的包裹阿霉素的重链铁蛋白后,成活率提高50%[76];负载光敏剂ZnF16Pc的叶酸与铁蛋白纳米偶联物能有效抑制小鼠体内肿瘤的生长和转移[77]。综上表明,铁蛋白可以作为体内靶向治疗的理想药物载体。
2.3.2 核酸或多肽类药物递送系统 在肿瘤治疗中,由于化学药物缺乏特异性,不良反应大,而核酸和多肽等生物制剂因稳定性差、易被降解或变性及半衰期短等,使其难以达到理想的治疗效果。为了提高生物制剂的稳定性,改善其生物学活性,Li等[78]用人H铁蛋白和L铁蛋白分别包封小干扰RNA(small interfering RNA,siRNA),制得的H-siRNA和L-siRNA可免受RNA酶的降解,在培养基中于37 ℃和4 ℃条件下能分别保存24 h和4周以上,期间未发现siRNA泄露或者降解,并能有效抑制目的基因的表达。Lee等[79]将阳离子肽(CAP)、肿瘤细胞靶向肽(CTP)、肿瘤细胞穿透肽(CPP)和酶促切割肽(ECP)融合到人H铁蛋白的C-末端,然后包封siRNA,获得了能与肿瘤细胞特异性结合,并能穿透细胞膜的铁蛋白-siRNA纳米粒,成功地实现了siRNA在肿瘤细胞细胞质的靶向释放及有效沉默靶基因的目的。Su等[80]将胰高血糖素样肽(glucagon-like peptide-1,GLP-1)与人铁蛋白H亚基N端基因融合,用大肠杆菌表达的GLP-HFT重组蛋白,保持了天然GLP-1的降血糖功能,降糖效果可至少保持24 h;皮下注射GLP-HFT重组蛋白的半衰期约为52 h,表明该铁蛋白作为递送载体在II型糖尿病治疗药物研发中具有巨大潜力。这些研究说明,将铁蛋白纳米递送系统与核酸或多肽类药物相结合,可以弥补生物类药物的缺陷,提高药物疗效,延长药物半衰期,并可实现药物靶向性治疗的目的,这将是今后生物医药研究的重要方向之一。
2.3.3 中药或植物提取物递送系统 中药在疾病防治中占有重要地位,但有些中药因溶解度差、生物利用度低或毒副作用大,而使其的应用受到限制。研究表明,用马脾去铁蛋白装载槲皮素和姜黄素纳米粒,不仅可提高中药的溶解度,而且药物能够靶向乳腺癌细胞,诱导癌细胞凋亡,实现低剂量的中药取得更高疗效的目标,并降低了药物耐药性和副作用[81]。另有研究发现,用大豆铁蛋白H2亚基装载花青素(cyanidin-3-O-glucoside chloride, C3G)后,C3G的热和光稳定性提高了2倍,装载在铁蛋白纳米笼中的C3G分子比游离C3G的转运效率高[82]。此外,在模拟胃肠道试验中,Ftn能减缓原花青素(PCs)的释放速度[83]。
3 小结与展望纳米技术已广泛应用于医学、药学和生物检测等领域。铁蛋白纳米颗粒存在于几乎所有生物体内,具有高度的稳定性、良好的生物相容性和独特的自组装能力;在体外铁蛋白合成简单,方便修饰,有利于实现多种活性物质的装载和靶向治疗。铁蛋白作为非病毒载体,在疾病诊断、抗原和药物递送方面的开发应用潜力巨大,但目前有关铁蛋白纳米颗粒的开发,仍然存在一些问题亟待解决,如:1)不同铁蛋白亚基装载目的蛋白或肽链大小的极限范围;2)铁蛋白纳米粒基因修饰后的稳定性;3)异源铁蛋白纳米笼或其衍生物在体内的代谢途径;4)铁蛋白装载药物释放的动力学机制;5)铁蛋白纳米笼对装载不同生物活性物质的包封率和载药量;6)铁蛋白与不同肿瘤细胞结合能力差异的原因。相信随着铁蛋白纳米技术研究的深入及上述问题的解决,铁蛋白纳米颗粒将在生物医疗领域具有更广阔的应用前景。
| [1] | DEMCHUK A M, PATEL T R. The biomedical and bioengineering potential of protein nanocompartments[J]. Biotechnol Adv, 2020, 41: 107547. DOI: 10.1016/j.biotechadv.2020.107547 |
| [2] | STANLEY S. Biological nanoparticles and their influence on organisms[J]. Curr Opin Biotechnol, 2014, 28: 69–74. |
| [3] |
张婷婷. 基于铁蛋白的纳米结构可控自组装与功能化[D]. 开封: 河南大学, 2016.
ZHANG T T. Controllable self-assembly and functionalization of ferritin based nanostructure[D]. Kaifeng: Henan University, 2016. (in Chinese) |
| [4] | VENTOLA C L. Progress in nanomedicine: Approved and investigational nanodrugs[J]. P T, 2017, 42(12): 742–755. |
| [5] | LAUFBERGER V. Sur la cristallisation de la ferritine[J]. Bull Soc Chim Biol, 1937, 19(2): 1575–1582. |
| [6] | LAWSON D M, ARTYMIUK P J, YEWDALL S J, et al. Solving the structure of human H ferritin by genetically engineering intermolecular crystal contacts[J]. Nature, 1991, 349(6309): 541–544. DOI: 10.1038/349541a0 |
| [7] | CHAKRABORTI S, CHAKRABARTI P. Self-assembly of ferritin: structure, biological function and potential applications in nanotechnology[J]. Adv Exp Med Biol, 2019, 1174: 313–329. |
| [8] | TRUFFI M, FIANDRA L, SORRENTINO L, et al. Ferritin nanocages: A biological platform for drug delivery, imaging and theranostics in cancer[J]. Pharmacol Res, 2016, 107: 57–65. DOI: 10.1016/j.phrs.2016.03.002 |
| [9] | HARRISON P M, AROSIO P. The ferritins: molecular properties, iron storage function and cellular regulation[J]. Biochim Biophys Acta, 1996, 1275(3): 161–203. DOI: 10.1016/0005-2728(96)00022-9 |
| [10] | MCHUGH C A, FONTANA J, NEMECEK D, et al. A virus capsid-like nanocompartment that stores iron and protects bacteria from oxidative stress[J]. EMBO J, 2014, 33(17): 1896–1911. DOI: 10.15252/embj.201488566 |
| [11] | ZHANG Y, ORNER B P. Self-assembly in the ferritin nano-cage protein superfamily[J]. Int J Mol Sci, 2011, 12(8): 5406–5421. DOI: 10.3390/ijms12085406 |
| [12] | KIM M, RHO Y, JIN K S, et al. pH-dependent structures of ferritin and apoferritin in solution: disassembly and reassembly[J]. Biomacromolecules, 2011, 12(5): 1629–1640. DOI: 10.1021/bm200026v |
| [13] | JUTZ G, BÖKER A. Bionanoparticles as functional macromolecular building blocks - A new class of nanomaterials[J]. Polymer, 2011, 52(2): 211–232. DOI: 10.1016/j.polymer.2010.11.047 |
| [14] | HE D D, PIERGENTILI C, ROSS J, et al. Conservation of the structural and functional architecture of encapsulated ferritins in bacteria and archaea[J]. Biochem J, 2019, 476(6): 975–989. DOI: 10.1042/BCJ20180922 |
| [15] | EBRAHIMI K H, HAGEDOORN P L, HAGEN W R. Unity in the biochemistry of the iron-storage proteins ferritin and bacterioferritin[J]. Chem Rev, 2015, 115(1): 295–326. DOI: 10.1021/cr5004908 |
| [16] | ZANG J C, CHEN H, ZHAO G H, et al. Ferritin cage for encapsulation and delivery of bioactive nutrients: From structure, property to applications[J]. Crit Rev Food Sci Nutr, 2017, 57(17): 3673–3683. DOI: 10.1080/10408398.2016.1149690 |
| [17] | HE D D, MARLES-WRIGHT J. Ferritin family proteins and their use in bionanotechnology[J]. New Biotechnol, 2015, 32(6): 651–657. DOI: 10.1016/j.nbt.2014.12.006 |
| [18] | YANG R, CHEN L, YANG S, et al. 2D square arrays of protein nanocages through channel-directed electrostatic interactions with poly(α, l-lysine)[J]. Chem Commun, 2014, 50(22): 2879–2882. DOI: 10.1039/c3cc49306g |
| [19] | CHANDRAMOULI B, BERNACCHIONI C, DI MAIO D, et al. Electrostatic and structural bases of Fe2+ translocation through ferritin channels[J]. J Biol Chem, 2016, 291(49): 25617–25628. DOI: 10.1074/jbc.M116.748046 |
| [20] | UCHIDA M, KANG S, REICHHARDT C, et al. The ferritin superfamily: Supramolecular templates for materials synthesis[J]. Biochim Biophys Acta, 2010, 1800(8): 834–845. DOI: 10.1016/j.bbagen.2009.12.005 |
| [21] | JUTZ G, VAN RIJN P, MIRANDA B S, et al. Ferritin: a versatile building block for bionanotechnology[J]. Chem Rev, 2015, 115(4): 1653–1701. DOI: 10.1021/cr400011b |
| [22] | PHAM D Q D, WINZERLING J J. Insect ferritins: Typical or atypical[J]. Biochim Biophys Acta, 2010, 1800(8): 824–833. DOI: 10.1016/j.bbagen.2010.03.004 |
| [23] | ORINO K, LEHMAN L, TSUJI Y, et al. Ferritin and the response to oxidative stress[J]. Biochem J, 2001, 357(Pt 1): 241–247. |
| [24] | KEREN N, AURORA R, PAKRASI H B. Critical roles of bacterioferritins in iron storage and proliferation of cyanobacteria[J]. Plant Physiol, 2004, 135(3): 1666–1673. DOI: 10.1104/pp.104.042770 |
| [25] | CRICHTON R R, DECLERCQ J P. X-ray structures of ferritins and related proteins[J]. Biochim Biophys Acta, 2010, 1800(8): 706–718. DOI: 10.1016/j.bbagen.2010.03.019 |
| [26] | CARRONDO M A. Ferritins, iron uptake and storage from the bacterioferritin viewpoint[J]. EMBO J, 2003, 22(9): 1959–1968. DOI: 10.1093/emboj/cdg215 |
| [27] | ZETH K. Dps biomineralizing proteins: multifunctional architects of nature[J]. Biochem J, 2012, 445(3): 297–311. DOI: 10.1042/BJ20120514 |
| [28] | CHIANCONE E, CECI P. The multifaceted capacity of Dps proteins to combat bacterial stress conditions: Detoxification of iron and hydrogen peroxide and DNA binding[J]. Biochim Biophys Acta, 2010, 1800(8): 798–805. DOI: 10.1016/j.bbagen.2010.01.013 |
| [29] | SUTTER M, BOEHRINGER D, GUTMANN S, et al. Structural basis of enzyme encapsulation into a bacterial nanocompartment[J]. Nat Struct Mol Biol, 2008, 15(9): 939–947. DOI: 10.1038/nsmb.1473 |
| [30] | ZETH K, HOICZYK E, OKUDA M. Ferroxidase-mediated iron oxide biomineralization: Novel pathways to multifunctional nanoparticles[J]. Trends Biochem Sci, 2016, 41(2): 190–203. DOI: 10.1016/j.tibs.2015.11.011 |
| [31] | RAHMANPOUR R, BUGG T D H. Assembly in vitro of Rhodococcus jostii RHA1 encapsulin and peroxidase DypB to form a nanocompartment[J]. FEBS J, 2013, 280(9): 2097–2104. DOI: 10.1111/febs.12234 |
| [32] | RAHMANPOUR R, BUGG T D H. Characterisation of Dyp-type peroxidases from Pseudomonas fluorescens Pf-5:Oxidation of Mn(Ⅱ) and polymeric lignin by Dyp1B[J]. Arch Biochem Biophys, 2015, 574: 93–98. DOI: 10.1016/j.abb.2014.12.022 |
| [33] | SITIA L, SEVIERI M, BONIZZI A, et al. Development of tumor-targeted indocyanine green-loaded ferritin nanoparticles for intraoperative detection of cancers[J]. ACS Omega, 2020, 5(21): 12035–12045. DOI: 10.1021/acsomega.0c00244 |
| [34] | JIANG B, FANG L, WU K M, et al. Ferritins as natural and artificial nanozymes for theranostics[J]. Theranostics, 2020, 10(2): 687–706. DOI: 10.7150/thno.39827 |
| [35] | XUE L, DENG D W, SUN J F. Magnetoferritin: process, prospects, and their biomedical applications[J]. Int J Mol Sci, 2019, 20(10): 2426. DOI: 10.3390/ijms20102426 |
| [36] | LI L, FANG C J, RYAN J C, et al. Binding and uptake of H-ferritin are mediated by human transferrin receptor-1[J]. Proc Natl Acad Sci U S A, 2010, 107(8): 3505–3510. DOI: 10.1073/pnas.0913192107 |
| [37] | FAN K L, CAO C Q, PAN Y X, et al. Magnetoferritin nanoparticles for targeting and visualizing tumour tissues[J]. Nat Nanotechnol, 2012, 7(7): 459–464. DOI: 10.1038/nnano.2012.90 |
| [38] | CAO C Q, WANG X X, CAI Y, et al. Targeted in vivo imaging of microscopic tumors with ferritin-based nanoprobes across biological barriers[J]. Adv Mater, 2014, 26(16): 2566–2571. DOI: 10.1002/adma.201304544 |
| [39] | CHEN L, ZANG F C, WU H A, et al. Using PEGylated magnetic nanoparticles to describe the EPR effect in tumor for predicting therapeutic efficacy of micelle drugs[J]. Nanoscale, 2018, 10(4): 1788–1797. DOI: 10.1039/C7NR08319J |
| [40] | SINGH A, SAHOO S K. Magnetic nanoparticles: a novel platform for cancer theranostics[J]. Drug Discov Today, 2014, 19(4): 474–481. DOI: 10.1016/j.drudis.2013.10.005 |
| [41] | CARREIRA S C, ARMSTRONG J P K, SEDDON A M, et al. Ultra-fast stem cell labelling using cationised magnetoferritin[J]. Nanoscale, 2016, 8(14): 7474–7483. DOI: 10.1039/C5NR07144E |
| [42] | CHARLTON J R, PEARL V M, DENOTTI A R, et al. Biocompatibility of ferritin-based nanoparticles as targeted MRI contrast agents[J]. Nanomedicine, 2016, 12(6): 1735–1745. DOI: 10.1016/j.nano.2016.03.007 |
| [43] | CAI Y, WANG Y Q, XU H T, et al. Positive magnetic resonance angiography using ultrafine ferritin-based iron oxide nanoparticles[J]. Nanoscale, 2019, 11(6): 2644–2654. DOI: 10.1039/C8NR06812G |
| [44] | RADOUL M, LEWIN L, COHEN B, et al. Genetic manipulation of iron biomineralization enhances MR relaxivity in a ferritin-M6A chimeric complex[J]. Sci Rep, 2016, 6: 26550. DOI: 10.1038/srep26550 |
| [45] | MELNIKOVA L, POSPISKOVA K, MITROOVA Z, et al. Peroxidase-like activity of magnetoferritin[J]. Mikrochim Acta, 2014, 181(3): 295–301. |
| [46] | ZHANG W, LIU X Y, WALSH D, et al. Caged-protein-confined bimetallic structural assemblies with mimetic peroxidase activity[J]. Small, 2012, 8(19): 2948–2953. DOI: 10.1002/smll.201102480 |
| [47] | LI L, ZHANG L, CARMONA U, et al. Semi-artificial and bioactive ferroxidase with nanoparticles as the active sites[J]. Chem Commun, 2014, 50(59): 8021–8023. DOI: 10.1039/C4CC03477E |
| [48] | WANG T, HE J Y, DUAN D M, et al. Bioengineered magnetoferritin nanozymes for pathological identification of high-risk and ruptured atherosclerotic plaques in humans[J]. Nano Res, 2019, 12(4): 863–868. DOI: 10.1007/s12274-019-2313-z |
| [49] | ZHAO S, DUAN H X, YANG Y L, et al. Fenozyme protects the integrity of the blood-brain barrier against experimental cerebral malaria[J]. Nano Lett, 2019, 19(12): 8887–8895. DOI: 10.1021/acs.nanolett.9b03774 |
| [50] | FAN K L, XI J Q, FAN L, et al. In vivo guiding nitrogen-doped carbon nanozyme for tumor catalytic therapy[J]. Nat Commun, 2018, 9(1): 1440. DOI: 10.1038/s41467-018-03903-8 |
| [51] | JIANG B, YAN L, ZHANG J L, et al. Biomineralization synthesis of the cobalt nanozyme in SP94-ferritin nanocages for prognostic diagnosis of hepatocellular carcinoma[J]. ACS Appl Mater Interfaces, 2019, 11(10): 9747–9755. DOI: 10.1021/acsami.8b20942 |
| [52] | ZHANG W, ZHANG Y, CHEN Y H, et al. Prussian blue modified ferritin as peroxidase mimetics and its applications in biological detection[J]. J Nanosci Nanotechnol, 2013, 13(1): 60–67. DOI: 10.1166/jnn.2013.6871 |
| [53] | JIANG X, SUN C J, GUO Y, et al. Peroxidase-like activity of apoferritin paired gold clusters for glucose detection[J]. Biosens Bioelectron, 2015, 64: 165–170. DOI: 10.1016/j.bios.2014.08.078 |
| [54] | LIU X Y, WEI W, YUAN Q, et al. Apoferritin-CeO2 nano-truffle that has excellent artificial redox enzyme activity[J]. Chem Commun, 2012, 48(26): 3155–3157. DOI: 10.1039/C1CC15815E |
| [55] | DASHTESTANI F, GHOURCHIAN H, NAJAFI A. Silver-gold-apoferritin nanozyme for suppressing oxidative stress during cryopreservation[J]. Mater Sci Eng C, 2019, 94: 831–840. DOI: 10.1016/j.msec.2018.10.008 |
| [56] | KANEKIYO M, WEI C J, YASSINE H M, et al. Self-assembling influenza nanoparticle vaccines elicit broadly neutralizing H1 N1 antibodies[J]. Nature, 2013, 499(7456): 102–106. DOI: 10.1038/nature12202 |
| [57] | KANEKIYO M, BU W, JOYCE M G, et al. Rational design of an epstein-barr virus vaccine targeting the receptor-binding site[J]. Cell, 2015, 162(5): 1090–1100. DOI: 10.1016/j.cell.2015.07.043 |
| [58] | GEORGIEV I S, JOYCE M G, CHEN R E, et al. Two-component ferritin nanoparticles for multimerization of diverse trimeric antigens[J]. ACS Infect Dis, 2018, 4(5): 788–796. DOI: 10.1021/acsinfecdis.7b00192 |
| [59] | POWELL A E, ZHANG K M, SANYAL M, et al. A single immunization with spike-functionalized ferritin vaccines elicits neutralizing antibody responses against SARS-CoV-2 in mice[J]. bioRxiv, 2020. DOI: 10.1101/2020.08.28.272518 |
| [60] | YAN Y, WANG X S, LOU P L, et al. A nanoparticle-based hepatitis C virus vaccine with enhanced potency[J]. J Infect Dis, 2020, 221(8): 1304–1314. |
| [61] |
李志鹏. 口服轮状病毒铁蛋白纳米疫苗生物反应器的制备及免疫学功能的初步研究[D]. 南宁: 广西大学, 2019.
LI Z P. A preliminary study on production and imminological function of oral rotavirus ferritin nanovaccine[D]. Nanning: Guangxi University, 2019. (in Chinese) |
| [62] | SWANSON K A, RAINHO-TOMKO J N, WILLIAMS Z P, et al. A respiratory syncytial virus (RSV) F protein nanoparticle vaccine focuses antibody responses to a conserved neutralization domain[J]. Sci Immunol, 2020, 5(47): eaba6466. DOI: 10.1126/sciimmunol.aba6466 |
| [63] | KAMP H D, SWANSON K A, WEI R R, et al. Design of a broadly reactive Lyme disease vaccine[J]. NPJ Vaccines, 2020, 5(1): 33. DOI: 10.1038/s41541-020-0183-8 |
| [64] | WANG Z T, XU L F, YU H, et al. Ferritin nanocage-based antigen delivery nanoplatforms: epitope engineering for peptide vaccine design[J]. Biomater Sci, 2019, 7(5): 1794–1800. DOI: 10.1039/C9BM00098D |
| [65] | KELLY H G, TAN H X, JUNO J A, et al. Self-assembling influenza nanoparticle vaccines drive extended germinal center activity and memory B cell maturation[J]. JCI Insight, 2020, 5(10): e136653. DOI: 10.1172/jci.insight.136653 |
| [66] | WANG W J, ZHOU X X, BIAN Y J, et al. Dual-targeting nanoparticle vaccine elicits a therapeutic antibody response against chronic hepatitis B[J]. Nat Nanotechnol, 2020, 15(5): 406–416. DOI: 10.1038/s41565-020-0648-y |
| [67] | QU Z H, GUO Y L, LI M Z, et al. Recombinant ferritin nanoparticles can induce dendritic cell maturation through TLR4/NF-κB pathway[J]. Biotechnol Lett, 2020, 42(12): 2489–2500. DOI: 10.1007/s10529-020-02944-8 |
| [68] | MACONE A, MASCIARELLI S, PALOMBARINI F, et al. Ferritin nanovehicle for targeted delivery of cytochrome C to cancer cells[J]. Sci Rep, 2019, 9(1): 11749. DOI: 10.1038/s41598-019-48037-z |
| [69] | MICHELA B, MAZZUCCHELLI S, GALBIATI E, et al. Protein nanocages for self-triggered nuclear delivery of DNA-targeted chemotherapeutics in Cancer Cells[J]. J Control Release, 2014, 196: 184–196. DOI: 10.1016/j.jconrel.2014.10.002 |
| [70] | JIANG B, ZHANG R F, ZHANG J L, et al. GRP78-targeted ferritin nanocaged ultra-high dose of doxorubicin for hepatocellular carcinoma therapy[J]. Theranostics, 2019, 9(8): 2167–2182. DOI: 10.7150/thno.30867 |
| [71] | CHENG X J, FAN K L, WANG L, et al. TfR1 binding with H-ferritin nanocarrier achieves prognostic diagnosis and enhances the therapeutic efficacy in clinical gastric cancer[J]. Cell Death Dis, 2020, 11(2): 92. DOI: 10.1038/s41419-020-2272-z |
| [72] | YAO H C, GUO X F, ZHOU H J, et al. Mild acid-responsive "Nanoenzyme Capsule" remodeling of the tumor microenvironment to increase tumor penetration[J]. ACS Appl Mater Interfaces, 2020, 12(18): 20214–20227. DOI: 10.1021/acsami.0c03022 |
| [73] | FAN K L, JIA X H, ZHOU M, et al. Ferritin nanocarrier traverses the blood brain barrier and kills glioma[J]. ACS Nano, 2018, 12(5): 4105–4115. DOI: 10.1021/acsnano.7b06969 |
| [74] | LIU W, LIN Q, FU Y, et al. Target delivering paclitaxel by ferritin heavy chain nanocages for glioma treatment[J]. J Control Release, 2020, 323: 191–202. DOI: 10.1016/j.jconrel.2019.12.010 |
| [75] | FALVO E, TREMANTE E, FRAIOLI R, et al. Antibody-drug conjugates: targeting melanoma with cisplatin encapsulated in protein-cage nanoparticles based on human ferritin[J]. Nanoscale, 2013, 5(24): 12278–12285. DOI: 10.1039/c3nr04268e |
| [76] | HUANG X L, CHISHOLM J, ZHUANG J, et al. Protein nanocages that penetrate airway mucus and tumor tissue[J]. Proc Natl Acad Sci U S A, 2017, 114(32): E6595–E6602. DOI: 10.1073/pnas.1705407114 |
| [77] | ZHEN Z P, TANG W, ZHANG W Z, et al. Folic acid conjugated ferritins as photosensitizer carriers for photodynamic therapy[J]. Nanoscale, 2015, 7(23): 10330–10333. DOI: 10.1039/C5NR01833A |
| [78] | LI L, MUÑOZ-CULLA M, CARMONA U, et al. Ferritin-mediated siRNA delivery and gene silencing in human tumor and primary cells[J]. Biomaterials, 2016, 98: 143–151. DOI: 10.1016/j.biomaterials.2016.05.006 |
| [79] | LEE E J, LEE S J, KANG Y S, et al. Engineered proteinticles for targeted delivery of siRNA to cancer cells[J]. Adv Funct Mater, 2015, 25(8): 1279–1286. DOI: 10.1002/adfm.201403680 |
| [80] | SU W C, TAN H B, JANOWSKI R, et al. Ferritin-displayed GLP-1 with improved pharmacological activities and pharmacokinetics[J]. Mol Pharm, 2020, 17(5): 1663–1673. DOI: 10.1021/acs.molpharmaceut.0c00098 |
| [81] | MANSOURIZADEH F, ALBERTI D, BITONTO V, et al. Efficient synergistic combination effect of Quercetin with Curcumin on breast cancer cell apoptosis through their loading into Apo ferritin cavity[J]. Colloids Surf B Biointerfaces, 2020, 191: 110982. DOI: 10.1016/j.colsurfb.2020.110982 |
| [82] | ZHANG T, LV C Y, CHEN L L, et al. Encapsulation of anthocyanin molecules within a ferritin nanocage increases their stability and cell uptake efficiency[J]. Food Res Int, 2014, 62: 183–192. DOI: 10.1016/j.foodres.2014.02.041 |
| [83] | ZHOU Z K, SUN G Y, LIU Y Q, et al. A novel approach to prepare protein-proanthocyanidins nano-complexes by the reversible assembly of ferritin cage[J]. Food Sci Technol Res, 2017, 23(2): 329–337. DOI: 10.3136/fstr.23.329 |