2. 军事科学院军事医学研究院军事兽医研究所, 长春 130122;
3. 扬州大学兽医学院, 扬州 225009
2. Institute of Military Veterinary Medicine, Academy of Military Medical Sciences, Changchun 130122, China;
3. Yangzhou University, Yangzhou 225009, China
非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)引起的一种急性、烈性、高度接触性传染病,死亡率可高达100%[1-2],被我国列为一类动物疫病、世界动物卫生组织(OIE)将其列为法定报告疫病。ASFV是非洲猪瘟相关病毒科(Asfarviridae)非洲猪瘟病毒属(Asfivirus)的成员[6]。ASFV病毒粒子直径为260~300 nm,为二十面体对称[7],结构复杂,不同毒株基因组全长不同,为170~194 kb,中央保守区为125 kb,基因组差异主要取决于基因组两端可变区的多基因家族[8]。
ASFV含有151~167个开放性阅读框(ORF),成熟的病毒粒子中约含50种以上结构蛋白[9]。其中,由pp220水解产生的p150、p37、p34和p14和由pp62水解产生的p35、p15,均存在于成熟病毒粒子中,占结构蛋白总质量的30%[10-12]。已有研究表明:ASFV蛋白水解酶pS273R蛋白能够识别Gly-Gly-Xaa水解位点裂解病毒多蛋白pp220和pp62,产生上述6种主要结构蛋白。pS273R编码1个31 ku的蛋白质,包含1个“核心域”,具有SUMO-1样蛋白酶保守的催化残基。有研究表明, S273R蛋白酶的水解加工可以影响病毒滴度,抑制pS273R蛋白的水解过程,会导致二十面体病毒粒子的组装缺陷[13]。因此,该蛋白酶功能研究将有助于认识ASFV复制过程。本研究通过原核表达ASFV S273R基因,制备纯化抗原免疫小鼠,通过细胞融合,成功制备获得pS273R单克隆抗体。该蛋白抗体旨在为S273R基因缺失毒株的鉴定及pS273R蛋白酶的功能研究提供生物材料。
1 材料与方法 1.1 病毒、细胞和实验动物非洲猪瘟病毒强毒株SY18株由军事兽医研究所保存,并在生物安全三级实验室中在猪原代肺泡巨噬细胞(PAM)和猪原代骨髓细胞(BM)中扩增及测定感染复数;人胚肾细胞系(HEK-293T)由本实验室保存;SPF级6~8周龄BALB/c小鼠购自北京维通利华实验动物技术有限公司。
1.2 质粒和主要试剂pET-30a(+)、pCMV-2×Flag载体由本实验室保存;高糖DMEM培养基、胎牛血清和胰蛋白酶购自美国Gibco公司;DH5α和BL21(DE3)感受态购自美国Invitrogen公司;限制性内切酶EcoRⅠ、HindⅢ购自英国NEB公司;T4 DNA连接酶购自美国Promega公司;PhantaⓇ Max Super-Fidelity DNA Polymerase购自南京诺唯赞生物科技有限公司;HRP标记兔抗Flag抗体、HRP标记山羊抗鼠IgG和Alexa FluorⓇ 488标记羊抗鼠IgG购自英潍捷基(上海)贸易有限公司;ECL显色液购自Pierce公司;GM-CSF购自美国R&D Systems公司;BCA蛋白浓度测定试剂盒购自碧云天生物技术有限公司;弗氏完全佐剂、弗氏不完全佐剂和IPTG购自美国Sigma公司。
1.3 S273R基因的合成与重组质粒的构建根据ASFV SY18毒株S273R基因序列,设计特异性引物,上游为EcoRⅠ-S273R-F:5′-CCGGAATTCATGTCTATATTAGAAAAAATTAC-GTCAAGT-3′;下游为HindⅢ-S273R-R:5′-CCCAAGCTTTTATGCGATGCGAAACAGATG GGTTCTAAA-3′,以SY18病毒基因组DNA为模板,进行S273R基因扩增。PCR扩增体系50 μL:2×Phanta Max Super-Fidelity DNA Polymerase 25 μL、上下游引物各2 μL、DNA模板50 ng,ddH2O补至50 μL。PCR反应条件:95 ℃预变性3 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,共33个循环;72 ℃延伸10 min。1%琼脂糖凝胶电泳后回收并纯化目的片段。目的片段和pET-30a(+)空载体分别经EcoRⅠ/HindⅢ双酶切,纯化回收相应目的片段,T4 DNA连接酶16 ℃连接过夜。连接产物转化感受态DH5α,涂布于相应LB平板,37 ℃倒置培养,菌液PCR鉴定正确后,送至上海擎科公司测序。测序正确的重组质粒按照小提质粒试剂盒说明书提取质粒,命名为pET30-S273R。定量后, 于-20 ℃保存。
1.4 S273R原核表达将原核表达质粒pET30-S273R转化大肠杆菌BL21(DE3)感受态细胞,挑取单菌落接种于卡那抗性的LB液体培养基,于37 ℃摇床中以220 r·min-1摇菌12 h后,按1∶100将菌液转接种到1 L卡那抗性LB培养基中摇菌约4 h即OD600 nm=0.6~0.8后,分别加入终浓度为0.5和1.0 mmol·L-1 IPTG,37 ℃培养6 h后,4 ℃ 12 000×g离心10 min,收集菌体沉淀。沉淀经PBS洗涤后,冰浴条件下进行超声破碎,12 000×g离心10 min后,分别取上清和沉淀,进行SDS-PAGE分析,鉴定表达情况并纯化。
1.5 免疫小鼠血清抗体测定将纯化后的蛋白经BCA蛋白测定试剂盒测定浓度后,腹腔注射免疫6~8周龄BALB/c小鼠:将100 μg蛋白与等体积弗氏完全佐剂混合并乳化完全,小鼠腹腔注射,首免之后隔7 d用等量不完全佐剂乳化,免疫2次,加强免疫3 d后尾静脉采血,分离血清。利用IFA鉴定小鼠血清是否为阳性,即将ASFV SY18毒株按1 MOI感染PAM细胞24 h,用预冷的丙酮∶乙醇固定液(体积比3∶2)固定5 min,或利用pFlag-S273R质粒转染293T细胞24 h,用固定液固定细胞产物。将多抗血清用PBS 1∶100稀释,与固定的细胞于37 ℃反应45 min,PBS洗3遍;加入1∶600稀释的Alexa FluorⓇ 488标记羊抗鼠IgG,37 ℃反应45 min,PBS洗3遍后,于倒置荧光显微镜下观察。
1.6 抗ASFV-S273R单抗制备选血清抗体阳性反应的小鼠进行加强免疫,72 h后,按常规方法进行细胞融合和单抗筛选。通过有限稀释法对检出的阳性杂交瘤细胞进行2~3次亚克隆,直至抗体阳性率达100%时,扩大培养并建株、保种。常规制备腹水,利用间接ELISA测定效价,并用免疫印迹(Western blot)和IFA进一步鉴定后,对腹水进行分装,纯化,置于-80 ℃冻存备用。
1.7 间接免疫荧光检测将pFlag-S273R质粒转染293T细胞或用ASFV SY18毒株以1 MOI感染PAM细胞,24 h后使用预冷的固定液(丙酮、乙醇体积比3∶2)固定细胞5 min;PBS洗涤3次后,每孔加入100 μL含5%脱脂乳的PBS溶液,于37 ℃封闭1 h;PBS洗涤2次后,加入杂交瘤细胞上清,37 ℃孵育45 min;PBS洗3次,加入100 μL FITC标记的羊抗鼠IgG,于37 ℃避光孵育45 min,洗涤3次后,置于荧光显微镜下观察结果。
1.8 间接ELISA测定抗体效价以pS273R蛋白作为检测抗原,通过间接ELISA法测定抗体效价。即将抗原稀释为浓度1 ng·μL-1,按每孔100 μL包被ELISA板,4 ℃过夜;用PBST洗3次,每孔加入100 μL PBST稀释的5%脱脂乳封闭液,37 ℃封闭2 h;充分洗涤后,加入单抗腹水(按不同稀释度为1∶100、1∶200、1∶500、1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000),每个稀释度设置2个重复孔,以未免疫小鼠血清为阴性对照,以免疫pS273R蛋白小鼠血清为阳性对照,37 ℃孵育1 h,洗3次;每孔加入100 μL HRP标记山羊抗鼠IgG(1∶2 000稀释),37 ℃孵育1 h,洗3次;每孔加入100 μL TMB显色液,至阴性对照显色时,加入50 μL 2 mol·L-1 H2SO4终止液,用酶标仪测定OD450 nm值。
1.9 免疫印迹(Western blot)鉴定以pFlag-S273R真核质粒转染293T细胞,24 h后,收集蛋白样品,或以1MOI ASFV感染PAM,不同时间点收集蛋白样品,再以常规方法进行SDS-PAGE电泳,湿转至硝酸纤维素膜(NC)。将NC膜用含5%脱脂乳的PBST溶液37 ℃封闭2 h,PBST洗3次,每次10 min;将小鼠多抗血清、单克隆抗体作为一抗,4 ℃孵育过夜后,PBST洗3次,每次10 min;将HRP标记山羊抗鼠IgG 1∶5 000稀释作为二抗,室温孵育1 h后,PBST洗3次,利用ECL显色液显色,通过成像系统成像。
2 结果 2.1 S273R基因重组质粒的构建PCR扩增产物经1%琼脂糖凝胶电泳,在700~1 000 bp可见单一扩增条带,条带大小为822 bp与预期相符。回收PCR产物,经双酶切后,与载体质粒pET-30a(+)连接,转化DH5α感受态细菌,挑取菌落,进行菌液PCR,鉴定后测序验证。测序正确的重组质粒命名为pET30-S273R。
2.2 S273R蛋白的原核表达pET30a-S273R重组质粒转化感受态大肠杆菌BL21(DE3))。挑取阳性菌落,经两种不同浓度IPTG诱导,设立未加IPTG诱导菌和空载体转化菌样本作为对照,进行SDS-PAGE电泳。结果显示:在37 ℃诱导后,继续培养6 h,S273R获得高表达。通过对菌体裂解液的上清和沉淀分析发现,该蛋白主要在包涵体中表达(图 1),蛋白大小为37 ku。

|
1. pET30-S273R未诱导上清;2. pET30a-S273R IPTG 0.5 mmol·L-1上清;3. pET30-S273R IPTG 1.0 mmol·L-1上清;4. pET30a空载体上清;M. 预染蛋白相对分子质量标准; 5. pET30-S273R未诱导沉淀;6. pET30-S273R IPTG 0.5 mmol·L-1沉淀;7. pET30-S273R IPTG 1.0 mmol·L-1沉淀;8. pET30a空载体沉淀 1. Supernatant of pET30-S273R without induction; 2. Supernatant of pET30-S273R induced with 0.5 mmol·L-1 IPTG; 3. Supernatant of pET30-S273R induced with 1.0 mmol·L-1 IPTG; 4. Supernatant of pET30a induced with 1.0 mmol·L-1 IPTG; M. Protein marker; 5. Precipitation of pET30-S273R without induction; 6. Precipitation of pET30-S273R induced with 0.5 mmol·L-1 IPTG; 7. Precipitation of pET30-S273R induced with 1.0 mmol·L-1 IPTG; 8. Precipitation of pET30a induced with 1.0 mmol·L-1 IPTG 图 1 pS273R蛋白SDS-PAGE分析 Fig. 1 SDS-PAGE analysis of pS273R protein |
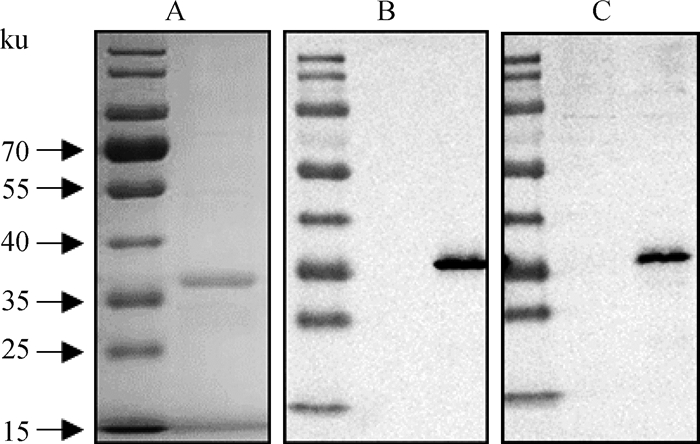
纯化后的pS273R蛋白条带较为单一,蛋白纯度达90%以上,BCA法定量蛋白浓度为1.1 mg·mL-1,满足后期免疫要求(图 2)。
|
图 2 S273R蛋白纯化SDS-PAGE分析(A)及多抗血清、5A4单抗Western blot验证(B、C) Fig. 2 Expression of purified S273R protein by SDS-PAGE (A) and Western blot analysis of polyclonal sera (B) or monoclonal antibody named 5A4 (C) |
为验证多抗的特异性,将pFlag-S273R真核质粒转染293T细胞、将SY18毒株以1 MOI感染猪肺泡巨噬细胞后分别固定,进行免疫荧光检测。IFA结果显示,小鼠多抗血清可特异性识别293T细胞中表达的pS273R蛋白,且在ASFV感染的猪肺泡巨噬细胞胞质呈阳性反应(图 3)。

|
A. pFlag-S273R转染293T;B. 未转染的293T;C. 感染24 hpi的PAM细胞;D. 未感染的PAM细胞 A. pFlag-S273R transfected 293T; B. Untransfected 293T; C. ASFV infected PAM cells for 24 h; D. Uninfected PAM cells 图 3 S273R蛋白免疫荧光检测(10×) Fig. 3 Immunofluorescence assay analysis of S273R protein(10×) |
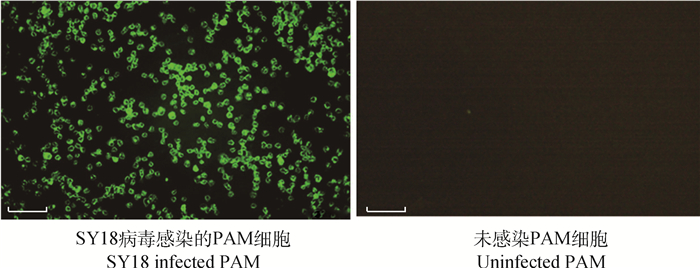
通过细胞融合,获得4株特异性单抗。IFA结果显示:5A4可与病毒感染和真核细胞表达产物呈阳性反应(图 4),1C12、5A3、7B9只能与真核细胞表达产物反应。Western blot结果显示:1C12、7B9可特异性识别ASFV病毒感染过程中产生的pS273R及真核细胞表达产物(图 5),而5A3、5A4仅识别真核细胞表达产物的pS273R(表 1)。经ELISA效价测定,4株单抗腹水效价均达1∶64 000。
|
图 4 5A4间接免疫荧光图片(PAM,10×) Fig. 4 5A4 identification of indirect immunofluorescence assay of MAb 5A4 (PAM, 10×) |

|
图 5 7B9特异性识别ASFV pS273R Fig. 5 7B9 specifically recognizes ASFV pS273R |
|
|
表 1 ASFV pS273R单抗类型及免疫特性 Table 1 ASFV pS273R monoclonal antibody types and immune characteristics |
ASFV pS273R是一种半胱氨酸蛋白酶,在ASFV感染过程中,该蛋白酶对ASFV多聚蛋白前体pp220和pp62进行水解,分别形成p150、p37、p34、p14和p35、p15、p8。上述蛋白组成致密的核衣壳,约占整个病毒粒子25%以上[12]。当多聚蛋白不能被蛋白酶正确切割时,新组装的子代病毒粒子呈现错误包装,易丧失传染性[13]。
从ASFV蛋白酶整体结构来看,蛋白酶pS273R主要由两个结构域组成:N端手臂结构域(N-ter arm domain)、C端核心结构域(core domain)。pS273R蛋白酶的N端手臂结构域是一个新结构域,且该结构域对维持蛋白酶活性具有至关重要的作用;C端结构域中则包含由催化三联体Cys-His-Asn组成的核心结构域,这部分结构特征与典型半胱氨酸类蛋白酶的结构相似[14]。
本研究进行了pS273R单克隆抗体制备并成功获得4株抗单克隆抗体,IFA结果显示:5A4可与病毒感染和真核细胞表达产物呈阳性反应,1C12、5A3、7B9只能与真核细胞表达产物反应(图 3)。Western blot结果显示:1C12、7B9可特异性识别ASFV病毒感染过程中产生的pS273R及真核细胞表达产物,而5A3、5A4仅识别真核细胞表达产物的pS273R(表 1)。造成这一结果的差异性可能与pS273R的空间结构和蛋白翻译后修饰有关,具体原因还需进一步分析。本试验获得的单抗为S273R功能研究奠定了基础,并为基因缺失毒的鉴定提供了生物材料。
4 结论成功获得ASFV S273R重组蛋白,以其制备4株单克隆抗体,并筛选出与病毒具有反应性的单克隆抗体,为ASFV S273R基因缺失毒的鉴别及S273R蛋白结构功能等基础研究提供了重要的生物材料。
| [1] | SIAMUPA C, SAASA N, PHIRI A M, et al. Contribution of market value chain to the control of African swine fever in Zambia[J]. Trop Anim Health Prod, 2018, 50(1): 177–185. DOI: 10.1007/s11250-017-1419-0 |
| [2] |
石国宁, 张涛, 王无为. 中国非洲猪瘟疫情的时空演化特征及影响因素[J]. 干旱区资源与环境, 2020, 34(3): 137–142.
SHI G N, ZHANG T, WANG W W. Temporal and spatial evolution characteristics and influencing factors of African swine fever in China[J]. Journal of Arid Land Resources and Environment, 2020, 34(3): 137–142. (in Chinese) |
| [3] | OURA C A, POWELL P P, ANDERSON E, et al. The pathogenesis of African swine fever in the resistant bushpig[J]. J Gen Virol, 1998, 79(6): 1439–1443. DOI: 10.1099/0022-1317-79-6-1439 |
| [4] | BLOME S, GABRIEL C, BEER M. Pathogenesis of African swine fever in domestic pigs and European wild boar[J]. Virus Res, 2013, 173(1): 122–130. DOI: 10.1016/j.virusres.2012.10.026 |
| [5] |
陈腾, 张守峰, 周鑫韬, 等. 我国首次非洲猪瘟疫情的发现和流行分析[J]. 中国兽医学报, 2018, 38(9): 1831–1832.
CHEN T, ZHANG S F, ZHOU X T, et al. The discovery and epidemic analysis of the first African swine fever epidemic in my country[J]. Chinese Journal of Veterinary Science, 2018, 38(9): 1831–1832. (in Chinese) |
| [6] | HOU X T, LI N, LUO Y Z, et al. Emergence of African swine fever in China, 2018[J]. Transbound Emerg Dis, 2018, 65(6): 1482–1484. DOI: 10.1111/tbed.12989 |
| [7] | ALEJO A, MATAMOROS T, GUERRA M, et al. Proteomic atlas of the African swine fever virus particle[J/OL]. J Virol, 2018, 92(23): e01293-18.[2020-06-01]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6232493/. |
| [8] | ZHAO D M, LIU R Q, ZHANG X F, et al. Replication and virulence in pigs of the first African swine fever virus isolated in China[J]. Emerg Microbes Infect, 2019, 8(1): 438–447. DOI: 10.1080/22221751.2019.1590128 |
| [9] | BLASCO R, AGVERO M, ALMENDRAL J M, et al. Variable and constant regions in African swine fever virus DNA[J]. Virology, 1989, 168(2): 330–338. DOI: 10.1016/0042-6822(89)90273-0 |
| [10] | ANDRÉS G, ALEJO A, SALAS J, et al. African swine fever virus polyproteins pp220 and pp62 assemble into the core shell[J]. J Virol, 2002, 76(24): 12473–12482. DOI: 10.1128/JVI.76.24.12473-12482.2002 |
| [11] | ANDRÉS G, SIMÓN-MATEO C, VIÓUELA E. Assembly of African swine fever virus: Role of polyprotein pp220[J]. J Virol, 1997, 71(3): 2331–2341. DOI: 10.1128/JVI.71.3.2331-2341.1997 |
| [12] | ANDRÉS G, ALEJO A, SIMÓN-MATEO C, et al. African swine fever virus protease, a new viral member of the SUMO-1-specific protease family[J]. J Biol Chem, 2001, 276(1): 780–787. DOI: 10.1074/jbc.M006844200 |
| [13] | ALEJO A, ANDRÉS G, SALAS M L. African swine fever virus proteinase is essential for core maturation and infectivity[J]. J Virol, 2003, 77(10): 5571–5577. DOI: 10.1128/JVI.77.10.5571-5577.2003 |
| [14] | LI G B, FU D, ZHANG G S, et al. Crystal structure of the African swine fever virus structural protein p35 reveals its role for core shell assembly[J]. Protein Cell, 2020, 11(8): 600–605. DOI: 10.1007/s13238-020-00730-w |



