中草药含有多种免疫调节成分,中草药中的黄酮、多糖以及皂苷等具有良好的免疫调节作用[1-3]。近年来,中草药活性成分作为有效的免疫刺激物在防治人和动物多种疾病中发挥了重要的作用。补益类中药一般均能较好地增强机体的免疫功能,提高机体的免疫力,且对正常细胞没有毒副作用,是良好的生物反应调节剂,作为天然、安全生物活性成分的来源用于动物和人类传染病的防治有着不可替代的优势。
新疆荒漠肉苁蓉(Cistanche deserticola)为列当科植物,产于我国新疆等荒漠化干旱地区,是一种具有极高药用价值的中草药,有“沙漠人参”的美誉,作为补益类中药在中国等地被普遍用作滋补食品已有多年历史[4-6]。研究者对肉苁蓉已经做了大量的研究,主要针对肉苁蓉有效成分分离、药理作用,药物疗效,肉苁蓉的化学组成等方面开展了深入而细致的研究,分离了百余种化合物,包括苯乙醇苷、木脂素类及生物碱和多糖等成分[7-9],可以增强机体的免疫功能,具有抗衰老、抗氧化以及免疫调节等作用[10-14]。由于不同中草药的活性成分含量有很大的差别,从具有免疫活性的中草药中进行广泛筛选,寻找合适的中草药活性成分对于动物和人类各种疾病的防治具有实际的意义。
为了阐明新疆野生荒漠肉苁蓉醇提物对特异性免疫反应的调节性质和强度,基于中药有效成分可以通过激活抗原提呈细胞树突状细胞(dendritic cells,DCs)的成熟和功能而发挥重要的免疫调节作用[15-17],本研究以新疆野生荒漠肉苁蓉醇提物为研究材料,OVA为抗原,采用皮下途径免疫小鼠,检测体液和细胞免疫反应,以及促进DCs成熟和对Treg的影响,通过深入探究新疆野生荒漠肉苁蓉醇提物对OVA特异性免疫应答的特点和作用机制的初步研究,为筛选具有良好免疫调节作用的中草药活性成分的研究和新型疫苗佐剂的发现提供理论参考。
1 材料与方法 1.1 材料健康ICR小鼠,雌性(5~6周龄,体重18~22 g)购于新疆医科大学动物中心,进行适应性饲养1周后开始试验。新疆野生荒漠肉苁蓉(EEWCD,其中,苯乙醇苷类化合物含量为17.12%,作者实验室制备)[18];OVA、噻唑蓝(MTT)、刀豆蛋白A (concanavalin A, ConA) 和脂多糖(lipopolysaccharide, LPS) 均购自Sigma公司;铝佐剂(Imject Alum Adjuvant, Alum)购自Thermo公司;羊抗鼠过氧化物酶抗体(IgG-HRP、IgG1-HRP、IgG2a-HRP)购自美国Southern Biotech公司;Cytofix/Cytoperm buffer、Perm/Wash buffer、CD4-FITC、CD8-FITC、IL-4-PE、IFN-γ-APC、CD11c-PE、CD40-FITC、CD80-APC、CD86-APC和MHCII-FITC抗体购自BD公司。Treg染色试剂盒购自eBioscience公司。其他各类试剂和耗材均为国产或进口产品。
1.2 免疫及分组EEWCD用Tween-20:0.9% NaCl =1∶9溶解。EEWCD与溶解在0.9% NaCl的OVA配制成疫苗后备用。小鼠免疫抗体检测分组见表 1,共分为7组,每组5只小鼠,0.9% NaCl组为空白对照组,EEWCD为对照组,Alum和OVA为阳性对照组,其他组为试验组。皮下免疫两次,间隔2周,免疫前眼眶采集小鼠血,制备血清后用于抗体检测。MTT、细胞因子、DCs及Treg检测采用同样的策略免疫小鼠,免疫分组见表 1,在抗体检测分组的基础上增加了Tween-20为对照组。
|
|
表 1 小鼠抗体水平、MTT检测分组设计(n=5) Table 1 The group of antibody, MTT detection in immunized mice (n=5) |
EEWCD与OVA皮下免疫小鼠后,小鼠眼眶采血,收集初免疫后各个时间点血清,间接ELISA法检测OVA特异性IgG抗体滴度及分型:将OVA抗原(2.5 μg·mL-1)包被96孔板后4 ℃过夜。将稀释好的血清加入到96孔板中37 ℃孵育1 h。接着,加入IgG-HRP、IgG1-HRP和IgG2a-HRP的抗体稀释液到96孔板中,37 ℃避光1 h。加入TMB显色液,避光显色10~20 min后,加入终止液终止反应,酶标仪上检测OD450 nm/OD655 nm的值。
1.4 EEWCD免疫小鼠后对脾细胞增殖的检测ELISA检测初次免疫后21 d小鼠血清中IgG抗体水平,验证抗体有效后,采用MTT法检测EEWCD对脾细胞的增殖作用:制备初次后21 d脾单细胞悬液,加入96孔细胞培养板后,分别加入20 μL浓度为10 μg·mL-1的OVA、10 μg·mL-1的OVA323-339、5 μg·mL-1的ConA和5 μg·mL-1的LPS刺激细胞48 h,设置3个复孔,未处理的空细胞和空培养基为对照。刺激后加入20 μL的5 mg·mL-1的MTT,37 ℃孵育3~4 h,弃上清后,加入DMSO溶解甲瓒颗粒后,检测OD570 nm/OD630 nm值,计算刺激指数SI (stimulation index, SI):(OD处理- OD培养基)/(OD未处理-OD培养基)。
1.5 FCAS检测胞内细胞因子采用FACS进行CD4+IL-4、CD4+IFN-γ和CD8+IFN-γ的检测,具体步骤:初次免疫后21 d,制备脾单细胞悬液,将细胞浓度调整为2×107个·mL-1,单细胞悬液铺到24孔板细胞培养中,OVA刺激4 h,加入Golgi stop继续孵育12 h,收集细胞,Perm/Washing buffer洗涤2次,先进行细胞表面分子CD4-FITC和CD8-FITC染色,避光20 min,细胞用Cytofix/Cytoperm buffer进行固定和破膜后,Perm/Washing buffer洗涤细胞后,分别加入IL-4和IFN-γ,避光孵育15~20 min,Perm/Wash buffer洗涤细胞后,FACS检测,FlowJo 7.6软件分析检测结果。
1.6 FCAS检测DCs表面分子采用FCAS检测EEWCD对小鼠脾中DCs的成熟和Treg的影响:制备初次免疫后21 d脾单细胞悬液,用PBS洗涤细胞后,进行DCs表面分子CD11c-PE、CD40-FITC、CD80-APC、CD86-APC和MHCII-FITC避光染色20 min,FACS检测,FlowJo分析结果。
1.7 FCAS检测CD4+CD25+Foxp3+Treg细胞用eBioscience试剂盒进行检测EEWCD对小鼠CD4+CD25+Foxp3+Treg细胞的影响,具体操作:PBS洗涤脾单细胞,CD4-APC和CD25-FITC细胞避光染色20 min,用eBioscience Fixation/Permeabilization buffer的进行固定破膜细胞,室温孵育20 min,Permeabilization buffer洗涤后,加入PBS后,FCAS检测,FlowJo分析结果。
1.8 EEWCD对小鼠生长状况的影响EEWCD皮下免疫小鼠后,在免疫前和免疫后不同时间点观察小鼠行为,测量小鼠体重,观察小鼠的日常行为,同时,检测EEWCD免疫后对小鼠体重的影响,初步判断EEWCD免疫小鼠后的安全性。
1.9 数据分析试验组与对照组的差异通过One-way ANOVA分析后,用Turkey’s post-test进行多重比较分析差异性。试验数据采用“x±s”表示。GraphPad Prism 5.0进行绘图和数据分析。P < 0.05表示差异显著。
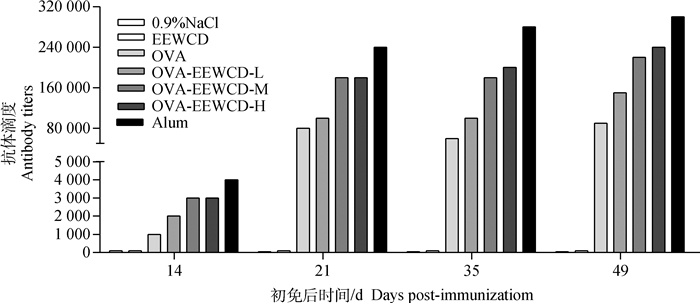
2 结果 2.1 EEWCD对OVA特异性抗体滴度的影响为了检测EEWCD对体液免疫的影响,采用ELISA检测了初免后14、21、35和49 d小鼠血清中OVA特异性的抗体滴度。从图 1中可以看出,EEWCD的抗体滴度与0.9% NaCl空白对照组相当,免疫后各组的抗体滴度随着免疫时间的增加抗体水平有所增加,与OVA处理组相比,EEWCD-M组和EEWCD-H组在21、35和49 d均能够提高OVA特异性抗体2倍左右,抗体滴度为18万~24万,Alum组的抗体滴度为24万~30万。EEWCD-M组和EEWCD-H组抗体水平高于EEWCD-L组,EEWCD-M为最佳剂量组,Alum组为抗体水平最高剂量组。这些结果表明,EEWCD可以提高体液免疫水平。
|
图 1 初免后不同时期EEWAR对OVA特异性抗体滴度的影响(n=5) Fig. 1 Detection of IgG titer in different time after immunization(n=5) |
小鼠初免后35 d对其抗体分型进行了检测,图 2的结果表明,EEWCD-M和EEWCD-H极显著促进OVA特异性IgG水平(P < 0.01),显著促进了IgG1的水平(P < 0.05),与铝佐剂没有显著差异(P>0.05);EEWCD-M极显著促进IgG2a的水平(P < 0.01),与Alum相比差异显著(P < 0.05),EEWCD-H显著促进IgG2a的水平(P < 0.05),与Alum相比差异不显著(P>0.05)。这表明EEWCD不仅可以提高体液免疫水平,也可以促进Th1和Th2的免疫反应,与Alum相比,尤其是可以促进Th1的反应。

|
与OVA组相比, *. P < 0.05; **. P < 0.01;与Alum组相比,#. P < 0.05 Compared with OVA group, *. P < 0.05; **. P < 0.01; Compared with Alum group, #. P < 0.05 图 2 EEWCD对OVA特异性抗体亚型的影响(n=5) Fig. 2 Effects of the EEWCD on OVA-specific IgG subclasses (n=5) |
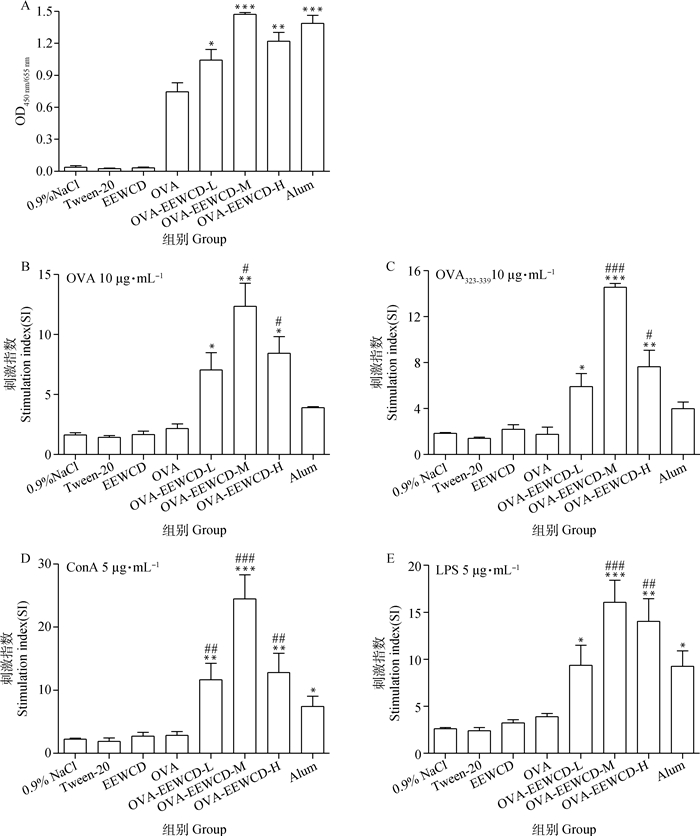
采用MTT法进行了EEWCD对小鼠脾细胞增殖的检测。首先,采用间接ELISA检测小鼠初免后21 d抗体水平,如图 3 A所示,EEWCD-L、EEWCD-M和EEWCD-H均能够显著或极显著促进抗体水平(P < 0.05或P < 0.01),Alum也能够极显著促进抗体水平(P < 0.05),EEWCD-M为最佳剂量,且与Alum之间无显著差异(P>0.05)。在此基础上,采用MTT法检测了EEWCD对脾细胞增殖的影响,如图 3B-E所示,在OVA和OVA323-339刺激下,EEWCD-L、EEWCD-M和EEWCD-H均能够显著或极显著促进脾细胞增殖水平(P < 0.05或P < 0.01),EEWCD-M和EEWCD-H的刺激作用显著高于Alum (P < 0.05),EEWCD-M为最佳剂量。在ConA和LPS刺激下,EEWCD-L、EEWCD-M、EEWCD-H和Alum对脾细胞增殖的作用也达到了显著或极显著的水平(P < 0.05或P < 0.01),EEWCD-M和EEWCD-H显著高于Alum(P < 0.05),且EEWCD-M为最佳剂量。试验结果表明,EEWCD可以促进OVA特异性的脾细胞增殖。
|
与OVA组相比, *. P < 0.05; **. P < 0.01, ***. P < 0.001; 与Alum组相比,#. P < 0.05, ##. P < 0.01, ###. P < 0.001 Compared with OVA group, *. P < 0.05; **. P < 0.01, ***. P < 0.001; Compared with Alum group, #. P < 0.05, ##. P < 0.01, ###. P < 0.001 图 3 EEWCD对脾细胞增殖的影响 Fig. 3 Effects of EEWCD on splenic lymphocyte proliferation |
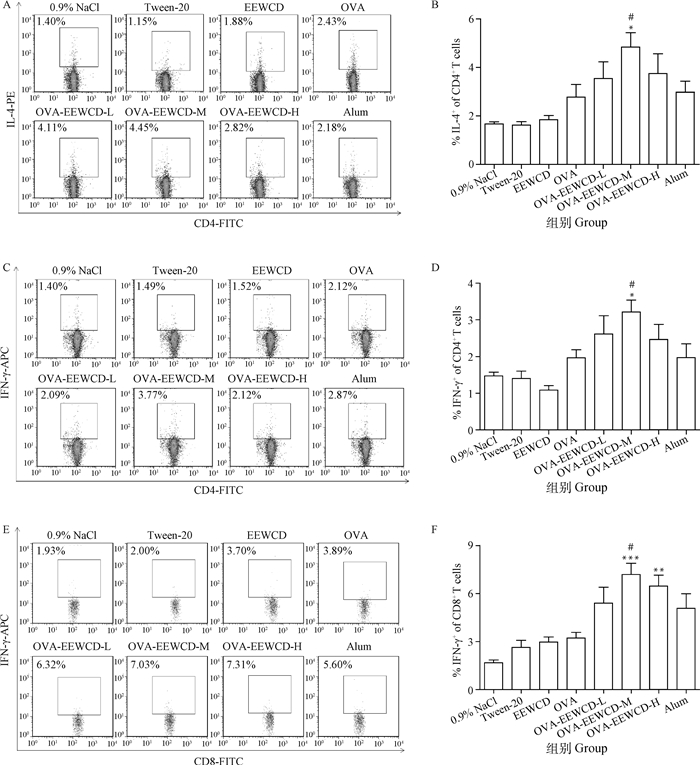
细胞因子在调节免疫细胞功能和防御感染中起重要的作用。为了检测EEWCD对IL-4和IFN-γ分泌的影响,EEWCD加强免疫7 d后,分离制备小鼠脾单细胞悬液,与OVA抗原体外共培养后进行CD4+/IL-4、CD4+/IFN-γ、CD8+/IFN-γ染色,FACS检测结果如图 4,EEWCD-M显著促进CD4+T细胞IL-4和IFN-γ的分泌(P < 0.05),与Alum相比差异显著(P < 0.05);EEWCD-M极显著促进CD8+T细胞IFN-γ的产生(P < 0.01),与Alum相比差异显著(P < 0.05)。综上表明,EEWCD可以促进细胞因子的产生,尤其促进了IFN-γ的产生。
|
与OVA组相比, *. P < 0.05; **. P < 0.01, ***. P < 0.01;与Alum组相比,#. P < 0.05 Compared with OVA group, *. P < 0.05; **. P < 0.01, ***. P < 0.001; Compared with Alum group, #. P < 0.05 图 4 EEWCD对CD4+和CD8+T细胞IL-4和IFN-γ分泌的影响 Fig. 4 Analysis of EEWCD on IL-4 and IFN-γ in CD4+ and CD8+ T cells |
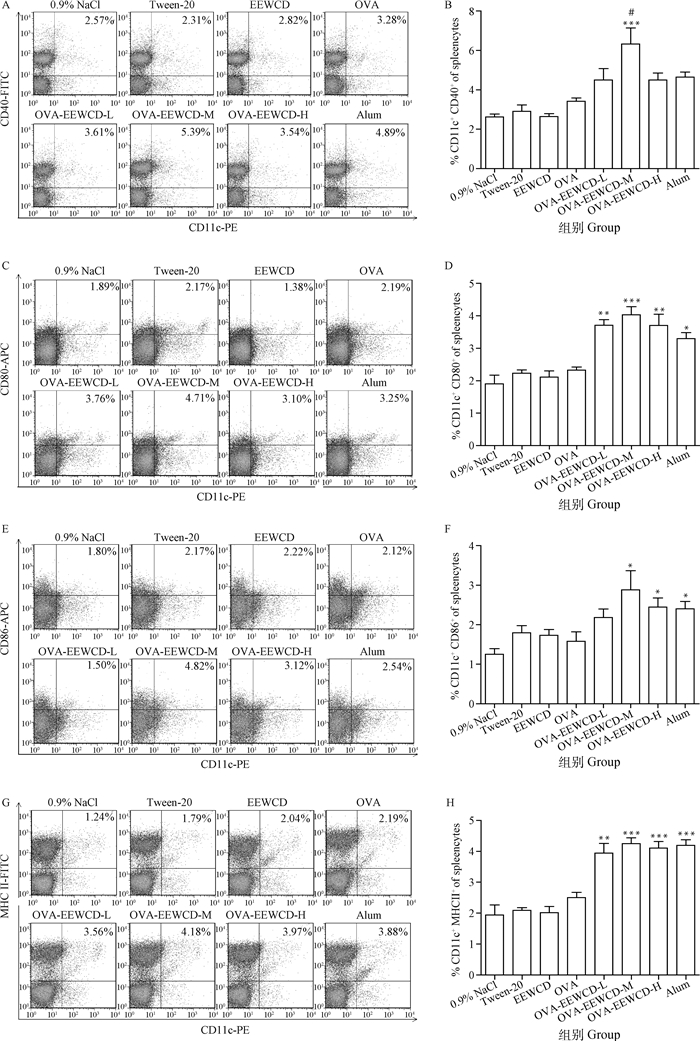
DCs在调节免疫反应中发挥了重要的作用,采用FACS检测了初免后21 d小鼠脾细胞中DCs共刺激分子CD80、CD40、CD86和MHCII的表达水平,探究EEWCD对DCs成熟的影响。从图 5可以看出,EECCD-M极显著CD40的表达水平(P < 0.01),EECCD-L、EWCCD-M和EWCCD-H均能够极显著促进CD80和MHCII的表达(P < 0.01),与Alum相比差异显著(P < 0.05)。EWCCD-M、EWCCD-H和Alum可以显著增强CD86的表达(P < 0.05),与Alum相比差异不显著(P>0.05)。这些结果表明,EEWCD可以促进DCs的成熟。
|
与OVA组相比, *. P < 0.05; **. P < 0.01, ***. P < 0.01;与Alum组相比,#. P < 0.05 Compared with OVA group, *. P < 0.05; **. P < 0.01, ***. P < 0.001; Compared with Alum group, #. P < 0.05 图 5 EEWCD对DCs表面分子表达的影响 Fig. 5 Analysis of Co-stimulatory molecules in DCs by FACS |
为了更好地了解EEWCD在免疫应答中的调节作用,小鼠加强免疫后7 d,利用FACS检测了CD4+CD25+Foxp3+ Treg细胞的变化。如图 6所示,与OVA组相比,EECCD-L、EWCCD-M和EWCCD-H极显著降低了CD4+CD25+Foxp3+ Treg频率(P < 0.01),Alum也极显著降低了Treg频率(P < 0.01),EWCCD处理组和Alum组没有显著差异,EEWCD可以显著下调Treg的水平。
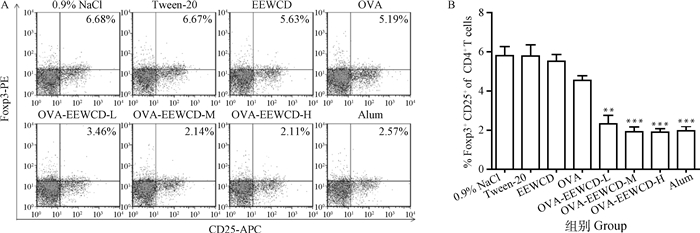
|
与OVA组相比, *. P < 0.05; **. P < 0.01, ***. P < 0.01 Compared with OVA group, *. P < 0.05; **. P < 0.01, ***. P < 0.01 图 6 EEWCD对Treg表达水平的影响 Fig. 6 Effects of the EEWCD on Treg frequency |
EEWCD免疫小鼠后,观察小鼠的日常行为,每周称量小鼠的体重,观察整个免疫期间EEWCD对小鼠的影响。在整个免疫期间小鼠无任何异常行为,如没有脱毛、拒食等现象,在同一时间点,各组体重之间无显著差异(P < 0.01),同一组小鼠随着免疫时间的延长体重也在不断增加,详见表 2。
|
|
表 2 EEWCD对小鼠体重的影响(x±s, n=5) Table 2 Effects of administration of EEWCD on the body weight (x±s, n=5) |
中草药在动物和人类疾病治疗中起着重要的作用,如黄芪多糖作为口蹄疫疫苗的免疫增强剂能够提供更好的免疫保护作用,枸杞多糖可通过抑制炎症改善过敏性哮喘,人参醇提物具有良好的抗炎活性等[19-22],由于中草药活性成分良好的免疫调节活性和安全性,因此,许多中草药用于免疫调节活性物质的筛选研究。本研究选取新疆荒漠地区的益补类中药荒漠肉苁蓉醇提物为研究材料,已有研究表明,肉苁蓉醇提物中主要活性成分是苯乙醇苷,具有抗炎,抗病毒,免疫调节等多种功能[9, 23-26]。利用已经建立的体内疫苗佐剂筛选平台,采用动物试验对荒漠肉苁蓉醇提物进行体内免疫调节活性评价,通过检测DCs成熟和Treg的表达来初步分析其作用机制。在动物模型中,发现EEWCD针对OVA抗原具有良好的免疫增强活性,在EEWCD免疫的小鼠中未观察到炎症反应和异常行为,提示EEWCD具有一定的安全性。
中草药活性成分对非特异和特异性免疫反应及各类免疫细胞的功能有明显的调节作用,可以促进T/B淋巴细胞的活化、抗原递呈细胞的成熟和功能[27-28],且这些免疫调节作用存在一定的量效关系[29]。试验中筛选到EEWCD-M和EEWCD-H提高OVA特异性IgG抗体滴度2~3倍,仅次于Alum,且EEWCD没有免疫原性。从MTT试验中可以看出,与Alum相比,EEWCD的3个剂量都可以更好地促进OVA和OVA323-339特异性的脾细胞增殖,激活T/B细胞,EEWCD-M为最佳剂量。这些结果说明EEWCD通过激发有效的B/T淋巴细胞促进体液免疫反应和细胞免疫反应。
Th1/Th2反应是动物机体产生保护性免疫反应所必需,Th1免疫反应是机体抵御某些传染病的关键,如口蹄疫、禽流感、猪瘟等[30-32]。为了阐明EEWCD对OVA抗原的Th1/Th2免疫效应特点,本研究结果显示,EEWCD-M和EEWCD-H可以增强IgG1 (Th2)和IgG2a (Th1)的抗体水平,尤其可以增强IgG2a的水平,效果优于Alum,Alum只能显著促进IgG1抗体水平;细胞因子检测的结果表明,EEWCD-M显著促进了CD4+和CD8+T细胞分泌IL-4和IFN-γ,效果优于Alum。这部分研究结果说明EEWCD增强了对OVA抗原特异性的Th1/Th2免疫反应,尤其可以促进IFN-γ的分泌增强Th1免疫反应,这对于各种动物传染病的防治有积极的意义。
DCs在诱导和调节免疫反应中发挥了重要作用。DCs通过捕获和递呈抗原激活抗原特异性T细胞,分泌免疫调节性细胞因子,调控B淋巴细胞和T淋巴细胞的功能,DCs的激活或成熟对免疫调节至关重要,很多中草药活性成分可以通过促进DCs的成熟和功能促进特异性的免疫反应[1, 15, 33]。Treg细胞可提高体液和细胞反应,调节免疫平衡[34]。为了初步阐明EEWCD增强OVA特异性免疫反应的机制,FACS检测了免疫后小鼠脾中DCs的成熟情况,结果显示,EEWCD-M显著上调了DCs的表面分子CD40、CD80、CD86和MHC-II的表达,下调了Treg的表达,说明EEWCD可以通过促进DCs的成熟和抑制Treg频率来提高OVA特异性的体液和细胞免疫应答。
4 结论通过体内试验评价EEWCD对OVA特异性免疫应答的特点,EEWCD可以通过激活DCs,下调Treg,增加抗体水平,促进细胞因子的产生从而增强Th1和Th2应答,尤其可以增强Th1的反应,EEWCD展示出了良好的免疫调节活性。
| [1] | LI J Y, LI J Y, ZHANG F C. The immunoregulatory effects of Chinese herbal medicine on the maturation and function of dendritic cells[J]. J Ethnopharmacol, 2015, 171: 184–195. DOI: 10.1016/j.jep.2015.05.050 |
| [2] | JIANG M H, ZHU L, JIANG J G. Immunoregulatory actions of polysaccharides from Chinese herbal medicine[J]. Expert Opin Ther Targets, 2010, 14(12): 1367–1402. DOI: 10.1517/14728222.2010.531010 |
| [3] |
张爱莲, 王丹阳, 赵淑述, 等. 新疆野生一枝蒿粗多糖对流感疫苗小鼠免疫增强效果的分析[J]. 畜牧兽医学报, 2016, 47(10): 2089–2097.
ZHANG A L, WANG D Y, ZHAO S S, et al. The analysis of immune enhancement effect of Xinjiang wild Artemisia rupestris L. crude polysaccharides on influenza viruses vaccines in mice[J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(10): 2089–2097. DOI: 10.11843/j.issn.0366-6964.2016.10.018 (in Chinese) |
| [4] |
屠鹏飞, 姜勇, 郭玉海, 等. 肉苁蓉研究及其产业发展[J]. 中国药学杂志, 2011, 46(12): 882–887.
TU P F, JIANG Y, GUO Y H, et al. Review on the research progress and industry development of Cistanches herba[J]. Chinese Pharmaceutical Journal, 2011, 46(12): 882–887. (in Chinese) |
| [5] | WANG T, ZHANG X Y, XIE W Y. Cistanche deserticola Y. C. Ma, "Desert ginseng": a review[J]. Am J Chin Med, 2012, 40(6): 1123–1141. DOI: 10.1142/S0192415X12500838 |
| [6] | LI Z M, LIN H N, GU L, et al. Herba Cistanche (rou cong-rong): one of the best pharmaceutical gifts of traditional Chinese medicine[J]. Front Pharmacol, 2016, 7: 41. |
| [7] | WANG L L, DING H, YU H S, et al. Cistanches herba: Chemical constituents and pharmacological effects[J]. Chin Herbal Med, 2015, 7(2): 135–142. DOI: 10.1016/S1674-6384(15)60017-X |
| [8] | JIANG Y, TU P F. Analysis of chemical constituents in Cistanche species[J]. J Chromatogr A, 2009, 1216(11): 1970–1979. DOI: 10.1016/j.chroma.2008.07.031 |
| [9] |
巴雪丽, 张爱莲, 黄炯, 等. 新疆野生荒漠肉苁蓉粗多糖对口蹄疫疫苗免疫小鼠的佐剂效应[J]. 畜牧兽医学报, 2017, 48(8): 1535–1542.
BA X L, ZHANG A L, HUANG J, et al. Adjuvant effect of Xinjiang wild Cistanche deserticola Y. C. Ma crude polysaccharides on foot-and-mouth disease vaccines in mice[J]. Acta Veterinaria et Zootechnica Sinica, 2017, 48(8): 1535–1542. (in Chinese) |
| [10] |
堵年生, 王泓, 易杨华. 肉苁蓉中苯乙醇甙类成分的分离和鉴定[J]. 天然产物研究与开发, 1993, 5(4): 5–8.
DU N S, WANG H, YI Y H. Isolation and indentification of phenylethanoid glycosides from Cistanche deserticola[J]. Natural Product Research and Development, 1993, 5(4): 5–8. (in Chinese) |
| [11] | LIN L W, HSIEH M T, TSAI F H, et al. Anti-nociceptive and anti-inflammatory activity caused by Cistanche deserticola in rodents[J]. J Ethnopharmacol, 2002, 83(3): 177–182. DOI: 10.1016/S0378-8741(02)00147-2 |
| [12] | HU Y B, HUANG J H, LI Y X, et al. Cistanche deserticola polysaccharide induces melanogenesis in melanocytes and reduces oxidative stress via activating NRF2/HO-1 pathway[J]. J Cell Mol Med, 2020, 24(7): 4023–4035. DOI: 10.1111/jcmm.15038 |
| [13] | ZHANG H, XIANG Z, DUAN X, et al. Antitumor and anti-inflammatory effects of oligosaccharides from Cistanche deserticola extract on spinal cord injury[J]. Int J Biol Macromol, 2019, 124: 360–367. DOI: 10.1016/j.ijbiomac.2018.11.132 |
| [14] |
谭雅超, 李泉晓, 康亚玲, 等. 新疆野生荒漠肉苁蓉粗多糖对OVA诱导小鼠免疫应答的影响[J]. 国际生物医学工程杂志, 2020, 43(2): 87–93.
TAN Y C, LI Q X, KANG Y L, et al. Immunoregulatory activity of wild Cistanche deserticola crude polysaccharides on OVA as a potential adjuvant in mice[J]. International Journal of Biomedical Engineering, 2020, 43(2): 87–93. (in Chinese) |
| [15] | BANCHEREAU J, STEINMAN R M. Dendritic cells and the control of immunity[J]. Nature, 1998, 392(6673): 245–252. DOI: 10.1038/32588 |
| [16] | CHEN X, YANG L, HOWARD O M Z, et al. Dendritic cells as a pharmacological target of traditional Chinese medicine[J]. Cell Mol Immunol, 2006, 3(6): 401–410. |
| [17] | LIU Y, CHEN Y, LAMB J R, et al. Triptolide, a component of Chinese herbal medicine, modulates the functional phenotype of dendritic cells[J]. Transplantation, 2007, 84(11): 1517–1526. DOI: 10.1097/01.tp.0000289990.55668.0d |
| [18] |
杨秀梅, 杨雨, 王丹阳, 等. 新疆野生及栽培荒漠肉苁蓉提取物免疫活性研究[J]. 生物技术通报, 2016, 32(1): 131–137.
YANG X M, YANG Y, WANG D Y, et al. The study of immune activities of extracts from wild and cultivated Cistanche deserticola in Xinjiang[J]. Biotechnology Bulletin, 2016, 32(1): 131–137. (in Chinese) |
| [19] | LI J F, ZHONG Y G, LI H R, et al. Enhancement of Astragalus polysaccharide on the immune responses in pigs inoculated with foot-and-mouth disease virus vaccine[J]. Int J Biol Macromol, 2011, 49(3): 362–368. DOI: 10.1016/j.ijbiomac.2011.05.015 |
| [20] |
张伟, 白景英, 杜红旭, 等. 中药复方芩藿饮对鸭肝炎病毒实验感染雏鸭的治疗效果分析[J]. 畜牧兽医学报, 2018, 49(5): 1027–1036.
ZHANG W, BAI J Y, DU H X, et al. Analysis of the therapeutic effect of traditional Chinese herbal compound of Qinhuo oral liquid in ducklings infected with duck hepatitis virus[J]. Acta Veterinaria et Zootechnica Sinica, 2018, 49(5): 1027–1036. (in Chinese) |
| [21] | HAN S Y, KIM J, KIM E, et al. AKT-targeted anti-inflammatory activity of Panax ginseng calyx ethanolic extract[J]. J Ginseng Res, 2018, 42(4): 496–503. DOI: 10.1016/j.jgr.2017.06.003 |
| [22] | CUI F, SHI C L, ZHOU X J, et al. Lycium barbarum polysaccharide extracted from Lycium barbarum leaves ameliorates asthma in mice by reducing inflammation and modulating gut microbiota[J]. J Med Food, 2020, 23(7): 699–710. DOI: 10.1089/jmf.2019.4544 |
| [23] | CHENG X Y, WEI T, GUO B, et al. Cistanche deserticola cell suspension cultures: Phenylethanoid glycosides biosynthesis and antioxidant activity[J]. Process Biochem, 2005, 40(9): 3119–3124. DOI: 10.1016/j.procbio.2005.03.012 |
| [24] | NAN Z D, ZENG K W, SHI S P, et al. Phenylethanoid glycosides with anti-inflammatory activities from the stems of Cistanche deserticola cultured in Tarim desert[J]. Fitoterapia, 2013, 89: 167–174. DOI: 10.1016/j.fitote.2013.05.008 |
| [25] |
由淑萍, 赵军, 马龙, 等. 肉苁蓉乙醇提取物抗大鼠免疫性肝纤维化的作用及其机制[J]. 中国药理学与毒理学杂志, 2016, 30(5): 504–510.
YOU S P, ZHAO J, MA L, et al. Effect and mechanism of Cistanche phenylethanoid glycosides on rats with immunological liver fibrosis[J]. Chinese Journal of Pharmacology and Toxicology, 2016, 30(5): 504–510. DOI: 10.3867/j.issn.1000-3002.2016.05.004 (in Chinese) |
| [26] | MORIKAWA T, XIE H H, PAN Y N, et al. A review of biologically active natural products from a desert plant Cistanche tubulosa[J]. Chem Pharm Bull (Tokyo), 2019, 67(7): 675–689. DOI: 10.1248/cpb.c19-00008 |
| [27] |
陈卓, 潘明佳, 邢雪飞, 等. 血清药物化学在中药及其复方药效物质基础研究中的进展[J]. 药物评价研究, 2016, 39(1): 143–147.
CHEN Z, PAN M J, XING X F, et al. Research progress on serum pharmacochemistry studies in pharmacodynamics material basis of Chinese materia medica and Chinese herbal formula[J]. Drug Evaluation Research, 2016, 39(1): 143–147. (in Chinese) |
| [28] | LUAN X, ZHANG L J, LI X Q, et al. Compound-based Chinese medicine formula: from discovery to compatibility mechanism[J]. J Ethnopharmacol, 2020, 254: 112687. DOI: 10.1016/j.jep.2020.112687 |
| [29] | PLOTKIN S. History of vaccination[J]. Proc Natl Acad Sci U S A, 2014, 111(34): 11283–11287. |
| [30] | NISHIMURA T, IWAKABE K, SEKIMOTO M, et al. Distinct role of antigen-specific T helper type 1 (Th1) and Th2 cells in tumor eradication in vivo[J]. J Exp Med, 1999, 190(5): 617–627. |
| [31] |
胡友军, 林映才, 周桂莲, 等. 补益类中草药提取物对黄羽肉鸡生产性能和T淋巴细胞亚群的影响[J]. 中国畜牧杂志, 2004, 40(9): 23–25.
HU Y J, LIN Y C, ZHOU G L, et al. Effects of Chinese herb extraction on growth performance and T lymphocyte subsets of yellow feather type broiler[J]. Chinese Journal of Animal Science, 2004, 40(9): 23–25. (in Chinese) |
| [32] | GUMAN E, TAYLOT G, CHARLESTON B, et al. An MHC-restricted CD8+ T-cell response is induced in cattle by foot-and-mouth disease virus (FMDV) infection and also following vaccination with inactivated FMDV[J]. J Gen Virol, 2008, 89(3): 667–675. |
| [33] | BLUESTONE J A, ABBAS A K. Natural versus adaptive regulatory T cells[J]. Nat Rev Immunol, 2003, 3(3): 253–257. |
| [34] | HORI S, NOMURA T, SAKAGUCHI S. Control of regulatory T cell development by the transcription factor Foxp3[J]. Science, 2003, 299(5609): 1057–1061. |



