小肠是仔猪食物消化和营养物质吸收的主要场所之一,肠绒毛是完成食物消化吸收的重要保障[1]。肠绒毛之间凹陷形成的隐窝结构主要用来合成新的肠绒毛上皮细胞[1]。肠绒毛上皮细胞主要由吸收性肠细胞、肠内分泌细胞、杯状细胞(goblet cell,GC)和潘氏细胞等组成[2]。覆盖在肠上皮细胞表面的黏液层是与外来食物或病原微生物接触的前沿[2-3]。肠黏液层主要由GC分泌产物构成,所以GC对维持肠道内环境稳态和肠上皮细胞的完整性尤为重要[2]。当肠道中GC缺失或分泌功能障碍往往伴发着肠道疾病[2-3]。
猪德尔塔冠状病毒(porcine deltacoronavirus,PDCoV)为有囊膜的单股正链RNA病毒,属于冠状病毒科δ冠状病毒属[4]。PDCoV在中国香港首次被检测报道之后陆续在全球多国发现[5-8]。临床上PDCoV导致仔猪腹泻、脱水和呕吐等现象[8]。感染PDCoV的仔猪组织病理学观察显示小肠中绒毛萎缩、断裂和上皮细胞变性坏死等[8-9]。肠道黏液层能及时清除外来病原微生物而对黏膜上皮细胞起到物理屏障保护作用[2, 10]。肠道中由GC分泌的黏蛋白2(mucoprotein2, MUC2)是形成黏液层的主要成分之一[2]。研究表明Notch信号通路在肠道的发育过程中起着至关重要的作用[11]。肠道中Notch信号通路不仅可以促进肠黏膜上皮的增殖,而且可以调控黏膜上皮细胞的分化方向,从而调控肠黏膜上皮细胞数量与比例来适应不同环境下肠道功能结构的稳定[11-12]。转录因子发状分裂相关增强子1(hairy and enhancer of split-1,Hes1)作为Notch信号通路下游主要的靶基因决定着肠道上皮细胞的分化[2, 12]。当Hes1被激活时,肠黏膜上皮细胞向着吸收细胞系分化,影响小肠分泌细胞数量[12]。肠道中Notch信号通路的激活可以抑制GC的形成和分化[11]。目前,关于PDCoV感染初生仔猪对小肠中GC的影响鲜有报道,因此作者通过仔猪感染试验探究PDCoV对仔猪小肠中GC数量及Hes1和MUC2转录和表达的影响,以期阐明PDCoV对仔猪小肠黏膜损伤作用机制。
1 材料与方法 1.1 毒株与细胞系PDCoV-CHN-HG-2017病毒株,由华中农业大学农业微生物国家重点实验室何启盖教授馈赠。PK-15细胞(ATCC编号CCL-33)由本实验室保存,用于PDCoV的培养增殖和TCID50测定。
1.2 动物试验湖北武汉某猪场购进6头未吃初乳的初生大白仔猪,采集所有初生仔猪的直肠拭子RT-PCR检测PEDV、TGEV、PDCoV、PRoV呈阴性。随机将6头初生仔猪分为对照组(Mock组)和感染组(PDCoV组),每组各3头。对照组和感染组分别安置在隔离器中。每4 h给仔猪喂新鲜液态代乳品的混合物。待静养48 h后给感染组仔猪口服感染5 mL 1×105 TCID50·mL-1 PDCoV-CHN-HG-2017毒株,对照组口服5 mL DMEM培养基。感染后每小时监测一次临床症状并观察记录,当感染组出现明显的腹泻、呕吐和脱水等临床症状实施安乐死,并及时剖检观察,对仔猪十二指肠、空肠和回肠组织进行取样,一份置于4%甲醛溶液中固定,另一份置于-80 ℃冰箱冻存。对照组仔猪在相对应时间点随机选择1头实施安乐死并取材小肠样品处理保存(同感染组仔猪)。
1.3 RT-PCR检测PDCoV取适当冻存的空肠组织样品,分别采用诺唯赞生物科技有限公司RNA isolater Total RNA Extraction Reagen说明书提取组织中总RNA,用HiScriptⓇ Ⅱ Q RT Super Mix for qPCR (+gDNA wiper)逆转录为cDNA用于病毒的PCR检测。参照GenBank中MF095123.1基因序列用Primer5.0软件设计PDCoV-M引物,引物序列(表 1)由生工生物工程(上海)股份有限公司合成。扩增反应体系为10 μL:2 × Taq Master Mix 5 μL,PCR Forward Primer 0.5 μL,PCR Reverse Primer 0.5 μL,cDNA 0.5 μL,ddH2O 3.5 μL。反应条件:95 ℃预变性5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,循环35次;72 ℃延伸7 min;4 ℃保存。
|
|
表 1 引物信息表 Table 1 The table of primer information |
仔猪小肠组织用4%甲醛室温固定48 h后,制备常规石蜡切片,厚4 μm。采用HE染色观察小肠组织的病理变化。采用Nikon 80i生物光学显微镜和Image-Proplus软件对每张组织切片选取测量结构完整的6根绒毛长度(villus height,VH)和6个隐窝深度(crypt depth,CD),进行VH∶CD检测分析。
1.5 PAS染色法和阿利新蓝染色(AB)法检测小肠中杯状细胞分别参照Servicebio品牌型号G1008-100ML说明书和参照Solarbio品牌型号G1560说明书对组织切片中GC进行PAS染色和AB染色。每张组织切片通过Nikon 80i生物光学显微镜选取6个视野观察,通过Image-Proplus计数GC数量。PAS/AB染色的每张切片分别选择至少6个结构完整的肠绒毛和隐窝进行GC计数。计算PAS/AB染色GC平均数(mean number of GC),分别比较对照组和感染组PAS/AB染色(mean number of GC)/(mean number of VH:CD)值。
1.6 RT-qPCR检测小肠中Hes1和MUC2的mRNA转录水平在NCBI上设计所需的引物序列并由生工生物工程(上海)股份有限公司合成引物(表 1)。同“1.3”的试验方法分别提取小肠各段总RNA并逆转录合成cDNA,用ChamQ SYBR qPCR Master Mix在实时荧光定量PCR仪(ABI stepone plus)中进行qPCR,共40个循环,每个样品3个重复,检测β-actin、Hes1和MUC2的mRNA在仔猪小肠各段中的表达水平。
1.7 ELISA法检测仔猪小肠中Hes1和MUC2的含量参考文献[10]试验方法分别采用慧嘉生物技术有限公司批号202009的Porcine MUC-2 ELISA KIT和Porcine HES1 ELISA KIT试剂盒检测小肠组织中MUC2和Hes1的含量。试验操作步骤严格按照各试剂盒说明书进行,在Thermo全波长酶标仪(型号:GO)450 nm下检测各孔OD值,计算各样本含量。
1.8 统计与分析用IBM SPSS Statistics.19软件对试验数据进行T检验分析比较,数据以“x±s”表示。对RT-qPCR mRNA相对表达量数据采用2-ΔΔCt方法处理、分析。用Graphpad Prism 8.0软件对数据结果作图。P < 0.05为有统计学差异,标注*;P < 0.01为有显著统计学差异,标注**;P < 0.001为有极其显著的统计学差异,标注***。
2 结果 2.1 PDCoV病毒检测1%琼脂糖凝胶核酸电泳结果显示,扩增条带在353 bp位置,与预期扩增片段的大小一致。从仔猪空肠组织RT-PCR检测感染组仔猪均为阳性条带,对照组仔猪均为阴性条带,则感染组仔猪成功接种PDCoV(图 1)。
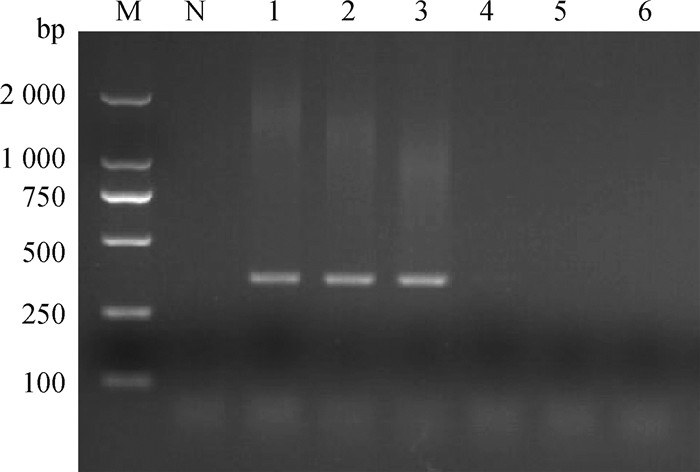
|
M. DL2000 DNA相对分子质量标准;N. 阴性对照;1~3. 感染组仔猪空肠组织样;4~6. 对照组仔猪空肠组织样 M. DL2000 DNA marker; N. Negative control; 1-3. Jejunum tissue of infected piglets; 4-6. Jejunum tissue of control group 图 1 PDCoV的RT-PCR检测电泳图 Fig. 1 Detection of PDCoV by RT-PCR |
仔猪小肠组织HE染色观察结果显示,对照组仔猪的十二指肠结构完整,无炎症反应;空肠褶皱结构完整,肠绒毛较长;回肠结构完整,肠绒毛较长,派尔结发育正常(图 2 A~C)。感染组仔猪的十二指肠绒毛萎缩,固有层和黏膜下层炎性细胞浸润;空肠绒毛严重萎缩变钝,绒毛上皮细胞脱落,上皮细胞变性坏死,固有层充血;回肠绒毛严重萎缩、断裂,固有层大量淋巴细胞浸润(图 2 D~F)。
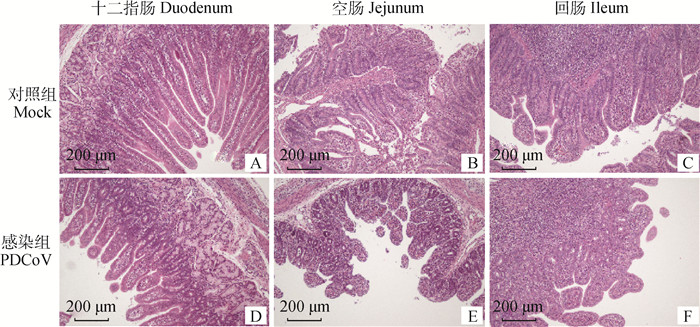
|
A~C. 对照组小肠组织病理学观察结果; D~F. 感染组小肠组织病理学观察结果 A-C. Histopathological observation results of small intestine in control group; D-F. Histopathological observation results of small intestine in infection group 图 2 仔猪小肠组织病理学变化 Fig. 2 Histopathological changes in small intestine of piglets |
感染组仔猪小肠各段肠绒毛长度、肠绒毛长度与隐窝深度比值(VH∶CD)相对于对照组仔猪均降低,且差异显著(P < 0.05)。
2.4 仔猪小肠组织中杯状细胞的PAS染色仔猪小肠中的GC经PAS染色呈紫红色(中性黏蛋白),主要分布在肠绒毛和隐窝中,感染组仔猪小肠各段阳性信号均低于对照组仔猪(图 3 A~F)。小肠各段GC计数统计分析结果显示,感染组仔猪小肠各段均低于对照组,差异显著(P < 0.001)(图 3 G~I)。
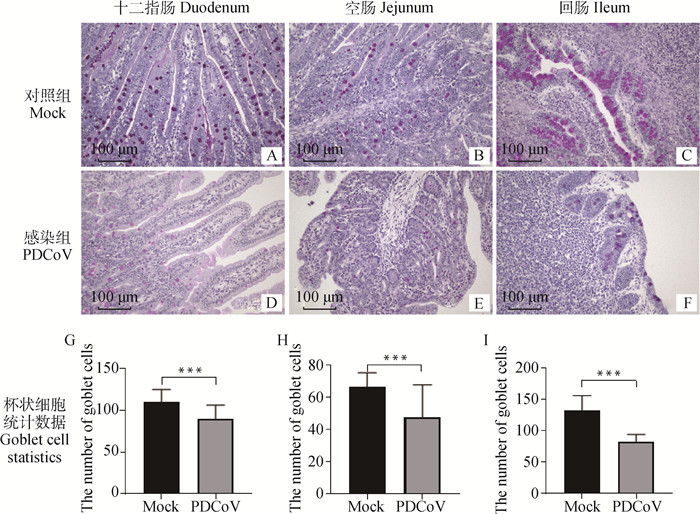
|
A~F. 杯状细胞在各组小肠各段PAS染色结果;G~I. PAS染色结果在各组小肠各段阳性率分析;***.P < 0.001 A-F. PAS staining results in small intestine of per group; G-I. The positive rate of PAS staining in each segment of small intestine was analyzed; ***.P < 0.001 图 3 仔猪小肠组织杯状细胞PAS染色结果及阳性率 Fig. 3 PAS staining results and positive rate of small intestinal tissue goblet cells in piglets |
仔猪小肠中的GC由AB染色呈蓝色(酸性黏蛋白), 主要分布在肠绒毛上皮和隐窝中,与PAS染色结果一致,感染组仔猪小肠各段阳性信号均低于对照组仔猪(图 4 A~F)。小肠各段GC计数统计分析结果显示,感染组仔猪小肠各段均低于对照组仔猪,十二指肠(P < 0.01)、空肠(P < 0.05)和回肠(P < 0.001)差异显著(图 4 G~I)。
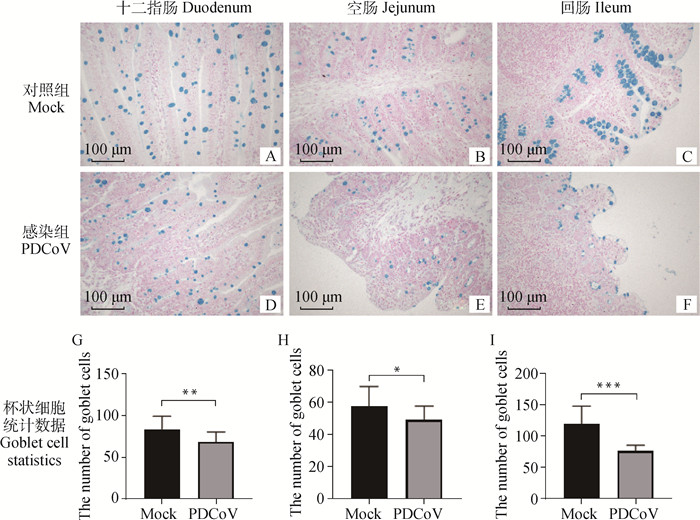
|
A~F. 杯状细胞在各组小肠各段AB染色结果;G~I. AB染色结果在各组小肠各段阳性率分析;*.P < 0.005; **.P < 0.01; ***.P < 0.001 A-F. AB staining results in small intestine of per group; G-I. The positive rate of AB staining in each segment of small intestine was analyzed; *.P < 0.05; **.P < 0.01; ***.P < 0.001 图 4 仔猪小肠组织杯状细胞AB染色结果及阳性率 Fig. 4 AB staining results and positive rate of goblet cells in small intestine of piglets |
由PAS染色和AB染色的小肠组织,各段平均单个肠绒毛和隐窝中GC数量显示感染组仔猪小肠各段均低于对照组仔猪,且差异显著(P < 0.05)。
2.7 小肠各段组织中GC平均数与VH∶CD平均值的比值参照文献[3]方法对小肠各段组织GC的平均数(表 3)与对应的小肠各段VH平均值∶CD平均值(表 2)的比值(表 4)进行统计,结果显示感染组仔猪均低于对照组仔猪。采用PAS染色结果显示,対照组仔猪小肠各段分别为3.98、3.21、11.58,感染组仔猪小肠各段分别为3.76、2.07、6.56。采用AB染色结果显示,对照组仔猪小肠各段分别为4.55、3.70、11.79,感染组仔猪小肠各段分别为3.02、3.03、8.88。
|
|
表 2 小肠各段肠绒毛长度与VH∶CD值(x±s) Table 2 Small intestine villi height and VH∶CD value (x±s) |
|
|
表 3 小肠组织各段平均单个肠绒毛和隐窝中GC数量(x±s) Table 3 Mean number of GC in single intestinal villi and crypt (x±s) |
|
|
表 4 对照组和感染组(mean number of GC)/(mean number of VH:CD)值 Table 4 Control group and infection group (mean number of GC)/(Mean Number of VH: CD) value |
结果显示,感染组仔猪与对照组仔猪相比小肠各段Hes1 mRNA水平表达均有不同程度的升高,在空肠(P < 0.01)和回肠(P < 0.05)中升高明显差异显著,十二指肠(P>0.05)中无显著差异(图 5A)。感染组仔猪与对照组仔猪相比小肠各段MUC2 mRNA水平表达均有不同程度降低,在十二指肠(P < 0.05)和回肠(P < 0.001)中降低明显差异显著,空肠(P>0.05)中无显著差异(图 5B)。
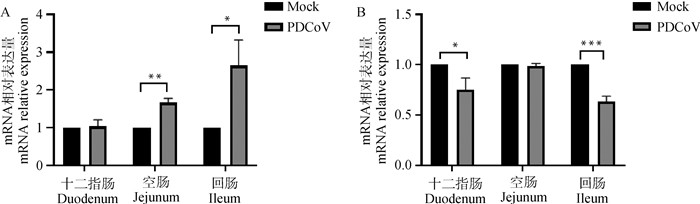
|
A. 用qPCR检测小肠各段Hes1的mRNA相对表达; B. 用qPCR检测小肠各段MUC2的mRNA相对表达; *.P < 0.05; **.P < 0.01;***.P < 0.001 A. Relative expression of Hes1 mRNA was detected by qPCR; B. Relative expression of MUC2 mRNA was detected by qPCR; *.P < 0.05; **.P < 0.01;***.P < 0.001 图 5 Hes1(A)和MUC2(B)的基因转录检测 Fig. 5 Detection of Hes1 (A) and MUC2 (B) genes transcription |
结果显示,感染组仔猪与对照组仔猪相比十二指肠、空肠和回肠组织中Hes1含量均升高,在十二指肠(P < 0.01)和回肠(P < 0.01)中升高明显差异显著,在空肠(P>0.05)中无显著差异(图 6A)。感染组仔猪与对照组仔猪相比十二指肠、空肠和回肠组织中MUC2含量均降低,在十二指肠(P < 0.01)和回肠(P < 0.05)中降低明显差异显著,在空肠(P>0.05)中无显著差异(图 6B)。
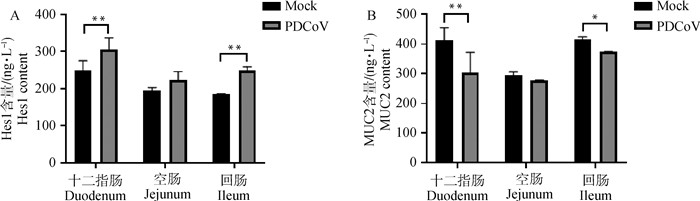
|
A. 用ELISA检测小肠各段Hes1含量; B. 用ELISA检测小肠各段MUC2含量; *P < 0.05; **.P < 0.01 A. The content of Hes1 in small intestine was detected by ELISA; B. The content of MUC2 in small intestine was detected by ELISA; *P < 0.05; **.P < 0.01 图 6 仔猪小肠各段组织中Hes1(A)和MUC2(B)含量 Fig. 6 The content of Hes1 (A) and MUC2 (B) in small intestine of piglets |
Zhang等[13]从腹泻的哺乳仔猪粪便中分离出PDCoV-CHN-HG-2017病毒株,并通过口服10 mL 1×106 TCID50·mL-1 PDCoV-CHN-HG-2017毒株感染5日龄的仔猪验证了病毒的致病性。本次试验对未吃初乳的初生仔猪口服感染5 mL 1×105 TCID50·mL-1 PDCoV-CHN-HG-2017毒株观察到的临床症状为腹泻、脱水和嗜睡,这与之前的研究结果相符[8, 13-14]。Ma等[15]和Jung等[16]对10~19日龄的仔猪感染PDCoV,24 h后观察到仔猪腹泻,并在直肠拭子中检测到PDCoV。Zhang等[13]在PDCoV感染5日龄仔猪1 d后观察到腹泻症状,并通过RT-qPCR检测了不同组织中病毒的拷贝数,发现空肠组织中相对较高。本试验对仔猪空肠组织样本进行RT-PCR检测发现在22 hpi时呈阳性结果,这与之前报道相一致,表明初生仔猪感染试验成功。Dong等[17]发现5日龄仔猪感染PDCoV后1 d有4/8出现临床症状,21日龄仔猪感染同等剂量PDCoV后1 d有1/5出现临床症状。Zhang等[13]在5日龄仔猪感染PDCoV后1 d观察到腹泻症状,在2~6 dpi观察到更严重的临床症状。本研究中初生仔猪分别在22、39和70 hpi出现明显腹泻、脱水和嗜睡等临床症状,这可能与仔猪之间的个体差异和本次试验感染病毒剂量有关。小肠组织病理学研究结果显示感染组仔猪与对照组相比,十二指肠绒毛萎缩,空肠绒毛严重萎缩变钝,上皮细胞变性坏死,固有层充血,回肠绒毛严重萎缩,大量淋巴细胞浸润,这与之前的试验结果相符[9, 13, 16]。小肠是仔猪重要的食物消化吸收场所之一,其丰富完整的肠绒毛与隐窝结构分别增加了肠道的有效吸收面积与绒毛上皮细胞的更换速率[1]。所以VH和VH∶CD值是用来衡量小肠黏膜功能完整性的重要指标[18]。本次试验PDCoV感染仔猪引起小肠各段肠绒毛萎缩且差异显著,感染组仔猪小肠各段的VH∶CD值均降低且差异显著,导致感染组仔猪小肠的吸收和屏障功能下降,进而出现腹泻和脱水现象。
肠黏膜上皮细胞往往是抵御外来病原体的第一道防线,在机体先天性免疫和适应性免疫中发挥着重要的作用[2]。黏液层覆盖在肠黏膜上皮细胞表面能及时地清除外来病原体,对肠道具有润滑和屏障作用[2, 10]。GC分泌的多种因子在维持肠道组织稳态中起重要作用,这些因子都有助于黏液层保护黏膜上皮细胞[2]。本试验对小肠组织中GC进行PAS染色(中性黏蛋白)和AB染色(酸性黏蛋白)结果一致,感染组仔猪在小肠各段GC数量均不同程度低于对照组仔猪且差异显著。这与Jung等[3]对9日龄仔猪接种PEDV后引起空肠中GC数量显著降低相似。Jung等[3]研究发现PEDV感染组仔猪和对照组仔猪空肠中GC的平均数与VH平均值∶CD平均值的比值,在感染后1 d分别为0.3(AB)/0.4(PAS)和2.3(AB)/2.5(PAS),在感染后3 d分别为0.9(AB)/1.7(PAS)和2.6(AB)/3.0(PAS),证明GC数量减少明显与PEDV感染相关。本试验比较分析了小肠各段组织切片GC的平均数与小肠各段的VH平均值∶CD平均值的比值,发现感染组仔猪与对照组相比在空肠和回肠减少明显(表 4),这与Jung等[3]的研究相似。表明PDCoV感染仔猪在空肠和回肠中对GC影响很大,这与研究报道PDCoV主要定位在空肠与回肠相符合[13-14]。Jung等[3]通过免疫组织化学检测PEDV发现部分阳性信号位于GC中。但本试验感染组仔猪数量偏少,且未通过免疫组织化学检测PDCoV在小肠各段的分布现象,所以是否PDCoV可以直接侵袭GC进而对GC的形成和分泌产生影响还需要试验探讨。
小肠的黏液层主要由GC分泌的MUC2、水和无机盐等构成[19]。肠道致病微生物进入机体往往伴发着MUC2结构、功能和数量的改变,当黏液层变薄时外来病原体就可以直接侵袭肠上皮细胞导致炎症或免疫反应等[10, 19]。张丽霞等[20]研究发现牛源致病性大肠埃希菌K99感染小鼠后6~60 h小肠各段组织中的GC数量均显著低于对照组,引起小肠黏膜上皮的损伤。吴异健等[21]研究发现番鸭呼肠孤病毒感染1日龄雏番鸭后在1~21 d小肠各段组织中GC数量均降低,引起肠道消化吸收功能障碍。王誉颖等[22]研究发现干酪乳杆菌可以提高腹泻大鼠回肠中GC数量和促进MUC2的合成,进而减轻腹泻对大鼠肠道黏膜的损伤。朱春洋等[23]研究发现四逆散可通过增加功能消化不良大鼠十二指肠中GC数量和MUC2的表达改善黏液屏障, 从而起到治疗功能消化不良作用。Notch信号通路是一条依赖于细胞间相互接触传递的保守信号通路,在动物发育过程中发挥着极为重要的作用[12]。研究表明肠道中激活Notch信号通路可调控肠黏膜上皮细胞的增殖与分化,转录因子Hes1可作为Notch信号通路下游的靶基因抑制GC的分化[11-12]。Yang等[24]研究发现在LS174T细胞中通过RNA干扰下调numb基因可激活Notch信号通路,上调Hes1表达。在LS174TI细胞中敲除numb基因可降低MUC2蛋白的表达和丧失杯状细胞表型分化[24]。本研究中PDCoV感染初生仔猪引起小肠各段组织Hes1 mRNA转录量和Hes1含量均升高,推测PDCoV感染仔猪激活小肠中Hes1的表达导致GC分化受到抑制,降低了小肠中GC数量,这与PAS染色和AB染色结果相对应。感染组仔猪与对照组相比小肠各段组织MUC2 mRNA转录量和MUC2含量均降低,这可能与PDCoV感染仔猪减少小肠组织中GC数量有关。
4 结论PDCoV感染初生仔猪引起小肠杯状细胞数量明显减少。原因可能是PDCoV激活了肠道Notch信号通路,使下游靶基因Hes1表达升高,抑制杯状细胞的形成和分化,导致杯状细胞数量减少和MUC2表达降低。
| [1] |
张翥, 董国忠. 影响断奶仔猪小肠结构完整性的因素[J]. 中国饲料, 2010(6): 9–13, 28.
ZHANG Z, DONG G Z. Factors affecting the structural integrality of the small intestine in weanling pigs[J]. China Feed, 2010(6): 9–13, 28. (in Chinese) |
| [2] | MCCAULEY H A, GUASCH G. Three cheers for the goblet cell: maintaining homeostasis in mucosal epithelia[J]. Trends Mol Med, 2015, 21(8): 492–503. DOI: 10.1016/j.molmed.2015.06.003 |
| [3] | JUNG K, SAIF L J. Goblet cell depletion in small intestinal villous and crypt epithelium of conventional nursing and weaned pigs infected with porcine epidemic diarrhea virus[J]. Res Vet Sci, 2017, 110: 12–15. DOI: 10.1016/j.rvsc.2016.10.009 |
| [4] | HU H, JUNG K, VLASOVA A N, et al. Isolation and characterization of porcine deltacoronavirus from pigs with diarrhea in the United States[J]. J Clin Microbiol, 2015, 53(5): 1537–1548. DOI: 10.1128/JCM.00031-15 |
| [5] | WOO P C Y, LAU S K P, LAM C S F, et al. Discovery of seven novel Mammalian and avian coronaviruses in the genus deltacoronavirus supports bat coronaviruses as the gene source of alphacoronavirus and betacoronavirus and avian coronaviruses as the gene source of gammacoro-navirus and deltacoronavirus[J]. J Virol, 2012, 86(7): 3995–4008. DOI: 10.1128/JVI.06540-11 |
| [6] | LEE S, LEE C H. Complete genome characterization of korean porcine deltacoronavirus Strain KOR/KNU14-04/2014[J]. Genome Announc, 2014, 2(6): e01191-14. DOI: 10.1128/genomeA.01191-14 |
| [7] | MARTHALER D, JIANG Y, COLLINS J, et al. Complete genome sequence of strain SDCV/USA/Illinois121/2014, a porcine deltacoronavirus from the United States[J]. Genome Announc, 2014, 2(2): e00218-14. DOI: 10.1128/genomeA.00218-14 |
| [8] | JANETANAKIT T, LUMYAI M, BUNPAPONG N, et al. Porcine deltacoronavirus, Thailand, 2015[J]. Emerg Infect Dis, 2016, 22(4): 757–759. DOI: 10.3201/eid2204.151852 |
| [9] | WANG L Y, HAYES J, SARVER C, et al. Porcine deltacoronavirus: histological lesions and genetic characterization[J]. Arch Virol, 2016, 161(1): 171–175. DOI: 10.1007/s00705-015-2627-4 |
| [10] |
林春发, 郝永峰, 刘娟. 术苦芩总多糖对湿热泄泻仔猪小肠杯状细胞数量以及MUC-2和ITF-3 mRNA转录的影响[J]. 畜牧兽医学报, 2019, 50(6): 1301–1311.
LIN C F, HAO Y F, LIU J. Effect of polysaccharides from Zhukuqin on the number of intestinal goblet cell and the transcription of MUC-2 and ITF-3 mRNA in the small intestine of damp-heat diarrhea piglets[J]. Acta Veterinaria et Zootechnica Sinica, 2019, 50(6): 1301–1311. (in Chinese) |
| [11] | FRE S, HUYGHE M, MOURIKIS P, et al. Notch signals control the fate of immature progenitor cells in the intestine[J]. Nature, 2005, 435(7044): 964–968. DOI: 10.1038/nature03589 |
| [12] |
林春发, 郝永峰, 刘娟. 术苦芩多糖对湿热泄泻仔猪小肠Notch信号通路干预的探究[J]. 中国兽医学报, 2020, 40(1): 172–178.
LIN C F, HAO Y F, LIU J. Intervention of polysaccharides from Zhukuqin on small intestinal Notch signaling pathway in piglets with damp-heat diarrhea[J]. Chinese Journal of Veterinary Science, 2020, 40(1): 172–178. (in Chinese) |
| [13] | ZHANG M J, LIU D J, LIU X L, et al. Genomic characterization and pathogenicity of porcine deltacoronavirus strain CHN-HG-2017 from China[J]. Arch Virol, 2019, 164(2): 413–425. DOI: 10.1007/s00705-018-4081-6 |
| [14] | CHEN Q, GAUGER P, STAFNE M, et al. Pathogenicity and pathogenesis of a United States porcine deltacoronavirus cell culture isolate in 5-day-old neonatal piglets[J]. Virology, 2015, 482: 51–59. DOI: 10.1016/j.virol.2015.03.024 |
| [15] | MA Y M, ZHANG Y, LIANG X Y, et al. Origin, evolution, and virulence of porcine deltacoronaviruses in the United States[J]. mBio, 2015, 6(2): e00064. |
| [16] | JUNG K, HU H, EYERLY B, et al. Pathogenicity of 2 porcine deltacoronavirus strains in gnotobiotic pigs[J]. Emerg Infect Dis, 2015, 21(4): 650–654. DOI: 10.3201/eid2104.141859 |
| [17] | DONG N, FANG L R, YANG H, et al. Isolation, genomic characterization, and pathogenicity of a Chinese porcine deltacoronavirus strain CHN-HN-2014[J]. Vet Microbiol, 2016, 196: 98–106. DOI: 10.1016/j.vetmic.2016.10.022 |
| [18] |
闫金坤, 陈耀星, 王子旭. 雌激素对大鼠肠黏膜结构及上皮内淋巴细胞和杯状细胞数量、分布的影响[J]. 畜牧兽医学报, 2008, 39(9): 1267–1271.
YAN J K, CHEN Y X, WANG Z X. Effect of estrogen on structure of mucosal epithelium and number of intraepithelial lymphocytes and goblet cells in small intestine of rat[J]. Acta Veterinaria et Zootechnica Sinica, 2008, 39(9): 1267–1271. (in Chinese) |
| [19] | LINDEN S K, SUTTON P, KARLSSON N G, et al. Mucins in the mucosal barrier to infection[J]. Mucosal Immunol, 2008, 1(3): 183–197. DOI: 10.1038/mi.2008.5 |
| [20] |
张丽霞, 丁玉林, 毕艳楠, 等. 牛源致病性大肠埃希菌K99对小鼠肠绒毛生长和肠三叶因子mRNA表达的影响[J]. 动物医学进展, 2019, 40(2): 91–99.
ZHANG L X, DING Y L, BI Y N, et al. Effects of Pathogenic E. coli K99 from bovine on growth of intestinal villi and expression of ITF mRNA in mice[J]. Progress in Veterinary Medicine, 2019, 40(2): 91–99. (in Chinese) |
| [21] |
吴异健, 姜慧慧, 黄丽娜, 等. 番鸭呼肠孤病毒感染对雏番鸭肠黏膜组织结构及肠道免疫细胞的影响[J]. 中国预防兽医学报, 2018, 40(5): 431–437, 458.
WU Y J, JIANG H H, HUANG L N, et al. Infection effects of Muscovy duck reovirus on intestinal mucosal structure and intestinal immune cells in Muscovy duckling[J]. Chinese Journal of Preventive Veterinary Medicine, 2018, 40(5): 431–437, 458. (in Chinese) |
| [22] |
王誉颖, 汤林杰, 李姣, 等. 干酪乳杆菌对发育期腹泻模型大鼠回肠黏膜结构及MUC2含量的影响[J]. 中国农业大学学报, 2019, 24(8): 94–101.
WANG Y Y, TANG L J, LI J, et al. Effect of Lactobacillus casei on the ileal mucosal structure and MUC2 content of rats with developmental diarrhea[J]. Journal of China Agricultural University, 2019, 24(8): 94–101. (in Chinese) |
| [23] |
朱春洋, 赵鲁卿, 赵静怡, 等. 四逆散对FD大鼠十二指肠杯状细胞及MUC2的影响[J]. 世界中医药, 2020, 15(11): 1575–1578, 1584.
ZHU C Y, ZHAO L Q, ZHAO J Y, et al. Effects of Sini powder on duodenum goblet cells and MUC2[J]. World Chinese Medicine, 2020, 15(11): 1575–1578, 1584. (in Chinese) |
| [24] | YANG Y T, ZHU R, BAI J Y, et al. Numb modulates intestinal epithelial cells toward goblet cell phenotype by inhibiting the Notch signaling pathway[J]. Exp Cell Res, 2011, 317(11): 1640–1648. |



