马腺疫是由马链球菌马亚种(S. equi)引起马属动物的急性接触性传染病,可引起2岁以下马匹发热、咽炎、头颈淋巴结肿大、化脓及流脓性鼻液,严重可造成马匹死亡[1-2]。该病是马属动物最常发的传染病之一,该病发病急,传播快,在世界范围内广泛流行,并已造成很大经济损失[3-4]。该病暴发后对有早期症状的病驹采用药物治疗有一定的疗效,但治疗完成后,马容易再次患病。此外,该菌产生耐药性的问题也变得日趋严重[5]。
疫苗是可有效预防和控制马腺疫的重要措施,但对其研究还不够成熟和完善。传统的灭活全菌疫苗或提取物疫苗因具有较低的免疫效果而不被看好,目前,国外使用较多的马腺疫疫苗主要有鼻腔接种的弱毒苗和肌内注射的蛋白亚单位苗。这两类疫苗虽有一定效果,但也存在着安全性差和免疫效力低等问题[6-7],因此,开发安全性好,免疫效果更佳的疫苗,可对有效防控该病提供技术支撑[8-9]。
S. equi的多抗原组成的亚单位疫苗可以弥补传统灭活疫苗和弱毒疫苗的不足和缺陷,且不涉及感染性病原菌,生产和应用较为安全,成为马腺疫疫苗发展的主要方向之一。SrtA为S.equi等多种革兰阳性菌表面的一种分选酶[10],可识别和酶解LPXTG基序,将表面蛋白锚定到细胞壁的肽聚糖上[11],以往对猪链球菌2型(Streptococcus suis serotype 2,SS2)、A群链球菌(group A streptococci,GAS)、单核细胞增生李斯特菌(Listeria monocytogenes,LM)等菌的研究已表明SrtA可影响病原菌对宿主细胞的黏附、识别和定植[12-14]。SeM可在S.equi的抗吞噬和黏附过程中发挥主要作用,且可参与该菌的免疫逃避[15]。EAG是一种IgG结合蛋白,参与该菌的黏附、抗调理吞噬及免疫逃避,Flock等[16]研究表明,用EAG免疫马驹,该抗原对马驹具有一定的免疫保护效果。
目前,已知EAG与CNE具有一定的相互协同作用。此外,Guss等[17]证明EAG、SclC和CNE蛋白联合免疫后可部分保护马驹抵抗S. equi的感染,最近的研究证明,以S. equi 7种不同蛋白免疫马驹,对驹的攻击保护率可达到85%,这表明多抗原亚单位疫苗具有发展的潜力,但这种由7种蛋白组成的疫苗存在生产成本过高的问题。有关EAG、SeM和SrtA蛋白联合免疫协同作用的研究未见报道,本研究在多层面和角度对这3种蛋白单独及联合免疫效果进行分析基础上,综合评价该亚单位疫苗组合的免疫效果。
1 材料与方法 1.1 实验动物及分组6~8周龄18~22 g雌性昆明小鼠购自乌鲁木齐市动物疾病预防控制中心,70只小鼠随机分为5组,每组14只,分别为SrtA免疫组、EAG免疫组、SeM免疫组、SeM+EAG+SrtA联合免疫组和PBS对照组。
1.2 菌株及主要试剂马链球菌马亚种ZZM-3株由新疆农业大学动物医学学院微生物实验室分离并保存;E. coli BL21(DE3)购自天根公司;大肠杆菌BL21由本室保存。E. coli BL21-pET-28a-SrtA、E. coli BL21-pGEX-4T-SeM、E. coli BL21-pET-28a-EAG由本实验室构建和保存。
DNA Marker、中分子量蛋白Marker购自TaKaRa公司,HRP-IgG和分型抗体IgG、弗氏完全及不完全佐剂购自Sigma公司,TMB显色液购自索莱宝科技有限公司。
1.3 SeM、EAG及SrtA的表达及纯化取E. coli BL21-pET-28a-SrtA、E. coli BL21-pGEX-4T-SeM、E. coli BL21-pET-28a-EAG表达菌株分别接种至含50 μg·mL-1的kan+LB培养液中37 ℃培养6 h至菌液OD600 nm值为0.6时,加入终浓度为1 mmol·L-1 IPTG诱导6 h,破碎菌体并收集上清,用亲和层析法进行纯化及测定蛋白浓度。
1.4 动物免疫将纯化的重组蛋白与弗氏佐剂以体积比1∶1混匀,共免疫两次,第一次免疫采用弗氏完全佐剂,第二次免疫抗原与弗氏不完全佐剂混合,免疫采取背部皮下注射,各免疫组小鼠的注射剂量为50 μg·只-1,首次免疫15 d后进行第二次免疫。首次免疫后0、14、35、45 d分别对小鼠尾静脉采血,收集血清保存于-20 ℃。
1.5 血清抗体效价及亚型的ELISA检测用SrtA、EAG和SeM各100 ng作包被抗原,50 mmol·L-1的碳酸盐作包被缓冲液(pH9.6) 溶解抗原,用3种重组蛋白(300 ng·孔-1)4 ℃过夜包被ELISA板,用间接ELISA法[16]分别对免疫小鼠抗体效价和亚型进行检测,将采集的小鼠血清作梯度稀释,以1∶10 000稀释的HRP山羊抗小鼠IgG为二抗,进行血清抗体效价测定。
IgG特异抗体分型采用方法同上,首次免疫后35 d小鼠血清以1∶300稀释作一抗,HRP标记山羊抗小鼠IgG1、IgG2a、IgG2b、IgG3 1∶6 000稀释作为二抗,进行抗体亚型的检测。
1.6 免疫保护试验第二次免疫后30 d,对免疫组及对照组小鼠攻毒,经腹腔注射马链球菌马亚种ZZM-3株,攻毒剂量为1 MLD (8.4×108CFU),连续观察12 d并记录小鼠精神状态、食欲、体重变化及死亡情况。
1.7 荷菌量测定及病理组织学观察攻毒后1 d,随机选取4个试验组和空白组小鼠各3只,取肝、脾、肺、肾组织研磨并梯度稀释后涂布培养,37 ℃培养后进行菌落计数。
攻毒后2 d,取免疫组及对照组小鼠各3只,取肝、脾、肺和肾组织用4%福尔马林固定,制作石蜡切片,进行HE染色,对病理组织变化进行观察。
1.8 q-RT PCR检测免疫相关基因的转录第二次免疫后7 d收集小鼠脾细胞,按照RNA提取说明书抽提各组组织总RNA。将重组质粒标准品稀释6个梯度,构建标准曲线。以各组织总RNA为模板,根据GenBank相关基因序列设计相关分子的引物(表 1),使用特异引物采用实时荧光定量RT-PCR扩增免疫相关基因IL-10、MHCⅠ、TCR、TLR2、TLR3、TLR4及RP105[18],检测用Quanti Tect RT-PCR kit (Qiagen)在BIO-RADiQ5荧光定量PCR仪上进行。
|
|
表 1 荧光定量PCR引物序列 Table 1 Primer sequence of the fluorescence quantitative PCR |
标准品和待测样品均设置2个复孔进行检测, 取其均值。反应体系: 2×RT-PCR master mix 25 μL, 上下游引物各0.4 μmol·mL-1, Taqman探针0.2 μmol·mL-1, RT mix 0.5 μL,RNA样品和标准品10 μL,加nuclease-free water补至50 μL。反应条件:95 ℃预变性3 min;然后95 ℃ 150 s;60 ℃ 30 s,40个循环。熔解曲线参数:55~95 ℃,每10 s上升0.5 ℃。然后进行定量分析。β-actin作为内参基因用来标定每个样品的相对表达水平的差异,PBS作为对照组,采用2-ΔΔCt法分析免疫相关基因的相对表达水平[18]。
1.9 数据分析采用SPSS 19.0软件对数据进行单因素方差统计学分析。
2 结果 2.1 重组蛋白的表达及纯化将3种不同的重组菌BL21-pET-28a-SrtA、BL21-pGEX-4T-SeM、BL21-pET-28a-EAG诱导表达后纯化,将获得的纯化蛋白进行SDS-PAGE电泳,结果在24、64和27 ku分别出现明显的目的条带,与预期目的蛋白大小相符,表明成功表达、纯化到EAG、SeM和SrtA重组蛋白(图 1A~C)。
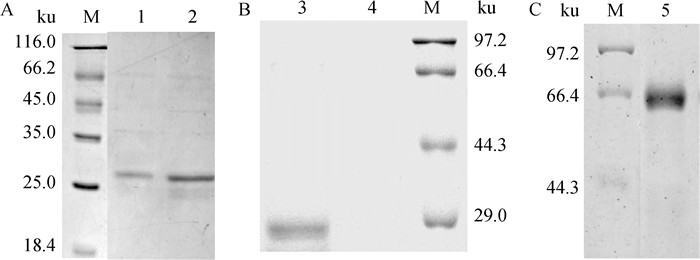
|
A. SrtA的表达及纯化; B. EAG的表达及纯化; C. SeM的表达及纯化; M. 蛋白质相对分子质量标准; 1~2. pET-28a-SrtA重组菌纯化后蛋白; 3. pET-28a-EAG重组菌纯化后蛋白; 4. pET-28a空载体诱导后的蛋白; 5. pGEX-4T-SeM重组菌纯化后的蛋白 A. Expression and purification of SrtA; B. Expression and purification of EAG; C. Expression and purification of SeM; M. Protein molecular weight marker; 1-2. Purified SrtA recombinant protein; 3. Purified SrtA recombinant protein; 4. pET-28a empty vetor; 5. Purified SeM recombinant protein 图 1 重组蛋白的表达、纯化 Fig. 1 The expression and purification of recombinant proteins |
用3种不同抗原蛋白免疫小鼠,首次免疫后35 d的抗体效价结果表明,免疫后可引起良好的抗体反应,各免疫组抗体效价均可达到1∶72 900,显著高于对照组,且3种蛋白联合免疫组抗体效价高于各重组蛋白单独免疫组(图 2)。

|
图 2 免疫小鼠血清抗体效价检测 Fig. 2 Specific serum antibody titers in immunized mice |
对IgG亚型的检测结果如图 3所示,3种抗原蛋白免疫后诱导的抗体亚型以IgG1和IgG2b为主,且联合免疫组诱导的特异性IgG1和IgG2b抗体水平高于SeM、EAG与SrtA免疫组。
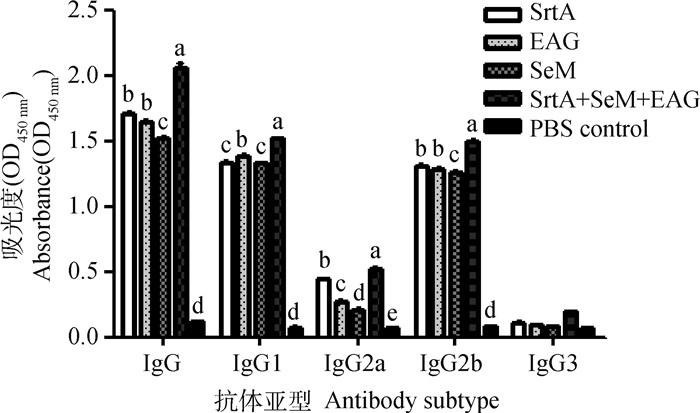
|
不同字母表示组间同种抗体亚型差异显著(P < 0.05) Different letters indicate significant differences of subtype detection among different groups(P < 0.05) 图 3 免疫小鼠血清抗体亚型检测 Fig. 3 Antibody subtype detection in immunized mice |
采集的第二次免疫后10 d各免疫组小鼠脾细胞,采用荧光定量RT-PCR方法对免疫相关基因进行检测。SrtA免疫组MHC Ⅰ、TCR、TLR2、TLR3及TLR4的表达水平高于EAG和SeM免疫组,EAG免疫组诱导的IL-10水平最高,联合免疫组MHC Ⅰ、RP105及TLR3的表达水平高于其他免疫组及对照组(图 4)。

|
A. IL-10; B. MHC Ⅰ; C. RP105; D. TCR; E. TLR2; F. TLR3; G. TLR4; 不同字母表示组间差异显著(P < 0.05) A. IL-10; B. MHC Ⅰ; C. RP105; D. TCR; E. TLR2; F. TLR3; G. TLR4; Different letters indicate significant differences among groups(P < 0.05) 图 4 荧光定量PCR检测免疫相关基因的相对转录水平 Fig. 4 The relative transcription level detection of immune related genes by fluorescence quantitative PCR |
首免后42 d对所有免疫组及对照组小鼠攻毒,腹腔注射1 MLD的S.equi ZZM-3菌株。结果显示PBS对照组小鼠在攻毒后3 d内全部死亡, EAG+SeM+SrtA联合免疫组存活率为87.5%,显著高于3种蛋白免疫组及对照组(图 5A)。各组小鼠体重在攻毒后4~5 d降低,免疫组体重在攻毒后5~6 d开始回升,除SeM免疫组和PBS对照组外各免疫组体重变化幅度较小,除PBS对照组外,各免疫组小鼠体重在攻毒后5 d恢复至正常(图 5B)。
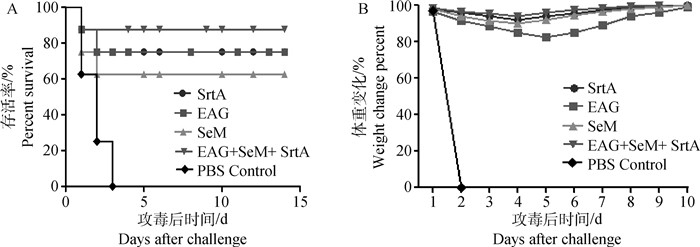
|
图 5 小鼠的攻毒保护率(A)和攻毒后的体重变化(B) Fig. 5 The protection rate and body weight change in immunized mice after challenge |
攻毒后1 d,各免疫组及对照组小鼠肝、脾、肺、肾荷菌量的检测结果显示(图 6),与对照组相比,3种蛋白单独免疫组及联合免疫组各脏器荷菌量低于PBS对照组(P < 0.05)。
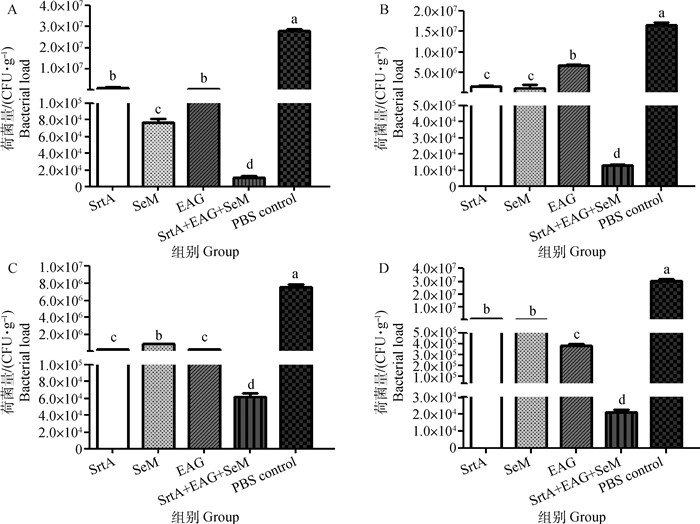
|
A.肝;B.脾;C.肺;D.肾。不同字母表示组间差异显著(P < 0.05) A. Liver; B. Spleen; C. Lung; D. Kidney. Different letters indicate significant differences among groups(P < 0.05) 图 6 攻毒后小鼠各脏器荷菌量检测 Fig. 6 The bacterial load of mice organs after challenge |
攻毒后2 d,分别取各试验组小鼠肝、脾、肺、肾进行病理组织学观察。
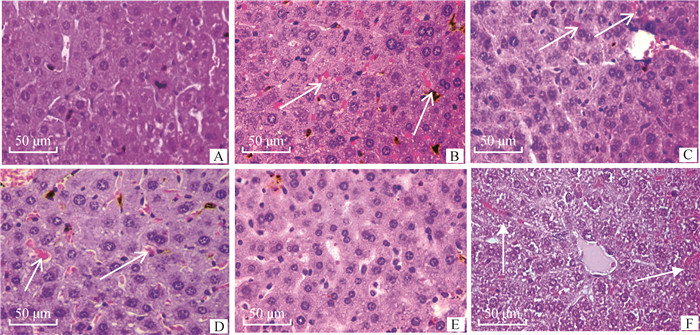
2.6.1 肝病理变化 肝病理组织学观察如图 7所示,攻毒后2 d免疫组小鼠肝组织可见明显出血,炎性细胞浸润等肝病理损伤有不同程度改善(图B、C和D);3种蛋白联合免疫组病理损伤最小(图E)。
|
A.健康对照组; B. EAG组; C. SeM组; D. SrtA组; E. EAG+SeM+SrtA组; F. PBS组。箭头指示脏器出血明显 A. Healthy control group; B. EAG group; C. SeM group; D. SrtA; E. EAG+SeM+SrtA group; F. PBS group. The arrow indicates obvious bleeding and inflammatory exudation 图 7 小鼠肝主要病理组织学变化(HE染色) Fig. 7 Histopathological changes of liver in mice(HE staining) |
2.6.2 脾病理变化 脾病理组织学观察如图 8所示,攻毒后2 d免疫组小鼠可见脾出血,炎性细胞增多(图B、C和D),3种蛋白免疫组小鼠脾出血较少,联合免疫组的脾病变最小(图E)。

|
A. 健康对照组; B. EAG组; C. SeM组; D. SrtA组; E. EAG+SeM+SrtA组; F. PBS组。箭头指示脏器出血明显 A. Healthy control group; B. EAG group; C. SeM group; D. SrtA; E. EAG+SeM+SrtA group; F. PBS group. The arrow indicates obvious bleeding and inflammatory exudation 图 8 小鼠脾主要病理组织学变化(HE染色) Fig. 8 Histopathological changes of spleen in mice(HE staining) |
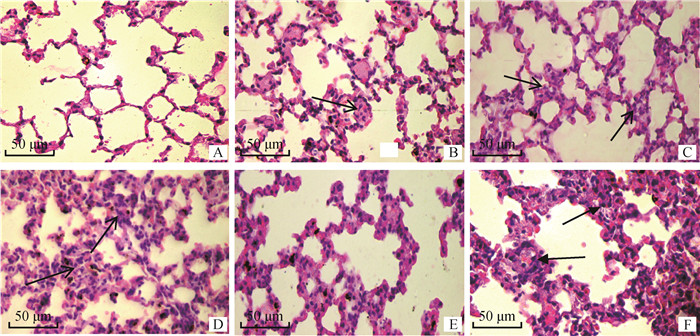
2.6.3 肺病理变化 肺病理组织学观察如图 9所示,攻毒后2 d PBS对照组小鼠可见肺间质增宽、断裂,炎性细胞浸润,各免疫组小鼠肺病理损伤有减轻(图 9B~D),联合免疫组肺病理损伤明显减轻(图 9E)。
|
A. 健康对照组; B. EAG组; C. SeM组; D. SrtA组; E. EAG+SeM+SrtA组; F. PBS组。箭头指示肺间隔增大明显,炎性细胞渗出 A. Healthy control group; B. EAG group; C. SeM group; D. SrtA; E. EAG+SeM+SrtA group; F. PBS group. The arrow indicates that the pulmonary septum is enlarged and inflammatory cells exudate 图 9 小鼠肺主要病理组织学变化(HE染色) Fig. 9 Histopathological changes of lung in mice(HE staining) |
2.6.4 肾病理变化 肾病理组织学观察如图 10所示,攻毒后各重组蛋白免疫组对该菌引起的小鼠肾间质充血,肾小管上皮细胞坏死脱落,肾小球嚢腔肿胀变大,空泡变性等病理损伤有明显改善,3种蛋白联合免疫组肾病理损伤最小。

|
A. 健康对照组; B. EAG组; C. SeM组; D. SrtA组; E. EAG+SeM+SrtA组; F. PBS组。箭头指示脏器出血明显 A. Healthy control group; B. EAG group; C. SeM group; D. SrtA; E. EAG+SeM+SrtA group; F. PBS group. The arrow indicates obvious bleeding and inflammatory exudation 图 10 小鼠肾主要病理组织学变化(HE染色) Fig. 10 Histopathological changes of kidney in mice(HE staining) |
马腺疫俗称“槽结”,高度传染马、骡和驴等马属动物,受到国内外的普遍重视[14]。因马腺疫弱毒菌苗和灭活菌苗在免疫效果、安全性和价格方面还存在安全隐患、交叉保护性差等问题,迫切需要研制新型、高效、安全、价廉的疫苗。
S. equi毒力因子众多,近年来随着对细菌基因组及亚单位结构的深入了解,研制多价亚单位疫苗已成为可能。当前对亚单位疫苗的研究已显示出良好的发展潜力[6, 8],研究证明EAG、SclC及CNE免疫可以提供部分保护力[19-21]。类M蛋白(SeM)可抵抗吞噬细胞对该菌的吞噬作用,诱发高度保护性调理抗体[22-23]。EAG为该菌表面可与IgG结合的毒力蛋白,可参与该菌的黏附、吞噬调理和免疫逃避[24]。本研究选择了这两种蛋白作为抗原组成成分,结果表明这两种免疫原在免疫保护力和诱发抗体方面可以显示出较佳的效果。
除了SeM和EAG外,本研究中还选择分选酶SrtA作为抗原成分之一。该酶是存在于多种革兰阳性菌表面的转肽酶,保守性好,主要参与该类病原菌的致病和黏附过程[25],目前被认为是非常有潜力的新型抗菌靶标。有关SrtA的研究国外主要集中在金黄色葡萄球菌[14],国内对该酶相关的研究较少,且主要集中在SrtA抑制剂的筛选方面[25]。Fan等[26]对A群链球菌的研究表明SrtA经黏膜免疫小鼠可诱导Th17介导的细胞免疫,对A群链球菌的交叉保护具有重要价值。Chen等[27]将A群链球菌SrtA与该菌毒力因子SCPA联合免疫小鼠,攻毒后存活率较每种蛋白单独免疫高,且能有效清除该菌的感染。为进一步探索具有Th17型细胞免疫诱导能力SrtA的联合免疫效果,本研究中将S. equi的SrtA与保护性抗原EAG与SeM的联合免疫小鼠,综合分析证明该种免疫原可以与其他抗原联合对S.equi感染产生良好的免疫保护效果。
SrtA与S. equi毒力因子SeM和EAG联合免疫小鼠,攻毒后组织荷菌量和免疫保护率得到显著改善,3种蛋白联合免疫较单独免疫可显著降低S. equi在肺、肝、脾及肾的定植及减轻这些组织的病理损伤,优于于每种蛋白单独免疫。这些结果表明这3种蛋白抗原在免疫效果和保护力方面可以发挥免疫协同作用。
此外,本研究还发现这3种抗原蛋白在诱导免疫相关分子的表达方面也显示出优势。以往研究表明MHCⅠ类分子可递呈内源性抗原肽,还可通过充当NK细胞和某些T细胞表面受体的配体,参与天然免疫应答过程[28]。本研究结果表明,SrtA蛋白单独免疫可诱导MHCⅠ的表达,在联合免疫中也表现出该诱导作用,推测SrtA可能通过MHCⅠ参与及诱导天然免疫。T细胞受体(T cell receptor,TCR)是一种重要的信号转导分子,在免疫应答过程中发挥着重要的靶向性作用[29]。本研究结果表明,SrtA分子单独免疫可有效诱导TCR的表达,3种蛋白的联合免疫结果也表明,SrtA可在联合免疫过程中发挥对细胞免疫的诱导作用。
Toll样受体(Toll-like receptors,TLRs)是一类跨膜糖蛋白模式识别受体,可在机体抵御病原菌的入侵中发挥重要作用[30]。Lecours等[31]发现猪链球菌感染猪树突状细胞后,TLR2和TLR6的表达表现上调,而TLR1和TLR4的表达水平没有变化,提示了TLRS可能参与猪链球菌感染宿主细胞后炎症反应的发生。Rönnberg等[32]用S. equi攻击TLR2缺失小鼠,发现TLR2相关细胞因子的表达水平显著下降,证明了S. equi可诱导细胞分泌细胞因子,可能与TLR2信号通路有关。国内杜润慈等[33]的研究证明S. equi在感染后24 h,能显著上调RAW264.7细胞TLR1、TLR2及TLR6 mRNA的表达。本研究结果表明,SrtA可诱导脾淋巴细胞中TLR2、TLR3及TLR4的转录,推测其在S. equi感染过程中是一个重要的免疫信号调节分子。
IL-10是Th2细胞分泌的一种抗炎细胞因子,参与炎症抑制反应,还可刺激抗体的产生。杜润慈等[34]的研究发现,S. equi感染小鼠后IL-10的mRNA水平显著升高。但这种诱导效果具体由该菌的哪些分子引起的还不明确。本研究结果表明,EAG免疫组IL-10表达水平显著升高,且明显高于其他2种蛋白和,该结果表明,S.equi的EAG蛋白在感染过程中可以发挥重要的抗炎作用。
Guss等[17]用S. equi的7种不同抗原蛋白免疫马驹并攻毒,证明这7种蛋白联合免疫保护率得到有效的提高,但这种多价亚单位疫苗仍存在着生产成本高的问题。本研究选择了EAG、SeM及SrtA3种抗原免疫小鼠模型并攻毒,取得了良好的免疫效果。除了EAG外,本研究所选择的免疫原与Guss等选择的免疫原均不同,且免疫原数量少,有助于解决亚单位疫苗抗原成分过多生产成本过高的问题,未来还需要继续开展本动物免疫试验进行进一步的验证。
4 结论采用3种不同抗原蛋白EAG、SeM及SrtA单独及联合免疫小鼠,有效诱导了免疫应答的产生,其中抗体亚型以IgG1和IgG2b为主,与单个抗原免疫相比,3种抗原蛋白联合免疫可显著降低S. equi在各脏器中的定植及对小鼠产生有效的攻毒保护。该结果可为马腺疫亚单位疫苗的研究提供一定的数据参考。此外本研究还探索了抗原分子免疫对免疫分子表达水平的影响。
| [1] | SWEENEY C R. Strangles: Streptococcus equi, infection in horses[J]. Equine Vet Educ, 2010, 8(6): 317–322. |
| [2] | BOYLE A G, RANKIN S C, DUFE L, et al. Streptococcus equi detection polymerase chain reaction assay for equine nasopharyngeal and guttural pouch wash samples[J]. Vet Intern Med, 2016, 30(1): 276–281. DOI: 10.1111/jvim.13808 |
| [3] | CHANTER N, TALBOT N C, NEWTON J R, et al. Streptococcus equi with truncated M-proteins isolated from outwardly healthy horses [J]. Microbiology, 2000, 146(6): 1361–1369. DOI: 10.1099/00221287-146-6-1361 |
| [4] | BOYLE A G, STEFANOVSKI D, RANKIN S C. Comparison of nasopharyngeal and guttural pouch specimens to determine the optimal sampling site to detect Streptococcus equi subsp equi carriers by DNA amplification[J]. Bmc Vet Res, 2017, 13(1): 75. DOI: 10.1186/s12917-017-0989-4 |
| [5] | BOYLE A G, TIMONEY J F, NEWTON J R, et al. Streptococcus equi infections in horses: guidelines for treatment, control, and prevention of strangles—revised consensus statement [J]. J Vet Intern Med, 2018, 32(2): 633–647. DOI: 10.1111/jvim.15043 |
| [6] | WALLER A S. New perspectives for the diagnosis, control, treatment, and prevention of strangles in horses [J]. Vet Clin North Am Equine Pract, 2014, 30(3): 591–607. DOI: 10.1016/j.cveq.2014.08.007 |
| [7] | JACOBS A A, GOOVAERTS D, NUIJTEN P J, et al. Investigations towards an efficacious and safe strangles vaccine: submucosal vaccination with a live attenuated Streptococcus equi[J]. Vet Rec, 2000, 147(20): 563–567. DOI: 10.1136/vr.147.20.563 |
| [8] |
刘建柱, 谢宁, 刘永夏. 马腺疫的研究进展[J]. 兽医导刊, 2018(5): 20–21.
LIU J Z, XIE N, LIU Y X. Research progress of equine adenosis[J]. Veterinary Orientation, 2018(5): 20–21. (in Chinese) |
| [9] |
赵亚南, 杨康, 张宝江, 等. 马流产沙门菌鞭毛蛋白FliC对马腺疫链球菌SeM蛋白免疫效应分析[J]. 畜牧兽医学报, 2018, 49(5): 1020–1026.
ZHAO Y N, YANG K, ZHANG B J, et al. Immune efficacy analysis of flagellin protein fliC of salmonella abortus equi on SeM of Streptococcus equi subsp. equi[J]. Acta Veterinaria et Zootechnica Sciences, 2018, 49(5): 1020–1026. (in Chinese) |
| [10] | MAZMANIAN S K, LIU G, TON-THAT H, et al. Staphylococcus aureus sortase, an enzyme that anchors surface proteins to the cell wall[J]. Science, 1999, 285(5428): 760–763. DOI: 10.1126/science.285.5428.760 |
| [11] |
罗正, 刘若尘, 郑世军. 单核增生性李氏杆菌溶血素的原核表达及其单克隆抗体的制备[J]. 生物工程学报, 2009, 25(11): 1652–1657.
LUO Z, LIU R C, ZHEN S J. Prokaryotic expression of Listeria monocytogene (LM) hly and development of monoclonal antibodies against listeriolysin O (LLO)[J]. Chinese Journal of Biotechnology, 2009, 25(11): 1652–1657. DOI: 10.3321/j.issn:1000-3061.2009.11.009 (in Chinese) |
| [12] |
吴涛, 常海涛, 谭臣, 等. 猪链球菌2型SrtA基因缺失菌株的构建及生物学特性[J]. 中国兽医学报, 2009, 29(10): 1293–1298.
WU T, CHANG H T, TAN C, et al. Construction and characteristic of srtA gene mutant strain of Streptococcus suis 2[J]. Chinese Journal of Veterinary Science, 2009, 29(10): 1293–1298. (in Chinese) |
| [13] | FROST H R, SANDERSON-SMITH M, WALKER M, et al. Group A streptococcal M-Like proteins: from pathogenesis to vaccine potential[J]. FEMS Microbiol Rev, 2017, 42(2): 193–204. |
| [14] | TON-THAT H, MAZMANIAN S K, FAULL K F, et al. Anchoring of surface proteins to the cell wall of Staphylococcus aureus. Sortase catalyzed in vitro transpeptidation reaction using LPXTG peptide and NH2-Gly3 substrates[J]. J Biol Chem, 2000, 275(13): 9876–9881. DOI: 10.1074/jbc.275.13.9876 |
| [15] |
刘云涛, 王彩蝶, 夏利宁, 等. 马链球菌马亚种新疆株SeM基因的克隆及序列差异分析[J]. 西北农业学报, 2015, 24(3): 14–19.
LIU Y T, WANG C D, XIA L N, et al. Cloning and sequence difference analysis of the SeM gene of Streptococcus equi subsp. equi isolated in xinjiang[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2015, 24(3): 14–19. (in Chinese) |
| [16] | FLOCK M, JACOBSSON K, FRYKBERG L, et al. Recombinant Streptococcus equi proteins protect mice in challenge experiments and induce immune response in horses[J]. Infect Immun, 2004, 72(6): 3228–3236. DOI: 10.1128/IAI.72.6.3228-3236.2004 |
| [17] | GUSS B, FLOCK M, FRYKBERG L, et al. Getting to grips with strangles: an effective multi-component recombinant vaccine for the protection of horses from Streptococcus equi infection[J/OL]. PLoS Pathog, 2009, 5(9): e1000584.[2021-01-01]. https://journals.plos.org/plospathogens/article?id=10.1371/journal.ppat.1000584. |
| [18] | LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402–408. DOI: 10.1006/meth.2001.1262 |
| [19] | KARLSTRÖM A, JACOBSSON K, FLOCK M, et al. Identification of a novel collagen-like protein, SclC, in Streptococcus equi using signal sequence phage display[J]. Vet Microbiol, 2004, 104(3-4): 179–188. DOI: 10.1016/j.vetmic.2004.09.014 |
| [20] | LANNERGÅRD J, FRYKBERG L, GUSS B. CNE, a collagen-binding protein of Streptococcus equi[J]. FEMS Microbiol Lett, 2003, 222(1): 69–74. DOI: 10.1016/S0378-1097(03)00222-2 |
| [21] |
邵俊高, 姜慧娇, 常建新, 等. 马链球菌马亚种IgG结合蛋白的原核表达和免疫原性[J]. 生物工程学报, 2016, 32(5): 577–583.
SHAO J G, JIANG H J, CHANG J X, et al. Prokaryotic expression and immunogenicity of IgG-binding protein of Streptococcus equi subspecies equi[J]. Chinese Journal of Biotechnology, 2016, 32(5): 577–583. (in Chinese) |
| [22] | JEAN-FRANÇOIS M J, POSKITT D C, TURNBULL S J, et al. Protection against Streptococcus equi infection by monoclonal antibodies against an M-like protein[J]. J Gen Microbiol, 1991, 137(9): 2125–2133. DOI: 10.1099/00221287-137-9-2125 |
| [23] |
邵俊高, 李善春, 苏艳. 马链球菌马亚种新疆分离株XZ 1 SeM蛋白表达和免疫原性分析[J]. 新疆农业大学学报, 2015, 38(4): 287–291.
SHAO J G, LI S C, SU Y. Expression and analysis on immunogenicity of SeM protein of streptococcus equi subspecies equi XZ1 strain from Xinjiang[J]. Journal of Xinjiang Agricultural University, 2015, 38(4): 287–291. (in Chinese) |
| [24] | VALENTIN-WEIGAND P, TRAORE M Y, BLOBEL H, et al. Role of α2-macroglobulin in phagocytosis of group A and C streptococci[J]. FEMS Microbiol Lett, 1990, 70(3): 321–324. |
| [25] | ZHUANG P L, YU L X, TAO Y, et al. Effects of missense mutations in sortase A gene on enzyme activity in Streptococcus mutants[J/OL]. BMC Oral Health, 2016, 16(1): 47.[2021-01-01]. https://bmcoralhealth.biomedcentral.com/articles/10.1186/s12903-016-0204-1. |
| [26] | FAN X, WANG X, LI N, et al. Sortase A induces Th17-mediated and antibody-independent immunity to heterologous serotypes of group A Streptococci[J/OL]. PLoS One, 2014, 9(9): e107638.[2021-01-01]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0107638. |
| [27] | CHEN X, LI N, BI S, et al. Co-activation of Th17 and antibody responses provides efficient protection against mucosal infection by group A Streptococcus[J/OL]. PLoS One, 2016, 11(12): e0168861.[2021-01-01]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0168861. |
| [28] |
范丽安, 周光炎. 人类基因组MHC测序及其免疫学意义[J]. 上海免疫学杂志, 1999, 19(6): 321–333.
FAN L A, ZHOU G Y. The immunological significance about the MHC sequencing of human genome[J]. Shanghai Journal of Immunology, 1999, 19(6): 321–333. (in Chinese) |
| [29] | GOVERS C, SEBESTYÉN Z, ROSZIK J, et al. TCRs genetically linked to CD28 and CD3ε do not mispair with endogenous TCR chains and mediate enhanced T cell persistence and anti-melanoma activity[J]. J Immunol, 2014, 193(10): 5315–5326. DOI: 10.4049/jimmunol.1302074 |
| [30] | SZATMARY Z. Molecular biology of toll-like receptors[J]. Gen Physiol Biophys, 2012, 31(4): 357–366. DOI: 10.4149/gpb_2012_048 |
| [31] | LECOURS M P, SEGURA M, LACHANCE C, et al. Characterization of porcine dendritic cell response to Streptococcus suis[J/OL]. Vet Res, 2011, 42(1): 72.[2021-01-01]. https://veterinaryresearch.biome-dcentral.com/articles/10.1186/1297-9716-42-72. |
| [32] | RÖNNBERG E, GUSS B, PEJLER G. Infection of mast cells with live Streptococci causes a Toll-like receptor 2- and cell-cell contact-dependent cytokine and chemokine response[J]. Infect Immun, 2010, 78(2): 854–864. DOI: 10.1128/IAI.01004-09 |
| [33] |
杜润慈, 刘建华, 史茜, 等. TLRS介导的信号通路在马链球菌感染RAW264.7细胞中的作用[J]. 中国畜牧兽医, 2016, 43(5): 1270–1276.
DU R C, LIU J H, SHI Q, et al. Effect of TLRs mediated signal pathway on Streptococcus equi infection in RAW264.7 Cells[J]. Chinese Animal Husbandary & Veterinary Medicine, 2016, 43(5): 1270–1276. (in Chinese) |
| [34] |
杜润慈, 冉多良, 李静, 等. 马链球菌对树突状细胞Toll样受体和MyD88及细胞因子mRNA表达的影响[J]. 动物医学进展, 2016, 37(10): 16–20.
DU R C, RAN D L, LI J, et al. Effects of Streptococcus equi on mRNA expressions of TLR1, TLR2, TLR6, MyD88 and cytokines in dendritic dells[J]. Progress in Veterinary Medicine, 2016, 37(10): 16–20. (in Chinese) |



