挥发性脂肪酸(VFA)是反刍动物日粮中碳水化合物在瘤胃微生物发酵下产生的可利用终产物。VFA是反刍动物重要的能源物质,它不仅参与动物体脂和乳成分的合成,还对维持瘤胃内环境稳态具有重要作用[1-2]。因此,瘤胃内VFA的产生及其吸收对于反刍动物来说尤为重要。早期的研究认为,VFA主要通过瘤胃壁扩散吸收,并证明了VFA的吸收速率与瘤胃pH有关。随着研究的深入,研究者对VFA在瘤胃上皮吸收的认识不断提高,发现VFA只有在非解离状态下才可以通过细胞脂质分子层进行扩散,随着pH降低,非解离态VFA比例增加,才能提高VFA通过瘤胃上皮自由扩散的速度。因此,通过扩散吸收的VFA是很有限的[3]。目前,研究者认为,瘤胃上皮对VFA吸收不仅依靠扩散作用,还存在一系列依赖载体促进吸收的转运途径。瘤胃作为VFA吸收的主要场所,通过复层鳞状瘤胃上皮对VFA的吸收转运及适应性调节发挥重要作用[4]。复层瘤胃上皮由可以代谢VFA生成酮体的基底层和棘状层、具有渗透屏障作用的颗粒层以及在瘤胃内环境与上皮细胞层间起物理保护作用的角质层4层细胞组成。细胞层间的蛋白载体是瘤胃上皮细胞对VFA吸收的主要介质,包括位于瘤胃上皮颗粒层顶膜的阴离子交换蛋白(AE)以及位于瘤胃上皮基底层的单羧酸转运蛋白(MCT)、钠氢离子交换蛋白亚型1(NHE1)、假定阴离子转运蛋白1(PAT1)[5]。
亚急性瘤胃酸中毒(SARA)是奶牛饲养过程中常见的营养代谢疾病[6]。高精料饲喂反刍动物导致瘤胃长时间pH降低,引发SARA[7]。低pH破坏瘤胃内环境,释放大量游离脂多糖。在瘤胃低pH环境下,脂多糖(LPS)易位引起机体免疫反应[8]。在LPS诱导的牛炎症模型中,瘤胃pH下降,VFA积累[9]。静脉注射LPS引起牛血液中细胞因子、急性期蛋白和激素等增加,这些物质共同组成机体炎症免疫应答[10]。本课题组前期体内研究发现,机体发生炎症反应时瘤胃中VFA吸收受到抑制,为研究相关机制,采用瘤胃上皮细胞作为研究对象,设计各种单一炎症因子处理组,以期找到导致VFA吸收受阻的物质基础。而白细胞介素10(IL-10)由LPS刺激巨噬细胞和自然杀伤细胞产生,释放进入血液循环[11]。在生理状态下,IL-10由多种细胞分泌产生,例如单核细胞、巨噬细胞、T细胞、B细胞、自然杀伤细胞等。在正常情况下,机体内IL-10含量极低。当机体处于应激状态下,IL-10含量明显增加。IL-10作为抗炎因子,在先天性免疫中发挥着重要作用。在奶牛静脉注射LPS引起的免疫应答中,奶牛血液IL-10含量增加[12]。细胞因子IL-10是否影响瘤胃上皮细胞VFA吸收尚不清楚。
为探索牛发生SARA时,IL-10对瘤胃上皮细胞VFA吸收相关基因的影响。本研究以牛瘤胃上皮细胞作为研究对象,体外培养瘤胃原代细胞,建立瘤胃上皮模型,模拟SARA酸性条件,研究IL-10刺激瘤胃上皮细胞对其VFA吸收相关蛋白基因表达的影响。
1 材料与方法 1.1 主要试剂DMEM/F12培养基(BI,01-172-1ACS);2.5 g·L-1胰蛋白酶-EDTA(BI, 03-050-1B);新生胎牛血清(GIBCO,16000044);青链霉素(BI, 030311B);D-Hanks溶液(Solarbio,H1045);IL-10(Peprotech, 210-10-2);CCK-8试剂盒(日本同仁,CK04);牛β-羟丁酸(β-HB)酶联免疫分析试剂盒(江莱生物,JL12238);细胞总RNA提取试剂盒(TaKaRa,9109);反转录试剂盒(TaKaRa,RR047A);SYBRⓇ Green定量试剂盒(TaKaRa,RR820A)。
1.2 细胞的原代分离与培养成年安格斯牛屠宰后,取瘤胃腹囊侧的上皮组织,用含5倍青链霉素的D-Hanks溶液冲洗多次,去除瘤胃内容物,将冲洗完的瘤胃上皮组织放入用4 ℃预冷的含5倍青链霉素的D-Hanks溶液中,立即带回实验室超净台工作。在培养皿中将瘤胃组织剪成1 mm×1 mm×1 mm左右的均匀小块,用5倍青链霉素的D-Hanks溶液清洗5次直至无血球为止。在离心管中加入消化液(2.5 g·L-1胰蛋白酶+0.2 g·L-1 EDTA),混合均匀后放入37 ℃水浴锅中消化20 min,每隔5 min摇匀一次,用细胞筛过滤,收集的消化液加入等体积含100 g·L-1胎牛血清的DMEM/F12培养基以终止酶的消化。重复4~6次,用D-Hanks缓冲液洗涤两次细胞悬液,最后收集的细胞悬液用70 μm的滤膜进行过滤,合并各管细胞滤液,400 g离心8 min,弃上清液,收集细胞。细胞再悬浮,密度调节为1×106个·mL-1。分装在10个左右的培养瓶中。置于50 mL·L-1CO2,37 ℃,90%~95%湿度的培养箱中培养。每隔24 h更换新的完全培养液继续培养,倒置显微镜下观察瘤胃上皮细胞形态及生长情况。
1.3 CCK-8试剂盒法选择VFA浓度收集对数生长期的牛瘤胃上皮细胞,用DMEM/F12培养基将细胞密度调节为1× 106个·mL-1,按照每孔3 000个接种于96孔板中(Corning,TCP011096),至细胞生长达到90%时,加入不同浓度(0、13.2、66、132 mol·L-1)的VFA处理12 h,用CCK-8法测定OD450 nm值,每组取3个平行样本的平均值。
1.4 CCK-8试剂盒法选择IL-10浓度在处于对数生长期的细胞中加入适量的2.5 g·L-1胰蛋白酶+0.2 g·L-1EDTA从而起到消化的作用,然后按照每孔3 000个将细胞接种于96孔板中,放置于CO2培养箱中,至细胞生长达到90%时去除上清液,然后设置每组IL-10的浓度分别为0、0.1、1、10、50、100 ng·mL-1,每一浓度3个孔。放置于培养箱中12 h后,将96孔板中200 μL培养基吸弃,每孔加入100 μL完全培养基;然后每孔加入10 μL CCK-8试剂(避光操作且不能在孔中形成气泡),培养箱中孵育1 h;用酶标仪测定OD450 nm值,每组取3个平行样本的平均值。
1.5 细胞处理本试验设5组,分别为pH7.2(空白组)、pH7.2+ VFA、pH7.2+VFA+IL-10、pH5.5+VFA、pH5.5+ VFA+IL-10。取对数生长期细胞接种到6孔板,至细胞生长达到90%时,用含VFA的培养基诱导3 h,然后分别换液继续培养12 h,收集培养基和提取细胞RNA。每个试验处理设3个重复。
1.6 RNA的提取和实时荧光定量PCR总RNA是根据制造商的指示使用Trizol(TaKaRa,9109)提取的。用微量分光光度计检测RNA浓度。用反转录试剂盒(TaKaRa, RR047A)将RNA反向转录成cDNA。试验条件为:95 ℃ 3 min;95 ℃ 15 s;60 ℃ 1 min,40个循环。基因引物如表 1所示。
|
|
表 1 real-time PCR引物信息 Table 1 Primer sequence of real-time PCR |
用PBS稀释细胞悬液,使细胞密度达到1×106个·mL-1左右。通过反复冻融使细胞破坏并放出细胞内成份。离心20 min左右,收集上清。设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;分别设空白孔、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL(样品最终稀释度为5倍)。将样品加于酶标板孔底部,每孔加入酶标试剂100 μL,空白孔除外。用封板膜封板后置37 ℃温育60 min。将20倍浓缩洗涤液用蒸馏水稀释20倍后备用。小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干。每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻震荡混匀,37 ℃避光显色15 min。每孔加终止液50 μL,终止反应。以空白孔调零,测定OD450 nm值。
1.8 统计分析使用SPSS Statistics V23.0统计学软件对试验结果数据进行单因素ANOVA检验,本试验中所有数值均采用“平均值±标准误(mean ± S.E.)”表示,以P < 0.05为差异显著性判断标准。
2 结果 2.1 牛瘤胃上皮细胞分离培养的细胞形态如图 1所示,细胞贴壁后24~72 h形态变化与前人分离培养的牛瘤胃上皮细胞形态一致,且经角蛋白18(CK18)免疫荧光染色和β-羟丁酸分泌物检测证明其为瘤胃上皮细胞,可开展后续试验。

|
图 1 牛瘤胃上皮细胞(BRECs) 接种24~72 h形态变化(100×) Fig. 1 Morphological changes of bovine rumen epithelial cells (BRECs) after 24-72 h inoculation(100×) |
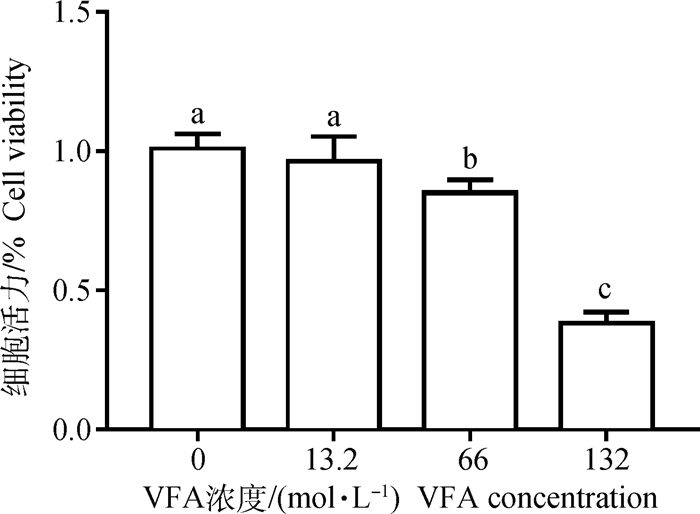
由图 2可知,用不同浓度VFA(0、13.2、66、132 mol·L-1)处理瘤胃上皮细胞12 h后,66和132 mol·L-1 VFA对瘤胃上皮细胞的增殖有明显的抑制作用(P < 0.05),而用13.2 mol·L-1VFA作用12 h后对瘤胃上皮细胞的增殖无明显的抑制作用(P>0.05)。因此选择13.2 mol·L-1VFA作为后续细胞处理的浓度。
|
图中小写字母完全不同者为差异显著P < 0.05,下同 The different lowercase letters indicate significant difference (P < 0.05), the same as below 图 2 不同浓度VFA对瘤胃上皮细胞活性的影响 Fig. 2 Effects of VFA at different concentrations on the activity of rumen epithelial cells |
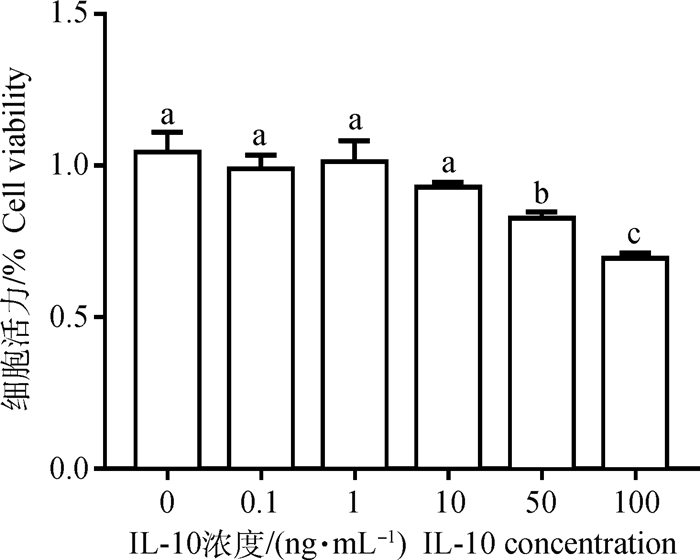
由图 3可知,用不同浓度IL-10(0、0.1、1、10、50、100 ng·mL-1)处理瘤胃上皮细胞12 h后,50和100 ng·mL-1IL-10对瘤胃上皮细胞的活力有明显的抑制作用(P < 0.05),但是出于细胞耐受性及致炎效果考虑,选择50 ng·mL-1 IL-10作为后续细胞处理的浓度。
|
图 3 不同浓度IL-10对瘤胃上皮细胞活性的影响 Fig. 3 Effects of IL-10 at different concentrations on the activity of rumen epithelial cells |
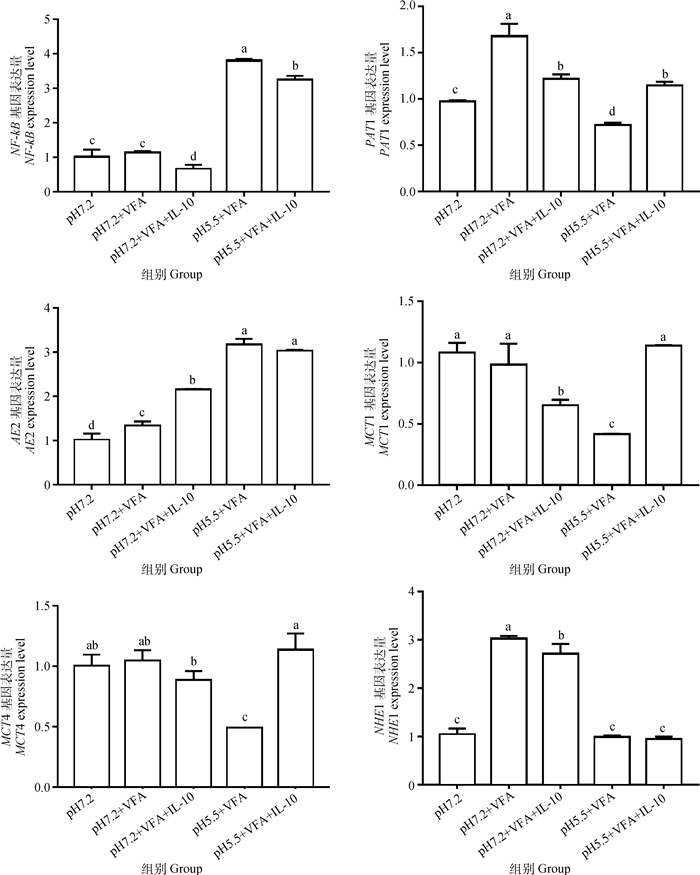
如图 4所示,VFA添加组与空白组比较,VFA的添加能够显著促进PAT1、AE2和NHE1基因的表达(P < 0.05),而对NF-κB基因的表达没有显著影响,表明添加VFA没有造成瘤胃上皮细胞产生炎症反应。在中性条件下,IL-10添加组显著下调了NF-κB、PAT1、MCT1、NHE1基因的相对表达(P < 0.05),AE2基因被显著性上调(P < 0.05),而对MCT4基因的表达没有显著影响。pH5.5组与pH7.2组比较,pH5.5组NF-κB基因表达显著上调(P < 0.05)。表明低pH对瘤胃上皮细胞有致炎作用。在酸性条件下,IL-10添加组的NF-κB基因表达被显著性抑制(P < 0.05),而促进PAT1、MCT1、MCT4基因表达(P < 0.05)。表明在酸性条件下,IL-10有一定的抗炎作用,并且有利于VFA的吸收。
|
图 4 细胞在不同处理下相关基因表达的柱状图 Fig. 4 Histogram of related genes expression in cells under different treatments |
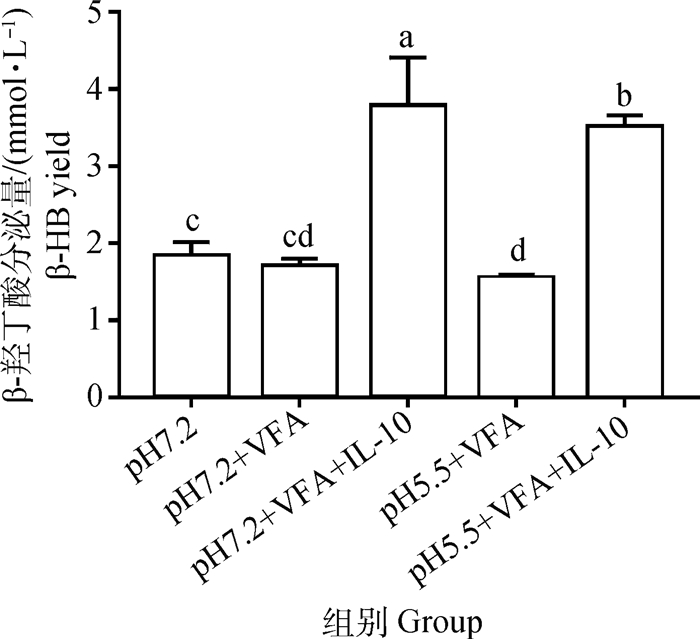
如图 5所示,VFA添加组与空白组比较,β-羟丁酸分泌量没有显著性变化(P>0.05)。与pH7.2+VFA组比较,pH7.2+VFA+IL-10组β-羟丁酸分泌量显著性增加(P < 0.05)。pH5.5+VFA组与pH7.2+VFA组比较,β-羟丁酸分泌量没有显著变化(P>0.05)。与pH5.5+VFA组比较,pH5.5+VFA+IL-10组β-羟丁酸分泌量显著增加(P < 0.05)。
|
图 5 细胞在不同处理下β-羟丁酸分泌量的柱状图 Fig. 5 Histogram of bHBA yield in cells under different treatments |
亚急性瘤胃酸中毒是奶牛常见的营养代谢病,主要是由高精料饲喂导致奶牛瘤胃内VFA的积累,从而降低瘤胃pH,破坏瘤胃内环境引起机体炎症反应。NF-κB作为细胞炎症反应的重要标志物,Zhao等[16]研究表明,高精料饲喂能激活牛瘤胃上皮组织NF-κB炎症信号通路。而牛在高精料饲喂情况下产生的炎症反应由瘤胃内多种因素造成,例如:低pH[17]、LPS[18]、组胺[19]等。而LPS引起机体的炎症反应会导致多种细胞因子的释放,例如:IL-1β、IL-6、IL-8、IL-10等。据报道,低pH、LPS、组胺、IL-1β、IL-6及IL-8都能引起细胞炎症反应,并引起细胞NF-κB基因表达上调[17-19]。与本试验中,低pH引起NF-κB基因表达上调一致。然而, IL-10作为一种抗炎细胞因子参与了促炎细胞因子的调节活性[20]。IL-10的释放有助于调控促炎细胞因子水平,防止组织过度损伤和过度免疫反应[21]。因此,IL-10具有缓解细胞炎症的功能。在本试验低pH条件下,IL-10也具有缓解瘤胃上皮细胞炎症并且降低NF-κB基因表达的作用。
瘤胃VFA可通过扩散或蛋白介导途径被瘤胃上皮有效吸收[22-23]。在瘤胃上皮细胞中,主要存在3种类型蛋白介导VFA吸收[24]。一是VFA-/H+交换载体,主要包括阴离子交换蛋白2(AE2)、假定阴离子转运蛋白1(PAT1)[25-26],AE2和PAT1主要是VFA-和HCO3-交换载体;二是VFA-和H+共同转运体,主要包括单羧酸转运蛋白1(MCT1)和单羧酸转运蛋白4(MCT4)[27],现已证明,MCT1和MCT4与VFA吸收有关[28-30];三是细胞稳态调节蛋白,包括钠氢离子交换蛋白1(NHE1)。AE2和PAT1蛋白决定瘤胃上皮细胞VFA吸收能力,特别是乙酸主要通过HCO3-吸收[31]。Cl-/HCO3-交换时,Cl-转运吸收有利于丁酸的吸收[32-33]。MCT1可以调控乙酸和丙酸在胃肠道吸收,有研究[34-35]发现,MCT1在基底层可转运乙酸和丙酸进入血液,同时,MCT1和MCT4也可以转运酮体进入血液。随着瘤胃VFA积累,NHE1调节瘤胃上皮细胞pH,NHE1在维持瘤胃上皮细胞稳态中发挥着重要作用[36]。
VFA作为反刍动物的主要能量来源。虽然体外研究表明,高浓度VFA对瘤胃上皮细胞活性有抑制作用,但是在本试验中,VFA浓度并不影响细胞活性,并且不引起细胞炎症反应,可以进行下一步研究。本试验中,VFA促进瘤胃上皮细胞NHE1和AE2基因的表达,有利于VFA吸收和调节瘤胃上皮细胞pH。NHE1表达有利于调节VFA吸收后细胞酸碱度平衡,维持瘤胃上皮细胞稳态。
3.1 IL-10在中性条件下对瘤胃上皮细胞VFA吸收的影响在pH7.2添加VFA和IL-10组发现,IL-10抑制了MCT1、PAT1、NHE1的基因表达。在Zhao等[37]的研究中,通过低pH降低了瘤胃上皮细胞MCT1基因表达,同时抑制了VFA的吸收。Kirat等[13]通过MCT1抑制剂处理瘤胃上皮细胞发现,乙酸和丙酸吸收被显著抑制。因此,MCT1基因表达下降会抑制乙酸和丙酸的吸收。MCT1基因表达下调导致进入瘤胃上皮细胞的乙酸和丙酸减少,减少细胞内H+和OH-产生,影响细胞内HCO3-产生。然而,来自上皮细胞内的HCO3-是通过PAT1为瘤胃提供HCO3-,从而中和瘤胃内H+生成CO2和H2O[25],由于VFA吸收受阻,细胞内HCO3-含量减少,所以PAT1基因表达显著下降。细胞内H+依赖NHE1与血液中Na+进行交换,稳定细胞内pH,由于VFA吸收受阻,细胞内H+含量减少,所以NHE1基因表达显著下降。然而,我们发现,IL-10上调AE2的基因表达,而AE2是Cl-转运体,Cl-转运丁酸进入细胞进行酮体合成并产生能量。前人研究表明,机体免疫应答会增加基础代谢导致能量需要增加[38],提高细胞对丁酸的利用会产生大量β-羟丁酸。因此,培养基中β-羟丁酸含量明显增高可能是IL-10上调AE2基因表达的作用。
3.2 IL-10在酸性条件下对瘤胃上皮细胞VFA吸收的影响Zhao等[37]在体外通过低pH处理瘤胃上皮细胞发现瘤胃上皮VFA吸收减少,并且降低了MCT1基因表达。在本试验中,低pH处理细胞除了降低MCT1基因表达,还降低了PAT1、MCT4、NHE1基因表达。这就更近一步说明,高精料饲喂降低瘤胃pH导致瘤胃上皮细胞VFA吸收减少,进一步加剧VFA在瘤胃中的积累。在酸性条件下,NF-κB基因表达上调,炎症状态机体能量需要增加[38],AE2基因表达上调增加丁酸摄取。MCT1和MCT4除了能调控VFA吸收之外,还负责瘤胃细胞内β-羟丁酸转运[13, 29]。MCT1和MCT4基因表达下调抑制丁酸代谢产物β-羟丁酸转运出瘤胃上皮细胞外,从而破坏细胞内环境平衡,影响细胞活性。
牛发生SARA主要是因为牛采食高精料后瘤胃长时间处于低pH环境,瘤胃低pH破坏瘤胃上皮组织黏膜使瘤胃内革兰阴性菌大肠杆菌进入血液循环[39]。在大肠杆菌感染期间,IL-10的释放有助于机体缓解炎症反应[40]。在本试验中,瘤胃上皮细胞在酸性条件下引起的炎症反应经过IL-10处理,降低NF-κB基因表达,缓解瘤胃上皮炎症反应,同时,提高PAT1、MCT1、MCT4基因表达,促进VFA吸收,释放出β-羟丁酸。因此,SARA引起机体炎症反应,IL-10作用于瘤胃上皮细胞缓解细胞炎症,促进VFA吸收,减少瘤胃内VFA积累,使瘤胃pH以及VFA恢复到正常水平。
4 结论综上所述,在酸性条件下,IL-10可以增加瘤胃上皮对VFA的吸收与利用,并且改善低pH条件下VFA吸收相关蛋白基因的表达。因此,IL-10通过平衡瘤胃上皮细胞炎症反应的方式促进VFA吸收。所以,发生SARA时,血液中的IL-10可以增加瘤胃内VFA吸收,并且促进β-羟丁酸分泌,满足机体其他部位能量供应,缓解SARA。
| [1] | VISENTIN G, NIERO G, BERRY D P, et al. Genetic (co)variances between milk mineral concentration and chemical composition in lactating Holstein-Friesian dairy cows[J]. Animal, 2019, 13(3): 477–486. DOI: 10.1017/S1751731118001507 |
| [2] | KLIEM K E, HUMPHRIES D J, KIRTON P, et al. Differential effects of oilseed supplements on methane production and milk fatty acid concentrations in dairy cows[J]. Animal, 2019, 13(2): 309–317. DOI: 10.1017/S1751731118001398 |
| [3] | BALDWIN R L, CONNOR E E. Rumen function and development[J]. Vet Clin North Am Food Anim Pract, 2017, 33(3): 427–439. DOI: 10.1016/j.cvfa.2017.06.001 |
| [4] |
杨春涛, 刁其玉, 司丙文, 等. 挥发性脂肪酸在反刍动物瘤胃上皮吸收转运及调节作用[J]. 中国畜牧杂志, 2015, 51(7): 78–83.
YANG C T, DIAO Q Y, SI B W, et al. Absorption and regulation of volatile fatty acids in the ruminal epithelium[J]. Chinese Journal of Animal Science, 2015, 51(7): 78–83. DOI: 10.3969/j.issn.0258-7033.2015.07.018 (in Chinese) |
| [5] | DIJKSTRA J, BOER H, VAN BRUCHEM J, et al. Absorption of volatile fatty acids from the rumen of lactating dairy cows as influenced by volatile fatty acid concentration, pH and rumen liquid volume[J]. Br J Nutr, 1993, 69(2): 385–396. DOI: 10.1079/BJN19930041 |
| [6] | JACOBSEN S, ANDERSEN P H, AASTED B. The cytokine response of circulating peripheral blood mononuclear cells is changed after intravenous injection of lipopolysaccharide in cattle[J]. Vet J, 2007, 174(1): 170–175. DOI: 10.1016/j.tvjl.2006.06.006 |
| [7] |
胡永林, 张祥胤, 毋程飞, 等. 高精料日粮对奶山羊肝、脾炎性因子表达的影响[J]. 畜牧兽医学报, 2020, 51(7): 1646–1655.
HU Y L, ZHANG X Y, WU C F, et al. Effects of high concentrate diet on expression of inflammatory factors of liver and spleen in dairy goats[J]. Acta Veterinaria et Zootechnica Sinica, 2020, 51(7): 1646–1655. (in Chinese) |
| [8] | CHALMEH A, BADIEI K, POURJAFAR M, et al. Modulation of inflammatory responses following insulin therapy in experimentally bolus intravenous Escherichia coli lipopolysaccharide serotype O55:B5 induced endotoxemia in Iranian fat-tailed sheep[J]. Small Ruminant Res, 2013, 113(1): 283–289. DOI: 10.1016/j.smallrumres.2013.03.002 |
| [9] | JING L H, ZHANG R Y, LIU Y J, et al. Intravenous lipopolysaccharide challenge alters ruminal bacterial microbiota and disrupts ruminal metabolism in dairy cattle[J]. Br J Nutr, 2014, 112(2): 170–182. DOI: 10.1017/S000711451400066X |
| [10] | WALDRON M R, NISHIDA T, NONNECKE B J, et al. Effect of lipopolysaccharide on indices of peripheral and hepatic metabolism in lactating cows[J]. J Dairy Sci, 2003, 86(11): 3447–3459. DOI: 10.3168/jds.S0022-0302(03)73949-6 |
| [11] | ADEREM A, ULEVITCH R J. Toll-like receptors in the induction of the innate immune response[J]. Nature, 2000, 406(6797): 782–787. DOI: 10.1038/35021228 |
| [12] | YAN L, ZHANG B, SHEN Z M. Dietary modulation of the expression of genes involved in short-chain fatty acid absorption in the rumen epithelium is related to short-chain fatty acid concentration and pH in the rumen of goats[J]. J Dairy Sci, 2014, 97(9): 5668–5675. DOI: 10.3168/jds.2013-7807 |
| [13] | KIRAT D, MASUOKA J, HAYASHI H, et al. Monocarboxylate transporter 1(MCT1) plays a direct role in short-chain fatty acids absorption in caprine rumen[J]. J Physiol, 2006, 576(2): 635–647. DOI: 10.1113/jphysiol.2006.115931 |
| [14] | DE CAMPOS F T, RINCON J A A, ACOSTA D A V, et al. The acute effect of intravenous lipopolysaccharide injection on serum and intrafollicular HDL components and gene expression in granulosa cells of the bovine dominant follicle[J]. Theriogenology, 2017, 89: 244–249. DOI: 10.1016/j.theriogenology.2016.11.013 |
| [15] | SCHLAU N, GUAN L L, OBA M. The relationship between rumen acidosis resistance and expression of genes involved in regulation of intracellular pH and butyrate metabolism of ruminal epithelial cells in steers[J]. J Dairy Sci, 2012, 95(10): 5866–5875. DOI: 10.3168/jds.2011-5167 |
| [16] | ZHAO K, CHEN Y H, PENNER G B, et al. Transcriptome analysis of ruminal epithelia revealed potential regulatory mechanisms involved in host adaptation to gradual high fermentable dietary transition in beef cattle[J]. BMC Genomics, 2017, 18(1): 976. DOI: 10.1186/s12864-017-4317-y |
| [17] | GUO J F, CHANG G J, ZHANG K, et al. Rumen-derived lipopolysaccharide provoked inflammatory injury in the liver of dairy cows fed a high-concentrate diet[J]. Oncotarget, 2017, 8(29): 46769–46780. DOI: 10.18632/oncotarget.18151 |
| [18] | MALIK M I, RASHID M A. Genomics of subacute ruminal acidosis[J]. Large Anim Rev, 2020, 26(2): 93–98. |
| [19] | SUN X D, YUAN X, CHEN L, et al. Histamine induces bovine rumen epithelial cell inflammatory response via NF-κB pathway[J]. Cell Physiol Biochem, 2017, 42(3): 1109–1119. DOI: 10.1159/000478765 |
| [20] | MVHL H, PFEILSCHIFTER J. Anti-inflammatory properties of pro-inflammatory interferon-γ[J]. Int Immunopharmacol, 2003, 3(9): 1247–1255. DOI: 10.1016/S1567-5769(03)00131-0 |
| [21] | MOCELLIN S, MARINCOLA F M, ROSSI C R, et al. The multifaceted relationship between IL-10 and adaptive immunity: putting together the pieces of a puzzle[J]. Cytokine Growth Factor Rev, 2004, 15(1): 61–76. DOI: 10.1016/j.cytogfr.2003.11.001 |
| [22] | LEONHARD-MAREK S, STUMPFF F, MARTENS H. Transport of cations and anions across forestomach epithelia: conclusions from in vitro studies[J]. Animal, 2010, 4(7): 1037–1056. DOI: 10.1017/S1751731110000261 |
| [23] | YAN L, ZHANG B, SHEN Z M. Dietary modulation of the expression of genes involved in short-chain fatty acid absorption in the rumen epithelium is related to short-chain fatty acid concentration and pH in the rumen of goats[J]. J Dairy Sci, 2014, 97(9): 5668–5675. DOI: 10.3168/jds.2013-7807 |
| [24] |
李洋, 高民, 胡红莲, 等. 反刍动物瘤胃挥发性脂肪酸的吸收机制[J]. 动物营养学报, 2018, 30(6): 2070–2078.
LI Y, GAO M, HU H L, et al. Ruminal absorption mechanism of volatile fatty acids in ruminants[J]. Chinese Journal of Animal Nutrition, 2018, 30(6): 2070–2078. DOI: 10.3969/j.issn.1006-267x.2018.06.008 (in Chinese) |
| [25] | BILK S, HUHN K, HONSCHA K U, et al. Bicarbonate exporting transporters in the ovine ruminal epithelium[J]. J Comp Physiol B, 2005, 175(5): 365–374. DOI: 10.1007/s00360-005-0493-1 |
| [26] |
艳城, 金鹿, 孙海洲, 等. 饲粮不同非纤维性碳水化合物/中性洗涤纤维对细毛羊氮代谢、瘤胃内环境及挥发性脂肪酸吸收的影响[J]. 动物营养学报, 2019, 31(4): 1685–1694.
YAN C, JIN L, SUN H Z, et al. Effects of dietary different non-fiber carbohydrate/neutral detergent fiber on nitrogen metabolism, rumen environment and volatile fatty acid absorption of fine wool sheep[J]. Chinese Journal of Animal Nutrition, 2019, 31(4): 1685–1694. DOI: 10.3969/j.issn.1006-267x.2019.04.026 (in Chinese) |
| [27] | DIEHO K, VAN BAAL J, KRUIJT L, et al. Effect of supplemental concentrate during the dry period or early lactation on rumen epithelium gene and protein expression in dairy cattle during the transition period[J]. J Dairy Sci, 2017, 100(9): 7227–7245. DOI: 10.3168/jds.2016-12403 |
| [28] | GRAHAM C, GATHERAR I, HASLAM I, et al. Expression and localization of monocarboxylate transporters and sodium/proton exchangers in bovine rumen epithelium[J]. Am J Physiol Regul Integr Comp Physiol, 2007, 292(2): R997–R1007. DOI: 10.1152/ajpregu.00343.2006 |
| [29] | KIRAT D, MATSUDA Y, YAMASHIKI N, et al. Expression, cellular localization, and functional role of monocarboxylate transporter 4(MCT4) in the gastrointestinal tract of ruminants[J]. Gene, 2007, 391(1-2): 140–149. DOI: 10.1016/j.gene.2006.12.020 |
| [30] |
李晓彤, 杨凯, 张瑞阳, 等. 反刍动物瘤胃发育规律及其调控机制研究进展[J]. 中国畜牧兽医, 2020, 47(7): 2055–2062.
LI X T, YANG K, ZHANG R Y, et al. Research progress of rumen development and its regulation mechanism of ruminants[J]. China Animal Husbandry & Veterinary Medicine, 2020, 47(7): 2055–2062. (in Chinese) |
| [31] | PENNER G B, ASCHENBACH J R, GÄBEL G, et al. Technical note: Evaluation of a continuous ruminal pH measurement system for use in noncannulated small ruminants[J]. J Anim Sci, 2009, 87(7): 2363–2366. DOI: 10.2527/jas.2008-1665 |
| [32] | SEHESTED J, BASSE A, ANDERSEN J B, et al. Feed-induced changes in transport across the rumen epithelium[J]. Comp Biochem Phys A, 1997, 118(2): 385–386. DOI: 10.1016/S0300-9629(96)00324-6 |
| [33] | MARTENS H, RABBANI I, SHEN Z M, et al. Changes in rumen absorption processes during transition[J]. Anim Feed Sci Technol, 2012, 172(1-2): 95–102. DOI: 10.1016/j.anifeedsci.2011.12.011 |
| [34] | CONNOR E E, LI R W, BALDWIN R L, et al. Gene expression in the digestive tissues of ruminants and their relationships with feeding and digestive processes[J]. Animal, 2010, 4(7): 993–1007. DOI: 10.1017/S1751731109991285 |
| [35] | MVLLER F, HUBER K, PFANNKUCHE H, et al. Transport of ketone bodies and lactate in the sheep ruminal epithelium by monocarboxylate transporter 1[J]. Am J Physiol Gastrointest Liver Physiol, 2002, 283(5): G1139–G1146. DOI: 10.1152/ajpgi.00268.2001 |
| [36] |
马嘉琪, 陈章炜, 钱菊英. 钠氢交换蛋白1及其抑制剂的研究进展[J]. 中国心血管杂志, 2019, 24(1): 89–93.
MA J Q, CHEN Z W, QIAN J Y. Research progress of sodium hydrogen exchange protein-1 and its inhibitors[J]. Chinese Journal of Cardiovascular Medicine, 2019, 24(1): 89–93. (in Chinese) |
| [37] | ZHAO C X, WANG Y Z, PENG Z C, et al. Subacute ruminal acidosis suppressed the expression of MCT1 in rumen of cows[J]. J Cell Physiol, 2019, 234(7): 11734–11745. |
| [38] |
魏凤仙. 湿度和氨暴露诱导的慢性应激对肉仔鸡生长性能、肉品质、生理机能的影响及其调控机制[D]. 杨凌: 西北农林科技大学, 2012.
WEI F X. Effects of exposure to humidity and ammoniainduced chronic stress on growth performance, meat quality, physiological function in broilers and its regulating mechanism[D]. Yangling: Northwest A & F University, 2012. (in Chinese) |
| [39] | SULABH S, PANIGRAHI M, VARSHNEY R, et al. In-vitro analysis of Interleukin-10 expression in cell cultures of Crossbred cattle, Tharparkar cattle and Murrah buffalo in response to mastitis causing antigens derived from Staphylococcus aureus and Escherichia coli[J/OL]. Biol Rhythm Res, 2019, doi: 10.1080/09291016.2019.1628407. |
| [40] | JIN D, CHANG G J, ZHANG K, et al. Rumen-derived lipopolysaccharide enhances the expression of lingual antimicrobial peptide in mammary glands of dairy cows fed a high-concentrate diet[J]. BMC Vet Res, 2016, 12(1): 128. |



